Benutzer:Thomas Lux: Unterschied zwischen den Versionen
(AA Chemie5 vervollständigt. Zum zweiten Mal, irgendjemand hat dazwischen gefunkt.) Markierung: 2017-Quelltext-Bearbeitung |
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| (111 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen... | |||
== | <br> <br> | ||
AB inkl. Musterlösung zum Thema "Säuren und Säure-Reste": als [[Spezial:FilePath/C9NTG_PP21_Säuren_4AB_ML.pdf|pdf-Datei]] | |||
== Aktuelle Seiten in Bearbeitung == | |||
[[8a_2022_23| 8a NTG]]<br> | |||
[[9a_2020_21/Chemie| 9a CSG]]<br> | |||
[[9e_2020_21/Chemie| 9e CNTG]]<br> | |||
[[10d_2020_21/Chemie| 10d CNTG]]<br> | |||
[[10e_2020_21/Bio_Chemie| 10e EK]]<br> | |||
[[Q11_1b2_2020_21| Q11]]<br> | |||
[[Q12_2b2_2021_22| Q12 neu]]<br> | |||
[[Q12_2b3_2020_21| Q12 alt]]<br> | |||
[[10d_2019_20/Chemie]]<br> | |||
[[Benutzer:Thomas_Lux/G9_Q12_Bio_eA]]<br> | |||
[[Benutzer:Thomas_Lux/Test Q11-Struktur|Q11-Struktur-Test-Seite]]<br> | |||
[[Benutzer:Thomas_Lux/Q12 Sozialverhalten|Q12 Sozialverhalten]]<br> | |||
[[Benutzer:Thomas_Lux/Test_Oberstufe|Oberstufen-Testseite]]<br> | |||
[[Benutzer:Thomas_Lux/Rhetorik|Rhetorik]] <br> | |||
[[Benutzer:Thomas_Lux/G92 C8 NTG|G92 C8 NTG]]<br> | |||
[[Benutzer:Thomas_Lux/Chemische Gleichungen aufstellen|chemische Gleichungen aufstellen]]<br> | |||
<span style="color:#F00">'''Neu: 09./11.01.:'''</span><br> | |||
=== Chemische Reaktionsgleichungen aufstellen === | |||
== Lösungen für Aufgaben am 27.11. == | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Übungsaufgaben: Chemische Gleichungen aufstellen'''</span> | ||
|Inhalt= | |Inhalt= | ||
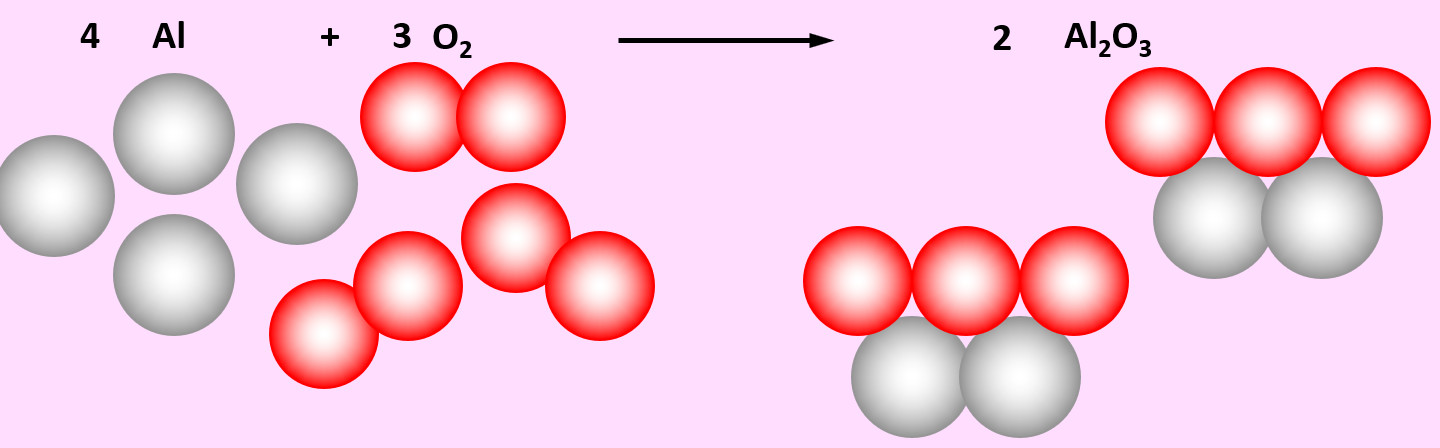
Zu | '''Aufgabe 4 (AB-Vorderseite)'''<br> | ||
[[Datei: | Zu den heftigsten Reaktionen unter den Elementen zählt die Reaktion von Aluminium mit Sauerstoff. Dabei entsteht Aluminiumoxid (Al<sub>2</sub>O<sub>3</sub>) | ||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_4Al3O22Al2O3.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
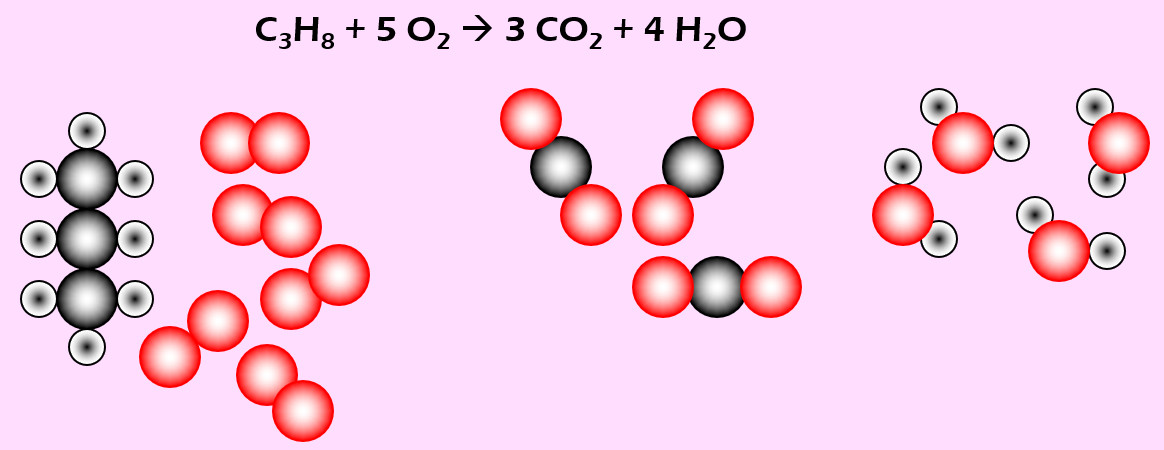
'''Aufgabe 5 (AB-Vorderseite)'''<br> | |||
Feuerzeuge enthalten vielfach Propan (C<sub>3</sub>H<sub>8</sub>). Bei Gebrauch strömt das Gas aus und wird durch einen Funken entzündet. Dabei reagiert es mit Sauerstoff zu Kohlenstoffdioxid (CO<sub>2</sub>) und Wasser (H<sub>2</sub>O) | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_PropanSauerstoff.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
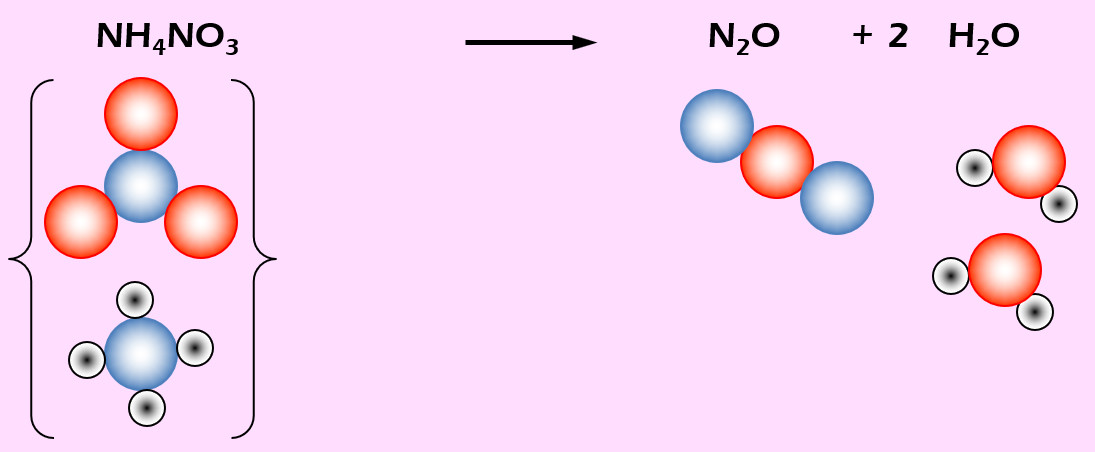
'''Aufgabe 6 (AB-Vorderseite)'''<br> | |||
Lachgas (N<sub>2</sub>O) entsteht beim starken Erhitzen von Ammoniumnitrat (NH<sub>4</sub>NO<sub>3</sub>). Daneben entsteht auch noch Wasser (H<sub>2</sub>O). | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_NH4NO3Zerfall.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
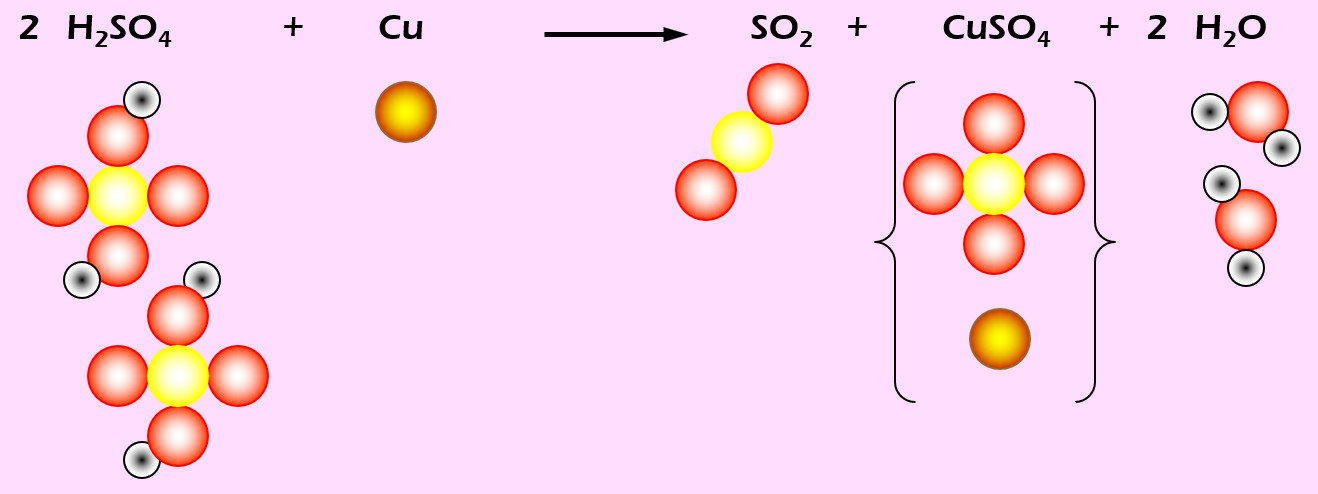
'''Aufgabe 7 (AB-Vorderseite)'''<br> | |||
Kupfer löst sich in erhitzter Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>). Dabei entsteht Schwefeldioxid (SO<sub>2</sub>), Kupfersulfat (CuSO<sub>4</sub>) und Wasser (die chem. Formel f. Wasser müsstet ihr langsam wissen...). | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Ausgleichen_H2SO4Cu.jpg]] | ||
|Lösung | |Lösung|Lösung ausblenden}} | ||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 23: | Zeile 63: | ||
<br> | <br> | ||
Bearbeitet die Aufgaben auf der zweiten Seite des aktuellen Arbeitsblattes. Falls ihr es nicht dabei haben solltet, hier die [[Spezial:FilePath/C9SG_010_Ausgleichen_AB.pdf| pdf-Datei]]. | |||
* Arbeitet zu zweit oder dritt! | |||
* Sucht zunächst gemeinsam nach einer Lösung. | |||
* Nur eine Person darf auf "Lösung" klicken! | |||
* War eure Lösung richtig, geht zur nächsten Aufgabe. | |||
* War eure Lösung falsch, muss die Person, die die Lösung angeschaut hat der anderen Person Tipps geben, was schief gelaufen ist. Wenn ihr auf den Button "Wie kommt man drauf" klickt, gibt es am Anfang noch ein paar Erklärungs-Tipps. | |||
* Bei der nächsten Aufgabe darf die andere Person die Lösung anklicken. | |||
<br> | |||
'''Bleibt beim bekannten Lösungsschema!''' | |||
* Legt zunächst fest, was Edukt und was Produkt ist. | |||
* Überlegt, ob vorkommende Elemente evtl. molekular formuliert werden müssen. | |||
* Gleicht erst zum Schluss aus. | |||
<br> | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Übungsaufgaben: Chemische Gleichungen aufstellen'''</span> | ||
|Inhalt= | |Inhalt= | ||
'''Aufgabe 1 (AB-Rückseite)'''<br> | |||
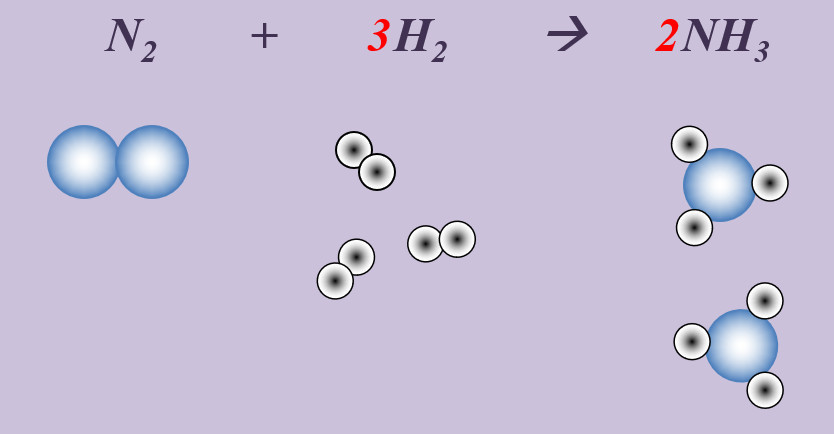
Stickstoff reagiert mit Wasserstoff zu Ammoniak (NH<sub>3</sub>). | |||
<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Ausgleichen_N23H22NH3.jpg]] <br> | |||
{{Lösung versteckt| | |||
'''Schritt 1''': Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden<br> | |||
<br> | |||
N + H --> NH<sub>3</sub><br> | |||
<br> | |||
'''Schritt 2''': Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier: Stickstoff, N und Wasserstoff, H)<br> | |||
<br> | |||
N<sub>2</sub> + H<sub>2</sub> --> NH<sub>3</sub><br> | |||
<br> | |||
'''Schritt 3''': Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante: <br> | |||
<br> | |||
'''Schritt 3a:''' Man kann erkennen, dass bisher '''links''' zwei N-Atome auftauchen (im N<sub>2</sub>-Molekül), '''rechts '''aber nur eines. Also könnte man die Anzahl rechts durch den Koeffizienten 2 vor dem Ammoniak erhöhen: <br> | |||
<br> | |||
N<sub>2</sub> + H<sub>2</sub> --> '''2''' NH<sub>3</sub><br> | |||
<br> | |||
'''Schritt 3b:''' Jetzt ist die Anzahl der N-Atome links und rechts ausgeglichen. Aber die Anzahl der H-Atome noch nicht, aktuell liegen links nur zwei vor, rechts sechs. Durch den Koeffizienten 3 vor dem Wasserstoffmolekül wird die Gleichung richtig gestellt. <br> | |||
<br> | |||
N<sub>2</sub> + '''3''' H<sub>2</sub> --> 2 NH<sub>3</sub><br> | |||
|Wie kommt man drauf|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
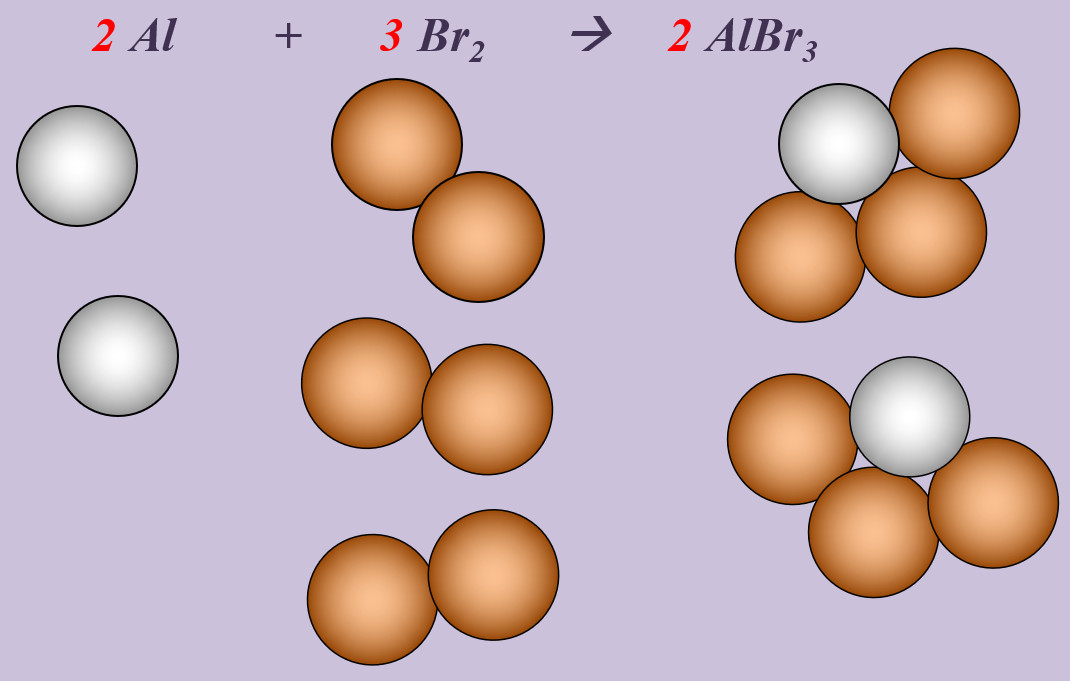
'''Aufgabe 2 (AB-Rückseite)'''<br> | |||
Aluminium reagiert mit Brom zu Aluminiumbromid (AlBr<sub>3</sub>). | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_2Al3Br2AlBr3.jpg]] <br> | |||
{{Lösung versteckt| | |||
'''Schritt 1''': Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden<br> | |||
<br> | |||
Al + Br --> AlBr<sub>3</sub><br> | |||
<br> | |||
'''Schritt 2''': Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier Brom, Br)<br> | |||
<br> | |||
Al + Br<sub>2</sub> --> AlBr<sub>3</sub><br> | |||
<br> | |||
'''Schritt 3''': Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante: <br> | |||
<br> | |||
'''Schritt 3a:''' Man kann erkennen, dass bisher '''links''' zwei Br-Atome auftauchen (im Br<sub>2</sub>-Molekül), '''rechts''' aber drei. Also könnte man die Anzahl links durch den Koeffizienten 2 vor Br erhöhen. Das würde aber nichts bringen, denn dann hätte man links 4 Br-Atome, rechts aber nur drei: <br> | |||
<br> | |||
Al + '''2''' Br<sub>2</sub> --> AlBr<sub>3</sub><br> | |||
<br> | |||
'''Schritt 3b:''' Also muss man auch rechts einen Koeffizienten 2 vor das Aluminiumbromid schreiben, dann liegen dort insgesamt 6 Br-Atome vor und wenn man auf der linken Seite anstatt dem Koeffizienten 2 eine 3 verwendet, liegen dort auch 6 Br-Atome vor. Die Br-Atome wären damit ausgeglichen: <br> | |||
<br> | |||
Al + '''3''' Br<sub>2</sub> --> '''2''' AlBr<sub>3</sub><br> | |||
<br> | |||
'''Schritt 3c:''' Dann kann man sich dem anderen Element zuwenden: Aluminium. Hier liegen nach aktuellem Stand auf der rechten Seite 2 Al-Atome vor, auf der linken nur 1. Durch den Koeffizienten 2 auf der linken Seite vor dem Aluminium kann das ausgeglichen werden: <br> | |||
<br> | |||
'''2''' Al + 3 Br<sub>2</sub> --> 2 AlBr<sub>3</sub><br> | |||
|Wie kommt man drauf|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
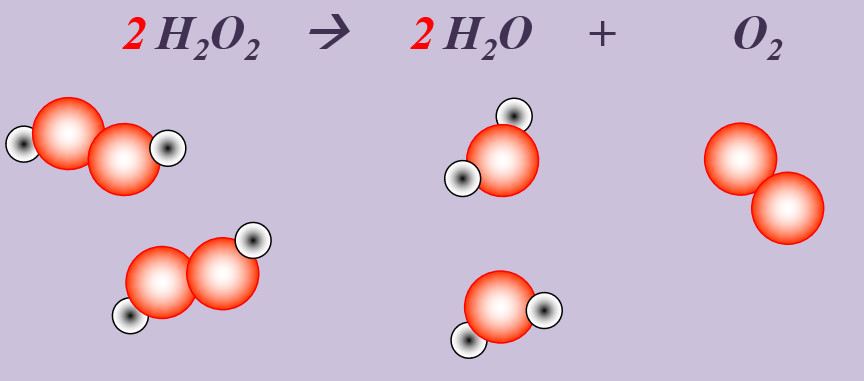
'''Aufgabe 3 (AB-Rückseite)'''<br> | |||
Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) zerfällt an der Luft zu Wasser und Sauerstoff. | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_2H2O22H2OO2.jpg]]<br> | |||
{{Lösung versteckt| | |||
'''Schritt 1''': Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden<br> | |||
<br> | |||
H<sub>2</sub>O<sub>2</sub> --> H<sub>2</sub>O + O <br> | |||
<br> | |||
'''Schritt 2''': Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier Sauerstoff, O)<br> | |||
<br> | |||
H<sub>2</sub>O<sub>2</sub> --> H<sub>2</sub>O + O<sub>2</sub><br> | |||
<br> | |||
'''Schritt 3''': Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante: <br> | |||
<br> | |||
'''Schritt 3a:''' Man kann erkennen, dass bisher '''links''' nur zwei O-Atome auftauchen (im H<sub>2</sub>O<sub>2</sub>-Molekül), '''rechts''' aber drei (eins im H<sub>2</sub>O-Molekül, zwei im O<sub>2</sub>-Molekül. Also könnte man die Anzahl links durch den Koeffizienten 2 vor dem Wasserstoffperoxid erhöhen: <br> | |||
<br> | |||
'''2''' H<sub>2</sub>O<sub>2</sub> --> H<sub>2</sub>O + O<sub>2</sub><br> | |||
<br> | |||
'''Schritt 3b:''' Scheinbar passt jetzt gar nichts mehr. Aber wenn man einen kühlen Kopf behält sieht, man, dass jetzt link zwei Wasserstoff-Atome und ein Sauerstoff-Atom zu viel sind. Das entspricht zusammen genau einem Wasser-Molekül, also davor einen Koeffizienten 2:<br> | |||
<br> | |||
2 H<sub>2</sub>O<sub>2</sub> --> '''2''' H<sub>2</sub>O + O<sub>2</sub><br> | |||
<br> | |||
Ta da! | |||
<br> | |||
|Wie kommt man drauf|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
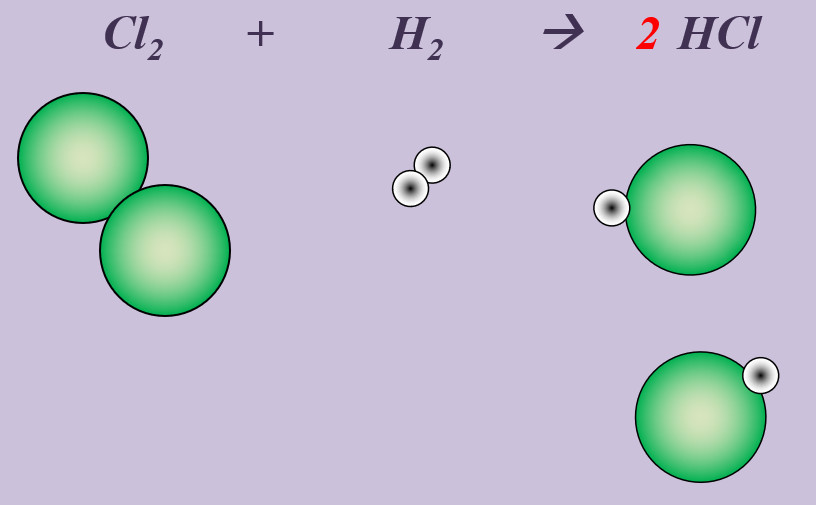
'''Aufgabe 4 (AB-Rückseite)'''<br> | |||
Chlor reagiert in einer heftigen Reaktion mit Wasserstoff zu Hydrogenchlorid (HCl). | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_Cl2H22HCl.jpg]]<br> | |||
{{Lösung versteckt| | |||
Das müsst ihr jetzt alleine schaffen. Ich glaub an euch! | |||
|Wie kommt man drauf|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 5 (AB-Rückseite)'''<br> | |||
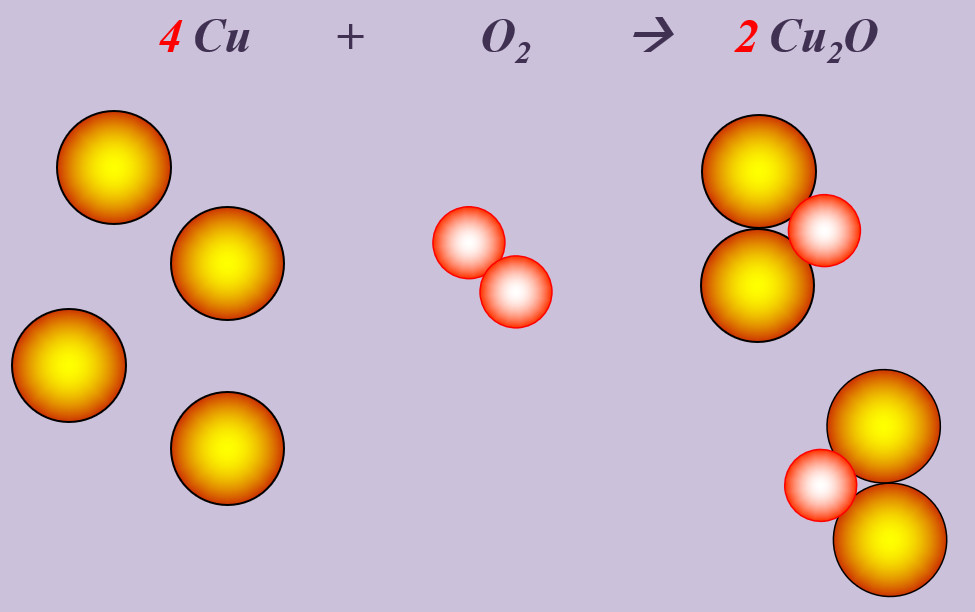
Kupfer kann beim starken Erhitzen mit Sauerstoff zu Kupfer(I)-oxid (Cu<sub>2</sub>O) reagieren. | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_4CuO22Cu2O.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 6 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Unter anderen Bedingungen reagiert Kupfer mit Sauerstoff zu Kupfer(II)-oxid (CuO) | |||
<br> | |||
{{Lösung versteckt| | |||
2 Cu + O<sub>2</sub> --> 2 CuO | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 7 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Bei der Fotosynthese von Pflanzen wird Kohlenstoffdioxid (CO<sub>2</sub>) aus der Luft und Wasser aus dem Boden zu Traubenzucker (C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>) und Sauerstoff umgewandelt. | |||
<br> | |||
{{Lösung versteckt| | |||
6 CO<sub>2</sub> + 6 H<sub>2</sub>O --> C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> + 6 O<sub>2</sub> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 8 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Eisen verbrennt in einem Standzylinder mit Chlor zu Eisen(III)-chlorid (FeCl<sub>3</sub>). | |||
<br> | |||
{{Lösung versteckt| | |||
2 Fe + 3 Cl<sub>2</sub> --> 2 FeCl<sub>3</sub> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 9 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Natrium verbrennt in einem Standzylinder mit Brom (wird als Gas aufgefasst) zu Natriumbromid (NaBr). | |||
<br> | |||
{{Lösung versteckt| | |||
2 Na + Br<sub>2</sub> --> 2 NaBr | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 10 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Um Salpetersäure (HNO<sub>3</sub>) herzustellen, lässt man Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>) mit Natriumnitrat (NaNO<sub>3</sub>) reagieren. Als Nebenprodukt entsteht auch Natriumhydrogensulfat (NaHSO<sub>4</sub>) | |||
<br> | |||
{{Lösung versteckt| | |||
H<sub>2</sub>SO<sub>4</sub> + NaNO<sub>3</sub> --> HNO<sub>3</sub> + NaHSO<sub>4</sub> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
'''Aufgabe 11 (AB-Rückseite) - ab jetzt ohne Kugeln'''<br> | |||
Eine anorganische „Universalverbindung“, die in etlichen Produkten des täglichen Lebens enthalten ist, ist das Titandioxid (TiO<sub>2</sub>). Man gewinnt es durch Lösen der Verbindung TiO(SO<sub>4</sub>) in Wasser. Daneben entsteht dabei auch Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>) | |||
<br> | |||
{{Lösung versteckt| | |||
TiO(SO<sub>4</sub>) + H<sub>2</sub>O --> TiO<sub>2</sub> + H<sub>2</sub>SO<sub>4</sub> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 38: | Zeile 231: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
=== Chemische Reaktionen einteilen === | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Drei Grundtypen chemischer Reaktionen'''</span> | ||
|Inhalt= | |Inhalt= | ||
Das folgende Video (3:28) stammt aus der Corona-Zeit und wurde von einem Lehrer für das Home-Schooling angefertigt. Dort werden drei Grundtypen chemischer Reaktionen theoretisch vorgestellt. Prägt euch die Begriffe ein, im Anschluss sollt ihr sie anwenden! <br> | |||
* | {{#ev:youtube|WSVnJPBwpek}}<br> | ||
<br> | |||
'''Aufgaben:''' Stellt für die folgenden Reaktionen die chemische Gleichung auf. Gebt an, ob es sich um eine Synthese, Analyse oder Umsetzung handelt!<br> | |||
<br> | |||
* Eisenpulver und Schwefelpulver wird vermischt. Man taucht einen glühenden Nagel kurz in das Gemisch und es beginnt eine starke Reaktion. Nach und nach glüht das gesamte Gemisch auf. Am Ende liegt der Stoff Pyrit (FeS<sub>2</sub>) vor. | |||
{{Lösung versteckt| | |||
* '''Chemische Gleichung''': Fe + 2 S --> FeS<sub>2</sub> | |||
* '''Grundtyp''': Synthese. Begründung: Aus '''mehreren Edukten''' wird '''ein Produkt''' | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
* Quecksilberoxid (HgO) wird in einem Reagenzglas mit dem Bunsenbrenner stark erhitzt. Solange sich das RG in der BB-Flamme befindet, strömt Sauerstoff aus dem RG und es bilden sich am Rand kleine Quecksilbertröpfchen | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
* '''Chemische Gleichung''': 2 HgO --> 2 Hg + O<sub>2</sub><br> | |||
* '''Grundtyp''': Analyse. Begründung: Aus '''einem Edukt''' werden '''mehrere Produkte''' | |||
|Lösung | |Lösung|Lösung ausblenden}}<br> | ||
<br> | <br> | ||
''' | * In einem RG befinden sich Wasser und ein Stück Magnesium-Band. Am oberen Ende ist das RG mit einem Stopfen verschlossen, in dem ein dünnes Glasrohr steckt. Das Wasser im RG wird vorsichtig erhitzt, so dass es verdampft und alle anderen Gase aus dem RG verbrennt. Es liegt also ein Stück Magensiumband in gasförmigem Wasser vor. Entzünden man das Magnesiumband dann an einer Stelle, reagiert es mit dem Wasser. Sobald die Reaktion gestartet ist, reagiert das gesamte Magnesiumband nach und nach auf der gesamten Länge unter Freisetzung großer Mengen von Licht und Wärme. Nach der Reaktion bleibt der der Stoff Magnesiumoxid (MgO) im RG übrig und während der Reaktion kann man zeigen, dass aus dem dünnen Glasrohr im Stopfen Wasserstoff entweicht. | ||
{{Lösung versteckt| | |||
* '''Chemische Gleichung''': Mg + H<sub>2</sub>O --> MgO + H<sub>2</sub><br> | |||
* '''Grundtyp''': Umsetzung. Begründung: Aus '''mehreren Edukten''' werden '''mehrere Produkte''' | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | <br> | ||
Hier ein paar Videos, in denen ihr die chemischen Reaktionen dieser Einheit sehen könnt: <br> | |||
Ein relativ ausführliches Video zur Synthese von Eisensulfid (Pyrit):<br> | |||
{{#ev:youtube|8c01I9Pq0is}}<br> | |||
<br> | <br> | ||
Die Thermolyse von Quecksilberoxid:<br> | |||
{{#ev:youtube|8jnLKkagFjw}}<br> | |||
<br> | <br> | ||
Die Umsetzung von Magnesium in Wasserdampf (mit lustiger Musik... YEAH!): | |||
{{#ev:youtube|IQ8Tx0gWM1E|||||start=0&end=115}}<br> | |||
<br> | <br> | ||
'''Hausaufgabe (könnt ihr auch sofort erledigen):'''<br> | |||
Entscheidet auf dem Arbeitsblatt, ob es sich bei den Reaktionen 1, 3, 5 und 7 auf der Vorderseite (links) und den Reaktionen 3, 8 und 10 auf der Rückseite (rechts) um eine Synthese, Analyse oder Umsetzung handelt.<br> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 79: | Zeile 276: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Nr. 1''': Ammoniak reagiert mit Sauerstoff zu Stickstoffmonooxid und Wasser.</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | |||
4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | <br> | ||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{Lösung versteckt| | |||
Ammoniak + Sauerstoff --> Stickstoffmonooxid + Wasser | |||
{{Lösung versteckt| | |||
* | * Ammoniak (Trivialname, muss man auswendig wissen): '''NH<sub>3</sub>''' | ||
* | * Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | ||
* | * Stickstoffmonooxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''NO''' | ||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* NH<sub>3</sub> + O<sub>2</sub> --> NO + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
| | |||
Beschreibe den Aufbau des Stoffs '''Ammoniak''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Stickstoff- und drei Wasserstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung | |Lösung|Lösung ausblenden}} | ||
|Farbe= # | |||
|Farbe= #080 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Nr. 2''': Benzol (C<sub>6</sub>H<sub>6</sub>) verbrennt (reagiert mit Sauerstoff) zu Kohlenstoffdioxid und Wasser</span> | ||
|Inhalt= | |Inhalt= | ||
{{ | {{Lösung versteckt| | ||
2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | <br> | ||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{Lösung versteckt| | |||
Benzol + Sauerstoff --> Kohlenstoffdioxid + Wasser | |||
{{Lösung versteckt| | |||
* Benzol (Trivialname, müsst ihr aktuell noch nocht wissen, daher ist chem. Formel angegeben): '''C<sub>6</sub>H<sub>6</sub>''' | |||
* Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | |||
* Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | |||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* C<sub>6</sub>H<sub>6</sub> + O<sub>2</sub> --> CO<sub>2</sub> + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Kohlenstoffdioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Kohlenstoff- und zwei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
|Farbe= # | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Nr. 3''': Phosphortribromid und Wasser reagieren zu Diphosphortrioxid und Wasserstoffbromid.</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr | |||
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | ||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | <br> | ||
{{ | {{Lösung versteckt| | ||
Phosphortribromid + Wasser --> Diphosphortrioxid + Wasserstoffbromid | |||
| | |||
{{Lösung versteckt| | |||
* Phosphortribromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''PBr<sub>3</sub>''' | |||
* | * Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | ||
* | * Diphosphortrioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''P<sub>2</sub>O<sub>3</sub>''' | ||
* Wasserstoffbromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''HBr''' | |||
* PBr<sub>3</sub> + H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + HBr | |||
{{Lösung versteckt| | |||
'''2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
| | |||
| | |||
Beschreibe den Aufbau des Stoffs '''Disphosphortrioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus zwei Phosphor- und drei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
|Farbe= # | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#007">'''Nr. a)''' Aluminium und Chlor reagieren zu Aluminiumchlorid</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub> | |||
| | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | ||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Aluminium + Chlor --> Aluminiumchlorid | |||
{{ | {{Lösung versteckt| | ||
* Aluminium (Element, nicht Bestandteil von HONClBrIF): '''Al''' | |||
* Chlor (Element, Bestandteil von HONClBrIF): '''Cl<sub>2</sub>''' | |||
* Aluminiumchlorid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Chlor steht in der 7. Hauptgruppe --> bildet in Salzen immer 1fach negativ geladene Anionen: Cl<sup>-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei Cl<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''AlCl<sub>3</sub>''' | |||
* Al + Cl<sub>2</sub> --> AlCl<sub>3</sub> | |||
< | {{Lösung versteckt| | ||
'''2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumchlorid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 1fach negativ geladenen Chlorid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #007 | |||
|Farbe= # | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#007">'''Nr. d)''' Zink(II)-oxid reagiert mit Kohlenstoff zu Zink und Kohlenstoffdioxid</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
2 ZnO + C --> 2 Zn + CO<sub>2</sub> | |||
< | |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | ||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
| | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Zink(II)-oxid + Kohlenstoff --> Zink + Kohlenstoffdioxid | |||
{{Lösung versteckt| | |||
* Zink(II)-oxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Zink steht in einer Nebengruppe. Welche Ionen Zink bildet ist daher nicht ganz klar. Die römische Zahl in der runden Klammer gibt aber die Ladung des Zink-Kations im Salz an: 2fach positiv --> Zn<sup>2+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, muss pro Zn<sup>2+</sup>-Ion ein O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''ZnO''' | |||
* Kohlenstoff (Element, kein Bestandteil von HONClBrIF): '''C''' | |||
* Zink (Element, kein Bestandteil von HONClBrIF): '''Zn''' | |||
* Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | |||
* ZnO + C --> Zn + CO<sub>2</sub> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
'''2 ZnO + C --> 2 Zn + CO<sub>2</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Lösung | |Chemische Formeln aufstellen|Lösung ausblenden}} | ||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Zinkoxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 2fach positiv geladenen Zink-Kationen und 2fach negativ geladenen Oxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung | |||
|Farbe= # | |Farbe= #007 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFF | ||
|Hintergrund= # | |Hintergrund= #DFF | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel=<span style="color:#007">'''Nr. f)''' Aluminiumhydroxid reagiert zu Aluminiumoxid und Wasser</span> | ||
|Inhalt= | |Inhalt= | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Aluminiumhydroxid --> Aluminiumoxid + Wasser | |||
{{Lösung versteckt| | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** "Hydroxid" ist ein feststehender Begriff für das Molekül-Ion OH<sup>-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei OH<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al(OH)<sub>3</sub>''' | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro zwei Al<sup>3+</sup>-Ionen drei O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al<sub>2</sub>O<sub>3</sub>''' | |||
* Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumhydroxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 2fach negativ geladenen Hydroxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
=== | |Farbe= #007 | ||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
=== Aufgaben zum Üben === | |||
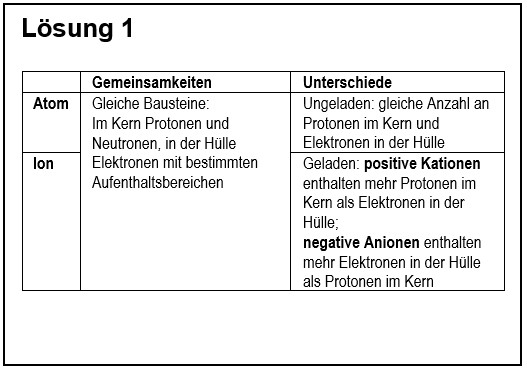
{{ | 1. Vergleiche in übersichtlicher Form ein '''Atom''' mit einem '''Ion'''! | ||
{{ | {{Lösung versteckt| | ||
{{ | [[Datei:G9_C8_AbschlA_Salze_Lsg1.jpg]] | ||
{{ | |Lösungsvorschlag|Lösung ausblenden}} | ||
{{ | 2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf! | ||
{{Lösung versteckt| | |||
{{ | [[Datei:G9_C8_AbschlA_Salze_Lsg2.jpg]] | ||
|Lösungsvorschlag|Lösung ausblenden}} | |||
{{ | 3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen. | ||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg3.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg4.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
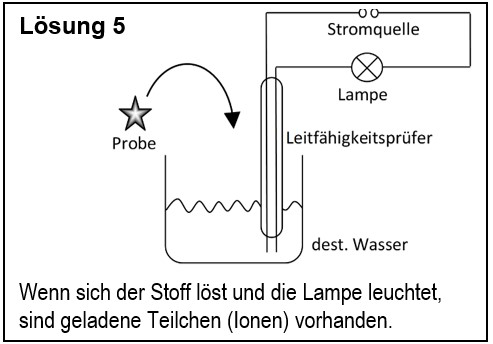
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg5.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg<sub>3</sub>N<sub>2</sub>, CaO, KI, BaCl<sub>2</sub> und Aluminiumfluorid | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg6.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li<sup>+</sup>, K, S<sup>2-</sup>, Na<sup>+</sup> | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg7.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg8.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
| | * Erklärung auf Teilchenebene als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_ClBrI_Erkl_Teilchenebene.pdf| Hier klicken]]. Auch im Buch, S. 162-163 | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Rechnen mit molaren Größen '''</span> | |||
|Inhalt= | |||
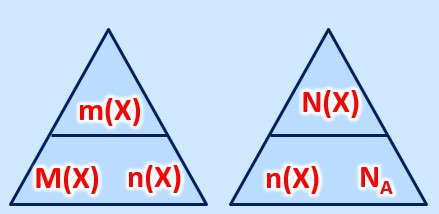
Allgemein müsst ihr mit folgenden Größen umgehen können: | |||
* Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | |||
* molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | |||
* Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math> | |||
* Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit | |||
* Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | |||
<br> | |||
Es gelten die folgenden Zusammenhänge: | |||
[[Datei:C8NTG_ReMiMoGr_2ZH_3ecke.jpg]]<br> | |||
<br><br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wochenaufgabe 1 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Fluor-Atom aufgebaut? | |||
Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 9''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 10''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl) | |||
* '''Elektronen: 9''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Es soll ein Diamant mit exakt einem Karat betrachtet werden. Das entspricht einer Masse von 0,2 Gramm. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten! | |||
{{Lösung versteckt| | |||
Hier ist die '''Stoffmenge '''gesucht, gegeben ist die '''Masse''' von Kohlenstoff. Die '''Molare Masse''' für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links. | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>n(C)= ? </math><br> | |||
'''gegeben:''' <math>m(C)= 0,2g </math>, <math>M(C)= 12,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>n(x)=\frac{m(X)}{M(X)} </math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>n(C)=\frac{m(C)}{M(C)}=\frac{0,2g}{12\frac{g}{mol}}=0,017mol </math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
=== | |Farbe= #607 | ||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Skript '''"W-Seminar"''' == | |||
| | '''1. Der Aufbau einer wissenschaftlichen Arbeit''' | ||
: '''1.1 Die Zusammenfassung''' | |||
: '''1.2 Die Einleitung''' | |||
''' | : '''1.3 Material & Methoden''' | ||
: '''1.4 Ergebnisse''' | |||
: '''1.5 Diskussion''' ''als ''[[Spezial:FilePath/WSem_B2224_0010_Aufbau.pdf|pdf-Datei]] | |||
: '''1.6 Einbindung der Arbeit in den Wissensbestand''' als [[Spezial:FilePath/WSem_B2224_0020_LitBezug.pdf|pdf-Datei]] | |||
'''2. Formale Aspekte einer wissenschaftlichen Arbeit''' | |||
: '''2.1 Das Zitieren''' ''+'' | |||
: '''2.2 Einbau von Abbildungen, Grafiken und Tabellen''' ''+'' | |||
: '''2.3 weitere formale Empfehlungen''' ''als'' [[Spezial:FilePath/WSem_B2224_0030_Formalia.pdf|pdf-Datei]] | |||
'''3. Fachlicher Hintergrund: Deskriptive Statistik''' | |||
: '''3.1 wichtige Größen''' | |||
:: 3.1.1 Lagemaße | |||
:: 3.1.2 Streuungsmaße | |||
: '''3.2 Diagrammtypen''' ''als'' [[Spezial:FilePath/WSem_B2224_0040_Fachlich.pdf|pdf-Datei]] | |||
: '''3.3 Gütekriterien''' | |||
:: 3.3.1 Reliabilität | |||
:: 3.3.2 Validität | |||
:: 3.3.3 Objektivität ''als'' [[Spezial:FilePath/WSem_B2224_0050_Fachlich2.pdf|pdf-Datei]] | |||
<br> | |||
== Skript '''"Ökologie"''' == | |||
:: Teil 1: '''"Grundbegriffe"''' als [[Spezial:FilePath/Skript_Öko_001.pdf|pdf-Datei]], Buch S. 62/63 | |||
:: Teil 2: '''"Einflussfaktoren auf Lebewesen"''' Buch, S. 64/65 + | |||
:: Teil 3: '''"Vitalitätskurven"''' als als [[Spezial:FilePath/Skript_Öko_002.pdf|pdf-Datei]], s. Buch, S. 70 | |||
:: Teil 4: '''"Nischenbildung"''' als als [[Spezial:FilePath/Skript_Öko_03.pdf|pdf-Datei]], s. Buch, S. 88/89 | |||
:: Teil 5: '''Tiergeographische Regeln''' als [[Spezial:FilePath/Skript_Öko_004.pdf|pdf-Datei]], s. Buch, S. 66/67 | |||
:: Teil 6: '''Umweltfaktor Licht bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_006.pdf|pdf-Datei]], s. Buch, S. 68 | |||
:: Teil 7: '''Umweltfaktor Wasser bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_007.pdf|pdf-Datei]], nicht explizit im Buch | |||
:: Teil 8: '''Beziehungen zwischen Lebewesen'''[[Spezial:FilePath/Skript_Öko_008.pdf|pdf-Datei]], s. Buch, S. 100 | |||
<br> | |||
: | == Skript '''"Verdauung"''' == | ||
=== Bio: Verdauungs-Skript === | |||
1. Verdauungsorgane: Überblick (nur AB im Unterricht verteilt) <br> | |||
2. Verdauungsprozesse im Mund ''als'' [[Spezial:FilePath/B10_Skript_Verdauung_1_4.pdf|pdf-Datei]] <br> | |||
3. Verdauungsprozesse im Magen ''als'' [[Spezial:FilePath/Skript_Verdauung_1_3.pdf|pdf-Datei]] (Buch, S. 26, Abs. 1-5)<br> | |||
* Einschub: Enzympraktikum ''als'' [[Spezial:FilePath/105_GA_EiPrakt_Versuchsprot_V2.pdf|pdf-Datei]] | |||
4. Verdauungsprozesse im Dünndarm ''als'' [[Spezial:FilePath/Skript_Verdauung_4.pdf|pdf-Datei]] (Buch, S. 28 bis "Der Dickdarm")<br> | |||
5. Blind- und Dickdarm ''als'' [[Spezial:FilePath/Skript_Verdauung_1_5.pdf|pdf-Datei]](Buch, S. 28 ab "Der Dickdarm")<br> | |||
* | == Skript '''"OC"''' == | ||
<span style="color:#F00;"> Neu, 10.06.21:</span><br> | |||
* Teil 1: '''Die organische Chemie''' [[Spezial:FilePath/C10EK_001_DieOrganischeChemie.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.) | |||
* Teil 2: '''Die Welt des Kohlenstoffatoms''' [[Spezial:FilePath/C10EK_002_WeltDesCAtoms.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 91 Rest + 94 | |||
* Teil 3: '''Die einfachsten organischen Moleküle: Kohlenwasserstoffe''' [[Spezial:FilePath/C10EK_003_EinfacheOrg_KWs.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 96 - 97 | |||
* Teil 4: '''Eigenschaften der Alkane''' [[Spezial:FilePath/C10EK_004_Eigenschaften_Alkane.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 100 - 101 | |||
==Lösungsvorschlag f. Arbeitsauftrag vom 29.04.== | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Lösungsvorschlag zur Dokumentation der Versuche im Video'''</span> | |||
| | |Inhalt= | ||
< | |||
''' | |||
</ | |||
| | |||
Bitte erst auf Lösung klicken, wenn ihr den Arbeitsauftrag wirklich erfüllt habt. Diese Lösung hier ist nur '''ein Vorschlag'''. Es gibt auch andere Varianten, die genauso gut sind. Falls ihr euch nicht sicher seid, ob eure Lösung auch richtig ist, schickt sie mir zum Überprüfen (am besten über den Schulmanager - bitte schreibt in den Betreff der Nachricht eure Klasse). | |||
{{Lösung versteckt| | |||
< | [[Datei:FS_AA1_FilmVersucheDokumentieren.jpg]]<br> | ||
Wenn das Bild zu klein ist, klickt mit der rechten Maustaste darauf und wählt "Bild in neuem Tab öffnen" oder so ähnlich... | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
==Arbeitsauftrag Biologie8 == | |||
* | * Heute nur eine sehr kurze Einheit. | ||
* Ihr könnt die Aufgabe allerdings erst bearbeiten, wenn wir wirklich den vorangegangenen Arbeitsauftrag erledigt habt. | |||
* Vergesst nicht, die Hausaufgabe vom letzten Mal (die ihr auch über den Schulmanager bekommen habt) mir bis Dienstag, 05.05. zu schicken. Danke! | |||
: | {{Box-spezial | ||
< | |Titel=<span style="color:#607">'''Ein Diagramm'''</span> | ||
|Inhalt= | |||
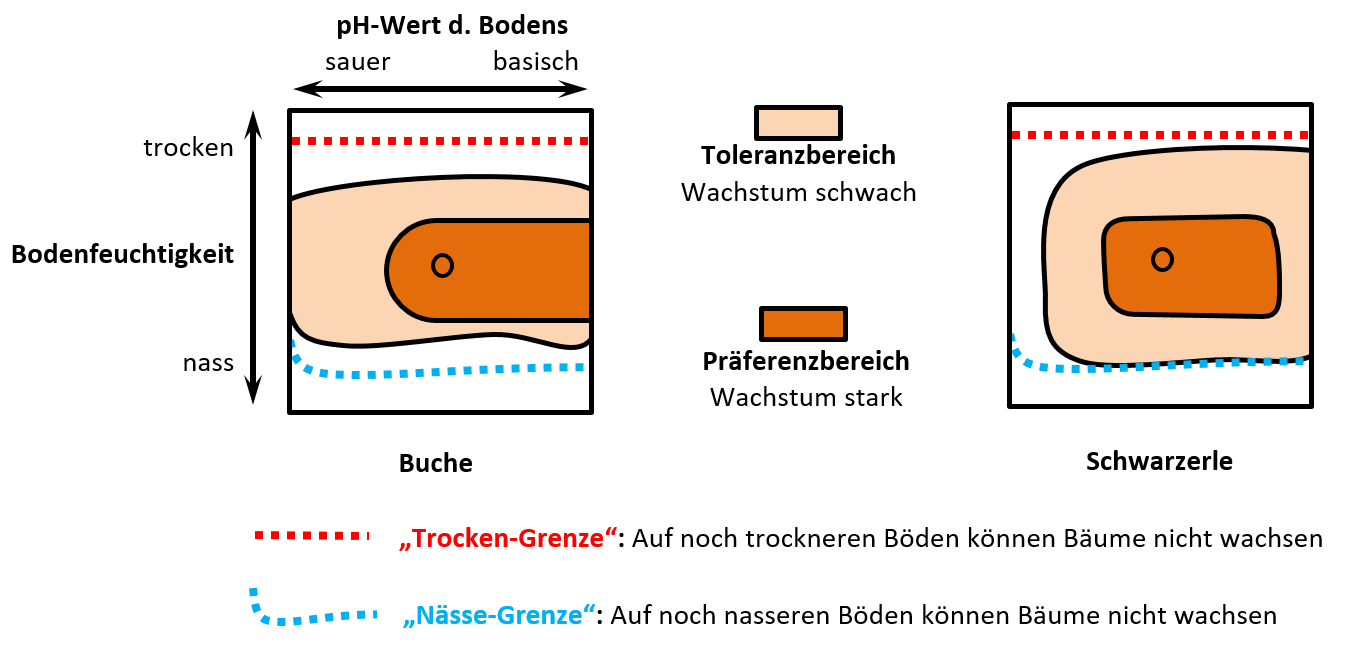
Das folgende Diagramm wurde erstellt, indem man sehr viele Buchen und Schwarzerlen im Freiland untersucht hat. Man hat beurteilt, wie gut diese Bäume wachsen und das in zwei Kategorien eingeteilt: '''Schwaches Wachstum''' und '''starkes Wachstum'''. Gleichzeitig hat man den Boden untersucht, auf dem die jeweiligen Bäume wachsen: Es wurde die Bodenfeuchte und der pH-Wert gemessen. (Falls ihr das aus der Chemie nicht mehr wisst: Der pH-Wert ist ein Maß dafür, wie sauer oder basisch etwas ist). <br> | |||
* Beschreibt das folgende Diagramm! | |||
* Eine Interpretation ist nicht nötig! | |||
* Beachtet, dass drei Parameter dargestellt sind! | |||
* Erinnert euch an die Begriff, die man für Lebewesen verwendet, die bezüglich eines Umweltfaktors entweder sehr tolerant oder sehr empfindlich sind. Versucht diese Begriff hier mit unterzubringen! | |||
[[Datei:ÖkkoNische_3dim_Baumdiagramm_Einstieg.jpg]]<br> | |||
<br> | |||
<br><br><br> | {{Lösung versteckt| | ||
Die Grafik zeigt die Vitalität von Buchen und Schwarzerlen, gemessen als Stärke des Wachstums, in Abhängigkeit vom pH-Wert und der Bodenfeuchtigkeit. <br> | |||
Man erkennt: Beide Bäume besitzen ihr Optimum bei mittleren pH-Werten und mittleren Bodenfeuchtigkeitswerten. Entfernt man sich von diesen Werten, nimmt die Stärke des Wachstums ab. <br> | |||
Die Buche ist ein Generalist (euryök) bezüglich des Parameters pH-Wert (euryacid), während die Schwarzerle auf sehr sauren Böden nicht mehr vorkommt.<br> | |||
Bezüglich der Bodenfeuchtigkeit ist die Buche etwas stärker auf mittlere Feuchtigkeitswerte spezialisiert, während sich die Schwarzerle hier eher generalistisch verhält. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
< | |Rahmenfarbe= #DFB | ||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
==Arbeitsauftrag Chemie9== | |||
: | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Wiederholung'''</span> | |||
|Inhalt= | |||
Mir ist aufgefallen, dass der letzte Arbeitsauftrag tatsächlich etwas anspruchsvoll war! - Deswegen heut nur ein kurzes Video von Mai. Die macht das super :) <br> | |||
* Einfach anschauen! | |||
* Wer beim letzten Arbeitsauftrag Schwierigkeiten hatte, nach dem Video einfach noch mal probieren! | |||
{{#ev:youtube|0bvldHVL_TU}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#070">'''Das war es schon für heute!'''</span> | |||
|Inhalt= | |||
Verbesserung der Hausaufgabe: | |||
* Das einzige bei Raumtemperatur flüssige Metall ist Quecksilber (kann man aus dem PSE ablesen, wenn man die Schmelzpukte auf der Rückseite anschaut: -39°C) | |||
* Ein Metall, das in der Hand schmilzt: Gallium (Smp.: 30°C). Wer möchte, kann das folgende Video schauen, in dem ein Mann mit Gallium herumspielt (Achtung: Gallium ist giftig uns sollte nicht angefasst werden. Ich schätze aber, das man in Deutschland sowieso nicht so einfach an reines Gallium kommt) | |||
'' | |||
</ | |||
{{#ev:youtube|4u6A40QTWVI}} | |||
* Eine Legierung ist eine stabile "Mischung" verschiedener Metalle. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
: | {{Box-spezial | ||
|Titel=<span style="color:#070">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Keine Hausaufgabe, da das die letzte Stunde vor den Ferien war. Erholt euch gut, trotz Ausgangsbeschränkungen und dem Fall, dass ihr eventuell unter Quarantäne steht. | |||
|Farbe= #070 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
<br> | |||
==Testseiten== | |||
[[Benutzer:Thomas_Lux/Test Eiweiße|Eiweiß-Test-Seite]]<br> | |||
[[Benutzer:Thomas_Lux/Test H5P|H5P-Test-Seite]]<br> | |||
[[Benutzer:Thomas_Lux/Test Q11-Struktur|Q11-Struktur-Test-Seite]]<br> | |||
[[Benutzer:Thomas_Lux/Test_Oberstufe|Oberstufen-Testseite]] | |||
< | |||
< | |||
==verlinkte Seiten== | |||
[[Corona-Arbeitsaufträge (Bio) LUX| Zu den Arbeitsaufträgen in Bio (Corona)]]<br> | |||
[[Corona-Arbeitsaufträge (Chemie) LUX| Zu den Arbeitsaufträgen Chemie (Corona)]]<br> | |||
[[Schulentwicklung am RMG|Zur Schulentwicklungs-Testseite]] <br> | |||
[[Studien- und Berufsorientierung am RMG (Oberstufe)|Zur Studien- und Berufsorientierung]]<br> | |||
[[Studien- und Berufsorientierung am RMG (Mittelstufe)|Zur Studien- und Berufsorientierung der Mittelstufe]]<br> | |||
[[Biologie-Rätsel des Monats| Biologie-Rätsel des Monats]]<br> | |||
[[Q11_Bio_LUX| Q11 Biologie]]<br> | |||
<br> | |||
==Biologie== | ==Biologie== | ||
| Zeile 524: | Zeile 787: | ||
B10_VerdauMund_Bild4.jpg|Erklärung | B10_VerdauMund_Bild4.jpg|Erklärung | ||
</gallery> | </gallery> | ||
{{Box-spezial | |||
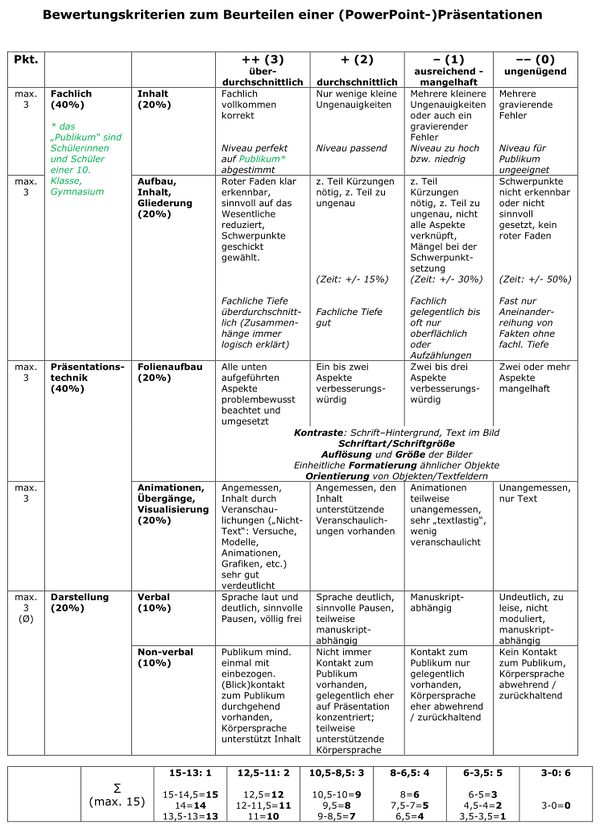
|Titel=<span style="color:#607">'''Referatsrunde'''</span> | |||
|Inhalt= | |||
Montag 25.04. | |||
* Person 1, Thema: XXX; Person 1, Thema: XXX; Person 1, Thema: XXX | |||
Dienstag 26.04.. | |||
* Person 2, Thema: XXX; Person 3, Thema: XXX; Person 4, Thema: XXX | |||
Montag 02.05. | |||
* Person 5, Thema: XXX; Person 6, Thema: XXX; Person 7, Thema: XXX | |||
Dienstag 03.05. | |||
* Person 8, Thema: XXX; Person 9, Thema: XXX; Person 10, Thema: XXX | |||
Montag 09.05. | |||
* Person 11, Thema: XXX; Person 12, Thema: XXX; Person 13, Thema: XXX | |||
Dienstag 10.05. | |||
* Person 14, Thema: XXX; Person 15, Thema: XXX; Person 16, Thema: XXX | |||
Montag 16.05. | |||
* Person 17, Thema: XXX; Person 18, Thema: XXX; Person 19, Thema: XXX | |||
Dienstag 17.05. | |||
* Person 20, Thema: XXX; Person 21, Thema: XXX; Person 22, Thema: XXX | |||
Montag 23.05. | |||
* Person 23, Thema: XXX; Person 24, Thema: XXX; Person 25, Thema: XXX | |||
Dienstag 24.05. | |||
* Person 26, Thema: XXX; Person 27, Thema: XXX; Person 28, Thema: XXX | |||
Montag 30.05. | |||
* Person 29, Thema: XXX; Person 30, Thema: XXX; Person 31, Thema: XXX | |||
Dienstag 31.05. | |||
* Ersatz1, Thema: XXX; Ersatz2, Thema: XXX; Ersatz3, Thema: XXX | |||
<br><br> | |||
Bewertungskriterien: <br> | |||
[[Datei:2022_Bewkrit_Ref.jpg|600px]] | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
==Chemie== | ==Chemie== | ||
| Zeile 532: | Zeile 833: | ||
</gallery> | </gallery> | ||
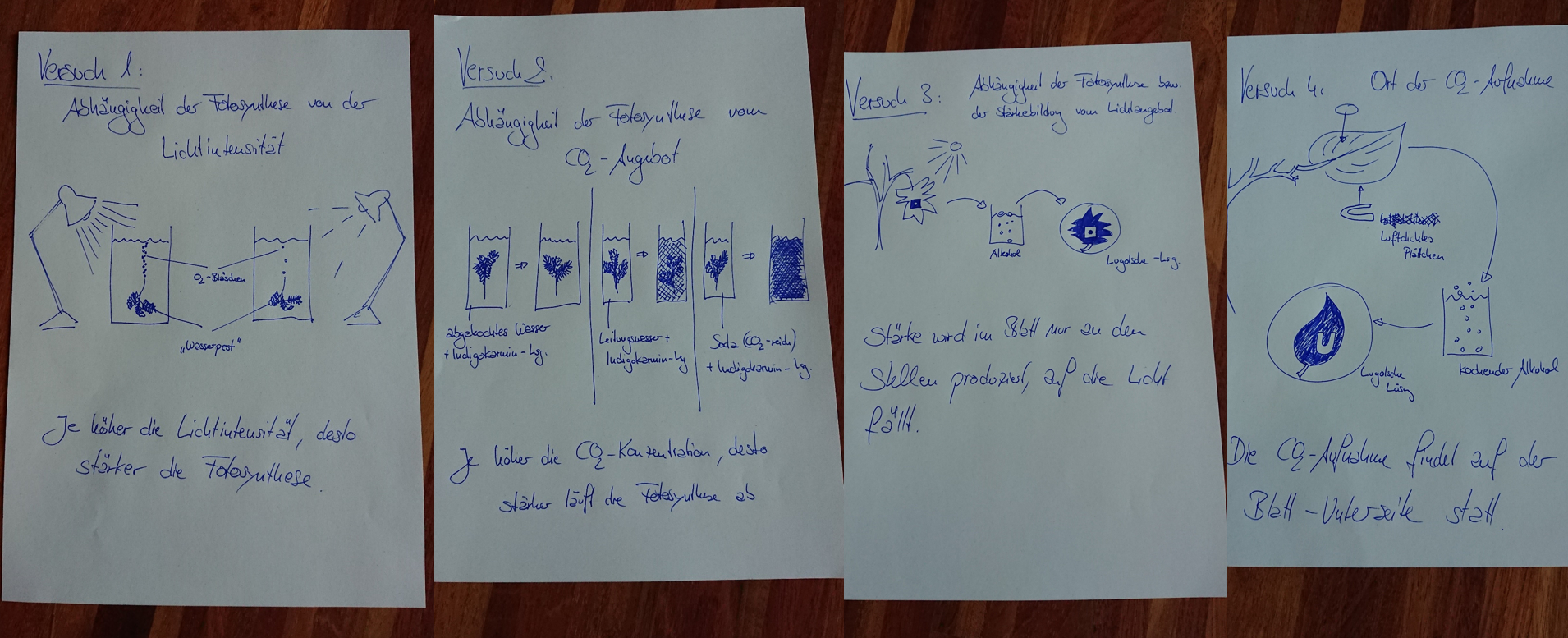
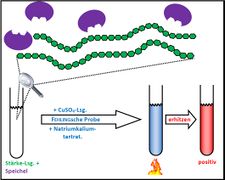
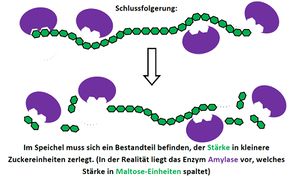
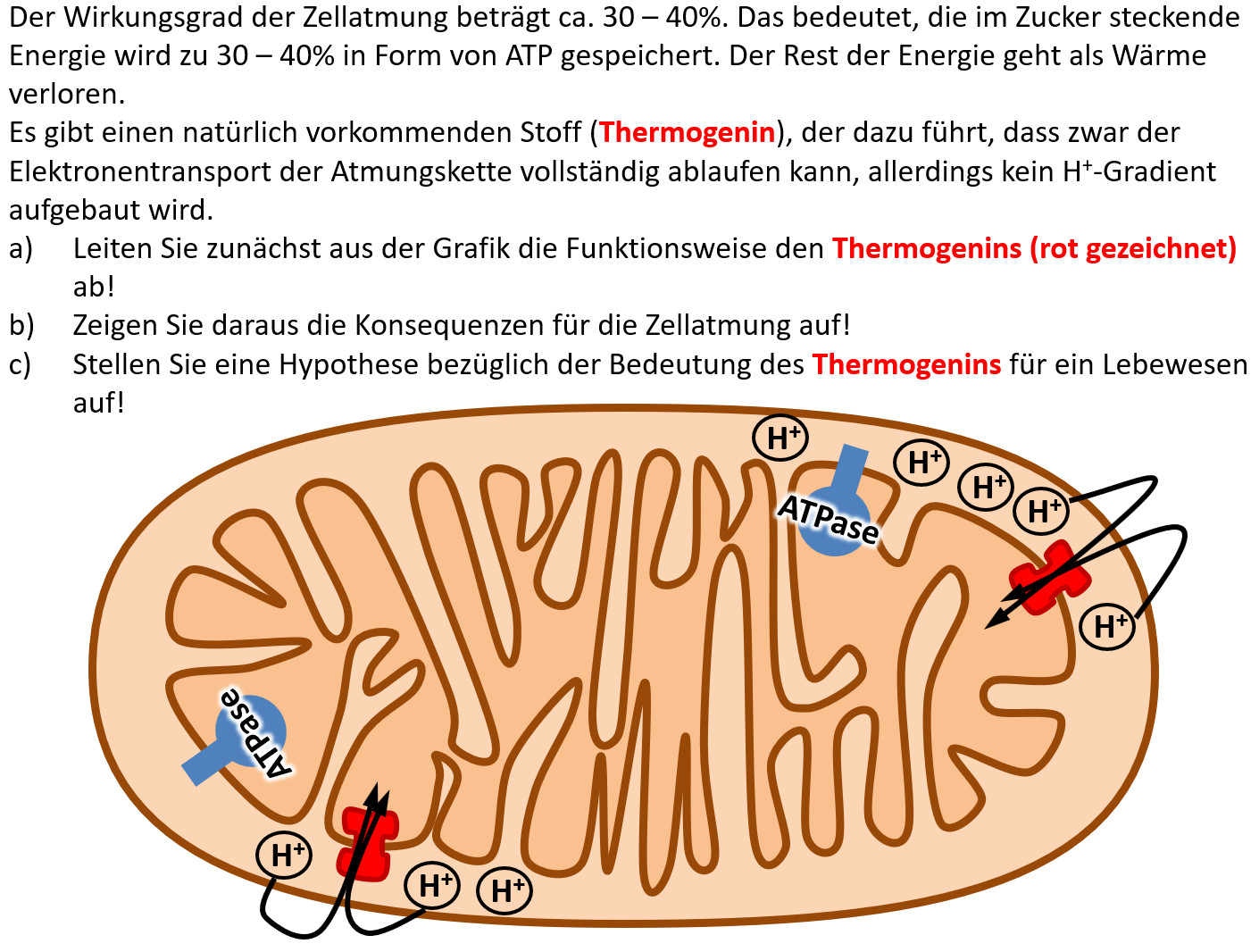
<span style="color:#080">'''Hausaufgabe:''' Bearbeitet die folgende Aufgabe! </span><br> | |||
[[Datei:2340_A_Thermogenin.jpg]] | |||
==Seminarangebot== | |||
Nachfolgend aufgeführt sind die im nächsten Schuljahr angebotenen W- und P-Seminare. Zusätzlich zu den bereits per Link über den Schulmanager verschickten '''Konzepten''' bieten die Lehrkräfte in der '''Woche vom 17.01. - 21.01 2022''' noch Pausentermine an um Fragen zu ihrem Seminar zu beantworten. Diese individuellen Termine sind hier in der Liste veröffentlicht und bereits über die Klassleiter weitergegeben worden.<br> | |||
<br> | |||
Hinweis: Es macht keinen großen Sinn an einer Konferenz eines Seminars teilzunehmen, das ihr sowieso zu 100% wählen werdet. Häufig stellt sich aber die Frage, welches Seminar man denn noch als Zweit- oder Drittwunsch nehmen möchte. Es bietet sich also eher an, Konferenzen zu besuchen bzw. bei Lehrkräften nachzufragen von Seminaren, bei denen ihr euch unsicher seid.<br> | |||
<br> | |||
Sowohl von den W- als auch den P-Seminaren muss jede Schülerin und jeder Schüler '''drei '''auswählen, denen sie bzw. er zugeordnet werden möchte. Mit den Ziffern 1 (Erstwunsch, "Lieblings-Seminar") bis 3 (Drittwunsch, "akzeptabel") kann eine Priorisierung vorgenommen werden. Die Abgabe der Wahlzettel muss zuverlässig bis Freitag, 28.01.2022 erfolgen. | |||
''' | |||
''' | |||
Version vom 11. September 2024, 14:38 Uhr
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
AB inkl. Musterlösung zum Thema "Säuren und Säure-Reste": als pdf-Datei
Aktuelle Seiten in Bearbeitung
8a NTG
9a CSG
9e CNTG
10d CNTG
10e EK
Q11
Q12 neu
Q12 alt
10d_2019_20/Chemie
Benutzer:Thomas_Lux/G9_Q12_Bio_eA
Q11-Struktur-Test-Seite
Q12 Sozialverhalten
Oberstufen-Testseite
Rhetorik
G92 C8 NTG
chemische Gleichungen aufstellen
Neu: 09./11.01.:
Chemische Reaktionsgleichungen aufstellen
Lösungen für Aufgaben am 27.11.
Bearbeitet die Aufgaben auf der zweiten Seite des aktuellen Arbeitsblattes. Falls ihr es nicht dabei haben solltet, hier die pdf-Datei.
- Arbeitet zu zweit oder dritt!
- Sucht zunächst gemeinsam nach einer Lösung.
- Nur eine Person darf auf "Lösung" klicken!
- War eure Lösung richtig, geht zur nächsten Aufgabe.
- War eure Lösung falsch, muss die Person, die die Lösung angeschaut hat der anderen Person Tipps geben, was schief gelaufen ist. Wenn ihr auf den Button "Wie kommt man drauf" klickt, gibt es am Anfang noch ein paar Erklärungs-Tipps.
- Bei der nächsten Aufgabe darf die andere Person die Lösung anklicken.
Bleibt beim bekannten Lösungsschema!
- Legt zunächst fest, was Edukt und was Produkt ist.
- Überlegt, ob vorkommende Elemente evtl. molekular formuliert werden müssen.
- Gleicht erst zum Schluss aus.
Chemische Reaktionen einteilen
Aufgaben zum Üben
1. Vergleiche in übersichtlicher Form ein Atom mit einem Ion!
2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf!
3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen.
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist.
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht.
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg3N2, CaO, KI, BaCl2 und Aluminiumfluorid
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li+, K, S2-, Na+
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid.
- Erklärung auf Teilchenebene als .pdf-Datei: Hier klicken. Auch im Buch, S. 162-163
Skript "W-Seminar"
1. Der Aufbau einer wissenschaftlichen Arbeit
- 1.1 Die Zusammenfassung
- 1.2 Die Einleitung
- 1.3 Material & Methoden
- 1.4 Ergebnisse
- 1.5 Diskussion als pdf-Datei
- 1.6 Einbindung der Arbeit in den Wissensbestand als pdf-Datei
2. Formale Aspekte einer wissenschaftlichen Arbeit
- 2.1 Das Zitieren +
- 2.2 Einbau von Abbildungen, Grafiken und Tabellen +
- 2.3 weitere formale Empfehlungen als pdf-Datei
3. Fachlicher Hintergrund: Deskriptive Statistik
- 3.1 wichtige Größen
- 3.1.1 Lagemaße
- 3.1.2 Streuungsmaße
- 3.2 Diagrammtypen als pdf-Datei
- 3.3 Gütekriterien
- 3.3.1 Reliabilität
- 3.3.2 Validität
- 3.3.3 Objektivität als pdf-Datei
Skript "Ökologie"
- Teil 1: "Grundbegriffe" als pdf-Datei, Buch S. 62/63
- Teil 2: "Einflussfaktoren auf Lebewesen" Buch, S. 64/65 +
- Teil 3: "Vitalitätskurven" als als pdf-Datei, s. Buch, S. 70
- Teil 4: "Nischenbildung" als als pdf-Datei, s. Buch, S. 88/89
- Teil 5: Tiergeographische Regeln als pdf-Datei, s. Buch, S. 66/67
- Teil 6: Umweltfaktor Licht bei Pflanzen pdf-Datei, s. Buch, S. 68
- Teil 7: Umweltfaktor Wasser bei Pflanzen pdf-Datei, nicht explizit im Buch
- Teil 8: Beziehungen zwischen Lebewesenpdf-Datei, s. Buch, S. 100
Skript "Verdauung"
Bio: Verdauungs-Skript
1. Verdauungsorgane: Überblick (nur AB im Unterricht verteilt)
2. Verdauungsprozesse im Mund als pdf-Datei
3. Verdauungsprozesse im Magen als pdf-Datei (Buch, S. 26, Abs. 1-5)
- Einschub: Enzympraktikum als pdf-Datei
4. Verdauungsprozesse im Dünndarm als pdf-Datei (Buch, S. 28 bis "Der Dickdarm")
5. Blind- und Dickdarm als pdf-Datei(Buch, S. 28 ab "Der Dickdarm")
Skript "OC"
Neu, 10.06.21:
- Teil 1: Die organische Chemie pdf-Datei, s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.)
- Teil 2: Die Welt des Kohlenstoffatoms pdf-Datei, s. Buch (Galvani S2), S. 91 Rest + 94
- Teil 3: Die einfachsten organischen Moleküle: Kohlenwasserstoffe pdf-Datei, s. Buch (Galvani S2), S. 96 - 97
- Teil 4: Eigenschaften der Alkane pdf-Datei, s. Buch (Galvani S2), S. 100 - 101
Lösungsvorschlag f. Arbeitsauftrag vom 29.04.
Arbeitsauftrag Biologie8
- Heute nur eine sehr kurze Einheit.
- Ihr könnt die Aufgabe allerdings erst bearbeiten, wenn wir wirklich den vorangegangenen Arbeitsauftrag erledigt habt.
- Vergesst nicht, die Hausaufgabe vom letzten Mal (die ihr auch über den Schulmanager bekommen habt) mir bis Dienstag, 05.05. zu schicken. Danke!
Arbeitsauftrag Chemie9
Testseiten
Eiweiß-Test-Seite
H5P-Test-Seite
Q11-Struktur-Test-Seite
Oberstufen-Testseite
verlinkte Seiten
Zu den Arbeitsaufträgen in Bio (Corona)
Zu den Arbeitsaufträgen Chemie (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Q11 Biologie
Biologie
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
Chemie
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
Hausaufgabe: Bearbeitet die folgende Aufgabe!
Seminarangebot
Nachfolgend aufgeführt sind die im nächsten Schuljahr angebotenen W- und P-Seminare. Zusätzlich zu den bereits per Link über den Schulmanager verschickten Konzepten bieten die Lehrkräfte in der Woche vom 17.01. - 21.01 2022 noch Pausentermine an um Fragen zu ihrem Seminar zu beantworten. Diese individuellen Termine sind hier in der Liste veröffentlicht und bereits über die Klassleiter weitergegeben worden.
Hinweis: Es macht keinen großen Sinn an einer Konferenz eines Seminars teilzunehmen, das ihr sowieso zu 100% wählen werdet. Häufig stellt sich aber die Frage, welches Seminar man denn noch als Zweit- oder Drittwunsch nehmen möchte. Es bietet sich also eher an, Konferenzen zu besuchen bzw. bei Lehrkräften nachzufragen von Seminaren, bei denen ihr euch unsicher seid.
Sowohl von den W- als auch den P-Seminaren muss jede Schülerin und jeder Schüler drei auswählen, denen sie bzw. er zugeordnet werden möchte. Mit den Ziffern 1 (Erstwunsch, "Lieblings-Seminar") bis 3 (Drittwunsch, "akzeptabel") kann eine Priorisierung vorgenommen werden. Die Abgabe der Wahlzettel muss zuverlässig bis Freitag, 28.01.2022 erfolgen.