Benutzer:Thomas Lux/Chemische Gleichungen aufstellen
Arbeitsauftrag für den 30.11.
Teil 1: Chemische Reaktionsgleichungen aufstellen
Bearbeitet die Aufgaben auf der zweiten Seite des aktuellen Arbeitsblattes. Falls ihr es nicht dabei haben solltet, hier die pdf-Datei.
- Arbeitet zu zweit oder dritt!
- Sucht zunächst gemeinsam nach einer Lösung.
- Nur eine Person darf hier im WIKI auf "Lösung" klicken!
- War eure Lösung richtig, geht zur nächsten Aufgabe.
- War eure Lösung falsch, muss die Person, die die Lösung angeschaut hat der anderen Person Tipps geben, was schief gelaufen ist. Wenn ihr auf den Button "Wie kommt man drauf" klickt, gibt es am Anfang noch ein paar Erklärungs-Hilfen.
- Bei der nächsten Aufgabe darf die andere Person die Lösung anklicken.
- Arbeitet bis 12:40 Uhr an diesem Teil. Egal wie weit ihr gekommen seid: Ab 12:40 Uhr wechselt ihr spätestens zu Teil 2!
Bleibt beim bekannten Lösungsschema!
- Legt zunächst fest, was Edukt und was Produkt ist.
- Überlegt, ob vorkommende Elemente evtl. molekular formuliert werden müssen.
- Gleicht erst zum Schluss aus.
Aufgabe 1 (AB-Rückseite)
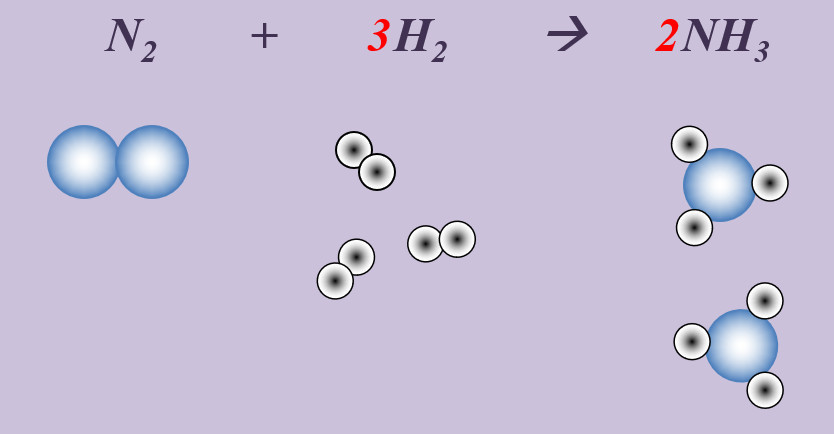
Stickstoff reagiert mit Wasserstoff zu Ammoniak (NH3).
Schritt 1: Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden
N + H --> NH3
Schritt 2: Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier: Stickstoff, N und Wasserstoff, H)
N2 + H2 --> NH3
Schritt 3: Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante:
Schritt 3a: Man kann erkennen, dass bisher links zwei N-Atome auftauchen (im N2-Molekül), rechts aber nur eines. Also könnte man die Anzahl rechts durch den Koeffizienten 2 vor dem Ammoniak erhöhen:
N2 + H2 --> 2 NH3
Schritt 3b: Jetzt ist die Anzahl der N-Atome links und rechts ausgeglichen. Aber die Anzahl der H-Atome noch nicht, aktuell liegen links nur zwei vor, rechts sechs. Durch den Koeffizienten 3 vor dem Wasserstoffmolekül wird die Gleichung richtig gestellt.
N2 + 3 H2 --> 2 NH3
Aufgabe 2 (AB-Rückseite)
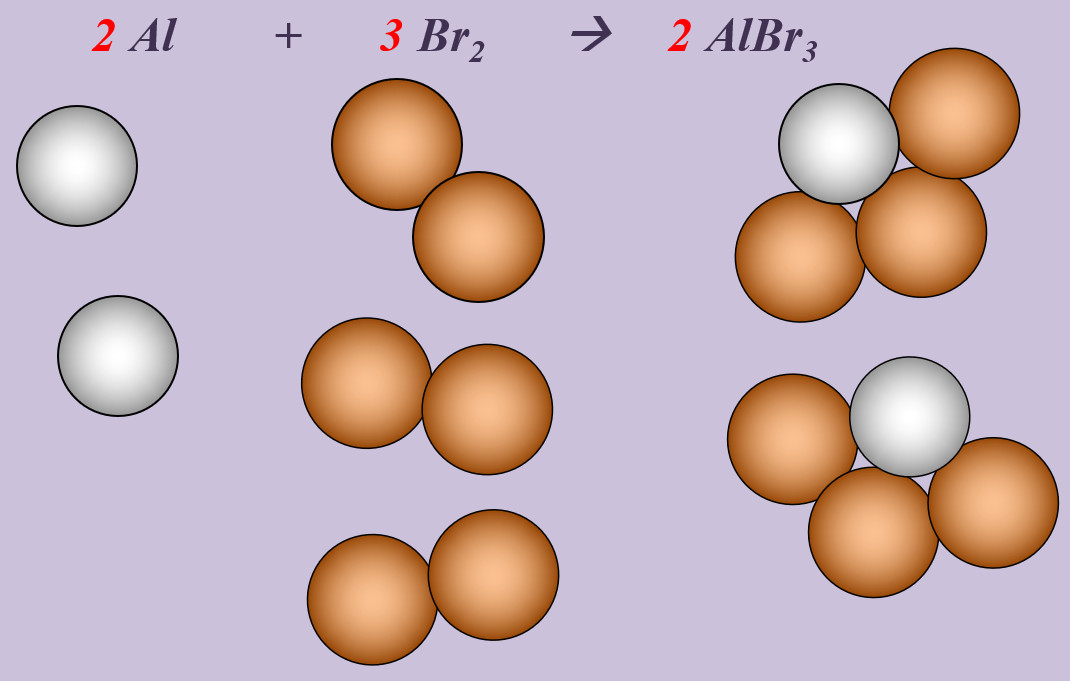
Aluminium reagiert mit Brom zu Aluminiumbromid (AlBr3).
Schritt 1: Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden
Al + Br --> AlBr3
Schritt 2: Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier Brom, Br)
Al + Br2 --> AlBr3
Schritt 3: Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante:
Schritt 3a: Man kann erkennen, dass bisher links zwei Br-Atome auftauchen (im Br2-Molekül), rechts aber drei. Also könnte man die Anzahl links durch den Koeffizienten 2 vor Br erhöhen. Das würde aber nichts bringen, denn dann hätte man links 4 Br-Atome, rechts aber nur drei:
Al + 2 Br2 --> AlBr3
Schritt 3b: Also muss man auch rechts einen Koeffizienten 2 vor das Aluminiumbromid schreiben, dann liegen dort insgesamt 6 Br-Atome vor und wenn man auf der linken Seite anstatt dem Koeffizienten 2 eine 3 verwendet, liegen dort auch 6 Br-Atome vor. Die Br-Atome wären damit ausgeglichen:
Al + 3 Br2 --> 2 AlBr3
Schritt 3c: Dann kann man sich dem anderen Element zuwenden: Aluminium. Hier liegen nach aktuellem Stand auf der rechten Seite 2 Al-Atome vor, auf der linken nur 1. Durch den Koeffizienten 2 auf der linken Seite vor dem Aluminium kann das ausgeglichen werden:
2 Al + 3 Br2 --> 2 AlBr3
Aufgabe 3 (AB-Rückseite)
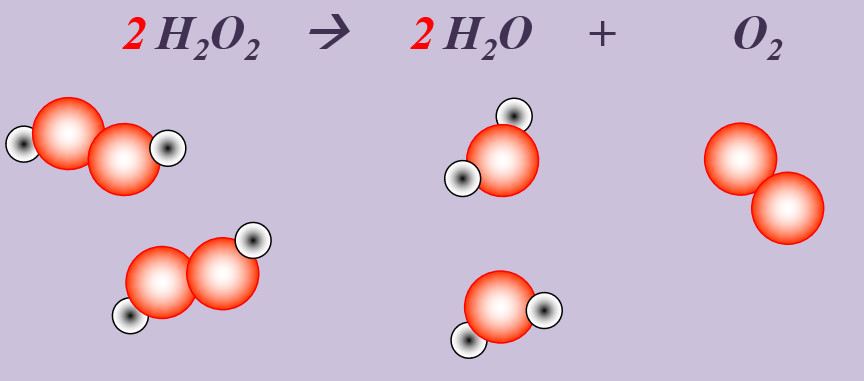
Wasserstoffperoxid (H2O2) zerfällt an der Luft zu Wasser und Sauerstoff.
Schritt 1: Edukte und Produkte festlegen, chemische Symbole und Formeln verwenden
H2O2 --> H2O + O
Schritt 2: Überlegen, ob Elemente vorkommen, die Bestandteil von "HONClBrIF" sind. Wenn ja --> molekular formulieren! (Hier Sauerstoff, O)
H2O2 --> H2O + O2
Schritt 3: Ausgleichen! Hier gibt es mehrere Möglichkeiten. Eine Variante:
Schritt 3a: Man kann erkennen, dass bisher links nur zwei O-Atome auftauchen (im H2O2-Molekül), rechts aber drei (eins im H2O-Molekül, zwei im O2-Molekül. Also könnte man die Anzahl links durch den Koeffizienten 2 vor dem Wasserstoffperoxid erhöhen:
2 H2O2 --> H2O + O2
Schritt 3b: Scheinbar passt jetzt gar nichts mehr. Aber wenn man einen kühlen Kopf behält sieht, man, dass jetzt link zwei Wasserstoff-Atome und ein Sauerstoff-Atom zu viel sind. Das entspricht zusammen genau einem Wasser-Molekül, also davor einen Koeffizienten 2:
2 H2O2 --> 2 H2O + O2
Ta da!
Aufgabe 4 (AB-Rückseite)
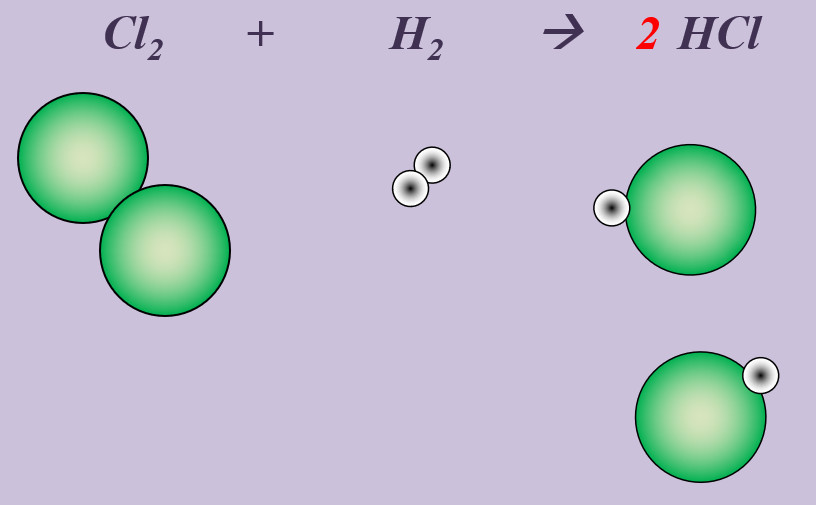
Chlor reagiert in einer heftigen Reaktion mit Wasserstoff zu Hydrogenchlorid (HCl).
Aufgabe 5 (AB-Rückseite)
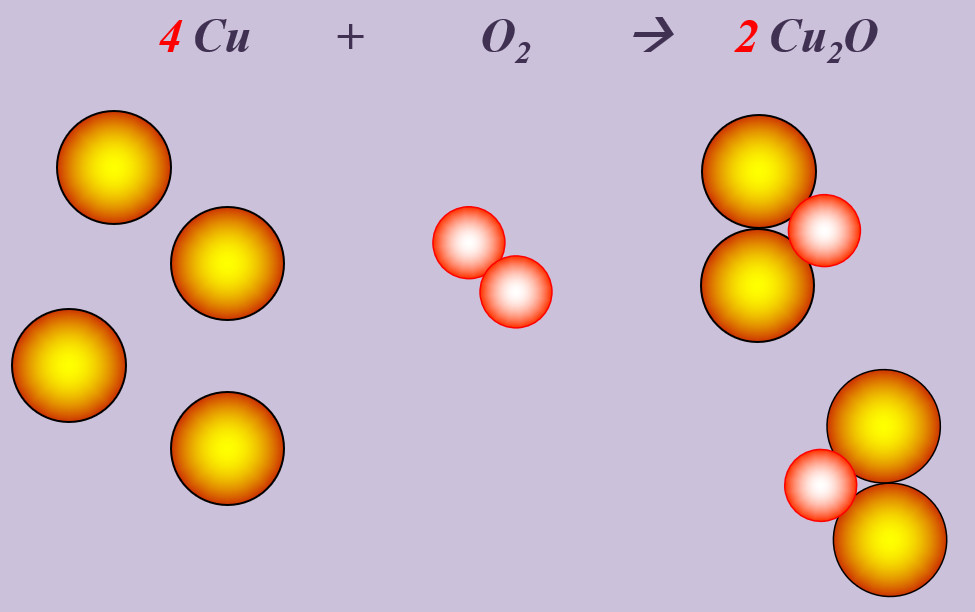
Kupfer kann beim starken Erhitzen mit Sauerstoff zu Kupfer(I)-oxid (Cu2O) reagieren.
Aufgabe 6 (AB-Rückseite) - ab jetzt ohne Kugeln
Unter anderen Bedingungen reagiert Kupfer mit Sauerstoff zu Kupfer(II)-oxid (CuO)
2 Cu + O2 --> 2 CuO
Aufgabe 7 (AB-Rückseite) - ab jetzt ohne Kugeln
Bei der Fotosynthese von Pflanzen wird Kohlenstoffdioxid (CO2) aus der Luft und Wasser aus dem Boden zu Traubenzucker (C6H12O6) und Sauerstoff umgewandelt.
6 CO2 + 6 H2O --> C6H12O6 + 6 O2
Aufgabe 8 (AB-Rückseite) - ab jetzt ohne Kugeln
Eisen verbrennt in einem Standzylinder mit Chlor zu Eisen(III)-chlorid (FeCl3).
2 Fe + 3 Cl2 --> 2 FeCl3
Aufgabe 9 (AB-Rückseite) - ab jetzt ohne Kugeln
Natrium verbrennt in einem Standzylinder mit Brom (wird als Gas aufgefasst) zu Natriumbromid (NaBr).
2 Na + Br2 --> 2 NaBr
Aufgabe 10 (AB-Rückseite) - ab jetzt ohne Kugeln
Um Salpetersäure (HNO3) herzustellen, lässt man Schwefelsäure (H2SO4) mit Natriumnitrat (NaNO3) reagieren. Als Nebenprodukt entsteht auch Natriumhydrogensulfat (NaHSO4)
H2SO4 + NaNO3 --> HNO3 + NaHSO4
Aufgabe 11 (AB-Rückseite) - ab jetzt ohne Kugeln
Eine anorganische „Universalverbindung“, die in etlichen Produkten des täglichen Lebens enthalten ist, ist das Titandioxid (TiO2). Man gewinnt es durch Lösen der Verbindung TiO(SO4) in Wasser. Daneben entsteht dabei auch Schwefelsäure (H2SO4)
TiO(SO4) + H2O --> TiO2 + H2SO4
Teil 2: Chemische Reaktionen einteilen
Das folgende Video (3:28) stammt aus der Corona-Zeit und wurde von einem Lehrer für das Home-Schooling angefertigt. Dort werden drei Grundtypen chemischer Reaktionen theoretisch vorgestellt. Prägt euch die Begriffe ein, im Anschluss sollt ihr sie anwenden!
Aufgaben: Stellt für die folgenden Reaktionen die chemische Gleichung auf. Gebt an, ob es sich um eine Synthese, Analyse oder Umsetzung handelt! Zeichnet zusätzlich ein Diagramm, das die Innere Energie im Verlauf der Zeit bei der Reaktion darstellt und entscheidet, ob es sich um eine exotherme oder endotherme Reaktion handelt!
- Eisenpulver und Schwefelpulver wird vermischt. Man taucht einen glühenden Nagel kurz in das Gemisch und es beginnt eine starke Reaktion. Nach und nach glüht das gesamte Gemisch auf. Am Ende liegt der Stoff Pyrit (FeS2) vor.
- Chemische Gleichung: Fe + 2 S --> FeS2
- Grundtyp: Synthese. Begründung: Aus mehreren Edukten wird ein Produkt
- energetische Betrachtung: Exotherm. Begründung: Es muss nur einmal kurz Energie zugeführt werden (glühender Nagel), dann läuft die Reaktion vollständig alleine ab und gibt ständig Energie ab (das gesamte Gemisch glüht auf).
- Quecksilberoxid (HgO) wird in einem Reagenzglas mit dem Bunsenbrenner stark erhitzt. Solange sich das RG in der BB-Flamme befindet, strömt Sauerstoff aus dem RG und es bilden sich am Rand kleine Quecksilbertröpfchen
- Chemische Gleichung: 2 HgO --> 2 Hg + O2
- Grundtyp: Analyse. Begründung: Aus einem Edukt werden mehrere Produkte
- energetische Betrachtung: Endotherm. Begründung: Die Reaktion läuft nur, solange man Energie hineinsteckt.
- In einem RG befinden sich Wasser und ein Stück Magnesium-Band. Am oberen Ende ist das RG mit einem Stopfen verschlossen, in dem ein dünnes Glasrohr steckt. Das Wasser im RG wird vorsichtig erhitzt, so dass es verdampft und alle anderen Gase aus dem RG verbrennt. Es liegt also ein Stück Magensiumband in gasförmigem Wasser vor. Entzünden man das Magnesiumband dann an einer Stelle, reagiert es mit dem Wasser. Sobald die Reaktion gestartet ist, reagiert das gesamte Magnesiumband nach und nach auf der gesamten Länge unter Freisetzung großer Mengen von Licht und Wärme. Nach der Reaktion bleibt der der Stoff Magnesiumoxid (MgO) im RG übrig und während der Reaktion kann man zeigen, dass aus dem dünnen Glasrohr im Stopfen Wasserstoff entweicht.
- Chemische Gleichung: Mg + H2O --> MgO + H2
- Grundtyp: Umsetzung. Begründung: Aus mehreren Edukten werden mehrere Produkte
- energetische Betrachtung: Exotherm. Begründung: Man muss die Reaktion nur einmal kurz durch Energiezufuhr starten (man entzündet Mg an einer Stelle). Danach läuft die Reaktion durchgängig ab und setzt permanent große Mengen Licht und Wärme frei.
Hier ein paar Videos, in denen ihr die chemischen Reaktionen dieser Einheit sehen könnt:
Ein relativ ausführliches Video zur Synthese von Eisensulfid (Pyrit):
Die Thermolyse von Quecksilberoxid:
Die Umsetzung von Magnesium in Wasserdampf (mit lustiger Musik... YEAH!):
Hausaufgabe (könnt ihr auch sofort erledigen):