9a 2020 21/Chemie
Inhaltsverzeichnis
- 1 Lernen zu Hause
- 1.1 Distanzunterricht Montag, 08.02.
- 1.2 Distanzunterricht Freitag, 05.02.
- 1.3 Distanzunterricht Dienstag, 02.02.
- 1.4 Distanzunterricht Freitag, 29.01.
- 1.5 Distanzunterricht Dienstag, 26.01.
- 1.6 Distanzunterricht Freitag, 22.01.
- 1.7 Distanzunterricht Montag, 18.01.
- 1.8 Distanzunterricht Freitag, 15.01.
- 1.9 Distanzunterricht Dienstag, 12.01.
- 1.10 Distanzlernen für Freitag, 18.12.
- 1.11 Quarantäne-Einheit 2
- 1.12 Quarantäne-Einheit 1
- 2 Versuchsprotokolle
- 3 Lösungen
Lernen zu Hause
Distanzunterricht Montag, 08.02.
Diese Unterrichtsstunde findet im Austausch zur Chemie-Stunde vom kommenden Freitag, 12.02. statt. Es ist die letzte Einheit mit neuen Inhalten. Morgen (Dienstag, 09.02.) findet nur noch eine Abschlussüberprüfung statt, ob ihr die Elektronenbesetzung bei Atomen verstanden habt.
- Im "normalen" Unterricht würde ich ein Arbeitsblatt austeilen, welches ihr bearbeiten müsst. In dieser Online-Version ist das nicht nötig, es wird ausgefüllt im Hefteintrag zum Herunterladen enthalten sein.
- Ihr benötigt euer Schulbuch, ein PSE, Stift, Zettel und eine einigermaßen stabile Internetverbindung
- Der passende Hefteintrag kann nach der Einheit hier heruntergeladen werden: pdf-Datei
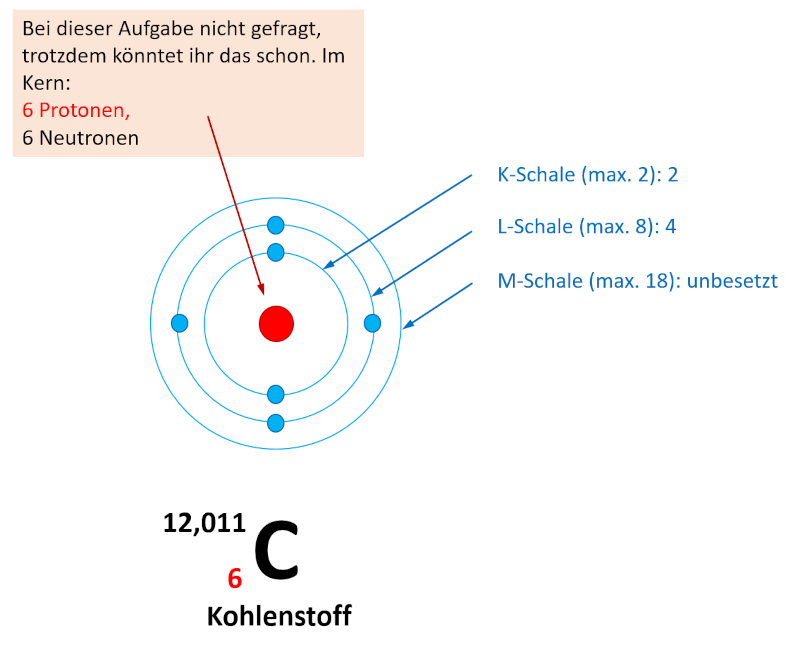
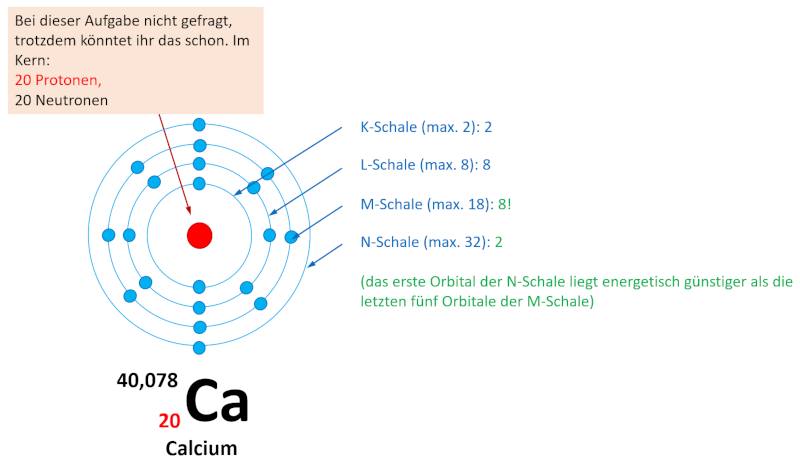
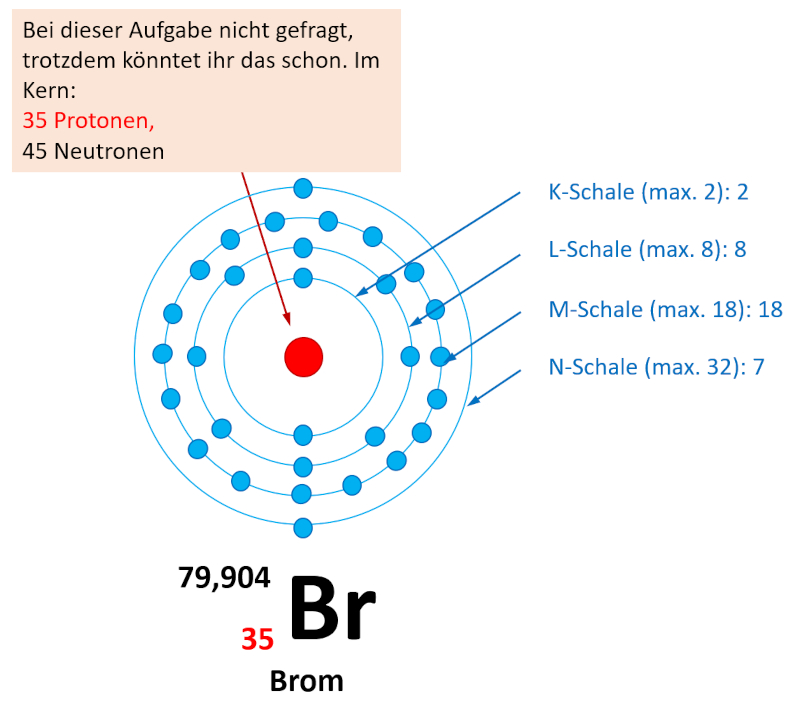
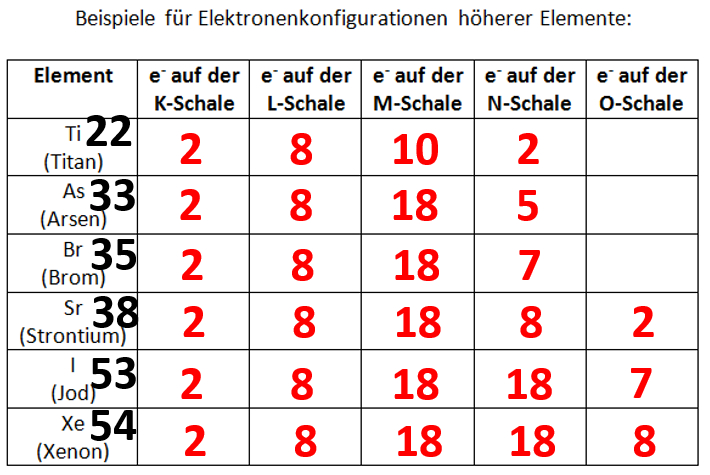
Je nachdem wie schnell ihr die letzte Online-Einheit erledigt habt, seid ihr evtl. mit der Aufgabe 1 im Buch, S. 70 schon fertig geworden. Falls nicht, bearbeitet diese Aufgabe jetzt und vergleicht dann mit der Lösung. Falls ihr diese Aufgabe schon einmal gelöst habt, dann frischt euer Wissen nur noch einmal kurz wieder auf: Entscheidet euch für eines der vier Atome und bestimmt nur für dieses Atom die Elektronenkonfiguration!
In der letzten Einheit wurde schon angesprochen, dass die Elektronen, die auf der äußersten Schale eines Atoms sitzen, großen Einfluss auf das Reaktionsverhalten des Stoffes haben. Ein Beispiel: Die Stoffe Lithium, Natrium und Kalium besitzen alle ein einzelnes Elektron auf der äußersten Schale. Diese Gemeinsamkeit auf Teilchen-Ebene (das heißt, man schaut sich in diesem Fall die "Teilchen", also die Atome an) führt zu Gemeinsamkeiten auf der Stoff-Ebene (das heißt, man schaut sich an, wie die Stoffe reagieren): Alle drei Stoffe (Li, Na, K) reagieren heftig mit Wasser. Wirft man ein Stücken Li, Na oder K in ein Gefäß mit Wasser, entsteht immer das Gas Wasserstoff und das Wasser fühlt sich danach "seifig" an. Das ist auf die Bildung von "Hydroxid-Ionen" zurückzuführen. Im folgenden Film (1,5min) wurde in das Wasser zusätzlich ein Stoff gegeben, der sich rosa färbt, wenn "Hydroxid-Ionen" entstehen.
- Schaut den Film
- Neben den genannten Stoffen Li, Na und K werden noch zwei weitere Stoffe mit Wasser in Kontakt gebracht. Welche?
- Sucht die fünf im Film verwendeten Stoffe im PSE. Wo stehen sie?
- Wie schon gesagt, ist die chemische Reaktion in allen Fällen ähnlich. Was ist der Unterschied?
- Es werden auch noch die Stoffe Rubidium und Cäsium verwendet
- Alle Stoffe stehen im PSE untereinander in der ersten Spalte
- Die Reaktion wird immer heftiger, je weiter unten im PSE der Stoff steht.
Im Prinzip ist das schon das wichtigste "Geheimnis" der Anordnung der Elemente im PSE: Die Elemente werden so sortiert, dass diejenigen untereinander stehen, die die gleiche Anzahl an Elektronen auf der äußersten Schale haben. Diese Elektronen heißen Valenzelektronen und bestimmen das chemische Reaktionsverhalten.
Im PSE enthält also eine Spalte (das was von oben nach unten geht) Elemente mit der gleichen Anzahl an Valenzelektronen. Man nennt eine Spalte daher auch "Gruppe" und manche Gruppen haben Namen, die ihr vielleicht schon einmal gehört habt:
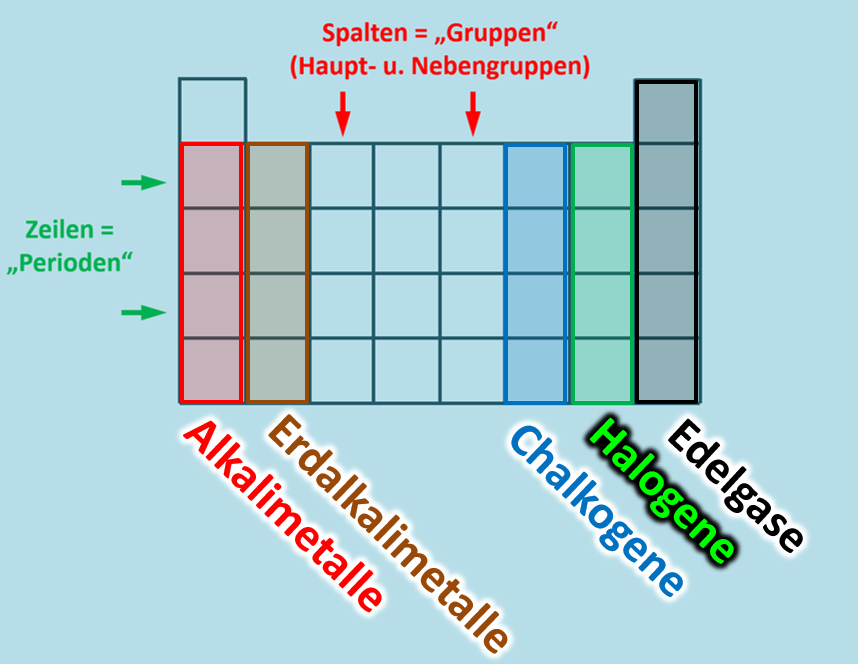
Nur zur Ergänzung: Die Zeilen (das was von links nach rechts geht) heißen Perioden. Weil sich die Eigenschaften der Stoffe von links nach rechts immer wieder (periodisch) wiederholen: Erst kommt ein Alkalimetall, dann ein Erdalkalimetall usw...
Das klappbare PSE, welches die meisten von euch benutzen ist vor allem auch deswegen so schön, weil im zusammengeklappten Zustand ganz oben die alten "Gruppennummern" stehen. (Ich hoffe, das ist bei euch noch so). Im zusammengeklappten Zustand seht ihr nämlich nur die früher als "Hauptgruppen" bezeichneten Gruppen und deren Nummer entspricht genau der Anzahl der Valenzelektronen, die die Elemente in dieser Gruppe haben:
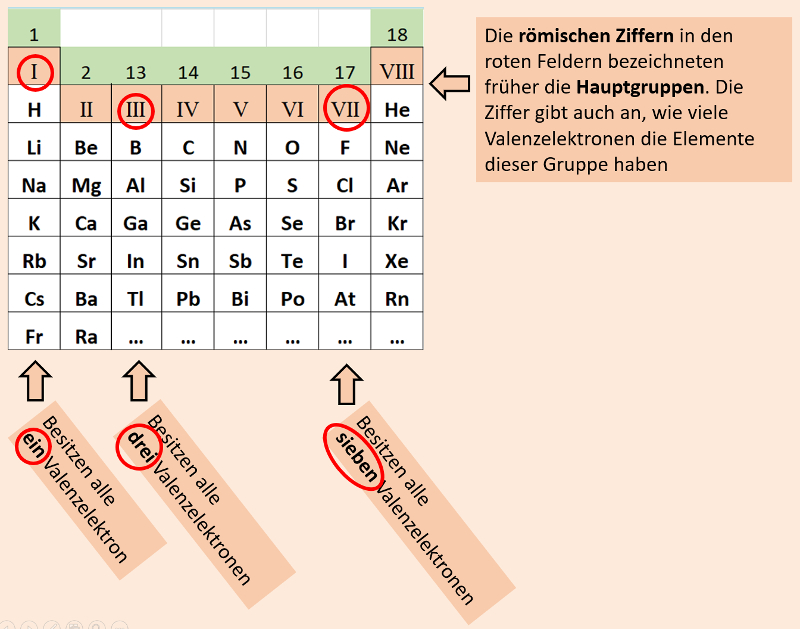
Wenn ihr euer PSE aufklappt, dann kommen zunächst die früher als "Nebengruppen" bezeichneten Element zum Vorschein. Diese Unterscheidung macht man heute nicht mehr. Man hat die Haupt- und Nebengruppen neu von links nach rechts durchgehend durchnummeriert. Leider geht dadurch der schöne Zusammenhang mit den Valenzelektronen etwas verloren: Bei den jetzt gültigen Gruppennummern muss man nun immer auf die letzte Ziffer schauen, um zu sehen, wie viele Valenzelektronen die Elemente dieser Gruppe enthalten:
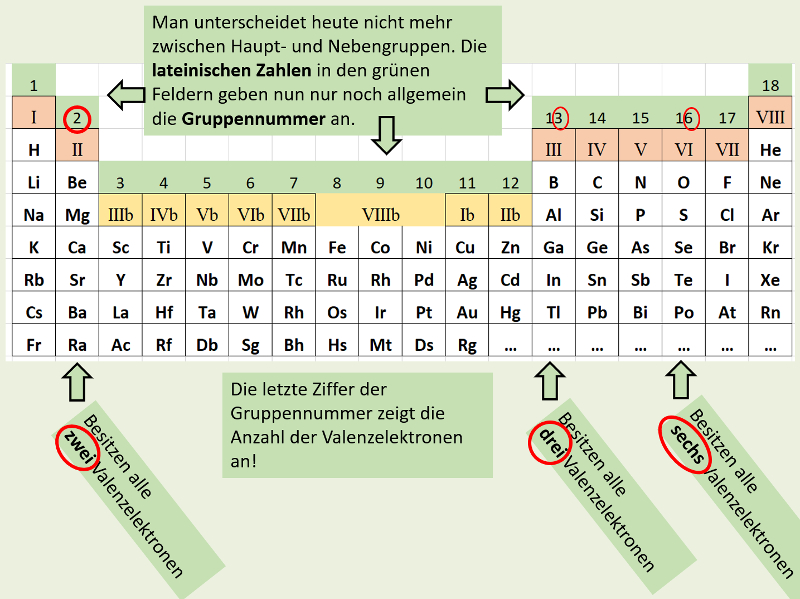
Überprüft stichpunktartig, ob das alles tatsächlich stimmt:
- Wählt drei beliebige Element aus (macht es euch nicht unnötig schwer und wählt nur Elemente des komplett eingeklappten PSEs, also nur aus den Hauptgruppen. Und wählt kein Element das in der 5. Periode oder höher steht.).
- Bestimmt von euren drei gewählten Elementen die Edelgaskonfiguration und überprüft, ob die Anzahl der Valenzelektronen tatsächlich mit der letzten Ziffer der Gruppennummer übereinstimmt!
- Es gibt eine einzige Ausnahme - vielleicht findet ihr sie ja zufällig...
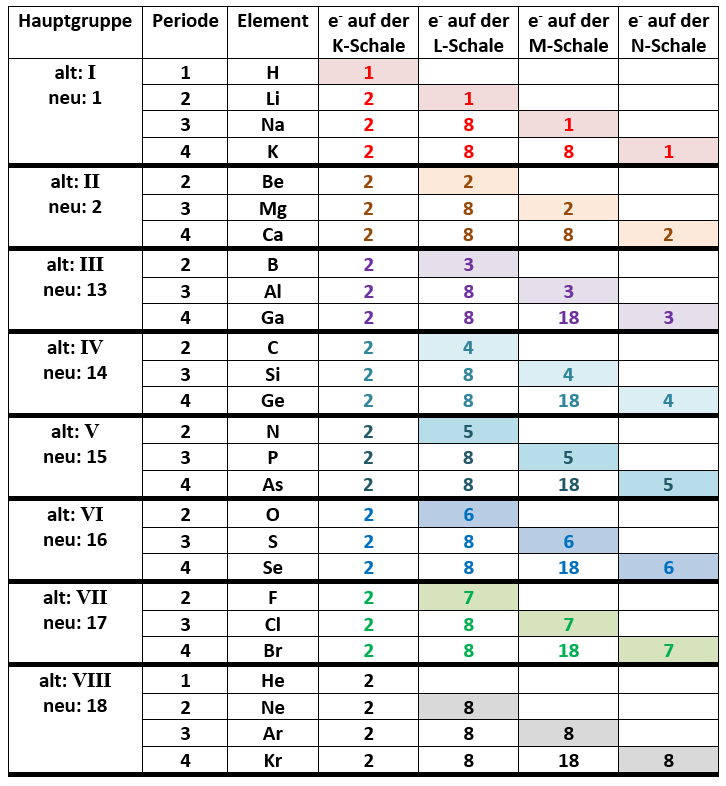
TATSÄCHLICH, es stimmt! :)
Die Ausnahme ist Helium (He). Es steht in der 8. Hauptgruppe (besser: der 18.Gruppe), hat aber nur 2 Valenzelektronen.
In Zukunft werdet ihr in der Chemie viele Aufgaben bearbeiten, bei denen man wissen muss, wie viele Valenzelektronen ein Element hat. Ihr müsst nun nicht mehr umständlich die gesamte Elektronenkonfiguration ableiten, es genügt ein Blick ins PSE: Die Gruppennummer gibt Auskunft!
Ein paar Aufgaben zum Überprüfen! Ihr solltet für alle nachfolgenden Aufgaben nur wenige Sekunden brauchen. Die einzige Schwierigkeit wird sein, das entsprechende Element im PSE zu finden. Alle Fragen beziehen sich auf Elemente der Hauptgruppen (also des zusammengeklappten PSEs). Sobald ihr das Element gefunden habt, habt ihr automatisch auch die Lösung!
Wie viele Valenzelektronen hat Brom (Br)?
Brom steht in der 7. Hauptgruppe (besser: 17. Gruppe) also muss es 7 Valenzelektronen besitzen.
Wie viele Valenzelektronen hat Magnesium (Mg)?
Magnesium steht in der 2. Hauptgruppe (besser: 2. Gruppe) also muss es 2 Valenzelektronen besitzen.
Wie viele Valenzelektronen hat Aluminium (Al)?
Aluminium steht in der 3. Hauptgruppe (besser: 13. Gruppe) also muss es 3 Valenzelektronen besitzen.
Wie viele Elemente der Hauptgruppen haben genau 1 Valenzelektron?
Sieben: Wasserstoff, Lithium, Natrium, Kalium, Rubidium, Cäsium, Francium
Welches Hauptgruppenelement aus der 4. Periode hat fünf Valenzelektronen?
Arsen
Welches Hauptgruppenelement aus der 5. Periode hat acht Valenzelektronen?
Xenon
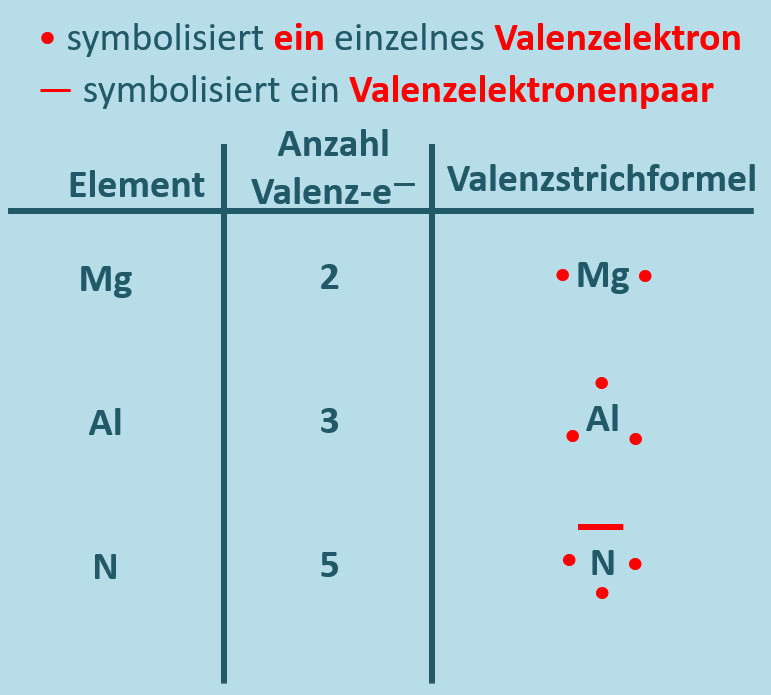
Nachdem die Valenzelektronen so eine große Bedeutung für das Reaktionsverhalten eines Stoffes haben, wurde eine Schreibweise entwickelt, mit der man die Zahl der Valenzelektronen einfach darstellen kann: Das Elementsymbol soll stellvertretend für den Atomkern und die inneren Elektronen stehen und für jeden Valenzelektron macht man einen Punkt um das Elementsymbol. In bestimmten Fällen verbindet man zwei Punkte zu einem Strich, so dass dieser Strich also zwei Valenzelektronen symbolisiert. Diese Darstellungsform nennt man Valenzstrichschreibweise:
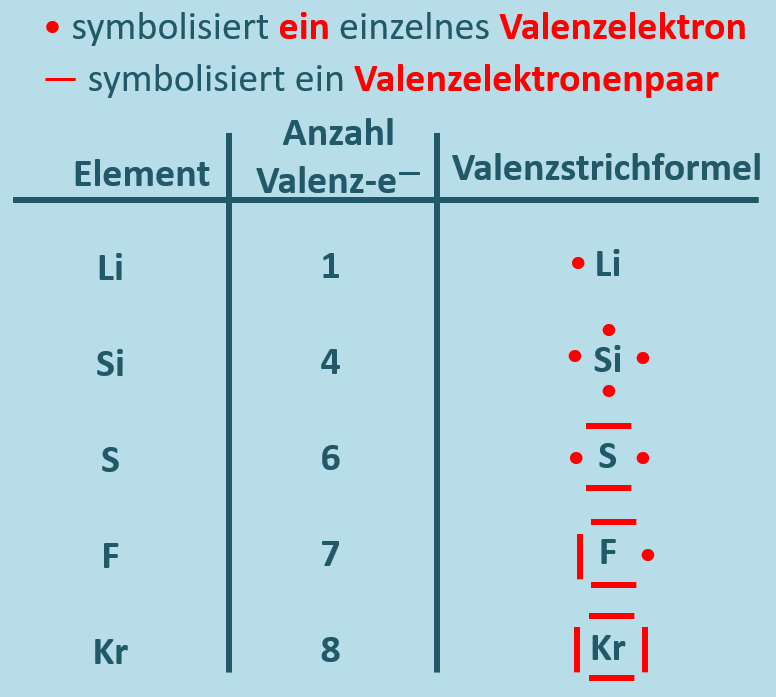
Aufgabe: Skizziere von den folgenden Elementen jeweils ein Atom in Valenzstrichschreibweise: Magnesium, Aluminium und Stickstoff
- Lest als Hausaufgabe im Buch, S. 71 und 84 - 85. Es sollte noch genügend Zeit übrig sein, um das innerhalb der laufenden Unterrichtsstunde zu erledigen.
- Ladet euch den Hefteintrag inkl. Arbeitsblatt herunter
- Wir hören uns morgen zum letzten Mal in einer Videokonferenz um 14:45 Uhr über MS-Teams
- Bis morgen!
Distanzunterricht Freitag, 05.02.
Für diese Einheit benötigt ihr das folgende Arbeitsblatt (ausgedruckt oder geöffnet in einem anderen Fenster): pdf-Datei, ein PSE, einen Stift und eine einigermaßen stabile Internetverbindung.
- Schaut zunächst das folgende Video.
- Am Anfang wird die Hausaufgabe vom letzten Mal verbessert (S. 67 A2 und A3), haltet diese bereit!
- Das Video ist mit fast 30min. relativ lang geworden, enthält aber viele Aspekte, die ihr schon aus der Physik oder Natur und Technik kennen solltet und dient somit nur der Auffrischung eurer Kenntnisse.
- Für den Chemie-Unterricht sollt ihr im Wesentlichen nur folgende neue Erkenntnis mitnehmen: Wo genau halten sich die Elektronen in der Hülle eines Atoms auf?
Nachdem ihr das Video geschaut habt, bearbeitet folgende Aufgabe(n):
- Ergänzt die untere Tabelle auf dem AB
Wenn die 45min. der Unterrichtsstunde schon um sind, dann ladet euch jetzt noch den Hefteintrag herunter: pdf-Datei. Ihr könnt ihn z.B. in euer Heft abschreiben oder ausdrucken und einkleben. Dann seid ihr mit dieser Einheit fertig. Am Dienstag gibt es weitere Aufgaben zu diesem Thema, die ihr alleine bearbeiten und verbessern könnt (keine Videokonferenz).
Falls noch Zeit übrig ist, bearbeitet die im Video genannte Aufgabe 1 auf S. 70 in eurem Buch! - Ihr dürft diese Aufgaben aber tatsächlich überspringen, wenn ihr schon seit 45 Minuten arbeitet. Sie wird in der nächsten Einheit ganz am Anfang (teilweise) noch einmal gestellt!
Distanzunterricht Dienstag, 02.02.
Videokonferenz über BigBlueButton: Unterrichtseinheit "Atombau 2: Isotope"
- Hefteintrag + Arbeitsblatt: pdf-Datei
Distanzunterricht Freitag, 29.01.
Videokonferenz über BigBlueButton: Unterrichtseinheit "Atombau 1: Der Rutherfordsche Streuversuch"
- Hefteintrag: zusammen mit nächster Einheit
Distanzunterricht Dienstag, 26.01.
Videokonferenz über BigBlueButton: Besprechung der restlichen Aufgaben auf dem Arbeitsblatt.
- Musterlösung: pdf-Datei
Distanzunterricht Freitag, 22.01.
Videokonferenz über BigBlueButton: Besprechung der Hausaufgabe vom 15.01. Anschließend: Anwendung der gelernten Begriffe "exotherm, endotherm" und "Synthese, Analyse, Umsetzung" auf neue Beispiele. Dazu hier das Arbeitsblatt, welches auch über den Schulmanager verschickt wurde:
- pdf-Datei
- Eine Musterlösung folgt hier, wenn alle Aufgaben bearbeitet wurden
Distanzunterricht Montag, 18.01.
Hallo 9a!
In der heutigen Einheit sollt ihr eine weitere Einteilungsmöglichkeit von chemischen Reaktionen kennenlernen und im Anschluss die neuen Begriff anhand einiger Beispiele einüben. Am Freitag würde ich gerne eine Videokonferenz mit euch durchführen, um die letzten drei Einheiten mit euch live zu besprechen.
Im folgenden Video (3:28min) werden drei Grundtypen chemischer Reaktionen theoretisch vorgestellt. Prägt euch die Begriffe ein, im Anschluss sollt ihr sie anwenden!
Aufgaben: Stellt für die folgenden Reaktionen die chemische Gleichung auf. Gebt an, ob es sich um eine Synthese, Analyse oder Umsetzung handelt und entscheidet, ob es eine exotherme oder endotherme Reaktion ist!
- Eisenpulver und Schwefelpulver wird vermischt. Man taucht einen glühenden Nagel kurz in das Gemisch und es beginnt eine starke Reaktion. Nach und nach glüht das gesamte Gemisch auf. Am Ende liegt der Stoff Pyrit (FeS2) vor.
- Chemische Gleichung: Fe + 2 S --> FeS2
- Grundtyp: Synthese. Begründung: Aus mehreren Edukten wird ein Produkt
- Energiebeteiligung: Exotherm. Begründung: Man muss nur am Anfang kurz den glühenden Eisennagel ins Gemisch tauchen. Danach läuft die Reaktion von alleine ab und setzt die ganze Zeit Energie frei.
- Quecksilberoxid (HgO) wird in einem Reagenzglas mit dem Bunsenbrenner stark erhitzt. Solange sich das RG in der BB-Flamme befindet, strömt Sauerstoff aus dem RG und es bilden sich am Rand kleine Quecksilbertröpfchen
- Chemische Gleichung: 2 HgO --> 2 Hg + O2
- Grundtyp: Analyse. Begründung: Aus einem Edukt werden mehrere Produkte
- Energiebeteiligung: Endotherm. Begründung: Nur solange man Energie zuführt, also sich das RG in der BB-Flamme befindet, läuft die Reaktion ab. Man muss also permanent Energie zuführen.
- In einem RG befinden sich Wasser und ein Stück Magnesium-Band. Am oberen Ende ist das RG mit einem Stopfen verschlossen, in dem ein dünnes Glasrohr steckt. Das Wasser im RG wird vorsichtig erhitzt, so dass es verdampft und alle anderen Gase aus dem RG verbrennt. Es liegt also ein Stück Magensiumband in gasförmigem Wasser vor. Entzünden man das Magnesiumband dann an einer Stelle, reagiert es mit dem Wasser. Sobald die Reaktion gestartet ist, reagiert das gesamte Magnesiumband nach und nach auf der gesamten Länge unter Freisetzung großer Mengen von Licht und Wärme. Nach der Reaktion bleibt der der Stoff Magnesiumoxid (MgO) im RG übrig und während der Reaktion kann man zeigen, dass aus dem dünnen Glasrohr im Stopfen Wasserstoff entweicht.
- Chemische Gleichung: Mg + H2O --> MgO + H2
- Grundtyp: Umsetzung. Begründung: Aus mehreren Edukten werden mehrere Produkte
- Energiebeteiligung: Exotherm. Begründung: Man muss die Reaktion nur einmal kurz starten. Danach läuft die Reaktion von alleine ab und setzt die ganze Zeit Energie frei.
Nachdem nicht klar ist, wann jemals wieder normaler Unterricht stattfindet, hier ein paar Videos, in denen ihr die chemischen Reaktionen dieser Einheit sehen könnt:
Ein relativ ausführliches Video zur Synthese von Eisensulfid (Pyrit):
Die Thermolyse von Quecksilberoxid:
Die Umsetzung von Magnesium in Wasserdampf (mit lustiger Musik... YEAH!):
Hausaufgabe (könnt ihr auch sofort erledigen):
- Ladet den Hefteintrag herunter. Schreibt ihn bitte entweder ab oder druckt ihn aus und klebt ihn in euer Heft: pdf-Datei
- Lest im Buch, S. 34
- Sucht das Arbeitsblatt heraus, auf dem wir das Aufstellen chemischer Gleichungen geübt haben. Falls ihr es nicht findet, kann es hier noch einmal heruntergeladen werden: pdf-Datei. Entscheidet, ob es sich bei den Reaktionen 1, 3, 5 und 7 auf der Vorderseite (links) und den Reaktionen 3, 8 und 10 auf der Rückseite (rechts) um eine Synthese, Analyse oder Umsetzung handelt. Falls die Beschreibung es zulässt, könnt ihr auch angeben, ob es eine exo- oder endotherme Reaktion ist und wenn ihr die chemische Gleichung noch nicht aufgestellt habt, dann holt das bitte nach!
Wir hören uns am Freitag, Link zur Konferenz kommt über den Schulmanager!
Distanzunterricht Freitag, 15.01.
Bitte bearbeitet die folgende Einheit am besten in der eigentlichen Unterrichtszeit von 08:45 - 09:30 Uhr. Ihr benötigt das Arbeitsblatt, welches ihr vor den Ferien erhalten habt und auf dem die Vorderseite bereits ausgefüllt ist. Solltet ihr das AB nicht mehr finden, könnt ihr es hier noch einmal herunterladen:
pdf-Datei
Schaut bitte zunächst das folgende Video. Es enthält eine Zusammenfassung der letzten Einheit und erklärt einen neuen Aspekt. Während des Videos solltet ihr auch das AB auf der Rückseite ausfüllen. Nach dem Video bearbeitet bitte die Aufgaben darunter. Lasst euch die Lösung erst anzeigen, wenn ihr tatsächlich eine gefunden habt!
Aufgaben:
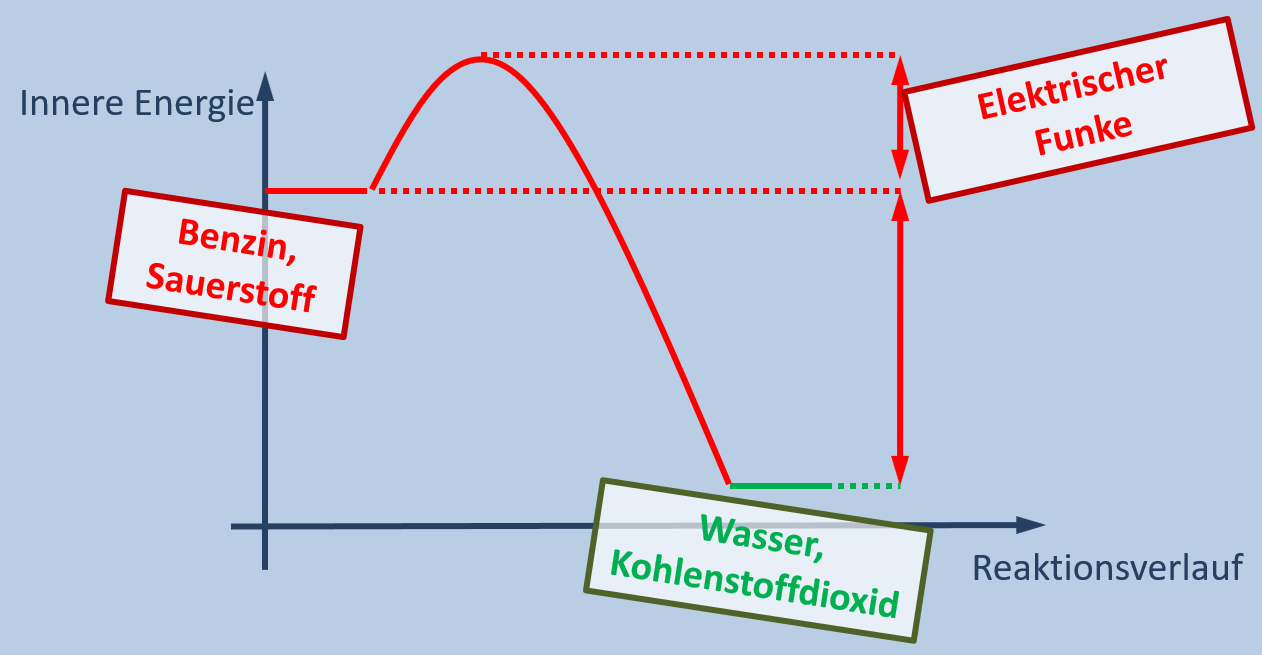
Startet man ein Auto, so wird durch das Umdrehen des Schlüssels etwas Energie aus der Batterie in einen elektrischen Funken im Motor umgewandelt, der vergastes Benzin entzünden. Dabei reagiert das Benzin mit Sauerstoff. Wenn der Motor läuft, könnte man die Batterie auch entfernen.
- Erkläre, ob es sich bei der Verbrennung von Benzin im Motor eines Autos um einen exothermen oder endothermen Vorgang handelt!
- Zeichne ein Energie-Reaktionsverlaufs-Diagramm, in dem die wichtigen Begriffe aus dem Text der Grafik richtig zugeordnet sind!
Es muss sich um eine exotherme Reaktion handeln. Sie muss nur einmal kurz durch Zufuhr von Aktivierungsenergie gestartet werden. Danach wird ständig Energie (in Form von Wärme oder auch Bewegungsenergie) frei.
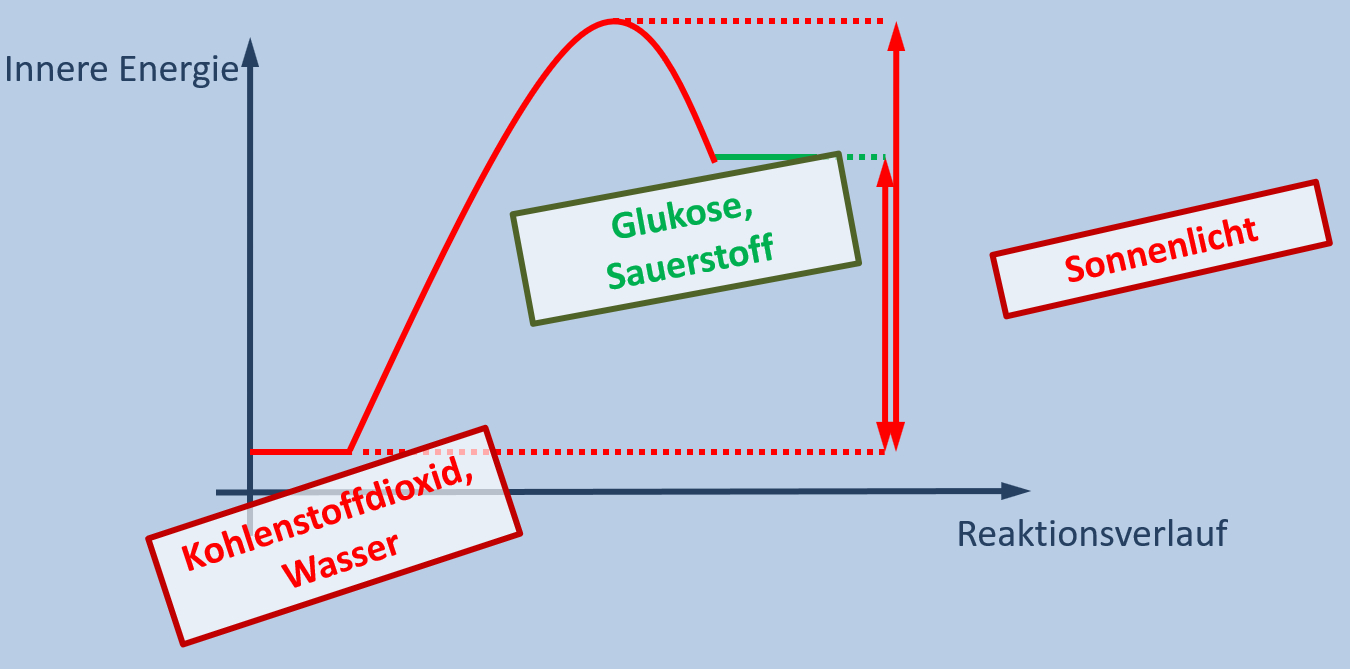
Pflanzen können mit Hilfe von Sonnenlicht aus Kohlenstoffdioxid und Wasser die Stoffe Glukose und Sauerstoff herstellen. Bei manchen Unterwasserpflanzen kann man den entstehenden Sauerstoff sehr schön sehen, da er in Form von Gasbläschen aufsteigt. Das funktioniert allerdings nur solange, wie die Unterwasserpflanze mit Licht bestrahlt wird. Verdunkelt man die Pflanze entstehen auch keine Gasblasen mehr.
- Erkläre, ob es sich bei der Verbrennung von Benzin im Motor eines Autos um einen exothermen oder endothermen Vorgang handelt!
- Zeichne ein Energie-Reaktionsverlaufs-Diagramm, in dem die wichtigen Begriffe aus dem Text der Grafik richtig zugeordnet sind!
Es muss sich um eine endotherme Reaktion handeln. Nur solange die Pflanze von Licht (Energie) getroffen wird, entstehen die Produkte (zu sehen am aufsteigenden Sauerstoff)
Distanzunterricht Dienstag, 12.01.
Bearbeitet diese Einheit bitte möglichst während der "normalen Unterrichtszeit", also von 14:45 - 15:30 Uhr. Zunächst sollt ihr hier im WIKI alleine die Inhalte aus dem Unterricht vor Weihnachten auffrischen. Gegen Ende der normalen Unterrichtszeit möchte ich mit euch in einer Videokonferenz diese Wiederholungseinheit gemeinsam besprechen. Habt daher etwas die Zeit im Auge oder stellt euch einen Wecker. Wir beginnen mit der Video-Konferenz um 15:15 Uhr. Den Link habt ihr in einer Nachricht über den Schulmanager erhalten.
Wir haben uns vor Weihnachten mit den Einteilungsmöglichkeiten von chemischen Reaktionen beschäftigt. Es gibt viele Möglichkeiten, chemische Reaktionen einzuteilen. Eine davon betrachtet die beteiligte Energie. Im Unterricht haben wir ein Stück Magnesium-Band (Mg) in Salzsäure (HCl) geworfen. Bei dieser chemischen Reaktion entsteht Magnesiumchlorid (MgCl2) und Wasserstoff. Die Temperatur steigt während der Reaktion stark an.
Stellt zunächst die chemische Gleichung für die beschriebene Reaktion auf!
Mg + 2 HCl --> MgCl2 + H2
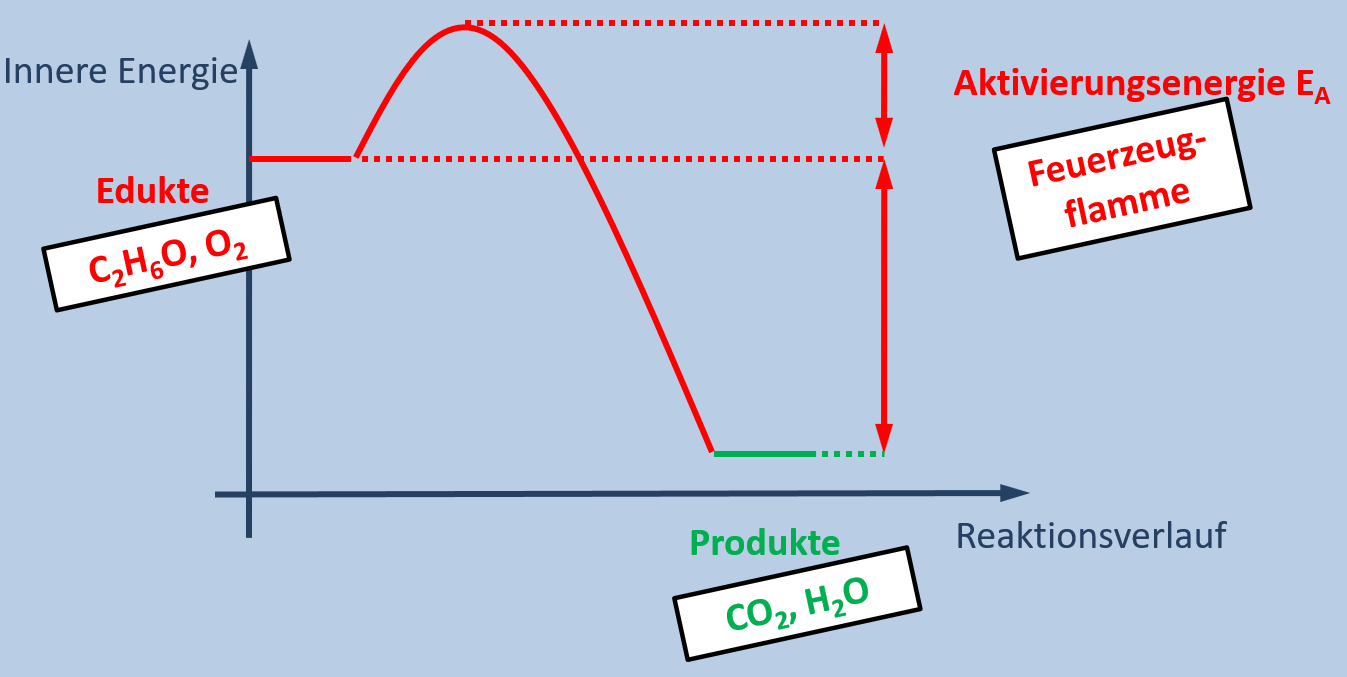
Im Heft haben wir eine zu dieser Reaktion passende Grafik gezeichnet, die wie folgt aussieht:
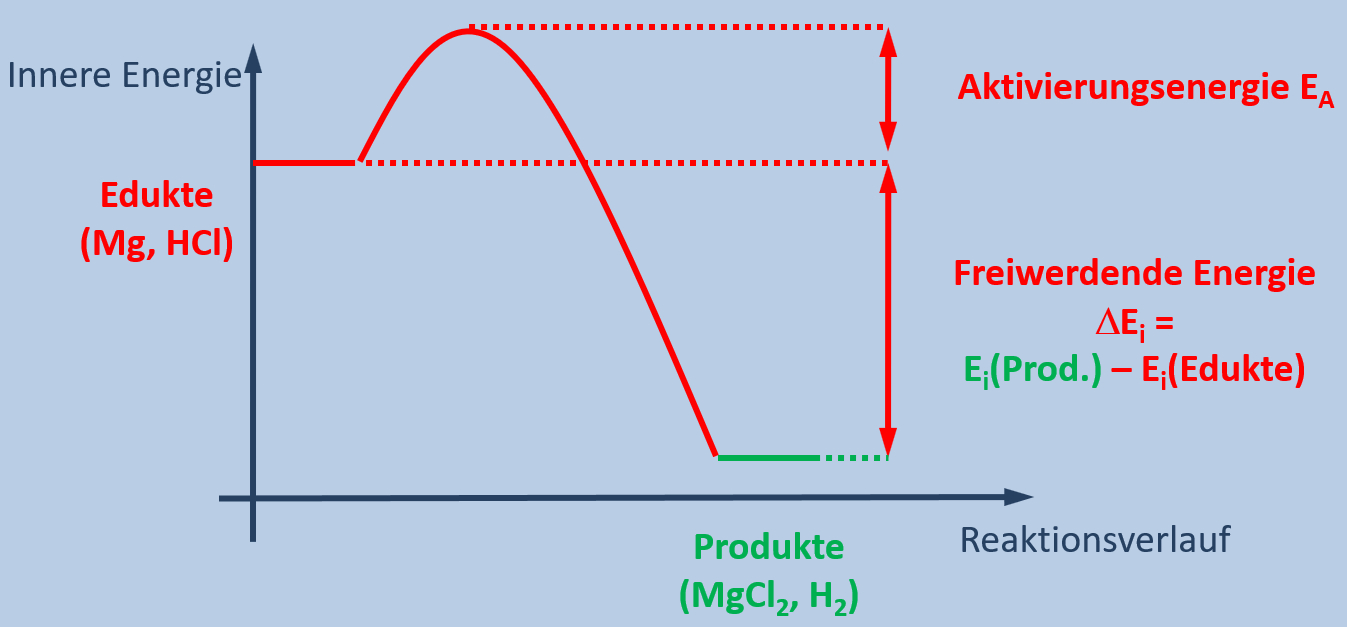
Beschreibt diese Grafik! Geht dazu wie folgt vor:
- Zunächst zeigt man auf, welche Parameter überhaupt dargestellt sind ("Was steht auf der Y-Achse, was auf der X-Achse")
Die sprachlich wohl schönste Lösung wäre: Die Grafik zeigt die innere Energie der Stoffe in Abhängigkeit vom Reaktionsverlauf.
- Als nächstes beschreibt man den Verlauf. Hier bietet es sich auch an, die Fachbegriffe und eine Erklärung gleich mit einzubauen. Versucht es! Klickt erst auf "Lösung", wenn ihr eure Lösung laut ausgesprochen habt!
Die Edukte besitzen eine relativ hohe innere Energie. Das ist eine Form von Energie, die in einem Stoff chemisch gespeichert ist. Die Produkte besitzen eine niedrigere innere Energie. Im Verlauf der Reaktion, wenn die Edukte in die Produkte umgewandelt werden, wird diese Energie frei und sie wird an die Umgebung abgegeben. Daher erwärmt sich das Gemisch und das Thermometer zeigt eine hohe Temperatur an.
Damit die Reaktion allerdings abläuft, muss zunächst etwas Energie hineingesteckt werden. Die so genannte Aktivierungsenergie. Im Beispiel von Magnesium und Salzsäure reicht die Raumtemperatur bereits aus, um die Reaktion zu starten.
Da in diesem Beispiel "das System" Energie verliert (die vorher in Form von innerer Energie vorhandene Energie wird als Wärme an die Umgebung abgegeben), spricht man von einer exothermen Reaktion.
Die fett gedruckten Begriffe sollten in euren Ausführungen enthalten gewesen sein. Falls nicht, klappt diese Lösung ein und versucht es nochmal.
Um das folgende Video aufzunehmen, habe ich ein paar Tropfen Ethanol (C2H6O) entzündet. Dabei reagiert die Flüssigkeit mit dem Sauerstoff aus der Luft. Es entsteht Wasser und Kohlenstoffdioxid (CO2).
- Stellt die chemische Gleichung für diese Reaktion auf!
- Übertragt dieses Beispiel auf das obere Diagramm. Versucht alles, was in dem Versuch vorkommt einer Stelle im Diagramm zuzuordnen!
C2H6O + 3 O2 --> 3 H2O + 2 CO2
Distanzlernen für Freitag, 18.12.
Je nachdem, wie viel Zeit euch zur Verfügung steht, könnt ihr im folgenden violetten Kasten Aufgaben zum Ausgleichen von chemischen Reaktionen üben (es handelt sich um die Aufgaben von dem Arbeitsblatt, das ihr im Unterricht bekommen habt). Oder ihr führt den Versuch durch, der im blauen Kasten beschrieben ist. Selbstverständlich dürft ihr auch beides machen :)
Auch wenn ihr die Aufgaben auf dem Arbeitsblatt bereits bearbeitet haben solltet: Macht sie einfach hier noch einmal. In der Regel kann man sich an die Lösung nicht automatisch erinnern.
Aufgabe 4 (AB-Vorderseite)
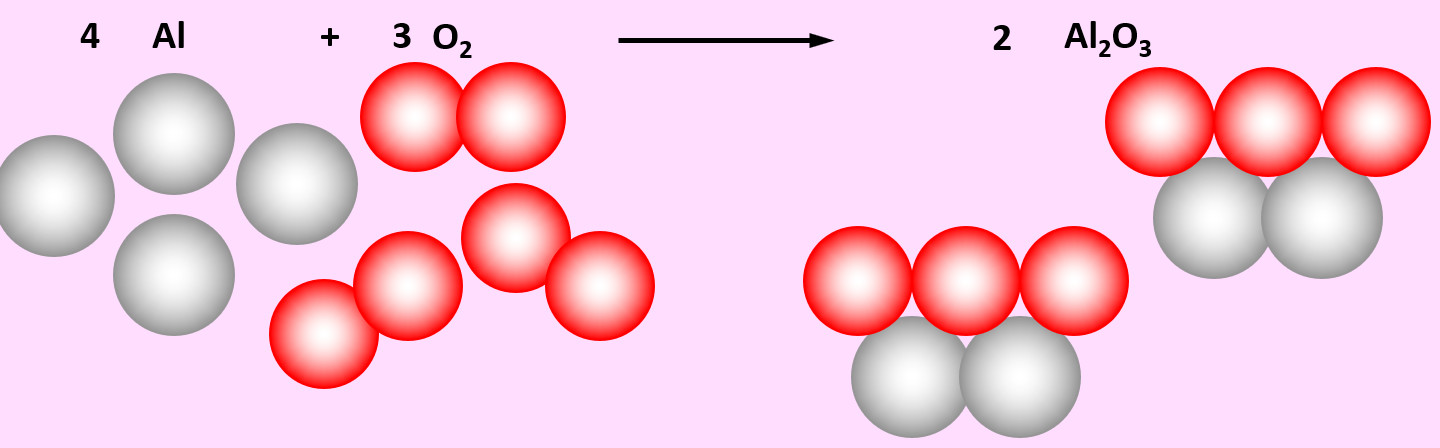
Zu den heftigsten Reaktionen unter den Elementen zählt die Reaktion von Aluminium mit Sauerstoff. Dabei entsteht Aluminiumoxid (Al2O3)
Aufgabe 5 (AB-Vorderseite)
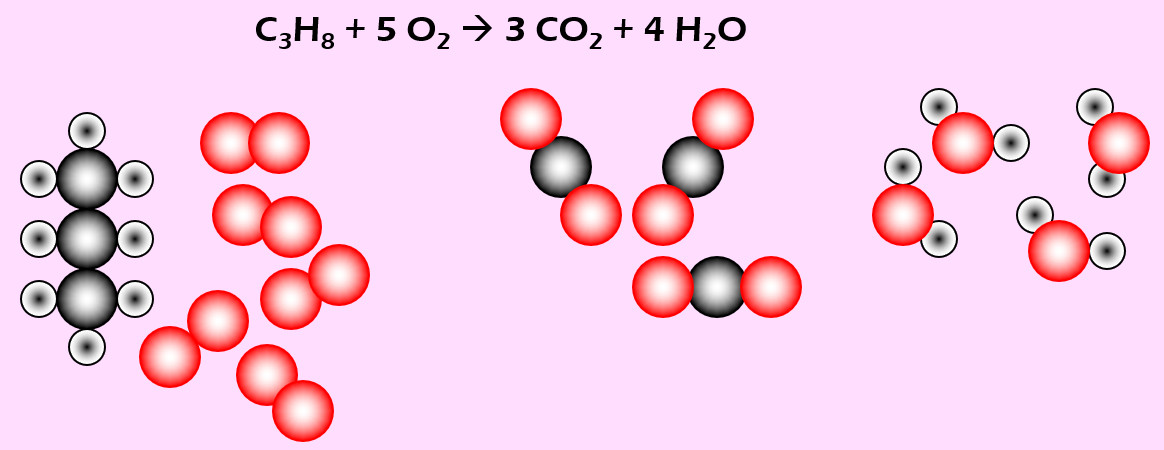
Feuerzeuge enthalten vielfach Propan (C3H8). Bei Gebrauch strömt das Gas aus und wird durch einen Funken entzündet. Dabei reagiert es mit Sauerstoff zu Kohlenstoffdioxid (CO2) und Wasser (H2O)
Aufgabe 6 (AB-Vorderseite)
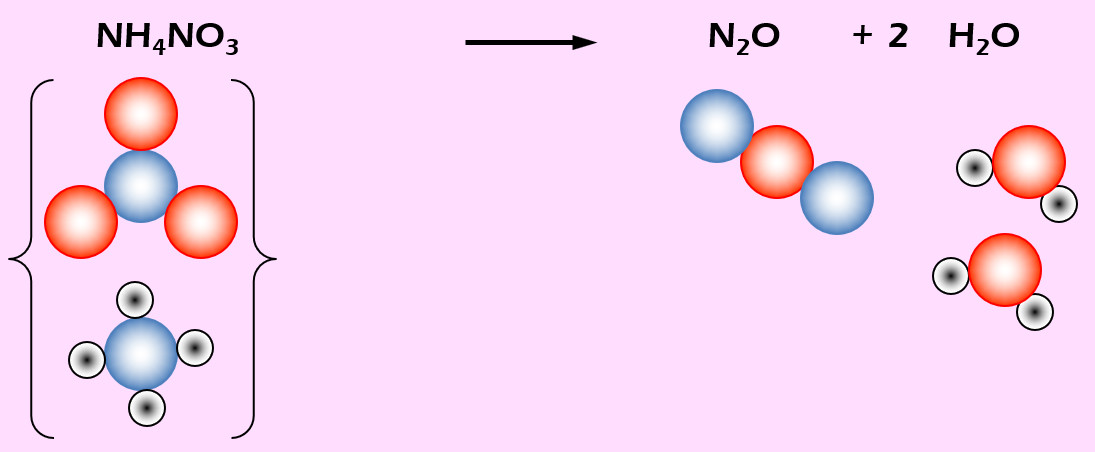
Lachgas (N2O) entsteht beim starken Erhitzen von Ammoniumnitrat (NH4NO3). Daneben entsteht auch noch Wasser (H2O).
Aufgabe 7 (AB-Vorderseite)
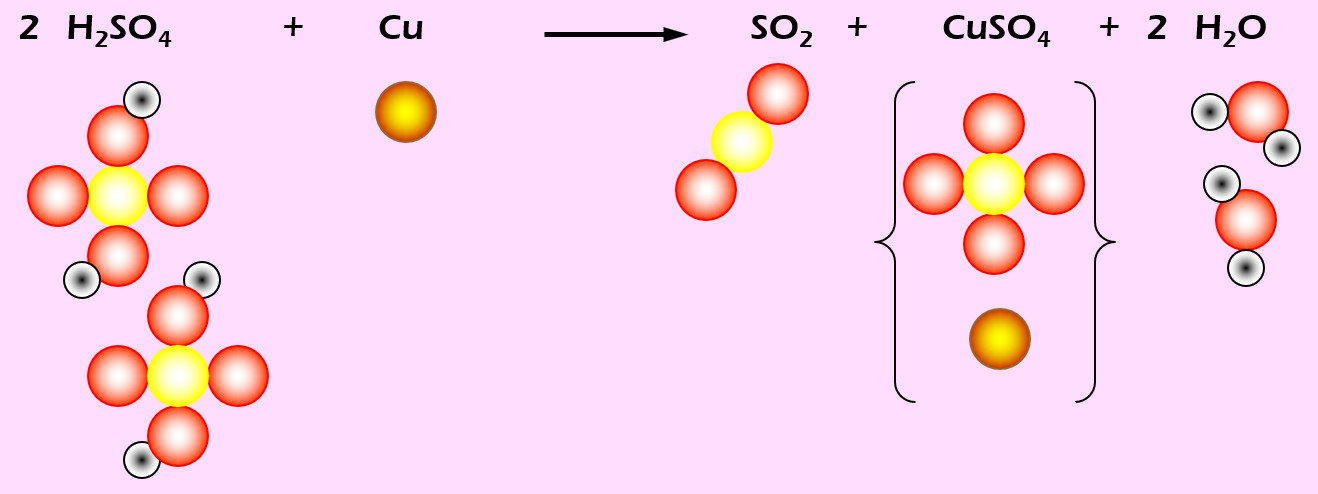
Kupfer löst sich in erhitzter Schwefelsäure (H2SO4). Dabei entsteht Schwefeldioxid (SO2), Kupfersulfat (CuSO4) und Wasser (die chem. Formel f. Wasser müsstet ihr langsam wissen...).
Aufgabe 1 (AB-Rückseite)
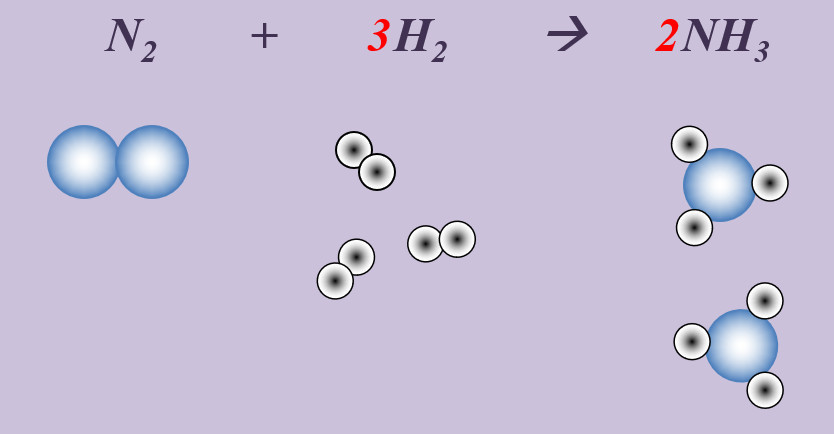
Stickstoff reagiert mit Wasserstoff zu Ammoniak (NH3).
Aufgabe 2 (AB-Rückseite)
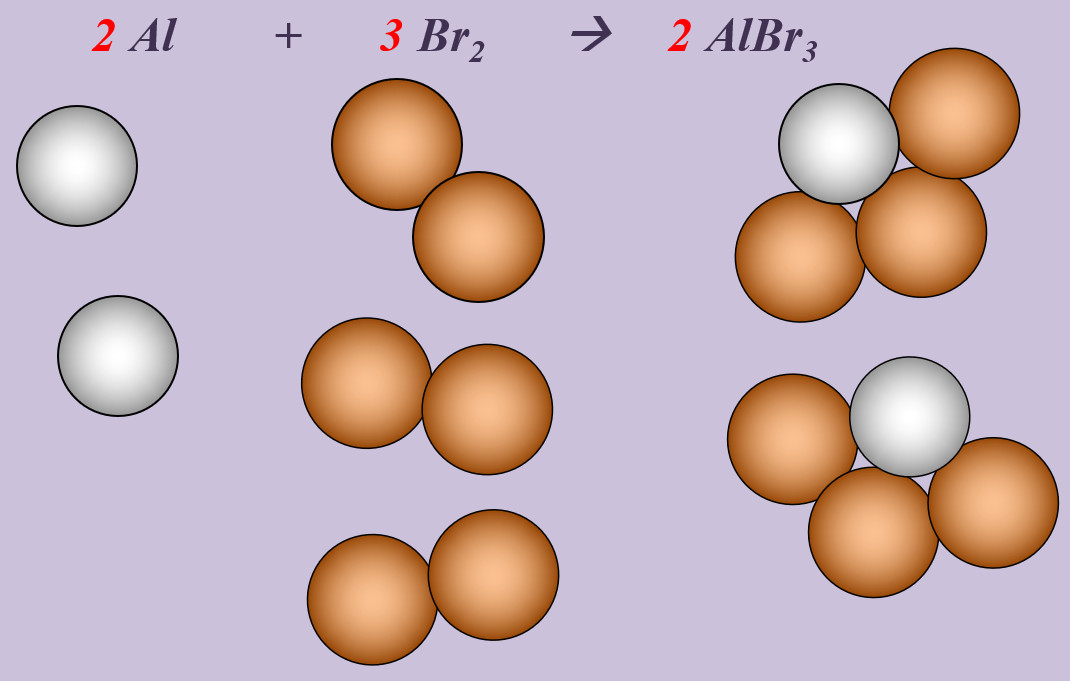
Aluminium reagiert mit Brom zu Aluminiumbromid (AlBr3).
Aufgabe 3 (AB-Rückseite)
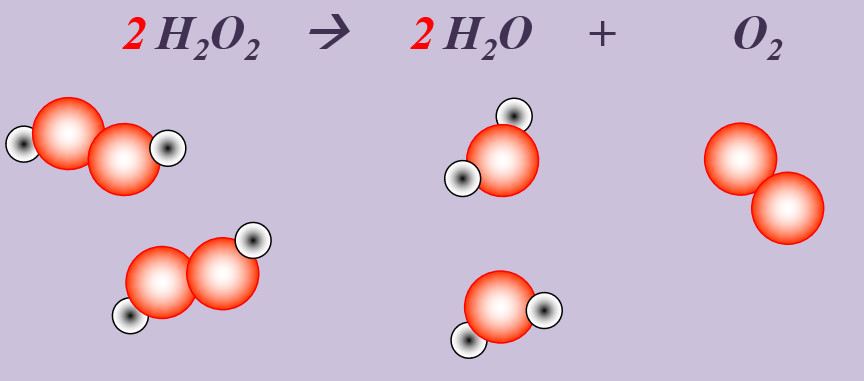
Wasserstoffperoxid (H2O2) zerfällt an der Luft zu Wasser und Sauerstoff.
Aufgabe 4 (AB-Rückseite)
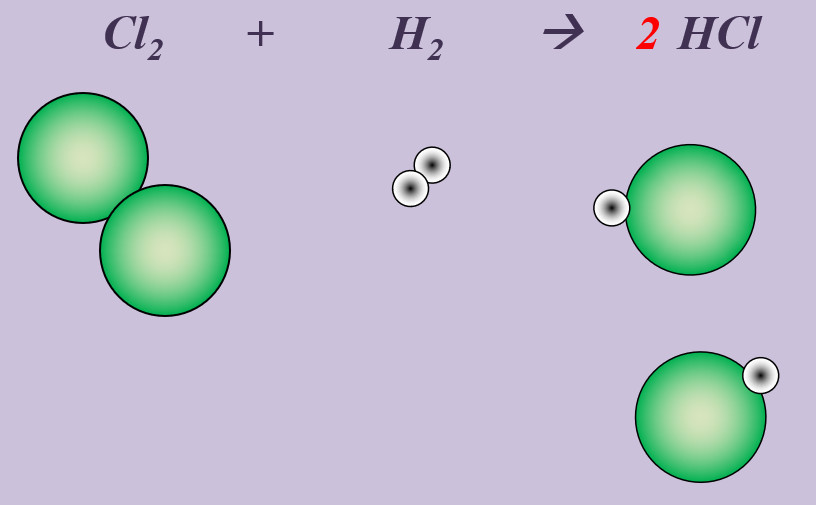
Chlor reagiert in einer heftigen Reaktion mit Wasserstoff zu Hydrogenchlorid (HCl).
Aufgabe 5 (AB-Rückseite)
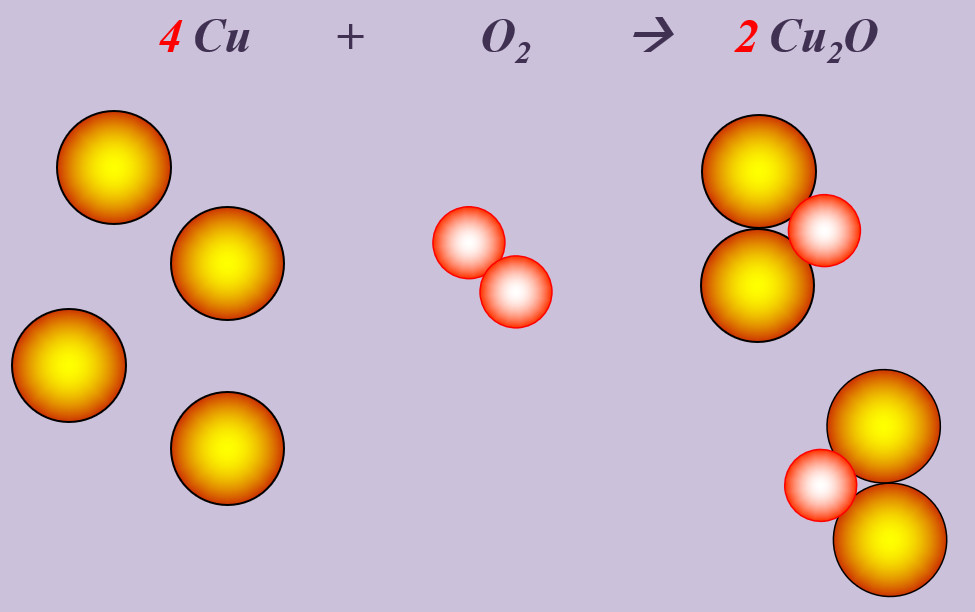
Kupfer kann beim starken Erhitzen mit Sauerstoff zu Kupfer(I)-oxid (Cu2O) reagieren.
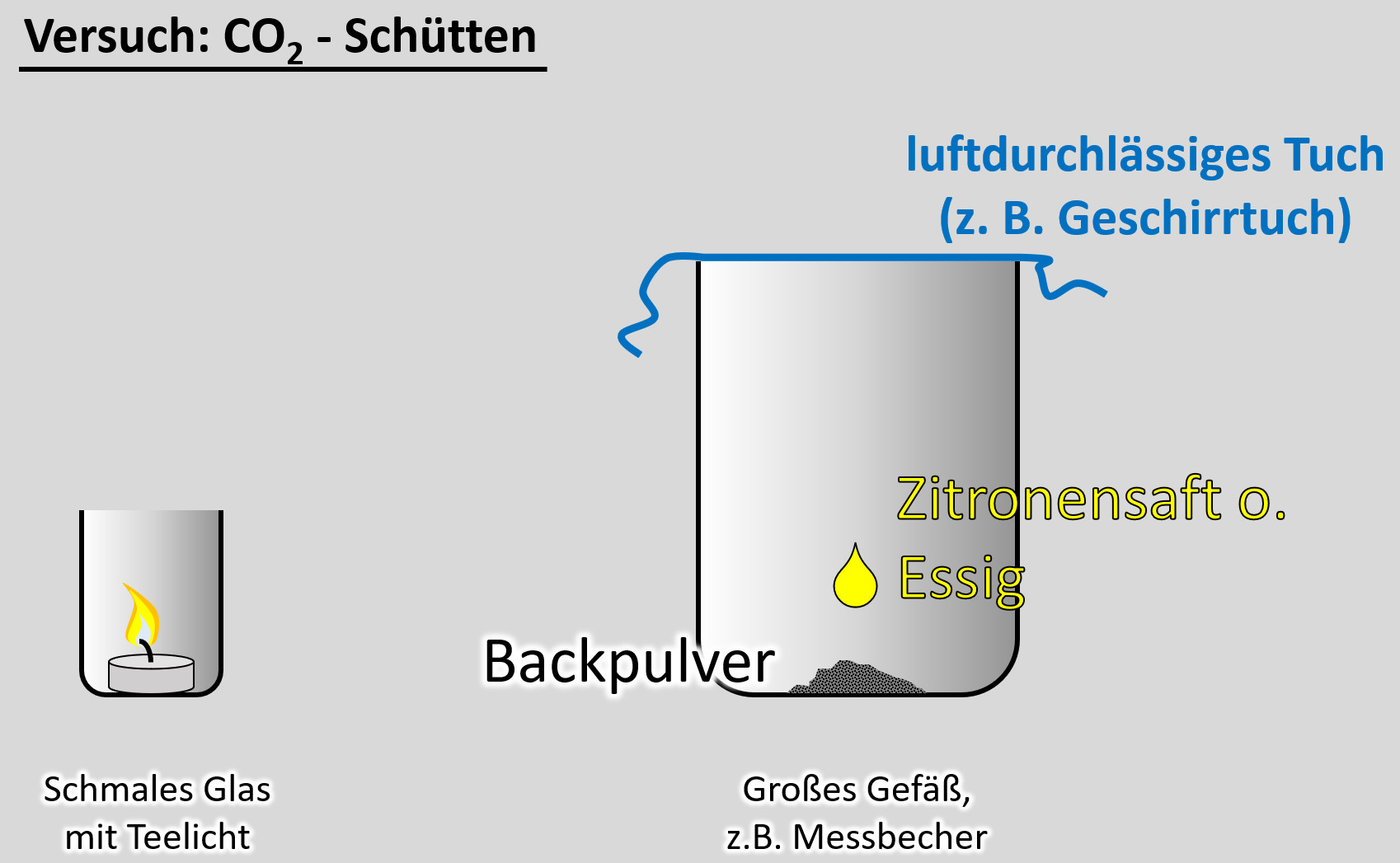
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmales Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 30 Minuten nicht wesentlich übersteigen.
In der letzten Online-Einheit habt ihr Belege für das Teilchen-Modell kennengelernt und gesehen, wie man damit bestimmte Beobachtungen erklären kann. Als Hausaufgabe habt ihr zwei Seiten im Buch gelesen, auf denen noch einmal der Unterschied zwischen Stoff-Ebene (Beobachtungs-Ebene) und Teilchen-Ebene (Vorstellungs-Ebene) erklärt wurde. Diese Unterscheidung solltet ihr schon aus der Unterstufe kennen.
Zunächst zur Hausaufgabe: Ihr solltet die in Abb. 4 auf S. 44 im Buch dargestellten Vorgänge „beschreiben“! Wenn ihr euch nicht mehr erinnert, schaut noch einmal nach. Klickt erst auf „Lösung“, wenn ihr eure Beschreibung vollständig laut ausgesprochen habt.
Auf der Stoff-Ebene könnt ihr festhalten: Sobald die Brausetablette ins Wasser fällt, entsteht ein Gas, welches in Form von kleinen Bläschen aufsteigt.
Mehr sieht man auf diesen Bildern nicht…
Auf Teilchen-Ebene laufen mehrere Prozesse ab, aber die kann man alle nicht sehen und wissen könnt ihr sie eigentlich auch nicht, zumindest nicht aus dem bisherigen Chemie-Unterricht. Ich stelle euch die Situation daher mal auf Teilchen-Ebene schematisch dar und ihr versucht sie erneut zu beschreiben!
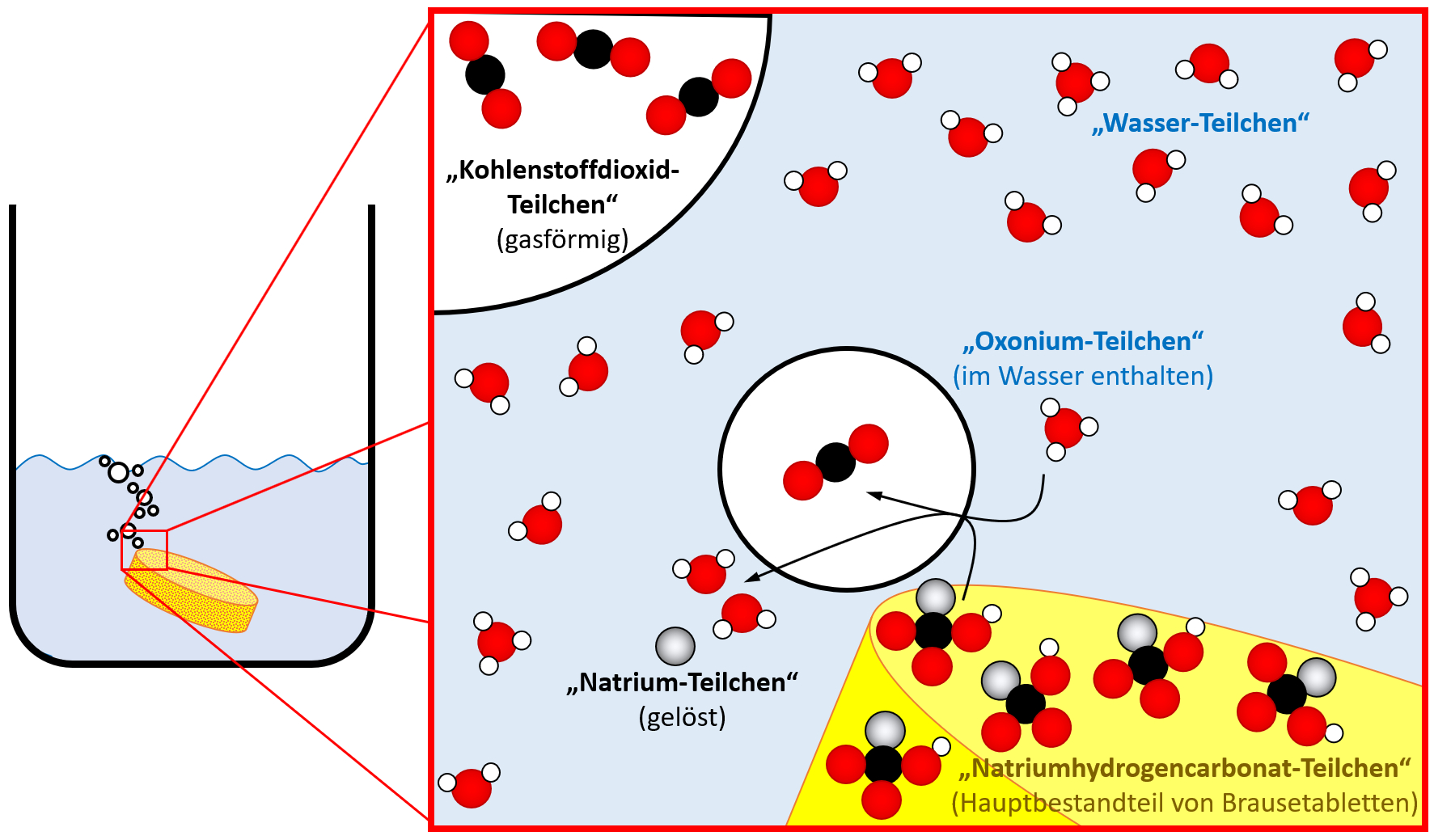
Jetzt könnte man auch auf Teilchen-Ebene etwas beschreiben: Bestimmte Teilchen aus dem Wasser (Oxonium-Teilchen) reagieren mit den Natriumhydrogencarbonat-Teilchen aus der Brausetablette. Dabei entsteht das Gas Kohlenstoffdioxid und Natrium-Teilchen werden im Wasser gelöst.
Wenn ihr auf die Anzahl der Kugeln vor der Reaktion und nach der Reaktion achtet, stellt ihr fest, dass die Anzahl der Kugeln gleich geblieben ist. Das muss so sein. Aus diesem Umstand lässt sich das "Gesetz der konstanten Proportionen" ableiten, um das es in der heutigen Einheit geht.
Die oben dargestellte chemische Reaktion ist schon ziemlich kompliziert. Ihr erkennt in der Abbildung hoffentlich, dass fast alle dort gezeichneten „Teilchen“ sich aus verschiedenen „Kugeln“ zusammensetzen. In der letzten Stunde vor dem Test haben wir darüber bereits gesprochen: Mit einem Hofmannschen Dreischenkelapparat können „Wasser-Teilchen“ zerlegt werden. Es entsteht Sauerstoff und Wasserstoff.
In der oberen Abbildung ist diese Tatsache symbolisch mit unterschiedlichen Kugeln verwirklicht: Sauerstoff wird durch rote Kugeln symbolisiert, Wasserstoff durch weiße. Ein „Wasser-Teilchen“ ist aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen zusammengesetzt.
In der letzten Online-Einheit habt ihr auch schon den Stoff Eisensulfid kennengelernt. Er entsteht, wenn man Eisen mit Schwefel reagieren lässt.
Ein Lehrer hat dazu ein Video ins Netz gestellt, wer es anschauen möchte, bitteschön:
In der schematischen Darstellung ganz am Ende der letzten Online-Einheit habt ihr schon gesehen, dass im Eisensulfid pro Eisen-Atom genau ein Schwefel-Atom vorhanden ist. Wie ihr heute gelernt habt, muss dieses „Teilchen-Verhältnis“ nicht immer so sein: In einem Wasser-Teilchen waren es ja genau zwei Wasserstoff-Atome, die mit einem Sauerstoff-Atom verbunden waren. Dazu in einer späteren Einheit mehr.
Bleiben wir beim Eisensulfid. In eurem Buch auf der Seite 37 seht ihr oben rechts eine Grafik!
Lest zunächst den Text auf S. 36 unten („Stoffe verbinden sich…) bis S. 37 zum ersten blauen Merksatz. Beantwortet dann die folgenden Fragen (schriftlich auf ein Blatt, bitte erst auf „Lösung“ klicken, wenn ihr tatsächlich eine Lösung gefunden habt):
- Wenn man 50g Eisen vollständig mit Schwefel zu Eisensulfid reagieren lassen möchte, braucht man eine bestimmte Menge Schwefel. Wenn man doppelt so Eisen verwendet, braucht man auch genau die doppelte Menge Schwefel. Warum ist das so?
Weil Materie aus kleinsten Teilchen aufgebaut ist. Das Verhältnis der verschiedenen Teilchen in einer bestimmten Verbindung ist immer gleich. Wenn die Anzahl der Teilchen des einen Stoffes erhöht wird, muss die Anzahl der Teilchen des anderen Stoffes um den selben Faktor erhöht werden, wenn die Reaktion vollständig ablaufen soll.
- Welche Masse an Eisen muss man verwenden, um mit exakt 100g Schwefel vollständig zu Eisensulfid zu reagieren?
Laut Text gilt "Die Masse von Eisen verhält sich zur Masse von Schwefel wie 1,75 zu 1,00". Das bedeutet man braucht 175g Eisen, um mit 100g Schwefel eine vollständige Reaktion zu Eisensulfid zu erhalten.
- Die Grafik verdeutlicht das "Gesetz der konstanten Proportionen. Wie würdest Du dieses Gesetz mit eigenen Worten beschreiben?
Im Prinzip müsstet ihr hier mit dem blauen Merksatz aus dem Buch antworten (oder so ähnlich): Zwei Elemente vereinigen sich zu einer bestimmten Verbindung immer im gleichen Massenverhältnis.
Echte Hausaufgabe
Wenn ihr in eurem Heft nachschaut, findet ihr dort vielleicht einen Hinweis darauf, dass bei der Spaltung von Wasser im Hofmannschen Dreischenkelapparat doppelt so viel Wasserstoff wie Sauerstoff entstanden ist. Stellt eine Vermutung an, warum das so ist!
Vorbereitungen für Freitag
Am Freitag würde ich gerne mit euch eine BigBlueButton-Konferenz durchführen. Ihr solltet inzwischen ja schon Erfahrung damit haben. Falls nicht, schicke ich euch zusammen mit dem Link noch einmal eine Anleitung. Link + Anmeldung + Zugangscode erhaltet ihr als Nachricht über den Schulmanager.
Bitte bereitet bis Freitag, 3. Std. folgendes vor: Wenn in den letzten beiden Unterrichtseinheiten noch Fragen offen geblieben sind oder ihr bei den Aufgaben Schwierigkeiten hatten, dann überlegt, wie ihr diese Fragen in der BBB-Konferenz stellen könnt:
- Wenn ihr mit Mikrofon teilnehmen könnt/wollt, dann könnt ihr die Frage einfach verbal stellen.
- Wenn ihr ohne Mikrofon teilnehmen wollt, könnt ihr die Frage auch in den Chat schreiben. Dann überlegt euch bitte schon eine Formulierung!
Quarantäne-Einheit 1
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Wir haben im Unterricht schon ein paar Mal angesprochen, dass Materie aus „Teilchen“ besteht. Bei den Aggregatszuständen zum Beispiel haben wir kleine Kugeln zur Darstellung verwendet. Das ist für euch jetzt wahrscheinlich keine wahnsinnig neue Erkenntnis, denn z. B. die Begriffe „Atom“ und „Molekül“, die eng mit dem Begriff des „Teilchens“ zusammenhängen, habt ihr vermutlich schon oft in den Medien gehört.
Tatsächlich war schon der griechische Philosoph Demokrit 400 v. Chr. der Meinung, alle Materie bestünde aus winzig kleinen Teilchen. Er nahm an, dass man bei extrem starker Vergrößerung von Materie auf kleine Teilchen stoßen würde, die sich zwar voneinander trennen lassen, selbst aber nicht teilbar sind. Diese Vorstellung nennt man „Teilchen-Modell“. Die unteilbaren, kleinsten Einheiten nannte er „Atome“.
Vielleicht fragt ihr euch jetzt: Na ja klar, wie sollte es denn auch sonst sein?
Tatsächlich gab es noch eine andere Vorstellung: Das „Kontinuums-Modell“. In diesem Modell nahm man an, dass Materie beliebig teilbar ist, ähnlich wie Knetmasse. Nach dieser Vorstellung gibt es keine kleinsten Teilchen, die sich nicht teilen lassen. Jede noch so kleine Stoff-Portion könnte man immer noch weiter teilen.
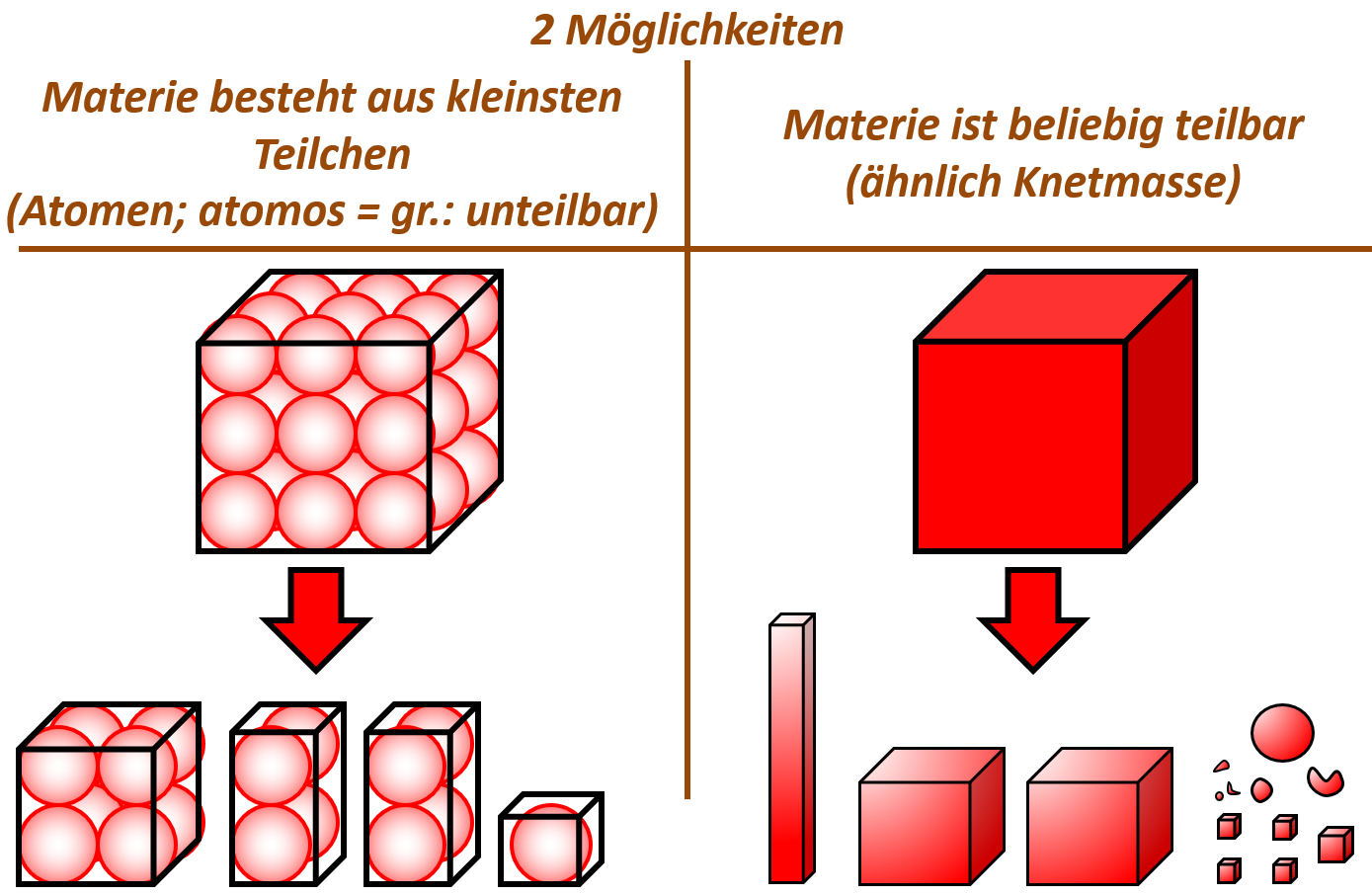
Schaut das folgende youtube-Video von der vielfach ausgezeichneten Wissenschafts-Journalisten Mai Thi Nguyen-Kim:
In dem Video werden drei Phänomene beschrieben, die wir mit unseren Sinnen wahrnehmen können und die sich mit dem „Teilchen-Modell“ gut erklären lassen. Eure Aufgabe soll es sein, nach dem Video zu überlegen, ob sich die genannten Phänomene auch mit dem Kontinuums-Modell erklären lassen würden.
- Legt Stift und Papier bereit!
- Startet das Video (Dauer: 4:35)!
- Nach dem Video: Fasst zunächst stichpunktartig zusammen, wie die genannten Effekte mit Hilfe des „Teilchen-Modells“ erklärt werden! (Klickt bitte erst auf "Lösung", wenn ihr wirkliche die Aufgabe erledigt habt)
Aggregatszustände:
Zwischen den Teilchen gibt es Anziehungskräfte. Wärme führt dazu, dass sich die Teilchen schneller bewegen, sie schwingen schneller hin- und her. Das erklärt warum bei tiefen Temperaturen die Teilchen eng aneinander "kleben" und ihre Form nicht ändern (ein würfelförmiger Pflasterstein bleibt immer würfelförmig, auch wenn man ihn in ein rundes Gefäß wirft).
Das Modell erklärt auch gut, warum sich eine Flüssigkeit beim Verdampfen so stark ausdehnt: Die Teilchen flitzen nun recht schnell durch die Gegend, und haben einen großen Abstand zueinander.
Wärmeleitfähigkeit:
Bei Stoffen, die sich berühren, stoßen die Teilchen des einen Stoffes an die Teilchen des anderen Stoffes. So werden Schwingungen an benachbarte Gegenstände oder Stoffe weitergegeben. Das erklärt dann auch, warum eine Tasse nach kurzer Zeit heiß wird, wenn man sie mit kochendem Wasser füllt.
Diffusion:
Nachdem Teilchen immer in Bewegung sind (außer am absoluten Nullpunkt), mischen sich zwei nebeneinander vorkommende Stoffe von ganz alleine (das ist nicht ganz korrekt, es kommt schon auch etwas auf die Stoffe an).
Wenn man lange genug warten würde, müsste man z.B. eine Tasse Tee gar nicht umrühren, nachdem man Zucker hinzu gegeben hat. Schon nach wenigen Stunden hätte sich der Zucker von ganz alleine im Tee gleichmäßig verteilt.
Das war ein Witz! Der Tee wäre dann ja eiskalt...
- Überlegt jetzt für alle drei Effekte einzeln, ob auch das „Kontinuums-Modell“ die Beobachtungen erklären könnte! (Klickt erst auf den entsprechenden Begriff, wenn ihr wirklich darüber nachgedacht habt.)
Vor allem die Volumenzunahme beim Verdampfen einer Flüssigkeit wäre mit dem Kontinuums-Modell schwierig zu erklären.
Die Vorstellung von "schwingender Knetmasse" ist eher schwierig. Hier ist das Teilchenmodell wirklich besser: Ihr kennt sicher diese Kugelpendel: Man kann eine Kugel auslenken und loslassen, dann stößt sie an die anderen und gibt so ihre Energie weiter. Das ist einfach einzusehen. Mit Knetmasse würde so etwas nicht funktionieren.
Hier sehe ich eher keine Probleme. Auch mit dem Kontinuums-Modell könnte man sich vorstellen, dass sich unterschiedliche Stoffe nach und nach vermischen.
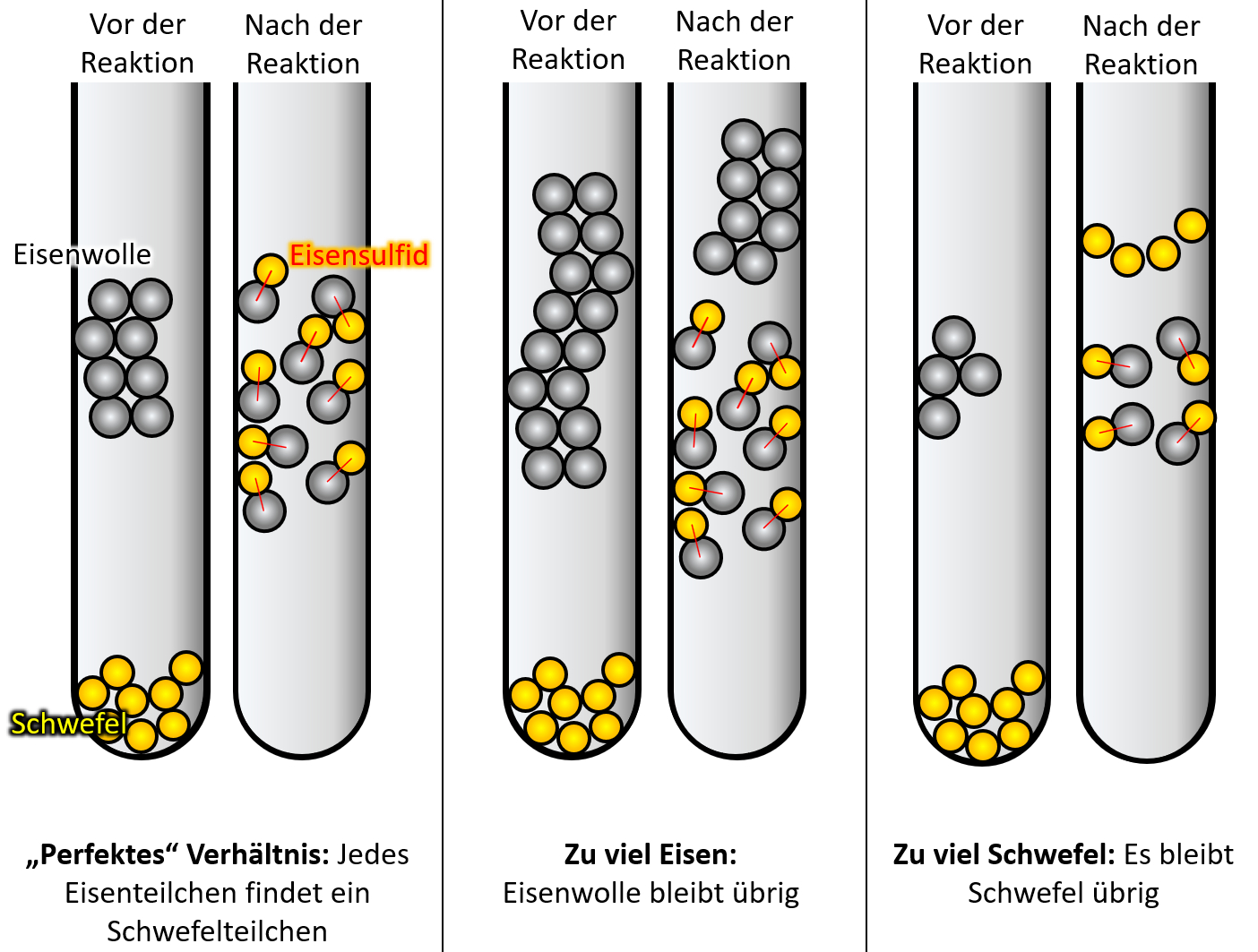
Wenn ihr ganz ehrlich zu euch seid, dann könnte es sein, dass der ein oder andere jetzt noch zweifelt. Sooo wahnsinnig überzeugend ist dieses Teilchen-Modell bis jetzt noch nicht. Der folgende Versuch sollte aber die letzten Zweifel ausräumen. Schlagt euer Buch auf der S. 37 auf. Die Abbildung 3 zeigt einen Versuch, der dreimal mit unterschiedlichen Ausgangsbedingungen durchgeführt wurde: In allen drei Fällen wurde Eisenwolle mit Schwefel in einem Reagenzglas zur Reaktion gebracht. Die Menge an Schwefel war immer gleich, allerdings wurde ist die Menge der Eisenwolle jedesmal anders. In allen drei Fällen entsteht bei der Reaktion ein neuer Reinstoff: Eisensulfid.
Leider ist das Ergebnis auf dem Bild im Buch nicht so schön zu erkennen, deswegen hier noch einmal eine schematische Darstellung:
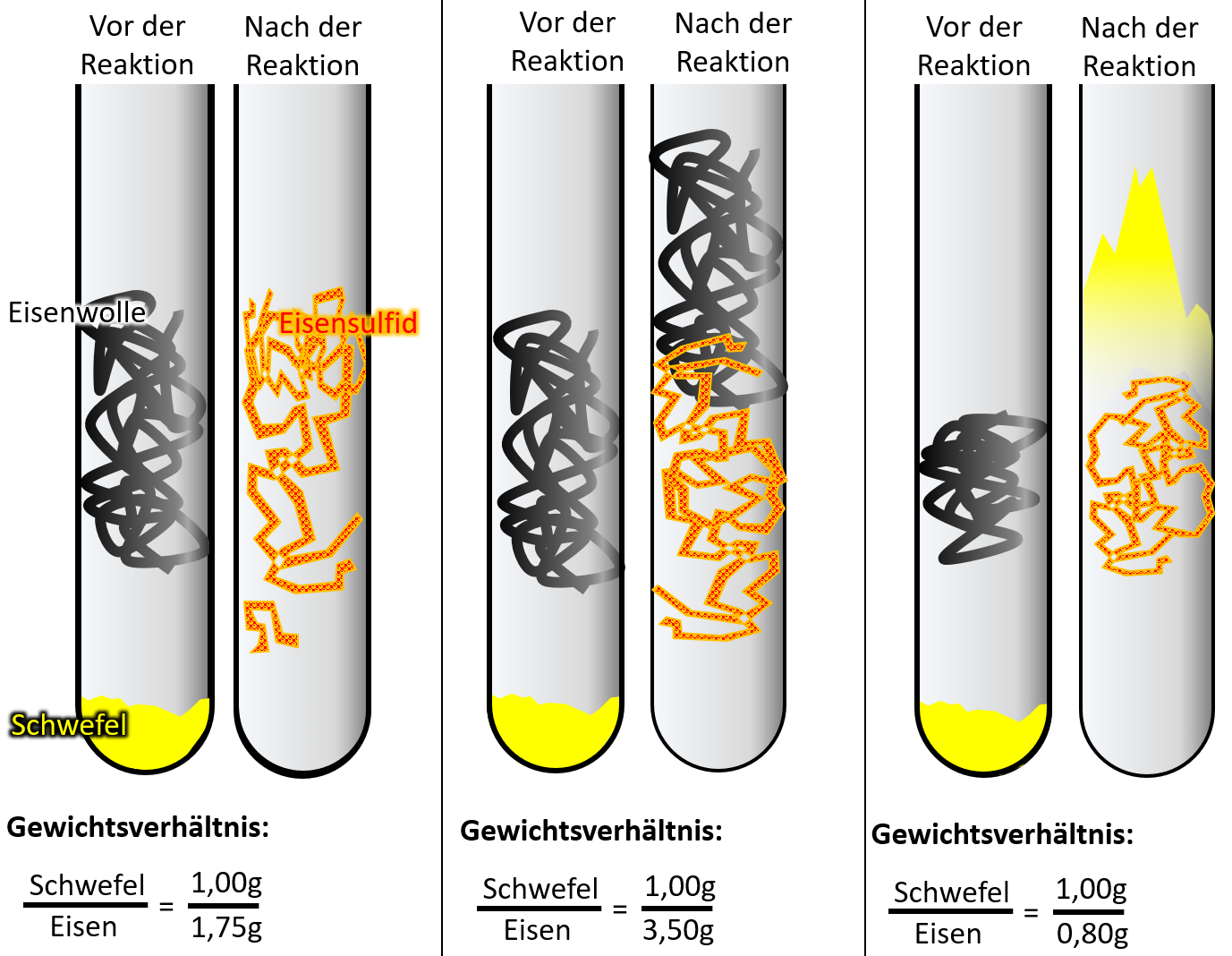
- Beschreibt zunächst kurz das Ergebnis!
- Im ersten Versuch reagiert der gesamte Schwefel mit der gesamten Eisenwolle vollständig zu Eisensulfid.
- Im zweiten Versucht bleibt Eisenwolle übrig.
- Im dritten Versucht bleibt Schwefel übrig.
- Warum ergibt dieses Ergebnis nur Sinn, wenn man annimmt, dass Materie aus kleinsten Teilchen besteht?
- Was müsste man beobachten können, wenn Materie nach dem Kontinuums-Modell aufgebaut wäre, also so etwas wie Knetmasse wäre?
- Versucht Antworten auf diese Fragen zu finden!
Wenn Materie (hier also Eisen und Schwefel) ähnlich wie Knetmasse aufgebaut wären, müsste man jedes beliebige Verhältnis miteinander reagieren lassen können. Nehmen wir an Eisen wäre rote Knetmasse und Schwefel gelbe Knetmassen. Dann müsste es völlig egal sein, wie viel rote Knetmasse ich mit gelber Knetmasse "reagieren lasse" (also durchkneten, bis ein einheitliches Produkt heraus komme. Es sollte immer irgendwas orangefarbenes rauskommen. Mal vielleicht ein bisschen heller, mal ein bisschen dunkler.
Das beobachtet man hier aber nicht!
Nur wenn man ein ganz bestimmtes Verhältnis von Eisen und Schwefel verwendet, reagieren beide Stoffe vollständig miteinander. Ansonsten bleibt einer der Stoffe übrig. Mit dem Teilchen-Modell ergibt die Beobachtung aber hervorragenden Sinn! Denn wenn ein Eisenteilchen immer genau ein Schwefelteilchen als Reaktionspartner benötigt, dann finden nur bei einem bestimmten Verhältnis alle Teilchen ihren Partner. Andernfalls bleiben Teilchen übrig.
Stelle die Situation in den 6 Reagenzgläsern von oben zeichnerisch so dar, dass man die einzelnen Eisen- und Schwefelteilchen erkennen kann!
Versuchsprotokolle
Hier gibt es Beispiele für gelungene Versuchsprotokolle
- Erstes Beispiel: "Trennung eines Salz-Sand-Gemisches": Hier klicken