Benutzer:Thomas Lux: Unterschied zwischen den Versionen
Markierung: 2017-Quelltext-Bearbeitung |
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 15: | Zeile 15: | ||
[[Benutzer:Thomas_Lux/Rhetorik|Rhetorik]] <br> | [[Benutzer:Thomas_Lux/Rhetorik|Rhetorik]] <br> | ||
<span style="color:#F00">'''Neu: 09./11.01.:'''</span><br> | <span style="color:#F00">'''Neu: 09./11.01.:'''</span><br> | ||
=== Chemische Reaktionsgleichungen aufstellen === | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Nr. 1''': Ammoniak reagiert mit Sauerstoff zu Stickstoffmonooxid und Wasser.</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Ammoniak + Sauerstoff --> Stickstoffmonooxid + Wasser | |||
{{Lösung versteckt| | |||
* Ammoniak (Trivialname, muss man auswendig wissen): '''NH<sub>3</sub>''' | |||
* Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | |||
* Stickstoffmonooxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''NO''' | |||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* NH<sub>3</sub> + O<sub>2</sub> --> NO + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Ammoniak''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Stickstoff- und drei Wasserstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Nr. 2''': Benzol (C<sub>6</sub>H<sub>6</sub>) verbrennt (reagiert mit Sauerstoff) zu Kohlenstoffdioxid und Wasser</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Benzol + Sauerstoff --> Kohlenstoffdioxid + Wasser | |||
{{Lösung versteckt| | |||
* Benzol (Trivialname, müsst ihr aktuell noch nocht wissen, daher ist chem. Formel angegeben): '''C<sub>6</sub>H<sub>6</sub>''' | |||
* Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>''' | |||
* Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | |||
* Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* C<sub>6</sub>H<sub>6</sub> + O<sub>2</sub> --> CO<sub>2</sub> + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Kohlenstoffdioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Kohlenstoff- und zwei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Nr. 3''': Phosphortribromid und Wasser reagieren zu Diphosphortrioxid und Wasserstoffbromid.</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Phosphortribromid + Wasser --> Diphosphortrioxid + Wasserstoffbromid | |||
{{Lösung versteckt| | |||
* Phosphortribromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''PBr<sub>3</sub>''' | |||
* Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* Diphosphortrioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''P<sub>2</sub>O<sub>3</sub>''' | |||
* Wasserstoffbromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''HBr''' | |||
* PBr<sub>3</sub> + H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + HBr | |||
{{Lösung versteckt| | |||
'''2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Disphosphortrioxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus zwei Phosphor- und drei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Nr. a)''' Aluminium und Chlor reagieren zu Aluminiumchlorid</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub> | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Aluminium + Chlor --> Aluminiumchlorid | |||
{{Lösung versteckt| | |||
* Aluminium (Element, nicht Bestandteil von HONClBrIF): '''Al''' | |||
* Chlor (Element, Bestandteil von HONClBrIF): '''Cl<sub>2</sub>''' | |||
* Aluminiumchlorid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Chlor steht in der 7. Hauptgruppe --> bildet in Salzen immer 1fach negativ geladene Anionen: Cl<sup>-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei Cl<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''AlCl<sub>3</sub>''' | |||
* Al + Cl<sub>2</sub> --> AlCl<sub>3</sub> | |||
{{Lösung versteckt| | |||
'''2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumchlorid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 1fach negativ geladenen Chlorid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Nr. d)''' Zink(II)-oxid reagiert mit Kohlenstoff zu Zink und Kohlenstoffdioxid</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
2 ZnO + C --> 2 Zn + CO<sub>2</sub> | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Zink(II)-oxid + Kohlenstoff --> Zink + Kohlenstoffdioxid | |||
{{Lösung versteckt| | |||
* Zink(II)-oxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Zink steht in einer Nebengruppe. Welche Ionen Zink bildet ist daher nicht ganz klar. Die römische Zahl in der runden Klammer gibt aber die Ladung des Zink-Kations im Salz an: 2fach positiv --> Zn<sup>2+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup> | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, muss pro Zn<sup>2+</sup>-Ion ein O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''ZnO''' | |||
* Kohlenstoff (Element, kein Bestandteil von HONClBrIF): '''C''' | |||
* Zink (Element, kein Bestandteil von HONClBrIF): '''Zn''' | |||
* Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>''' | |||
* ZnO + C --> Zn + CO<sub>2</sub> | |||
{{Lösung versteckt| | |||
'''2 ZnO + C --> 2 Zn + CO<sub>2</sub>''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Zinkoxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 2fach positiv geladenen Zink-Kationen und 2fach negativ geladenen Oxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Nr. f)''' Aluminiumhydroxid reagiert zu Aluminiumoxid und Wasser</span> | |||
|Inhalt= | |||
{{Lösung versteckt| | |||
2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O | |||
|Sofort gesamte Gleichung anzeigen|Lösung ausblenden}} | |||
<br> | |||
'''oder Schritt für Schritt:''' | |||
<br> | |||
{{Lösung versteckt| | |||
Aluminiumhydroxid --> Aluminiumoxid + Wasser | |||
{{Lösung versteckt| | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** "Hydroxid" ist ein feststehender Begriff für das Molekül-Ion OH<sup>-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei OH<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al(OH)<sub>3</sub>''' | |||
* Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153): | |||
** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup> | |||
** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>. | |||
** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro zwei Al<sup>3+</sup>-Ionen drei O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al<sub>2</sub>O<sub>3</sub>''' | |||
* Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O''' | |||
* Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O | |||
{{Lösung versteckt| | |||
'''2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O''' | |||
|Ausgleichen|Lösung ausblenden}} | |||
|Chemische Formeln aufstellen|Lösung ausblenden}} | |||
|Edukte und Produkte festlegen|Lösung ausblenden}} | |||
Beschreibe den Aufbau des Stoffs '''Aluminiumhydroxid''' unter Verwendung von Fachbegriffen so genau wie möglich! | |||
{{Lösung versteckt| | |||
Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 2fach negativ geladenen Hydroxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen. | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
=== Aufgaben zum Üben === | === Aufgaben zum Üben === | ||
Version vom 25. April 2023, 15:09 Uhr
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
AB inkl. Musterlösung zum Thema "Säuren und Säure-Reste": als pdf-Datei
Aktuelle Seiten in Bearbeitung
9a CSG
9e CNTG
10d CNTG
10e EK
Q11
Q12
10d_2019_20/Chemie
Q11-Struktur-Test-Seite
Oberstufen-Testseite
Rhetorik
Neu: 09./11.01.:
Chemische Reaktionsgleichungen aufstellen
Aufgaben zum Üben
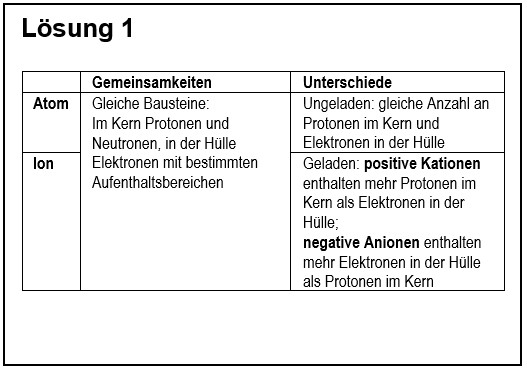
1. Vergleiche in übersichtlicher Form ein Atom mit einem Ion!
2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf!
3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen.
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist.
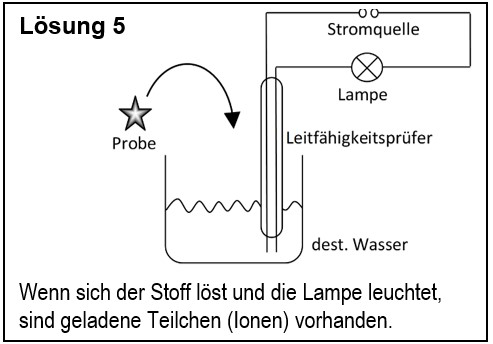
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht.
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg3N2, CaO, KI, BaCl2 und Aluminiumfluorid
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li+, K, S2-, Na+
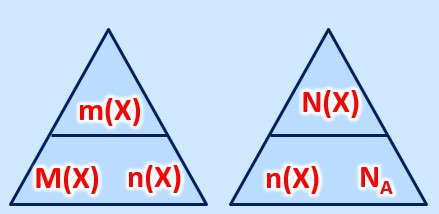
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid.
- Erklärung auf Teilchenebene als .pdf-Datei: Hier klicken. Auch im Buch, S. 162-163
Skript "W-Seminar"
1. Der Aufbau einer wissenschaftlichen Arbeit
- 1.1 Die Zusammenfassung
- 1.2 Die Einleitung
- 1.3 Material & Methoden
- 1.4 Ergebnisse
- 1.5 Diskussion als pdf-Datei
- 1.6 Einbindung der Arbeit in den Wissensbestand als pdf-Datei
2. Formale Aspekte einer wissenschaftlichen Arbeit
- 2.1 Das Zitieren +
- 2.2 Einbau von Abbildungen, Grafiken und Tabellen +
- 2.3 weitere formale Empfehlungen als pdf-Datei
3. Fachlicher Hintergrund: Deskriptive Statistik
- 3.1 wichtige Größen
- 3.1.1 Lagemaße
- 3.1.2 Streuungsmaße
- 3.2 Diagrammtypen als pdf-Datei
- 3.3 Gütekriterien
- 3.3.1 Reliabilität
- 3.3.2 Validität
- 3.3.3 Objektivität als pdf-Datei
Skript "Ökologie"
- Teil 1: "Grundbegriffe" als pdf-Datei, Buch S. 62/63
- Teil 2: "Einflussfaktoren auf Lebewesen" Buch, S. 64/65 +
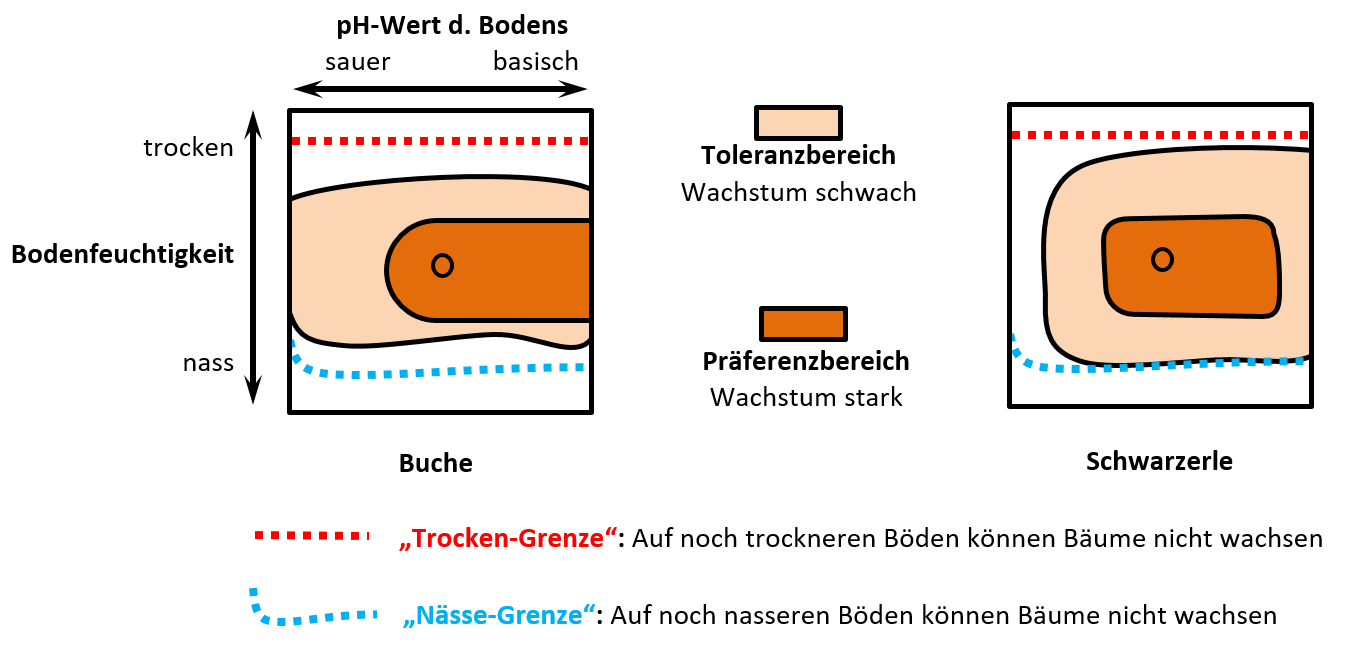
- Teil 3: "Vitalitätskurven" als als pdf-Datei, s. Buch, S. 70
- Teil 4: "Nischenbildung" als als pdf-Datei, s. Buch, S. 88/89
- Teil 5: Tiergeographische Regeln als pdf-Datei, s. Buch, S. 66/67
- Teil 6: Umweltfaktor Licht bei Pflanzen pdf-Datei, s. Buch, S. 68
- Teil 7: Umweltfaktor Wasser bei Pflanzen pdf-Datei, nicht explizit im Buch
- Teil 8: Beziehungen zwischen Lebewesenpdf-Datei, s. Buch, S. 100
Skript "Verdauung"
1. Verdauungsorgane: Überblick
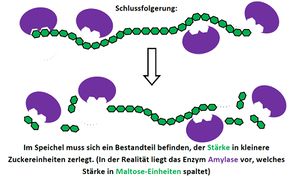
2. Verdauungsprozesse im Mund als pdf-Datei
Neu: 15.11.:
3. Verdauungsprozesse im Magen als pdf-Datei (Buch, S. 26, Abs. 1-5)
- Einschub: Enzympraktikum als pdf-Datei
4. Verdauungsprozesse im Dünndarm als pdf-Datei (Buch, S. 26 ab "Der Dünndarm" - S. 27)
5. Blind- und Dickdarm als pdf-Datei (Noch nicht verfügbar)
Neu, 14.03.19
Skript "OC"
Neu, 10.06.21:
- Teil 1: Die organische Chemie pdf-Datei, s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.)
- Teil 2: Die Welt des Kohlenstoffatoms pdf-Datei, s. Buch (Galvani S2), S. 91 Rest + 94
- Teil 3: Die einfachsten organischen Moleküle: Kohlenwasserstoffe pdf-Datei, s. Buch (Galvani S2), S. 96 - 97
- Teil 4: Eigenschaften der Alkane pdf-Datei, s. Buch (Galvani S2), S. 100 - 101
Lösungsvorschlag f. Arbeitsauftrag vom 29.04.
Arbeitsauftrag Biologie8
- Heute nur eine sehr kurze Einheit.
- Ihr könnt die Aufgabe allerdings erst bearbeiten, wenn wir wirklich den vorangegangenen Arbeitsauftrag erledigt habt.
- Vergesst nicht, die Hausaufgabe vom letzten Mal (die ihr auch über den Schulmanager bekommen habt) mir bis Dienstag, 05.05. zu schicken. Danke!
Arbeitsauftrag Chemie9
Testseiten
Eiweiß-Test-Seite
H5P-Test-Seite
Q11-Struktur-Test-Seite
Oberstufen-Testseite
verlinkte Seiten
Zu den Arbeitsaufträgen in Bio (Corona)
Zu den Arbeitsaufträgen Chemie (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Q11 Biologie
Biologie
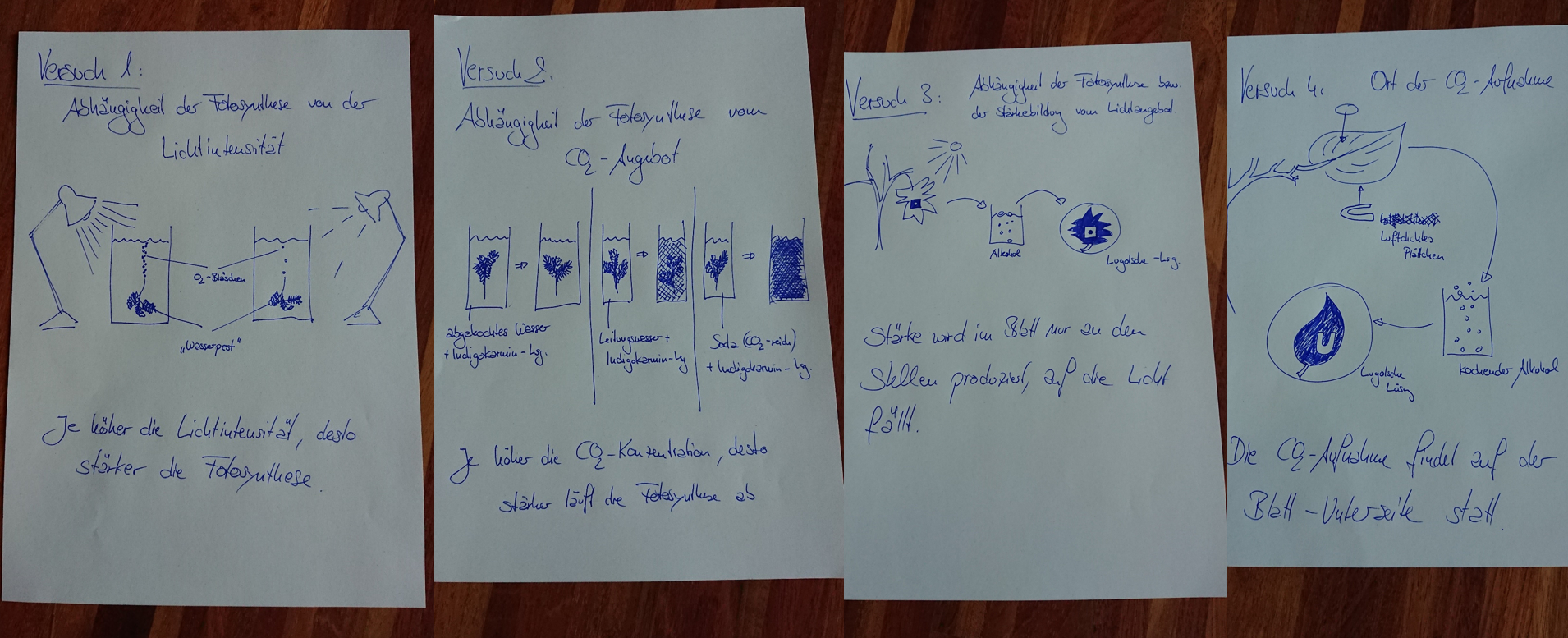
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
Chemie
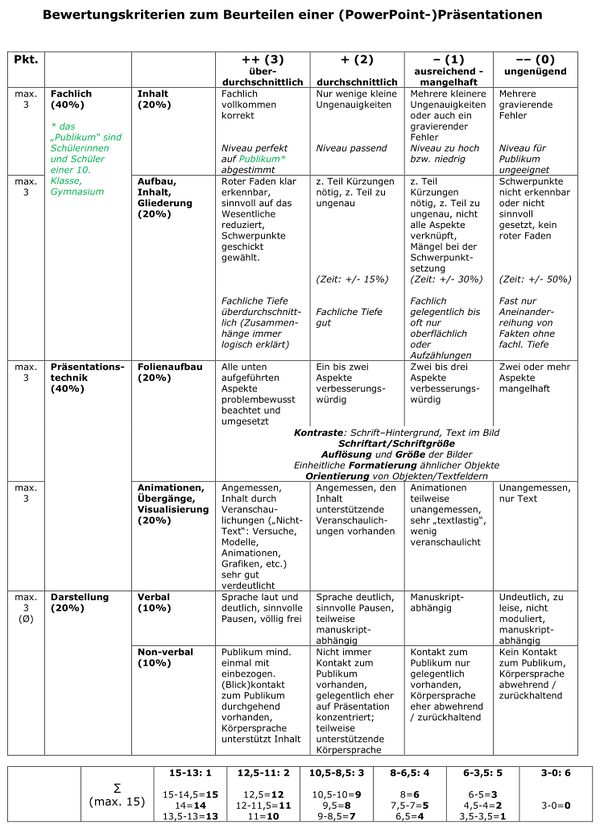
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
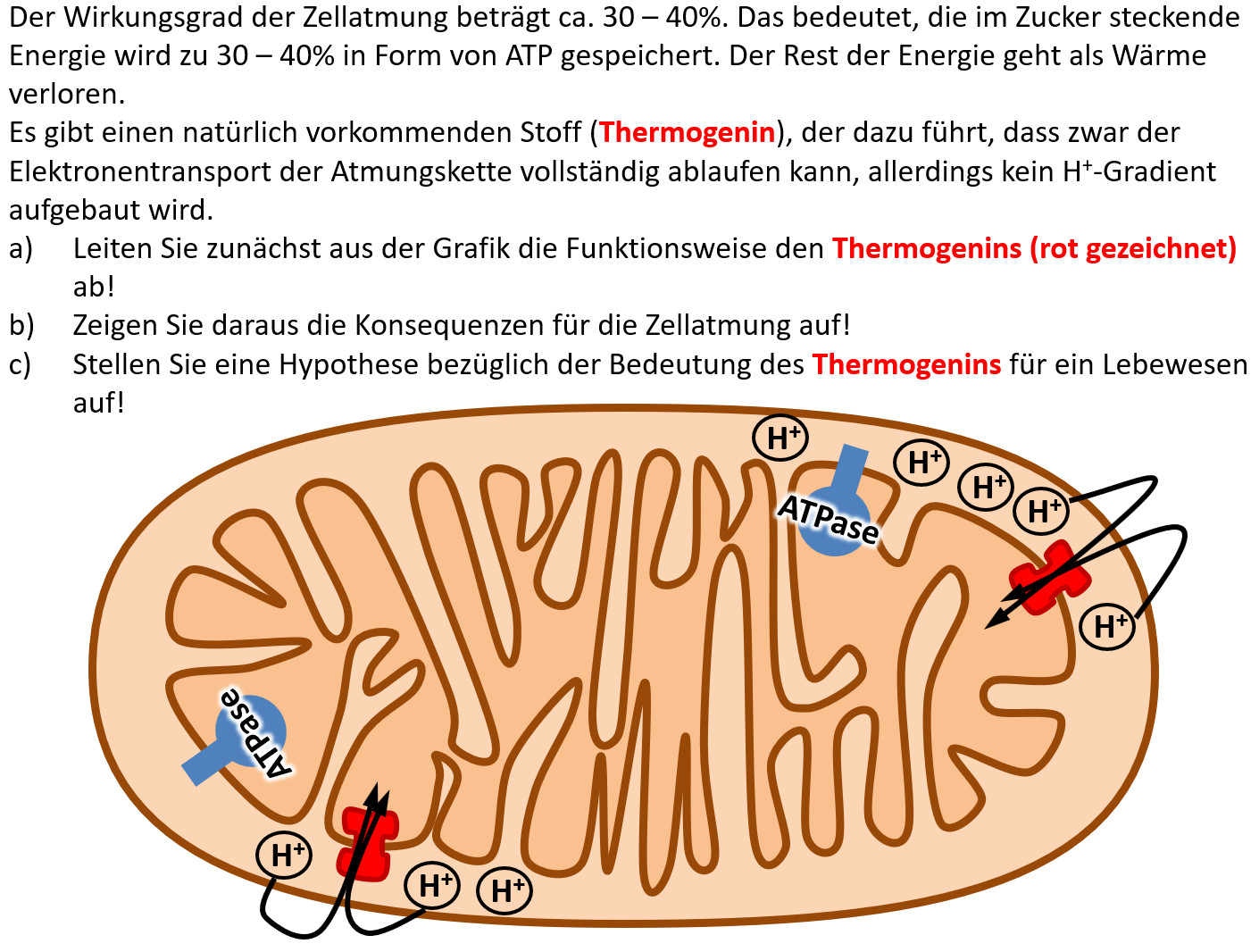
Hausaufgabe: Bearbeitet die folgende Aufgabe!
Datei:SAPlan SJ2122 122 V1.jpg
Seminarangebot
Nachfolgend aufgeführt sind die im nächsten Schuljahr angebotenen W- und P-Seminare. Zusätzlich zu den bereits per Link über den Schulmanager verschickten Konzepten bieten die Lehrkräfte in der Woche vom 17.01. - 21.01 2022 noch Pausentermine an um Fragen zu ihrem Seminar zu beantworten. Diese individuellen Termine sind hier in der Liste veröffentlicht und bereits über die Klassleiter weitergegeben worden.
Hinweis: Es macht keinen großen Sinn an einer Konferenz eines Seminars teilzunehmen, das ihr sowieso zu 100% wählen werdet. Häufig stellt sich aber die Frage, welches Seminar man denn noch als Zweit- oder Drittwunsch nehmen möchte. Es bietet sich also eher an, Konferenzen zu besuchen bzw. bei Lehrkräften nachzufragen von Seminaren, bei denen ihr euch unsicher seid.
Sowohl von den W- als auch den P-Seminaren muss jede Schülerin und jeder Schüler drei auswählen, denen sie bzw. er zugeordnet werden möchte. Mit den Ziffern 1 (Erstwunsch, "Lieblings-Seminar") bis 3 (Drittwunsch, "akzeptabel") kann eine Priorisierung vorgenommen werden. Die Abgabe der Wahlzettel muss zuverlässig bis Freitag, 28.01.2022 erfolgen.