8a 2021 22/Chemie/Thema 3 SALZE: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 39: | Zeile 39: | ||
{{Box|Abschreiben|Notiere auch hier das kursiv gedruckte ins Heft und übernehme die BESCHRIFTETE Abbildung. Finde jeweils 2 Beispiele für die dargestellten Ionengitter und notiere diese darunter|Arbeitsmethode}} | {{Box|Abschreiben|Notiere auch hier das kursiv gedruckte ins Heft und übernehme die BESCHRIFTETE Abbildung. Finde jeweils 2 Beispiele für die dargestellten Ionengitter und notiere diese darunter|Arbeitsmethode}} | ||
Bearbeite anschließend folgende Übungen: | Bearbeite anschließend folgende Übungen: | ||
<iframe src="https://learningapps.org/watch?v=pkbt29gu522" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | <iframe src="https://learningapps.org/watch?v=pkbt29gu522" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | ||
{{Box|Üben|Hole dir aus Kuvert zwei das Übungsmaterial und bearbeite es|Unterrichtsidee }} | {{Box|Üben|Hole dir aus Kuvert zwei das Übungsmaterial und bearbeite es|Unterrichtsidee }} | ||
Version vom 2. Juni 2022, 09:48 Uhr
Salze in der Chemie
Salze bestehen aus Ionen
Diese Ionen lassen sich im Kern-Hülle-Modell einfach darstellen. Löse die folgenden Aufgaben, um das Kern-Hülle-Modell zu verstehen.
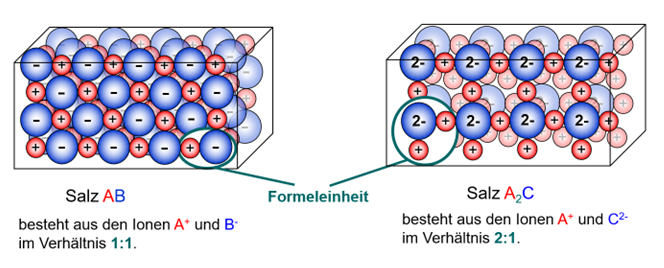
Salze bilden Ionengitter
Bildet sich ein Salz neu, so setzt es sich stets aus einem bestimmten Verhältnis von Kationen und Anionen zusammen.
Da die Anziehungskraft die von einem Ion ausgeht in alle Richtungen wirkt, setzen sich mehrere dieser "gebauten Einheiten" umeinander. Es entsteht ein sog. Ionengitter. Dabei sitzen die Ionen an festen Plätzen an denen sie durch die Anziehungskräfte ihrer entgegengesetzten Ladungen gehalten werden.
Auch im Ionengitter selbst, spiegelt sich dabei das bestimmte Verhältnis von Kationen zu Anionen. Die von dir zusammengesetzte Einheit ist quasi der Grundbaustein des Salzes. Millionen bzw. Milliarden dieser Grundbausteine lagern sich aneinander und bilden schließlich den Salzkristall
Diesen Grundbaustein selbst bezeichnet man auch als Formeleinheit.
Bearbeite anschließend folgende Übungen: