10a 2022 23/Chemie/Redox: Unterschied zwischen den Versionen
Aus RMG-Wiki
(Die Seite wurde neu angelegt: „'''Regeln zum Bestimmen von Oxidationszahlen organischer Verbindungen:''' # Man betrachtet jedes C-Atom einzeln, hier wurde das rechte ausgewählt # Nu…“) Markierung: 2017-Quelltext-Bearbeitung |
Keine Bearbeitungszusammenfassung |
||
| (12 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
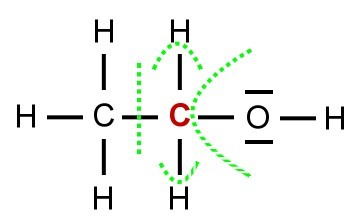
'''Regeln zum Bestimmen von Oxidationszahlen | [[Datei:1.jpg|gerahmt]] | ||
'''Regeln zum Bestimmen von Oxidationszahlen bei Kohlenwasserstoffen''' | |||
1. Man betrachtet jedes C-Atom einzeln, hier wurde das rechte ausgewählt | |||
2. Nun werden die Atombindungen vom C zu benachbarten Atomen gedanklich nach der Elektronegativität aufgespalten: | |||
*das C erhält wenn es elektronegativer ist beide Elektronen, wenn es elektropositiver ist keines. | |||
*das C erhält nur ein Elektron, wenn das benachbarte Atom die gleiche Elektronegativität besitzt | |||
- Hat es weniger besitzt es eine positive OZ.(z.B. 3 statt 4 | |||
3. Zähle nun die Anzahl der so erhaltenen Elektronen des Cs und vergleiche sie mit seiner gewöhnlichen Anzahl an Valenzelektornen, also 4. | |||
*Hat es nun mehr, besitzt es eine negative OZ, da es negativer ist als gewöhnlich. (z.B. 6 statt 4 --> OZ= -2) | |||
*Hat es weniger besitzt es eine positive OZ.(z.B. 3 statt 4 --> OZ = +1) | |||
{{Box|Üben|Bestimme die Oxidationszahlen der C-Atome im rechten Beispiel. ( -III;-I) und löse anschließend die folgenden Aufgaben|Üben}} | |||
<iframe src="https://learningapps.org/watch?app=9051967" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | |||
Aktuelle Version vom 24. März 2023, 20:58 Uhr
Regeln zum Bestimmen von Oxidationszahlen bei Kohlenwasserstoffen
1. Man betrachtet jedes C-Atom einzeln, hier wurde das rechte ausgewählt
2. Nun werden die Atombindungen vom C zu benachbarten Atomen gedanklich nach der Elektronegativität aufgespalten:
- das C erhält wenn es elektronegativer ist beide Elektronen, wenn es elektropositiver ist keines.
- das C erhält nur ein Elektron, wenn das benachbarte Atom die gleiche Elektronegativität besitzt
3. Zähle nun die Anzahl der so erhaltenen Elektronen des Cs und vergleiche sie mit seiner gewöhnlichen Anzahl an Valenzelektornen, also 4.
- Hat es nun mehr, besitzt es eine negative OZ, da es negativer ist als gewöhnlich. (z.B. 6 statt 4 --> OZ= -2)
- Hat es weniger besitzt es eine positive OZ.(z.B. 3 statt 4 --> OZ = +1)