|
|
| (18 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) |
| Zeile 1: |
Zeile 1: |
| ==Distanzlernen Distanzunterricht==
| |
|
| |
| === Distanzunterricht Donnerstag, 20.05. ===
| |
| Wir starten eine Videokonferenz um 08:45 Uhr. Bitte loggt euch rechtzeitig ein. Haltet die Biologie-Hausaufgabe vom letzten Mal bereit (Fotosynthese-Filme). In der Zeit von 08:00 Uhr bis 08:45 bearbeitet ihr bitte die folgenden Aufgaben, orientiert euch dabei an dem ersten Beispiel.
| |
|
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Redoxgleichungen'''</span>
| |
| |Inhalt=
| |
| '''Beispiel'''<br>
| |
| Bei der Herstellung von reinem Eisen (Fe) strömt das Gas Kohlenstoffmonoxid (CO) durch heißes Eisenerz, welches hauptsächlich Eisenoxid (Fe<sub>2</sub>O<sub>3</sub>) enthält. Neben dem gewünschten Eisen entsteht auch Kohlenstoffdioxid (CO<sub>2</sub>)<br>
| |
| Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat!
| |
| {{Lösung versteckt|
| |
| [[Datei:C9NTG_Redox_Bsp_Hochofen.jpg]]<br>
| |
| |Lösung|Lösung ausblenden}}<br>
| |
| <br>
| |
| '''Aufgabe 1'''<br>
| |
| Mangan (Mn) ist ein Element, welches gerne als "Chamäleon" bezeichnet wird. Das liegt daran, dass Manganverbindungen je nach Oxidationszahl des Mangans unterschiedliche gefärbt sind. Man kann also anhand der Farbe schon erkennen, welche OZ vorliegt. Schüttet man eine violette Lösung, die Permangant-Ionen enthält (MnO<sub>4</sub><sup>-</sup>) in eine saure Sulfit-Lösung (SO<sub>3</sub><sup>2-</sup>), so "verschwindet" die violette Farbe. Tatsächlich sind jedoch farblose Mn<sup>2+</sup>-Ionen entstand und gleichzeitig fand eine Umwandlung von Sulfit in Sulfat statt (SO<sub>4</sub><sup>2-</sup>).<br>
| |
| Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat!
| |
| <br><br>
| |
| '''Aufgabe 2''' (Bild: Abb. 1 auf S. 138 im Buch)<br>
| |
| Wirft man ein Stück Kupfer (Cu) in Salpetersäure (HNO<sub>3</sub>), so löst es sich unter Entwicklung eines sehr giftigen, braunen Gases auf. Bei dem Gas handelt es sich um Stickstoffdioxid (NO<sub>2</sub>), das Kupfer selbst regiert zu Cu<sup>2+</sup>-Ionen.<br>
| |
| Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat!
| |
| <br><br>
| |
| '''Aufgabe 3''' (Bild: Abb. 1 auf S. 146 im Buch) <br>
| |
| Im Labor kann man ein kleine Portion Kupfer(II)-oxid (CuO) in ein Glasrohr legen, durch das Wasserstoffgas (H<sub>2</sub>) strömt. Erhitzt man von außen das Kupfer(II)-oxid, so regiert es nach einiger Zeit mit dem vorbei strömenden Wasserstoff zu elementarem Kupfer (Cu). Gleichzeit entsteht bei dieser Reaktion Wasser (H<sub>2</sub>O).<br>
| |
| Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat!
| |
| <br><br>
| |
| '''Aufgabe 4''' (schwer, also wirklich: sehr schwer!)<br>
| |
| Wenn die Verkehrspolizei heute überprüfen möchte, ob eine Autofahrerin bzw. ein Autofahrer Alkohol getrunken hat, dann muss die entsprechende Person in ein elektronisches Messgerät pusten. Das Gerät zeigt dann direkt einen Atemalkohol-Gehalt in Promille an. Früher gab es diese Technik noch nicht. Zwar musste man auch pusten, aber durch ein Röhrchen hindurch in einen Beutel, ähnlich wie ein Luftballon. In dem Röhrchen befand sich gelbes Kaliumdichromat (K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>). Wenn die autofahrende Person Alkohol in der Ausatemluft hatte, dann entstanden grüne Chrom(III)-Ionen (Cr<sup>3+</sup>). Der Alkohol reagierte dabei zur Essigsäure. Die folgende Abbildung zeigt die Valenzstrichformeln der beiden Verbindungen. Hier müsst ihr die Oxidationszahlen so bestimmen, wie ihr es ganz am Anfang gelernt habt: Durch Aufteilen der bindenden Elektronenpaare!<br>
| |
| [[Datei:C9NTG_EthanolEssigsäure_Valenzstrich.jpg]]<br>
| |
| <br>
| |
| Zeige anhand der Oxidationszahlen auf, wo in diesem Beispiel eine Reduktion und wo eine Oxidation stattgefunden hat!
| |
| Haltet eure Lösungen am Donnerstag in der Videokonferenz bereit!
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
| === Distanzunterricht Dienstag, 18.05.===
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">'''Fotosynthese'''</span>
| |
| |Inhalt=
| |
| In der letzten Biologie-Einheit ging es um den Umweltfaktor '''Temperatur'''. Ihr habt "Tiergeographische Regeln" kennengelernt, die einen Zusammenhang zwischen der Temperatur im Lebensraum und Körpermerkmalen bei Tieren herstellt. Bitte ladet euch den entsprechenden Hefteintrag dazu herunter, speichert ihn oder druckt ihn aus und klebt ihn ins Heft oder schreibt ihn einfach ab.<br>
| |
| Heute soll es um einen anderen Umweltfaktor gehen: '''Licht'''. Auch Tiere werden teilweise sehr stark vom Licht beeinflusst, bevor wir dazu kommen, betrachten wir aber Pflanzen. Für sie ist die regelmäßige Versorgung mit Licht überlebensnotwendig.<br>
| |
| Ihr habt sicherlich in eurer Schullaufbahn schon einmal die '''Fotosynthese''' besprochen, also den Prozess, bei dem Pflanzen mit Hilfe von Sonnenlicht die Stoffe Kohlenstoffdioxid und Wasser in Traubenzucker und Sauerstoff umwandeln. <br>
| |
| Das folgende Video ist ziemlich alt. Die darin enthaltenen Versuche jedoch unschlagbar gut in Szene gesetzt. Schüler eines W-Seminars wollten mit mir diese Versuche schon einmal nachmachen und filmen, aber wir sind schlimm gescheitert. Umso größer ist die Anerkennung für die "Macher" des Videos.<br>
| |
| Das Video zeigt nacheinander vier Versuche und dauert insgesamt ca. 18 Minuten. Stoppt das Video nach jeder Versuchseinheit und notiert euch:
| |
| * Wie könnte eine "Überschrift" für den Versuch heißen?
| |
| * Stellt den '''Versuchsaufbau''' grafisch dar (keinen Text, sondern nur einfache Skizzen).
| |
| * Notiert in einem Satz das Ergebnis des Versuchs.
| |
| * ''Zeitbedarf:'' Pro Versuch solltet ihr ca. 5 Minuten für die Bearbeitung der Aufgaben brauchen, im "schlimmsten" Fall also 20 Minuten. Mit Anschauen insgesamt 38 Minuten - müsste zu schaffen sein! :)
| |
| * Haltet eure Lösung für Donnerstag bereit. Ich würde eure Ergebnisse dann gerne in einer Videokonferenz besprechen.<br>
| |
| <br>
| |
|
| |
| {{#ev:youtube|J9KwbIdNXo0}}
| |
|
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
| <br>
| |
|
| |
| === Distanzunterricht Di, 11.05. ===
| |
| Ihr dürft heute zwischen zwei Versuchen wählen, die ihr durchführen sollt. Selbstverständlich dürft ihr auch beide machen, aber verpflichtend ist nur einer:
| |
|
| |
| * Den Versuch '''CO<sub>2</sub>-Löscher''' hattet ihr schon vor Weihnachten mal auf, damals aber freiwillig. Wenn ihr ihn damals nicht gemacht habt: Auf geht´s :). <br> Am Ende des Versuchs ist eine Aufgabe gestellt, die ihr bitte bearbeitet und als Antwort auf den Arbeitsauftrag im Schulmanager schickt.
| |
| * Der Versuch '''Apfel oxidieren''' ist neu. Hier sollt ihr am Ende keine Aufgabe bearbeiten, sondern es geht darum, den Versuch in Form eines "wissenschaftlichen Versuchsprotokolls" möglichst sachlich zu dokumentieren. Denkt immer daran: Ein Versuchsprotokoll besteht aus den Teilen '''"Versuchsaufbau/Durchführung"''' (hier wird beschrieben, was man getan hat), '''"Ergebnisse"''' (hier dokumentiert man in Wort und Bild die Ergebnisse des Versuchs - ohne dafür schon eine "Erklärung" zu geben) und '''"Erklärung/Diskussion"''' (hier versucht man unter anderem, die Ergebnisse zu erklären).
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#007">'''CO<sub>2</sub>-Löscher'''</span>
| |
| |Inhalt=
| |
| '''Ihr benötigt:'''
| |
| * ein schmales Glas, in das gerade so ein Teelicht passt
| |
| * ein Teelicht
| |
| * ein größeres Gefäß, z.B. Messbecher
| |
| * ein Geschirrtuch (o.ä.)
| |
| * ein Päckchen Backpulver
| |
| * Essig oder besser: Essigessenz
| |
| <br>
| |
|
| |
| '''Durchführung''':<br>
| |
| [[Datei:CO2Schütten_V.jpg|800px]]<br>
| |
| * Entzündet das Teelicht im schmalen Glas
| |
| * Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
| |
| * Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
| |
| * Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
| |
| * Zieht nun '''vorsichtig '''das Geschirrtuch ab. Gießt nun das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
| |
| <br>
| |
| '''Beobachtung/Erklärung''':<br>
| |
| Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie das Ergebnis aussehen könnte.
| |
|
| |
| {{Lösung versteckt|
| |
| [[Datei:CO2Schütten_V1.gif]]
| |
| |Video|Lösung ausblenden}}
| |
| <br>
| |
| Einen Teilprozess bei der Reaktion von Zitronensäure mit dem Hauptbestandteil des Backpulvers, Natriumhydrogencarbonat, kann man vereinfacht so formulieren: <br>
| |
| <br>
| |
| NaHCO<sub>3</sub> + H<sub>3</sub>O<sup>+</sup> --> CO<sub>2</sub> + 2 H<sub>2</sub>O + Na<sup>+</sup><br>
| |
| <br>
| |
| <br>
| |
| '''Aufgabe:'''<br>
| |
| Begründet unter Angabe von Oxidationszahlen, ob es sich bei diesem Vorgang um eine Redoxreaktion handelt! <br>
| |
|
| |
| Lösungsvorschlag auf Blatt --> Foto machen --> Als Antwort auf Arbeitsauftrag im SM hochladen!
| |
|
| |
| |Farbe= #007
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFF
| |
| |Hintergrund= #DFF
| |
| }}
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Apfel oxidieren'''</span>
| |
| |Inhalt=
| |
| '''Material:'''<br>
| |
| Ihr benötigt:
| |
| * Einen Apfel
| |
| * Zitronensaft (frisch oder auch nicht)
| |
| * Eine Reibe oder ein Messer
| |
| * etwas Geduld...
| |
| <br>
| |
| '''Durchführung:'''
| |
| * Stellt Zitronensaft bereit (evtl. Zitrone auspressen).
| |
| * Raspelt auf einer Reibe einen Apfel in kleine Stücke. Solltet ihr keine Raspel haben, dann schneidet den Apfel anders in so kleine Stücke wie möglich.
| |
| * Verteilt die Apfelstücke auf zwei Untertassen. Das sind die beiden Ansätze, die ihr später miteinander vergleichen sollt.
| |
| * Tropft auf den einen Ansatz Zitronensaft (nicht alles, ihr benötigt später den Saft noch einmal).
| |
| * Stellt beide Ansätze für einige Minuten (20-30min) beiseite und vergleicht die Ansätze dann.
| |
| <br>
| |
| '''Dokumentation:'''
| |
| Ich nehme an, ihr wisst was passiert: Die Apfelmasse wird braun. Dokumentiert euer Ergebnis, so gut ihr könnt! Achtet auf die Kriterien, die wir bereits besprochen haben:
| |
| * Bei Fotos sollten keine Gegenstände des Hintergrundes zu sehen sein!
| |
| * Wenn ihr keine Kamera habt, die für Nahaufnahmen geeignet ist, versucht es doch mit einer Skizze (tatsächlich mit Stift und Blatt oder auch am PC)!
| |
| * Bilder brauchen dringend eine aussagekräftige Abbildungsbeschriftung!
| |
| <br>
| |
| '''Erklärung:'''
| |
| * Recherchiert, woher die Braunfärbung kommt. Eine Seite im Internet, die relativ kurz und dabei verständlich ist, gibt es z.B. hier: [https://www.wochenblatt.com/natur-warum-wird-der-apfel-braun-12475358.html#:~:text=Zu%20viel%20frische%20Luft&text=Sauerstoff%20aus%20der%20Luft%20gelangt,Apfels%20bewirkt%20sie%20eine%20Braunfärbung. Zur Homepage] - Wenn sich die Seite öffnet, erscheint in der Regel zunächst ein Fenster, in dem "Privatsphäre-Informationen" angezeigt werden. Klickt auf "Einstellungen verwalten" unten links. Deaktiviert alle grünen Haken die bei "Legitimes Interesse" stehen (sollten 9 Stück sein). Ich bin mir ziemlich sicher: '''NIEMAND''' hat ein '''legitimes Interesse''' daran, eure Aktionen im Internet zu verfolgen!
| |
| * Versucht die auf der Seite beschriebenen Zusammenhänge '''zeichnerisch''' darzustellen! - Im Text ist zum Beispiel von Chinonen die Rede. Deren chemische Formel wisst ihr zwar nicht, aber ihr könnt ja ein Symbol verwenden, z.B. eine geometrische Figur wie ein Sechseck. Vielleicht schafft ihr es auf diese Weise sogar so etwas ähnliches wie eine Redoxgleichung darzustellen (natürlich ohne Koeffizienten oder Indizes).
| |
| * Auf der Seite steht, dass man die Braunfärbung von Äpfeln auch nachträglich mit Zitronensaft wieder aufheben kann. Probiert das!
| |
| <br><br>
| |
| Fertigt nun ein richtiges Versuchsprotokoll mit den einleitend beschriebenen Teilen (Durchführung, Ergebnisse, Erklärung) an. Es sollte alles auf eine Seite passen! --> Foto machen --> Als Antwort auf Arbeitsauftrag im Schulmanager hochladen
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
|
| |
| === Distanzunterricht Do, 06.05.===
| |
| * Chemie: Verbesserung der Hausaufgabe (Oxidationszahlen bestimmen)
| |
| * Biologie: Der Umweltfaktor Temperatur - Tiergeographische Regeln
| |
| ** Es wurde ein neuer Hefteintrag hochgeladen, der Teil des Ökologie-Skriptes (s. u.) ist. Er kann auch hier heruntergeladen werden (bitte ausdrucken und ist Heft kleben oder abschreiben): '''Tiergeographische Regeln''' als [[Spezial:FilePath/Skript_Öko_004.pdf|pdf-Datei]], s. Buch, S. 66/67
| |
|
| |
| === Distanzunterricht Di, 04.05.===
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Redoxreaktionen mit Molekülen'''</span>
| |
| |Inhalt=
| |
| Heute wird ein Problem gelöst, welches in der letzten Stunde aufgetaucht ist: Nach dieser Einheit solltet ihr in der Lage sein auch bei Molekülen zu entscheiden, ob eine Reduktion oder Oxidation stattgefunden. Schaut dazu zunächst das folgende Video (ca. 30min):<br>
| |
| {{#ev:youtube |wT_b59HgM2s}}<br>
| |
| <br>
| |
| '''Bearbeitet dann die im Video gestellten Aufgaben:'''<br>
| |
| (Das sollte noch locker innerhalb der 45min. Unterrichtszeit zu schaffen sein)<br>
| |
| * Bei der Elektrolyse von Wasser entsteht aus den gebundenen Sauerstoffteilchen im Wasser (H<sub>2</sub>O) elementares Sauerstoff-Gas (O<sub>2</sub>).
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox3_H2OzuO2_ML.jpg]]<br>
| |
| Bitte beachten: Es handelt sich hier nicht um eine vollständige, chemische Gleichung. Es wird nur ein Teilprozess beachtet!
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Bei der Verbrennung Schwefel (S) entsteht unter anderem Schwefeltrioxid (SO<sub>3</sub>).
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox3_SzuSO3_ML.jpg]]<br>
| |
| Bitte beachten: Es handelt sich hier nicht um eine vollständige, chemische Gleichung. Es wird nur ein Teilprozess beachtet!<br>
| |
| Ob ihr die sechs Valenzelektronen des Schwefels als Punkte, Striche oder gemischt dargestellt habt, ist in diesem Zusammenhang nicht so wichtig.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Es wäre technisch sehr praktisch, wenn man aus Kohlenstoffdioxid (CO<sub>2</sub>) reinen Kohlenstoff (C) gewinnen könnte.
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox3_CO2zuC_ML.jpg]]<br>
| |
| Bitte beachten: Es handelt sich hier nicht um eine vollständige, chemische Gleichung. Es wird nur ein Teilprozess beachtet!<br>
| |
| Ob ihr die vier Valenzelektronen des Kohlenstoffs als Punkte, Striche oder gemischt dargestellt habt, ist in diesem Zusammenhang nicht so wichtig.
| |
| |Lösung|Lösung ausblenden}}
| |
| <br>
| |
| <br>
| |
| <span style="color:#607">'''Was noch zu tun ist'''</span>
| |
| * Ladet den Hefteintrag und das im Video erwähnte Arbeitsblatt herunter:
| |
| ** Hefteintrag als [[Spezial:FilePath/C9NTG_OZbestimmen_Heft.pdf|pdf-Datei]]. Ausdrucken und ins Heft kleben oder abschreiben.
| |
| ** Arbeitsblatt: [[Spezial:FilePath/C9NTG_PP31_OZbestimm_AB.pdf|pdf-Datei]]. <br>
| |
| * Als Hausaufgabe lest ihr im Buch die S. XXXX (muss ich noch ergänzen) und löst mind. 3 Aufgaben auf dem Arbeitsblatt
| |
|
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
|
| |
| === Distanzunterricht Di, 27.04. ===
| |
| Falls noch nicht heruntergeladen, hier der Hefteintrag (Chemie) von letzter Stunde: [[Spezial:FilePath/C9NTG_RedoxEinf_Heft.pdf|pdf-Datei]] (Redoxreaktionen)<br>
| |
| <br>
| |
| '''Neuer Arbeitsauftrag:'''<br>
| |
| Heute ein paar Wiederholungsaufgaben zum Thema Redoxreaktionen.<br>
| |
| Ladet zunächst das Arbeitsblatt herunter (ihr müsst es nicht ausdrucken, ihr könnt die Lösungen auf ein normales Blockblatt schreiben! Lest dann die einleitenden Texte hier und bearbeitet dann die Aufgaben. Für die jeweils erste Aufgabe eines Blocks ist ein Lösungsvorschlag verfügbar.
| |
| * Arbeitsblatt als [[Spezial:FilePath/C9NTG_Redox_WH_e.pdf|pdf-Datei]]
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''1. Erkennen, ob ein Salz oder molekular gebauter Stoff vorliegt'''</span>
| |
| |Inhalt=
| |
| Ihr solltet wissen: Die Elemente im PSE können grob eingeteilt werden in '''Metalle '''und '''Nichtmetalle'''. In eurem Buch auf der letzten Seite ist „die Grenze“ zwischen diesen beiden Gruppen im PSE erkennbar.<br>
| |
| '''Metalle '''stehen eher links im PSE und besitzen in der Regel wenige Valenzelektronen. Um in Verbindungen Edelgaskonfiguration zu erreichen, werden diese abgegeben.<br>
| |
| <br>
| |
| Bsp.: Magnesium steht in der zweiten Hauptgruppe, besitzt daher zwei Valenzelektronen. In Verbindungen (Salzen) haben die Magnesium-Atome diese zwei Elektronen abgegeben und liegen als Mg<sup>2+</sup>-Ionen vor.<br>
| |
| <br>
| |
| Chem. Gleichung: Mg --> Mg<sup>2+</sup> + 2e<sup>-</sup>
| |
| <br><br>
| |
| '''Nichtmetalle '''stehen eher recht im PSE und besitzen in der Regel mehr als vier Valenzelektronen. Um Edelgaskonfiguration zu erreichen, können sie z.B. Elektronen aufnehmen. In Salzen liegen daher negativ geladene Ionen vor.<br>
| |
| <br>
| |
| Bsp.: Sauerstoff steht in der sechsten Hauptgruppe, besitzt daher sechs Valenzelektronen. In Verbindungen (Salzen) liegt es in der Regel als O<sup>2-</sup>-Ion vor, da es zwei Elektronen aufgenommen hat.<br>
| |
| <br>
| |
| Chem. Gleichung: O + 2e<sup>-</sup> --> O<sup>2-</sup>
| |
| <br><br>
| |
| Salze sind oft Verbindungen aus '''Metallionen '''und '''Nichtmetallionen'''. Ihr solltet Salze erkennen, benennen und ihre Ionen ableiten können!<br>
| |
| <br>
| |
| Lösungen für die ersten Aufgaben auf dem Arbeitsblatt:
| |
| * Natrium reagiert mit Sauerstoff zu Natriumoxid
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox2_WH_Salzbld_ML1_V2.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Ist MgO ein Salz?
| |
| {{Lösung versteckt|
| |
| Ja! Magnesium ist ein typisches Metall (steht links im PSE) und Sauerstoff ein typisches Nichtmetall (steht rechts im PSE). Aufgrund der Hauptgruppen, in denen die beiden Elemente stehen, kann man ableiten, was für Ionen in dem Salz vorliegen müssen: <br>
| |
| [[Datei:Redox2_WH_MgO_ML1.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''2. Redoxreaktionen'''</span>
| |
| |Inhalt=
| |
|
| |
| Ihr habt gelernt, dass bei '''Redoxreaktionen''' Elektronen ausgetauscht werden. Man kann daher eine Redoxgleichung in eine Oxidations- und eine Reduktionsgleichung unterteilen, bzw. bei den Edukten einer Reaktion festlegen, welcher Stoff '''Reduktions'''- und welcher '''Oxidationsmittel''' ist. Bei den Gleichungen zur Bildung von Salzen aus den Elementen (s. oben) ist das immer sehr einfach möglich. Bei einigen anderen Gleichungen etwas komplizierter. Oft funktioniert es aber, wenn man nach Salzen sucht und daraus die entsprechenden Ionen ableitet.<br>
| |
| <br>
| |
| Lösung für die erste Aufgabe auf dem Arbeitsblatt:
| |
| * Magnesium brennt unter Wasser weiter
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox2_WH_MgUnterWasser_ML1.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
| === Distanzunterricht Do, 22.04. ===
| |
| '''Teil 1:'''<br>
| |
| Videokonferenz zur Besprechung der letzten Einheit.<br>
| |
| <br>
| |
| '''Teil 2:'''<br>
| |
| Fragen und Antworten zu RNS-Impfstoffen<br>
| |
| <br>
| |
| '''Teil 3:'''<br>
| |
| Ein (freiwilliger) Versuch
| |
| <br>
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">'''Osmotische Prozesse'''</span>
| |
| |Inhalt=
| |
| Osmose bei Kartoffeln. <br>
| |
| Der Prozess der Osmose begegnet euch im Alltag wahrscheinlich häufiger als ihr meint. Auch im Unterricht habt ihr SICHER (!) schon MEHRFACH (!) darüber gesprochen. Für den Fall, dass ihr es trotzdem vergessen haben solltet, hier ein kurzes Video: [https://www.youtube.com/watch?v=tHzkRtzVmUM Hier klicken] <br>
| |
| <br>
| |
| ''Zusammenfassung:''<br>
| |
| '''''Diffusion:''' Teilchen verteilen sich freiwillig gleichmäßig im Raum (oder in einem Lösungsmittel). Der umgekehrte Prozess wird nicht beobachtet: Verteilte Teilchen konzentrieren sich nicht an einer Stelle.''<br>
| |
| '''''Osmose:''' Existiert eine semi-permeable Membran (dazu zählen auch Zellwände) können bestimmte Teilchen (hier: Wasser) diese passieren, andere nicht (hier: "Salz-Teilchen" oder generell "gelöste Teilchen"). Befinden sich auf der einen Seite der Membran viele gelöste Teilchen, die nicht durch die Membran können, strömen die anderen Teilchen (hier: Wasser) dorthin, um die Konzentration zu verdünnen.''<br>
| |
| <br>
| |
| Führt folgenden Versuch durch und macht Fotos von den einzelnen Schritten, damit ihr später ein anschauliches Protokoll erstellen könnt: <br>
| |
| * Material: 3 Gläser, Salz, Wasser (am besten destilliertes), Kartoffel
| |
| * Schneidet aus einer Kartoffel drei gleich große, längliche Stäbchen (wie Pommes Frites), messt die Länge und legt sie beiseite (es geht auch mit einer Karotte).
| |
| * Stellt in den drei Gläsern drei verschieden stark konzentrierte Salzlösungen her:
| |
| ** (reines) '''Wasser''': '''100g destilliertes Wasser''' (wenn nicht vorhanden: normales)
| |
| ** (physiologische) '''Kochsalzlösung''': '''99,1g destilliertes Wasser''' (wenn nicht vorhanden: normales) '''+ 0,9g Salz''' (Eine Waage, die 0,9g abwiegen kann hat nicht jeder zu Hause, daher: 0,9g entsprechen ungefähr 2 Messerspitzen. Eine andere Möglichkeit wäre 991g Wasser und 9g Salz zu mischen. Dann habt ihr einen Liter Salzwasser, von dem ihr aber nur ein Glas voll braucht.)
| |
| ** stark konzentrierte Kochsalzlösung: '''100g destilliertes Wasser''' (wenn nicht vorhanden: normales) + '''1 Teelöffel Salz'''
| |
| * Legt in jede Flüssigkeit einen Kartoffelstreifen
| |
| * Wartet 30 - 240 min. (Je nach '''Dicke''' der Kartoffel)
| |
| * Messt anschließend die Länge der Kartoffelstreifen und biegt die Streifen stark (versucht die beiden Enden zusammenzuführen).
| |
| * Dokumentiert eure Ergebnisse anschaulich!
| |
| * Formuliert eine wissenschaftliche Erklärung für eure Ergebnisse!
| |
| <br>
| |
| [[Datei:Osmose_Kartoffel_VAnsatz.jpg]]
| |
|
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
|
| |
| {{Lösung versteckt|
| |
| [[Datei:Osmose_Kartoffel_Ergebnis.jpg]]
| |
| |Dokumentation einblenden|Dokumentation ausblenden}}
| |
|
| |
| ===Distanzunterricht Di, 20.04.===
| |
| Das Thema "Säuren und Basen" ist noch nicht ganz abgeschlossen. Die verbleibenden Teilgebiete eignen sich für den Distanzunterricht aber eher weniger. Daher möchte ich heute mit einem neuen Thema beginnen. Arbeitsaufträge:
| |
| * Schaut das folgende Video (18:44min)!
| |
| * Wenn ihr im Video dazu aufgefordert werdet, stoppt das Video und bearbeitet die unten stehenden Aufgaben. Schaut erst danach den Rest des Videos!
| |
| * Lest als Hausaufgabe im Buch (Galvani Chemie S2) die S. 72 - 73 und bearbeitet die Aufgaben 2 und 3 (auf der S. 73)!
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Ein neuer Rektionstyp: Die Redox-Reaktion'''</span>
| |
| |Inhalt=
| |
| Hier das Video: <br>
| |
| {{#ev:youtube|c32AjPnvJk8}}<br>
| |
| <br>
| |
| '''Achtung: Im Video ist am Schluss eine Seite genannt, die sich auf ein anderes Buch bezieht! Ihr braucht Galvani Chemie S2, S. 72-73'''
| |
| <br>
| |
| Aufgaben: Stelle für die folgenden Salzbildungsreaktionen zunächst die Gesamtgleichung auf, dann die Teilgleichungen zur Bildung der Ionen. Bestimme anschließend welche Teilgleichung einer Oxidation und welche einer Reduktion entspricht. Kennzeichne zum Schluss das Reduktions- und das Oxidationsmittel!
| |
| <br>
| |
| * Kalium reagiert mir Fluor zu Kaliumfluorid
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox1_einfA_ML_KF.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Aluminium reagiert mit Sauerstoff zu Aluminiumoxid
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox1_einfA_ML_Al2O3.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Magnesium reagiert mit Stickstoff zu Magnesiumnitrid
| |
| {{Lösung versteckt|
| |
| [[Datei:Redox1_einfA_ML_Mg3N2.jpg]]
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
| === Distanzunterricht Do, 15.04. ===
| |
| Videokonferenz zur Besprechung der letzten Einheit.
| |
|
| |
| === Distanzunterricht Di, 13.04. ===
| |
|
| |
| Hallo 10e! <br>
| |
| <br>
| |
| Willkommen zurück nach den Osterferien! - Gut, "Home-Schooling" ist jetzt wahrscheinlich nicht für alle das Gelbe vom Ei (sollte ein Witz sein, wegen Ostern...) aber was will man machen. <br>
| |
| Zum Einstieg: Das folgende Bild zeigt noch einmal einen Versuchsaufbau, den ihr vor den Ferien ansetzen solltet. <br>
| |
| <br>
| |
| [[Datei:C9NTG_KresseSäure_VA.jpg]] <br>
| |
| <br>
| |
| Ich hoffe, ihr habt euch an die Anweisung gehalten. Macht heute bitte folgendes: <br>
| |
| '''Präsentation der Ergebnisse in Wort und Bild'''
| |
| * Sucht eure besten Fotos aus.
| |
| * Ordnet diese Fotos auf einer DIN-A4-Seite sinnvoll und übersichtlich an (entweder in einem Textdokument oder '''einer''' Folie eines Präsentationsprogrammes)
| |
| * Es soll sich um die '''wissenschaftliche Dokumentation''' eurer Arbeit handeln. Daher achtet auf Seriosität und Sauberkeit. Die folgende Abbildung zeigt ein schlechtes Bsp. (links) und ein gutes Beispiel (rechts) aus einem anderen Zusammenhang.
| |
| {{Lösung versteckt|
| |
| [[Datei:ErgebnisBilderAnordnen.jpg]]<br>
| |
| |Beispiele anzeigen|Lösung ausblenden}}
| |
| * Versucht anschließend das Ergebnis kurz und knapp (aber in ganzen Sätzen) zu beschreiben. Bitte achtet darauf, dass ihr das Ergebnis wirklich nur '''beschreibt''', ihr sollt noch keine Erklärung abgeben oder eine Vermutung anstellen.<br>
| |
| * Euren Text könnt ihr noch mit auf die Seite schreiben, die auch schon die Bilder enthält.
| |
| * Speichert eure Arbeit ab und schickt sie mir als Antwort auf einen Arbeitsauftrag im Schulmanager, den ihr um 08:00 Uhr bekommt.
| |
|
| |
| === Distanzlernen Dezember bis März ===
| |
| s. Archiv: [[10e_2020_21/Bio_Chemie/Archiv| Hier klicken]]
| |
|
| |
| ==Termine== | | ==Termine== |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#B00">'''Termine'''</span> | | |Titel=<span style="color:#B00">'''Termine'''</span> |
| |Inhalt= | | |Inhalt= |
| angekündigter kleiner Leistungsnachweis in Biologie: '''Freitag, 16.10.''' (erledigt)
| | ''- Aktuell keine Termine -'' |
| |Farbe= #B00 | | |Farbe= #B00 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 385: |
Zeile 14: |
| Einheit: '''Atombau''' | | Einheit: '''Atombau''' |
|
| |
|
| *knappe Zusammenfassung und Aufgaben als [[Spezial:FilePath/EK BC 001AtombauAA_VneuWIKI.pdf|pdf-Datei]] | | *knappe Zusammenfassung und Aufgaben als [[Spezial:FilePath/EK_BC_001AtombauAA_V2.pdf|pdf-Datei]] |
| *Lösung als [[Spezial:FilePath/EK BC 001AtombauML_VneuWIKI.pdf|pdf-Datei]] | | *Lösung als [[Spezial:FilePath/EK BC 001AtombauML_VneuWIKI.pdf|pdf-Datei]] |
|
| |
|
| Zeile 424: |
Zeile 53: |
| # ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} | | # ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} |
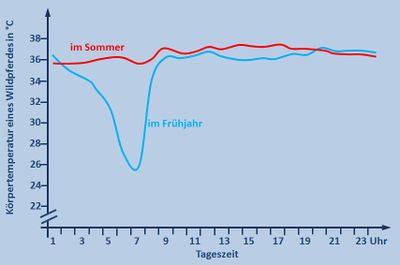
|
| |
|
| ==Ökologie-Skript== | | ==Skripten== |
| | |
| | ===Ökologie-Skript=== |
|
| |
|
| * Teil 1: '''"Grundbegriffe"''' als [[Spezial:FilePath/Skript_Öko_001.pdf|pdf-Datei]], s. Buch S. 62/63 | | * Teil 1: '''"Grundbegriffe"''' als [[Spezial:FilePath/Skript_Öko_001.pdf|pdf-Datei]], s. Buch S. 62/63 |
| Zeile 430: |
Zeile 61: |
| * Teil 3: '''"Vitalitätskurven"''' als als [[Spezial:FilePath/Skript_Öko_002.pdf|pdf-Datei]], s. Buch, S. 70 | | * Teil 3: '''"Vitalitätskurven"''' als als [[Spezial:FilePath/Skript_Öko_002.pdf|pdf-Datei]], s. Buch, S. 70 |
| * Teil 4: '''"Nischenbildung"''' als als [[Spezial:FilePath/Skript_Öko_03.pdf|pdf-Datei]], s. Buch, S. 88/89 | | * Teil 4: '''"Nischenbildung"''' als als [[Spezial:FilePath/Skript_Öko_03.pdf|pdf-Datei]], s. Buch, S. 88/89 |
| <span style="color:#F00;"> Neu, 06.05.20:</span>
| |
| * Teil 5: '''Tiergeographische Regeln''' als [[Spezial:FilePath/Skript_Öko_004.pdf|pdf-Datei]], s. Buch, S. 66/67 | | * Teil 5: '''Tiergeographische Regeln''' als [[Spezial:FilePath/Skript_Öko_004.pdf|pdf-Datei]], s. Buch, S. 66/67 |
| | * Teil 6: '''Umweltfaktor Licht bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_006.pdf|pdf-Datei]], s. Buch, S. 68 |
| | <span style="color:#F00;"> Neu, 29.06.21:</span><br> |
| | :: Teil 7: '''Umweltfaktor Wasser bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_007.pdf|pdf-Datei]], nicht explizit im Buch |
| | |
| | ===Grundlagen Chemie - Skript=== |
| | 1. Atombau ''als ''[[Spezial:FilePath/EK_CSkript_001_Atombau.pdf| pdf-Datei]]<br> |
| | 2. Bau der Elektronenhülle ''als ''[[Spezial:FilePath/EK_CSkript_002_EHülle_V2.pdf| pdf-Datei]]<br> |
| | 3. Ordnung in der Vielfalt: Das PSE ''als ''[[Spezial:FilePath/EK_CSkript_003_e_und_PSE.pdf| pdf-Datei]]<br> |
| | 4. Ionenbildung ''als ''[[Spezial:FilePath/EK_CSkript_004_Ionenbildung.pdf| pdf-Datei]]<br> |
| | 5. Salze: Bau + <br> |
| | 6. Salze: Zusammenhang zwischen Bau und Eigenschaften''als ''[[Spezial:FilePath/EK_CSkript_005_Salze_ZHBauEigenschaft_V2.pdf| pdf-Datei]]<br> |
| | 7. Moleküle: Grundlagen der Atombindung ''als ''[[Spezial:FilePath/EK_CSkript_010_Moleküle.pdf| pdf-Datei]]<br> |
| | 8. Moleküle: Molekülgeometrie ''als ''[[Spezial:FilePath/EK_CSkript_011_Molekülgeometrie.pdf| pdf-Datei]]<br> |
| | 9. Moleküle: Polare Atombindungen ''als ''[[Spezial:FilePath/EK_CSkript_012_polareAtombindungen.pdf| pdf-Datei]]<br> |
| | 10. Moleküle: Dipolmoleküle ''als ''[[Spezial:FilePath/EK_CSkript_013_Dipolmoleküle.pdf| pdf-Datei]]<br> |
| | 11. Zwischenmolekulare Kräfte ''als ''[[Spezial:FilePath/EK_CSkript_014_ZwMokelkKr.pdf| pdf-Datei]]<br> |
| | 12. Heterolyse + Säuren ''als ''[[Spezial:FilePath/EK_CSkript_015_Heterolyse_Säuren.pdf| pdf-Datei]]<br> |
| | 13. Basen + Neutralisationsreaktion ''als ''[[Spezial:FilePath/EK_CSkript_016_Basen_Neutralisation.pdf| pdf-Datei]]<br> |
| | 14. Redoxreaktionen (Einführung) ''als ''[[Spezial:FilePath/EK_CSkript_017_RedoxEinführung.pdf| pdf-Datei]]<br> |
| | 15. Redoxreaktionen: Die Oxidationszahl ''als ''[[Spezial:FilePath/EK_CSkript_018_RedoxOZ.pdf| pdf-Datei]]<br> |
| | |
| | ===Organische Chemie - Skript=== |
| | |
| | * Teil 1: '''Die organische Chemie''' [[Spezial:FilePath/C10EK_001_DieOrganischeChemie.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.) |
| | * Teil 2: '''Die Welt der Kohlenstoffatome''' [[Spezial:FilePath/C10EK_002_WeltDesCAtoms.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 91 Abs. 2 - Ende |
| | <span style="color:#F00;"> Neu, 22.06.21:</span><br> |
| | * Teil 3: '''Die einfachsten organischen Moleküle: Kohlenwasserstoffe''' [[Spezial:FilePath/C10EK_003_EinfacheOrg_KWs.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 96 - 97 |
| | * Teil 4: '''Eigenschaften der Alkane''' [[Spezial:FilePath/C10EK_004_Eigenschaften_Alkane.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 100 - 101 |
| | |
| | ==Distanzlernen Distanzunterricht== |
| | |
| | Alle Online-Unterrichtseinheiten befinden sich jetzt im Archiv: [[10e_2020_21/Bio_Chemie/Archiv| Hier klicken]] |