8a 2021 22/Chemie/Thema 3 SALZE: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 14: | Zeile 14: | ||
===Salze bilden Ionengitter=== | ===Salze bilden Ionengitter=== | ||
''Bildet sich ein Salz neu, so | ''Bildet sich ein Salz neu, so lagern sich Kationen und Anionen zu einer „Einheit“ zusammen. Allerdings IMMER in einem bestimmten Verhältnis, bei einigen sind es z.B. IMMER 1 Kation und 1 Anion, bei anderen IMMER 2 Kationen und 1 Anion usw.'' | ||
<br /> | <br /> | ||
{{Box|Warum ist das so?|Nehme dir | {{Box|Warum ist das so?|Nehme dir das Kuvert 1 vom Pult, schneide die Teilchen GROB aus und setze mit den vorhanden Kationen und Anionen 7 mögliche Salze zusammen. | ||
ACHTUNG: Verwende hierfür kein PSE. | ACHTUNG: Verwende hierfür kein PSE. | ||
Nach welchem Kriterium gehst du vor? | Nach welchem Kriterium gehst du vor? | ||
| Zeile 27: | Zeile 27: | ||
''Da die Anziehungskraft die von einem Ion ausgeht in alle Richtungen wirkt, setzen sich mehrere dieser "gebauten Einheiten" umeinander. Es entsteht ein sog. Ionengitter. Dabei sitzen die Ionen an festen Plätzen an denen sie durch die Anziehungskräfte ihrer entgegengesetzten Ladungen gehalten werden.'' | |||
''Da die Anziehungskraft die von einem Ion ausgeht in alle Richtungen wirkt, setzen sich mehrere dieser "gebauten Einheiten" umeinander. Es entsteht ein sog. Ionengitter. Dabei sitzen die Ionen an festen Plätzen an denen sie durch die Anziehungskräfte ihrer entgegengesetzten Ladungen gehalten werden.'' | |||
Auch im Ionengitter selbst, spiegelt sich dabei das bestimmte Verhältnis von Kationen zu Anionen. Die von dir zusammengesetzte Einheit ist quasi der Grundbaustein des Salzes. Millionen bzw. Milliarden dieser Grundbausteine lagern sich aneinander und bilden schließlich den Salzkristall | Auch im Ionengitter selbst, spiegelt sich dabei das bestimmte Verhältnis von Kationen zu Anionen. Die von dir zusammengesetzte Einheit ist quasi der Grundbaustein des Salzes. Millionen bzw. Milliarden dieser Grundbausteine lagern sich aneinander und bilden schließlich den Salzkristall | ||
| Zeile 35: | Zeile 34: | ||
<br /> | <br /> | ||
[[Datei:Formeleinheit.png|Ionengitter|alternativtext=| | [[Datei:Formeleinheit.png|Ionengitter|alternativtext=|mini|664x664px|zentriert]] | ||
| Zeile 41: | Zeile 40: | ||
'''Es folgt zunächst eine Zusammenfassung mit der Lehrkraft - ANSCHLIEßEND darfst du weiterarbeiten!!!''' | |||
{{Box|Üben|Hole dir vorne am Pult | Bearbeite folgende Übungen: | ||
<iframe src="https://learningapps.org/watch?app=17214412" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | |||
<iframe src="https://learningapps.org/watch?v=p4dvjkain22" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | |||
{{Box|Üben|Hole dir vorne am Pult die Übungen der Kuverte 1+2+3 und bearbeite sie|Unterrichtsidee }} | |||
===Benennung der Ionen=== | |||
'''Die Benennung der Ionen hast du bereits bei den Benennungen der Salze mitgelernt''' | |||
''Die Metallkationen besitzen den deutschen Namen z.B. Natriumion, Kaliumion,'' | |||
''die Nichtmetallantionen dagegegen den lateinischen Nachnamen z.B. Sulfid-Ion, Oxid-Ion usw.'' | |||
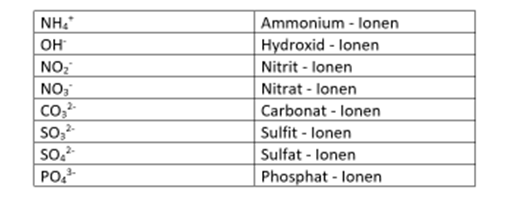
Allerdings gibt es ein paar besondere Ionen, die sog. Molekülionen, die man auswendig lernen muss. Salze wie bspw. Gips, Kalk oder Soda bestehen aus ihnen. | |||
[[Datei:Bild3.png|links|alternativtext=|mini|508x508px]] | |||
{{Box|Abschreiben|Übernehme die Überschrift, das kursiv gedruckte und die Tabelle ins Heft und versuche dir die Ionen schon einmal so gut es geht einzuprägen. | |||
Überprüfe dein Wissen anschließend mit folgender Übung|Üben | |||
}} | |||
<iframe src="https://learningapps.org/watch?v=pzdzci4fk22" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | |||
{{Box|Merke|ACHTUNG: Wir hatten uns gemerkt, dass die Ionenladung der Wertigkeit entspricht. Das gilt auch für die Molekül-Ionen. So besitzt bspw. das Hydroxid-Ion OH- die Wertigkeit 1 und es entsteht aus Mg2+ und OH- das Salz Mg(OH)2. Man arbeitet hier wenn nötig mit Klammern|Merksatz | |||
}}{{Box|Üben|Hole dir vorne am Pult die Übung des Kuverts 4 und bearbeite sie|Unterrichtsidee }} | |||
{{Box|FÜR SCHNELLE|Am Pult liegen die Blankovorlagen für Würfel. Ein Würfel für Kationen, einer für Anionen. Erstelle ein Würfelspiel für deine Mitschüler, bei dem sie das Aufstellen von Salzformeln lernen. Notiere die Lösungen auf ein Lösungsblatt, mit dem sie ihre Ergebnisse verbessern können. Hinweis: Verwende auch schwerere Ionen|Hervorhebung2}} | |||
<br /> | |||
Aktuelle Version vom 28. Juni 2022, 08:21 Uhr
Salze in der Chemie
Salze bestehen aus Ionen
Diese Ionen lassen sich im Kern-Hülle-Modell einfach darstellen. Löse die folgenden Aufgaben, um das Kern-Hülle-Modell zu verstehen.
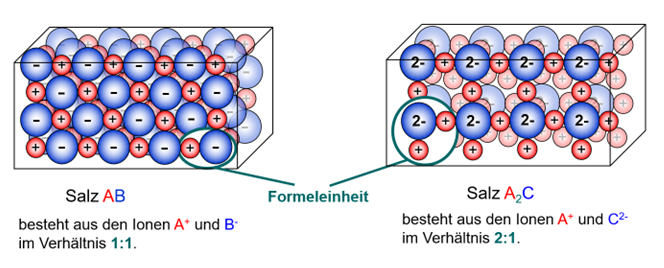
Salze bilden Ionengitter
Bildet sich ein Salz neu, so lagern sich Kationen und Anionen zu einer „Einheit“ zusammen. Allerdings IMMER in einem bestimmten Verhältnis, bei einigen sind es z.B. IMMER 1 Kation und 1 Anion, bei anderen IMMER 2 Kationen und 1 Anion usw.
Da die Anziehungskraft die von einem Ion ausgeht in alle Richtungen wirkt, setzen sich mehrere dieser "gebauten Einheiten" umeinander. Es entsteht ein sog. Ionengitter. Dabei sitzen die Ionen an festen Plätzen an denen sie durch die Anziehungskräfte ihrer entgegengesetzten Ladungen gehalten werden.
Auch im Ionengitter selbst, spiegelt sich dabei das bestimmte Verhältnis von Kationen zu Anionen. Die von dir zusammengesetzte Einheit ist quasi der Grundbaustein des Salzes. Millionen bzw. Milliarden dieser Grundbausteine lagern sich aneinander und bilden schließlich den Salzkristall
Diesen Grundbaustein selbst bezeichnet man auch als Formeleinheit.
Es folgt zunächst eine Zusammenfassung mit der Lehrkraft - ANSCHLIEßEND darfst du weiterarbeiten!!!
Bearbeite folgende Übungen:
Benennung der Ionen
Die Benennung der Ionen hast du bereits bei den Benennungen der Salze mitgelernt
Die Metallkationen besitzen den deutschen Namen z.B. Natriumion, Kaliumion,
die Nichtmetallantionen dagegegen den lateinischen Nachnamen z.B. Sulfid-Ion, Oxid-Ion usw.
Allerdings gibt es ein paar besondere Ionen, die sog. Molekülionen, die man auswendig lernen muss. Salze wie bspw. Gips, Kalk oder Soda bestehen aus ihnen.