8a 2021 22/Chemie/Thema 3 SALZE: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 45: | Zeile 45: | ||
<iframe src="https://learningapps.org/watch?v=pkbt29gu522" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | <iframe src="https://learningapps.org/watch?v=pkbt29gu522" style="border:0px;width:100%;height:500px" allowfullscreen="true" webkitallowfullscreen="true" mozallowfullscreen="true"></iframe> | ||
{{Box|Üben|Hole dir aus | {{Box|Üben|Hole dir vorne am Pult Schritt für Schritt die restlichen Übungen aus den Kuverten und bearbeite sie|Unterrichtsidee }} | ||
Version vom 2. Juni 2022, 09:49 Uhr
Salze in der Chemie
Salze bestehen aus Ionen
Diese Ionen lassen sich im Kern-Hülle-Modell einfach darstellen. Löse die folgenden Aufgaben, um das Kern-Hülle-Modell zu verstehen.
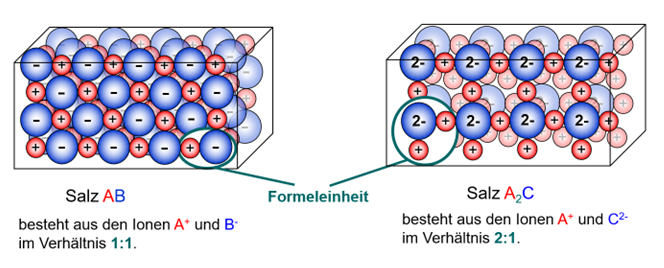
Salze bilden Ionengitter
Bildet sich ein Salz neu, so setzt es sich stets aus einem bestimmten Verhältnis von Kationen und Anionen zusammen.
Da die Anziehungskraft die von einem Ion ausgeht in alle Richtungen wirkt, setzen sich mehrere dieser "gebauten Einheiten" umeinander. Es entsteht ein sog. Ionengitter. Dabei sitzen die Ionen an festen Plätzen an denen sie durch die Anziehungskräfte ihrer entgegengesetzten Ladungen gehalten werden.
Auch im Ionengitter selbst, spiegelt sich dabei das bestimmte Verhältnis von Kationen zu Anionen. Die von dir zusammengesetzte Einheit ist quasi der Grundbaustein des Salzes. Millionen bzw. Milliarden dieser Grundbausteine lagern sich aneinander und bilden schließlich den Salzkristall
Diesen Grundbaustein selbst bezeichnet man auch als Formeleinheit.
Bearbeite anschließend folgende Übungen: