10f 2021 22/Bio Chemie
Termine
Grundlagen in Chemie
Einheit: Atombau
Einheit: Aufbau des PSE
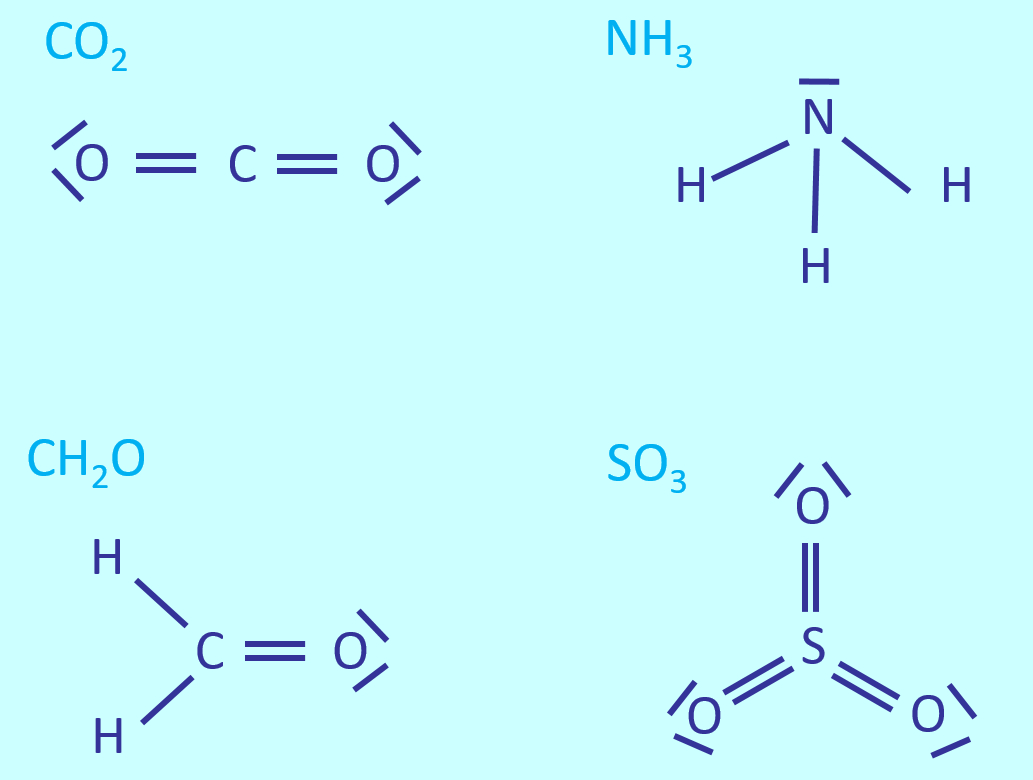
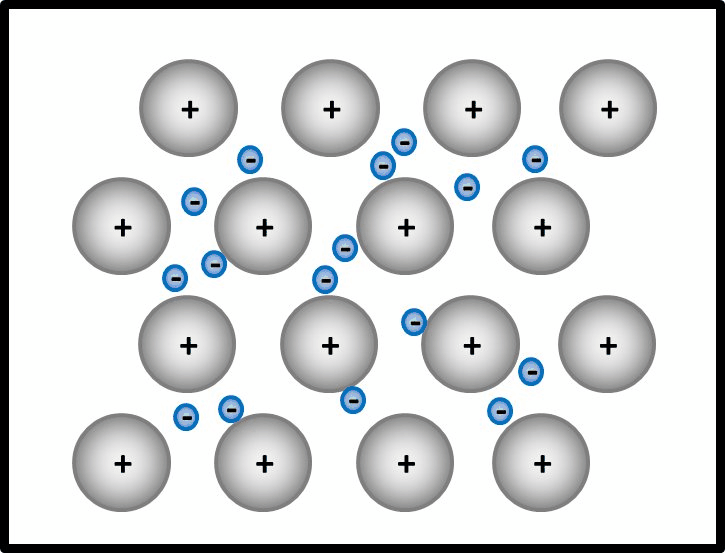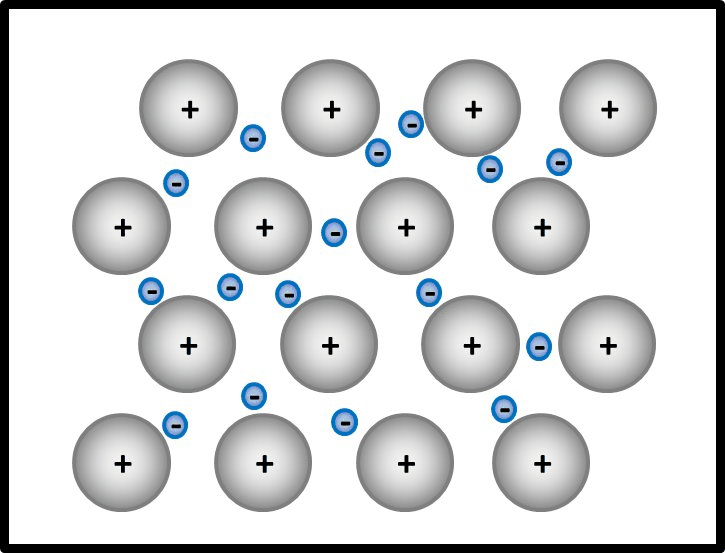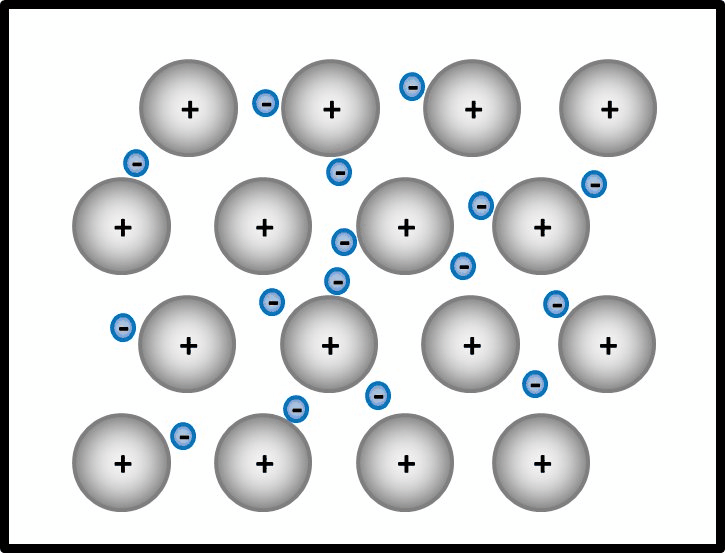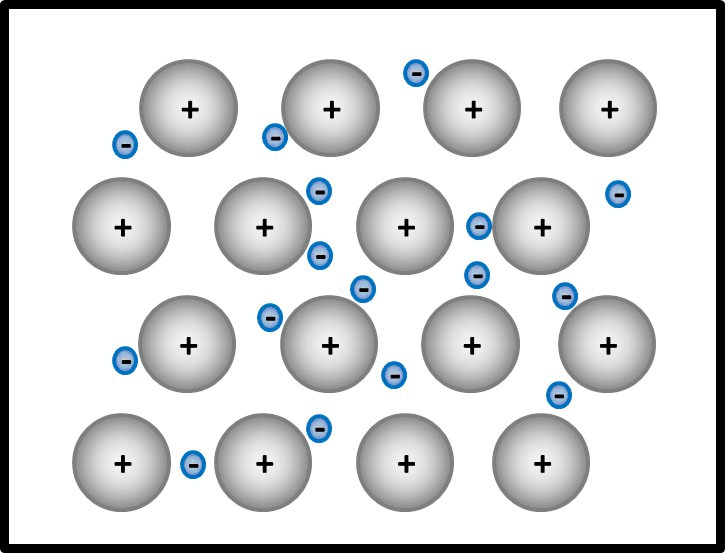
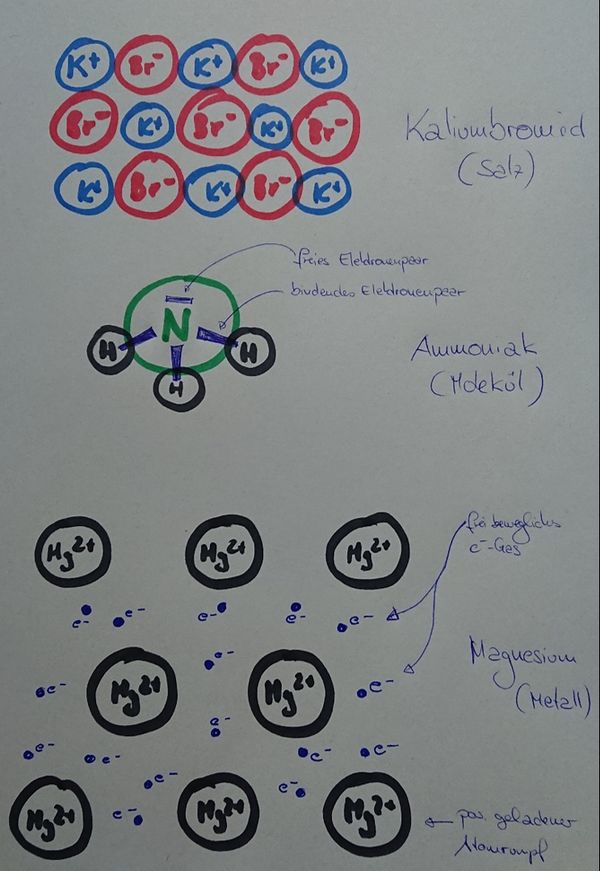
Einheit: Bindungsarten
Skript "OC"
Neu, 20.06.22:
- Teil 1: Die organische Chemie pdf-Datei, s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.)
Neu, 27.06.22:
- Teil 2: Die Welt des Kohlenstoffatoms pdf-Datei, s. Buch (Galvani S2), S. 91 Rest + 94
- Teil 3: Die einfachsten organischen Moleküle: Kohlenwasserstoffe pdf-Datei, s. Buch (Galvani S2), S. 96 - 97
- Teil 4: Eigenschaften der Alkane pdf-Datei, s. Buch (Galvani S2), S. 100 - 1001
Wie man Grafiken interpretiert
Das Interpretieren von Grafiken (auch Tabellen oder Karikaturen) ist eine oft verlangte Fähigkeit von Oberstufen-Schülern. Ich empfehle folgendes Vorgehen:
- Man beginnt mit einer Beschreibung
- Was zeigt die Grafik? (y-Achse und x-Achse in Beziehung setzen, z.B. mit der Formulierung: "Die Grafik zeigt das was auf der y-Achse steht in Abhängigkeit von dem was auf der x-Achse steht.)
- Welche Zusammenhänge sind zu sehen? Man verzichtet zunächst auf Erklärungen/Begründungen, bleibt zunächst noch bei einer reinen Beschreibung (Schöne Formulierungen: "Je ...größer/kleiner/höher/niedriger/usw. desto ..."
- Erst zum Schluss versucht man die Zusammenhänge zu erklären. Je nach behandeltem Stoff im Unterricht kann diese Erklärung recht umfangreiches Wissen verlangen. Gelegentlich sind hier auch Hypothesen über eine mögliche Begründung verlangt, die noch nicht besprochen wurden.
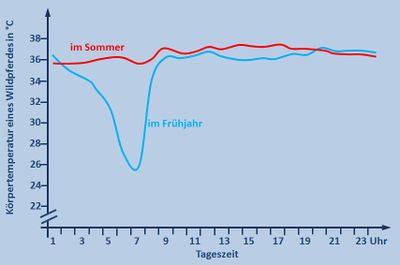
Abb. selbst erstellt, Originalgrafik: Kuntz, Regina; Der versteckte Winterschlaf der Wildpferde; Spektrum der Wissenschaft; August 2008; S. 46 - 53, 2008
Versucht zunächst selbst diese Grafiken zu interpretieren. - Lasst euch dann die Lösung anzeigen.
- Die Grafik zeigt die Körpertemperatur eines Wildpferdes in Abhängigkeit von der Uhrzeit einmal im Sommer und einmal im Winter.
- Im Sommer bleibt die Körpertemperatur den ganzen Tag konstant bei 36°C. Im Frühjahr sinkt die Körpertemperatur nachts und in den frühen Morgenstunden um 10°C auf 26°C ab. Ab 08:00 Uhr steigt sie wieder auf 36°C und bleibt dann konstant.
- Im Unterricht könnte man dazu folgendes besprochen haben: Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.
Skripten
Skript: Verdauung
1. Verdauungsorgane: Überblick kein Hefteintrag
2. Verdauungsprozesse im Mund als pdf-Datei
3. Verdauungsprozesse im Magen als pdf-Datei (Buch, S. 26, Abs. 1-5)
- Einschub: Enzympraktikum als pdf-Datei
4. Verdauungsprozesse im Dünndarm als pdf-Datei (Buch, S. 26 ab "Der Dünndarm" - S. 27)
5. Verdauungsprozesse im Dickdarm kein Hefteintrag (Buch, S. 28)
Skript "Ökologie"
- Teil 1: "Grundbegriffe" als pdf-Datei, Buch S. 62/63
- Teil 2: "Einflussfaktoren auf Lebewesen" Buch, S. 64/65 +
- Teil 3: "Vitalitätskurven" als als pdf-Datei, s. Buch, S. 70
- Teil 4: "Nischenbildung" als als pdf-Datei, s. Buch, S. 88/89
- Teil 5: Tiergeographische Regeln als pdf-Datei, s. Buch, S. 66/67
- Teil 6: Umweltfaktor Licht bei Pflanzen pdf-Datei, s. Buch, S. 68
- Teil 7: Umweltfaktor Wasser bei Pflanzen pdf-Datei, nicht explizit im Buch
Neu, 23.06.22:
- Teil 8: Beziehungen zwischen Lebewesen pdf-Datei, s. Buch, S. 100
Referate