9a 2020 21/Chemie: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
(Q-Einheit 2 eingestellt) Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 1: | Zeile 1: | ||
==Chemie 9a(SG)== | ==Chemie 9a(SG)== | ||
==Quarantäne-Einheit 2== | |||
''Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.'' | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#008">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
In der letzten Online-Einheit habt ihr Belege für das Teilchen-Modell kennengelernt und gesehen, wie man damit bestimmte Beobachtungen erklären kann. Als Hausaufgabe habt ihr zwei Seiten im Buch gelesen, auf denen noch einmal der Unterschied zwischen Stoff-Ebene (Beobachtungs-Ebene) und Teilchen-Ebene (Vorstellungs-Ebene) erklärt wurde. Diese Unterscheidung solltet ihr schon aus der Unterstufe kennen.<br> | |||
Zunächst zur Hausaufgabe: Ihr solltet die in Abb. 4 auf S. 44 im Buch dargestellten Vorgänge „beschreiben“! Wenn ihr euch nicht mehr erinnert, schaut noch einmal nach. Klickt erst auf „Lösung“, wenn ihr eure Beschreibung vollständig laut ausgesprochen habt. | |||
{{Lösung versteckt| | |||
Auf der Stoff-Ebene könnt ihr festhalten: Sobald die Brausetablette ins Wasser fällt, entsteht ein Gas, welches in Form von kleinen Bläschen aufsteigt.<br> | |||
Mehr sieht man auf diesen Bildern nicht…<br> | |||
<br> | |||
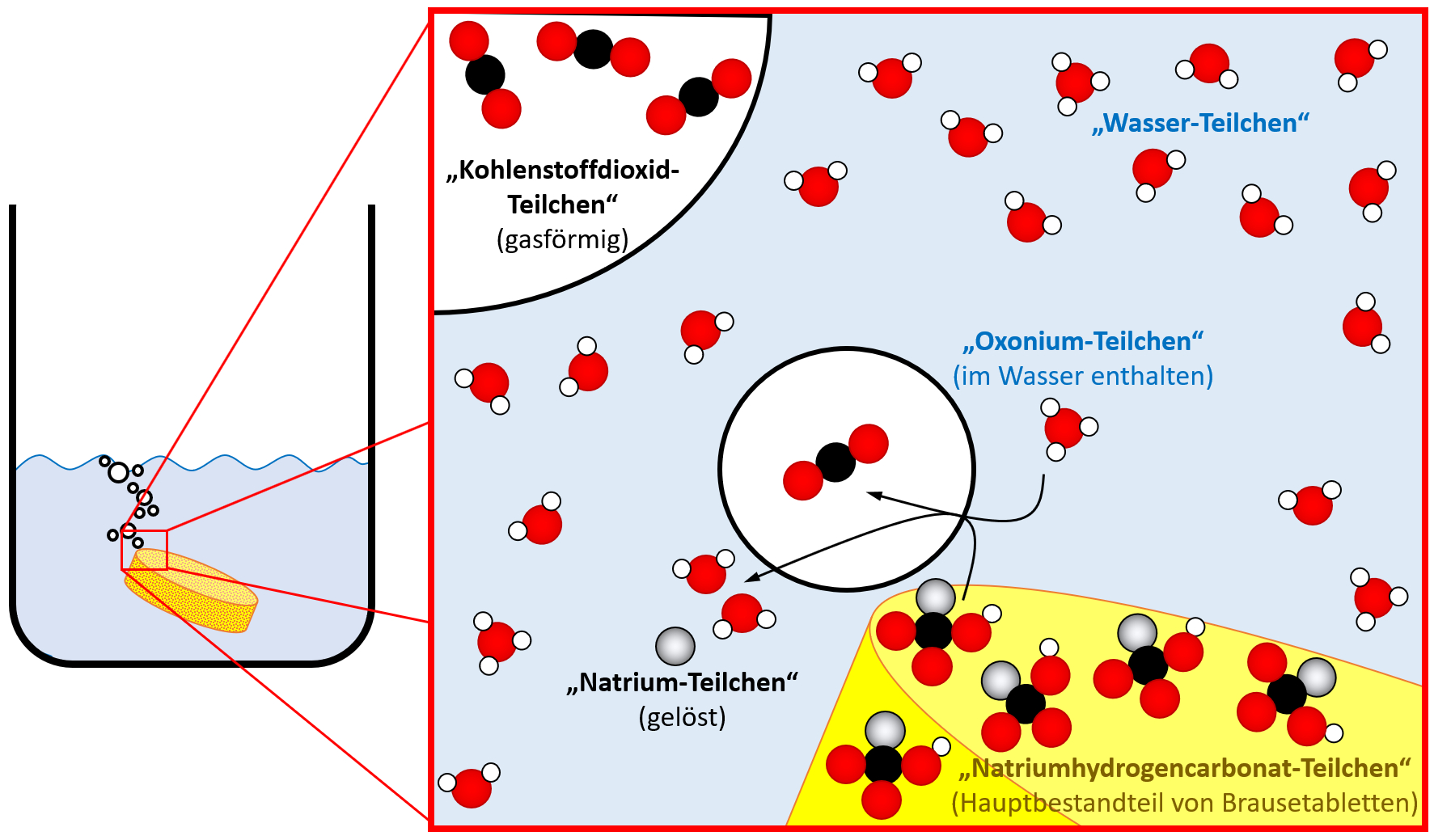
Auf Teilchen-Ebene laufen mehrere Prozesse ab, aber die kann man alle nicht sehen und wissen könnt ihr sie eigentlich auch nicht, zumindest nicht aus dem bisherigen Chemie-Unterricht. Ich stelle euch die Situation daher mal auf Teilchen-Ebene schematisch dar und ihr versucht sie erneut zu beschreiben!<br> | |||
[[Datei:C9_SG_S45A1_ML.jpg]]<br> | |||
{{Lösung versteckt| | |||
Jetzt könnte man auch auf Teilchen-Ebene etwas beschreiben: Bestimmte Teilchen aus dem Wasser (Oxonium-Teilchen) reagieren mit den Natriumhydrogencarbonat-Teilchen aus der Brausetablette. Dabei entsteht das Gas Kohlenstoffdioxid und Natrium-Teilchen werden im Wasser gelöst.<br> | |||
Wenn ihr auf die Anzahl der Kugeln vor der Reaktion und nach der Reaktion achtet, stellt ihr fest, dass die Anzahl der Kugeln gleich geblieben ist. Das muss so sein. Aus diesem Umstand lässt sich das "Gesetz der konstanten Proportionen" ableiten, um das es in der heutigen Einheit geht. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #008 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Das Gesetz der konstanten Proportionen'''</span> | |||
|Inhalt= | |||
Die oben dargestellte chemische Reaktion ist schon ziemlich kompliziert. Ihr erkennt in der Abbildung hoffentlich, dass fast alle dort gezeichneten „Teilchen“ sich aus verschiedenen „Kugeln“ zusammensetzen. In der letzten Stunde vor dem Test haben wir darüber bereits gesprochen: Mit einem Hofmannschen Dreischenkelapparat können „Wasser-Teilchen“ zerlegt werden. Es entsteht Sauerstoff und Wasserstoff.<br> | |||
In der oberen Abbildung ist diese Tatsache symbolisch mit unterschiedlichen Kugeln verwirklicht: Sauerstoff wird durch rote Kugeln symbolisiert, Wasserstoff durch weiße. Ein „Wasser-Teilchen“ ist aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen zusammengesetzt.<br> | |||
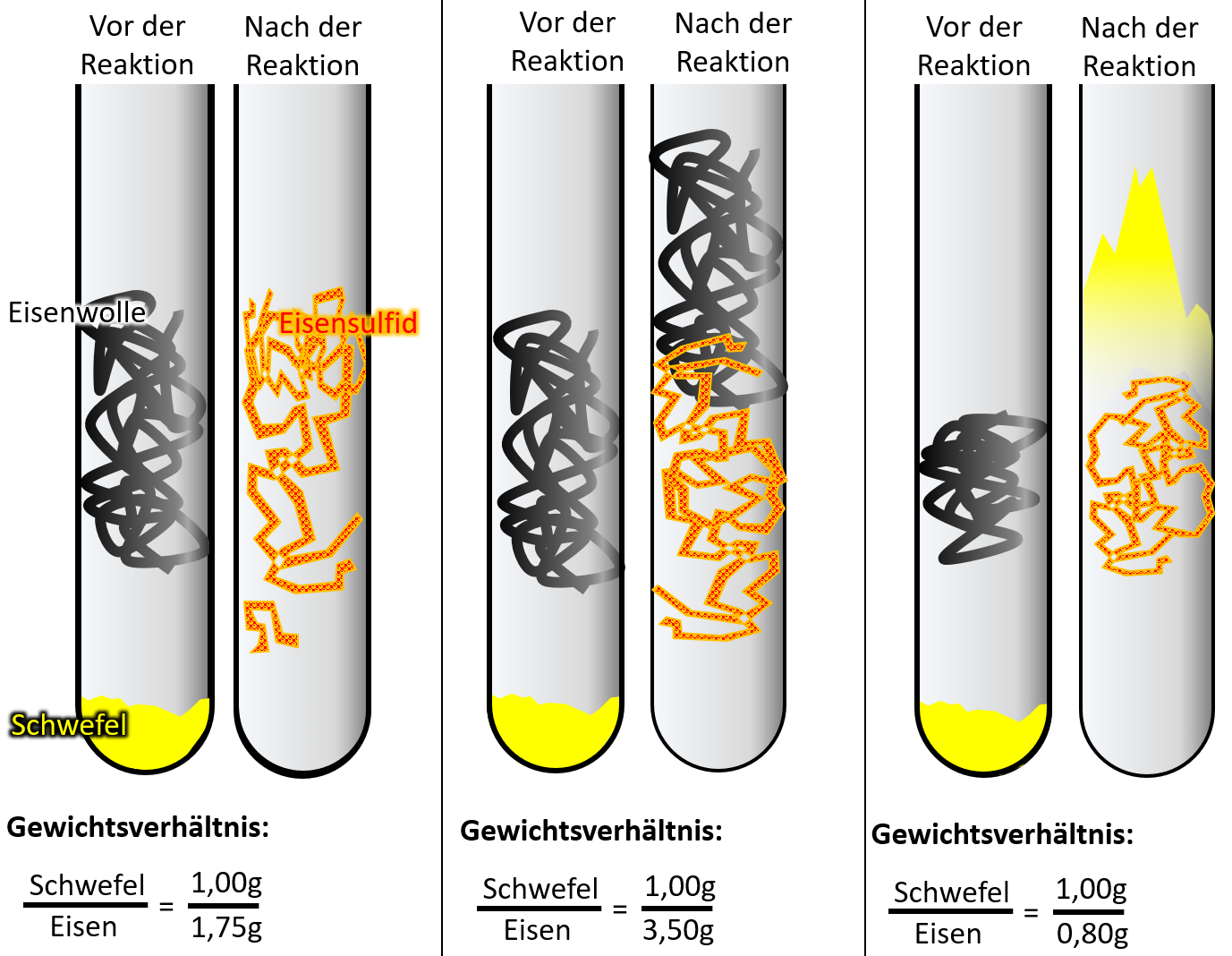
In der letzten Online-Einheit habt ihr auch schon den Stoff Eisensulfid kennengelernt. Er entsteht, wenn man Eisen mit Schwefel reagieren lässt.<br> | |||
Ein Lehrer hat dazu ein Video ins Netz gestellt, wer es anschauen möchte, bitteschön: | |||
<br> | |||
{{#ev:youtube|wJs9W-MkGZo}}<br> | |||
<br> | |||
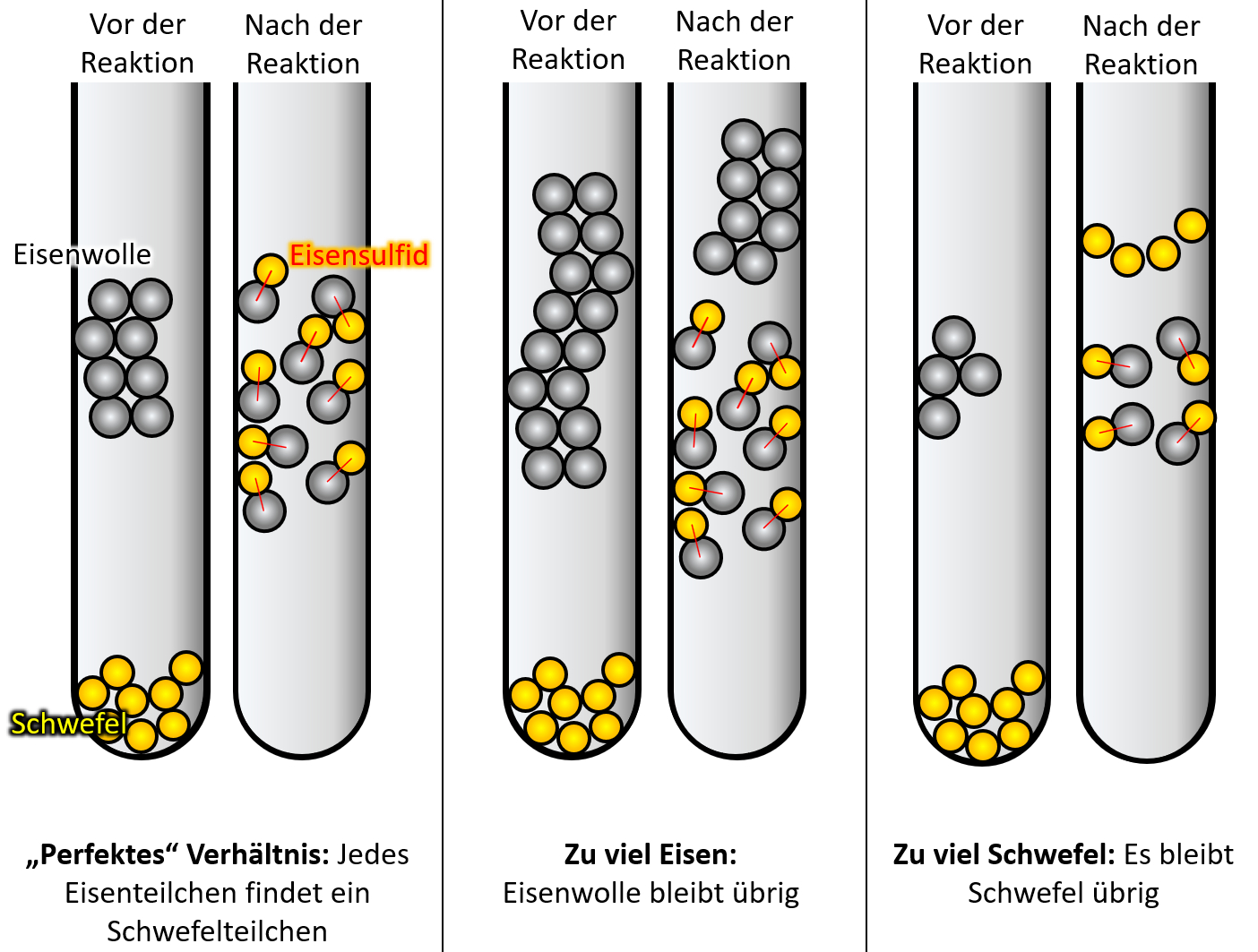
In der schematischen Darstellung ganz am Ende der letzten Online-Einheit habt ihr schon gesehen, dass im Eisensulfid pro Eisen-Atom genau ein Schwefel-Atom vorhanden ist. Wie ihr heute gelernt habt, muss dieses „Teilchen-Verhältnis“ nicht immer so sein: In einem Wasser-Teilchen waren es ja genau zwei Wasserstoff-Atome, die mit einem Sauerstoff-Atom verbunden waren. Dazu in einer späteren Einheit mehr.<br> | |||
Bleiben wir beim Eisensulfid. In eurem Buch auf der Seite 37 seht ihr oben rechts eine Grafik!<br> | |||
Lest zunächst den Text auf S. 36 unten („Stoffe verbinden sich…) bis S. 37 zum ersten blauen Merksatz. Beantwortet dann die folgenden Fragen (schriftlich auf ein Blatt, bitte erst auf „Lösung“ klicken, wenn ihr tatsächlich eine Lösung gefunden habt): | |||
* Wenn man 50g Eisen vollständig mit Schwefel zu Eisensulfid reagieren lassen möchte, braucht man eine bestimmte Menge Schwefel. Wenn man doppelt so Eisen verwendet, braucht man auch genau die doppelte Menge Schwefel. Warum ist das so? | |||
{{Lösung versteckt| | |||
Weil Materie aus kleinsten Teilchen aufgebaut ist. Das Verhältnis der verschiedenen Teilchen in einer bestimmten Verbindung ist immer gleich. Wenn die Anzahl der Teilchen des einen Stoffes erhöht wird, muss die Anzahl der Teilchen des anderen Stoffes um den selben Faktor erhöht werden, wenn die Reaktion vollständig ablaufen soll. | |||
|Lösung|Lösung ausblenden}}<br> | |||
* Welche Masse an Eisen muss man verwenden, um mit exakt 100g Schwefel vollständig zu Eisensulfid zu reagieren? | |||
{{Lösung versteckt| | |||
Laut Text gilt "Die Masse von Eisen verhält sich zur Masse von Schwefel wie 1,75 zu 1,00". Das bedeutet man braucht 175g Eisen, um mit 100g Schwefel eine vollständige Reaktion zu Eisensulfid zu erhalten. | |||
|Lösung|Lösung ausblenden}}<br> | |||
* Die Grafik verdeutlicht das "Gesetz der konstanten Proportionen. Wie würdest Du dieses Gesetz mit eigenen Worten beschreiben? | |||
{{Lösung versteckt| | |||
Im Prinzip müsstet ihr hier mit dem blauen Merksatz aus dem Buch antworten (oder so ähnlich): Zwei Elemente vereinigen sich zu einer bestimmten Verbindung immer im gleichen Massenverhältnis. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#008">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
'''Echte Hausaufgabe'''<br> | |||
Wenn ihr in eurem Heft nachschaut, findet ihr dort vielleicht einen Hinweis darauf, dass bei der Spaltung von Wasser im Hofmannschen Dreischenkelapparat doppelt so viel Wasserstoff wie Sauerstoff entstanden ist. Stellt eine Vermutung an, warum das so ist!<br> | |||
'''Vorbereitungen für Freitag'''<br> | |||
Am Freitag würde ich gerne mit euch eine BigBlueButton-Konferenz durchführen. Ihr solltet inzwischen ja schon Erfahrung damit haben. Falls nicht, schicke ich euch zusammen mit dem Link noch einmal eine Anleitung. Link + Anmeldung + Zugangscode erhaltet ihr als Nachricht über den Schulmanager. <br> | |||
Bitte bereitet bis Freitag, 3. Std. folgendes vor: Wenn in den letzten beiden Unterrichtseinheiten noch Fragen offen geblieben sind oder ihr bei den Aufgaben Schwierigkeiten hatten, dann überlegt, wie ihr diese Fragen in der BBB-Konferenz stellen könnt: | |||
* Wenn ihr mit Mikrofon teilnehmen könnt/wollt, dann könnt ihr die Frage einfach verbal stellen. | |||
* Wenn ihr ohne Mikrofon teilnehmen wollt, könnt ihr die Frage auch in den Chat schreiben. Dann überlegt euch bitte schon eine Formulierung! | |||
|Farbe= #008 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
===Quarantäne-Einheit 1=== | ===Quarantäne-Einheit 1=== | ||
''Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.'' | ''Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.'' | ||
Version vom 26. Oktober 2020, 14:27 Uhr
Chemie 9a(SG)
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Quarantäne-Einheit 1
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Versuchsprotokolle