10f 2021 22/Bio Chemie: Unterschied zwischen den Versionen
Markierung: 2017-Quelltext-Bearbeitung |
Markierung: 2017-Quelltext-Bearbeitung |
||
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 3: | Zeile 3: | ||
|Titel=<span style="color:#B00">'''Termine'''</span> | |Titel=<span style="color:#B00">'''Termine'''</span> | ||
|Inhalt= | |Inhalt= | ||
21. | '''Montag, 21.03.:''' | ||
* | * angekündigter, kleiner Leistungsnachweis aus der Biologie | ||
* Lernstoff: Ökologie, s. unten | |||
|Farbe= #B00 | |Farbe= #B00 | ||
| Zeile 27: | Zeile 26: | ||
*knappe Zusammenfassung und Aufgaben als [[Spezial:FilePath/EK BC 002 AufbauPSEAA_VneuWIKI.pdf|pdf-Datei]] | *knappe Zusammenfassung und Aufgaben als [[Spezial:FilePath/EK BC 002 AufbauPSEAA_VneuWIKI.pdf|pdf-Datei]] | ||
*Lösung als [[Spezial:FilePath/EK BC 002 AufbauPSEML_VneuWIKI.pdf|pdf-Datei]] | *Lösung als [[Spezial:FilePath/EK BC 002 AufbauPSEML_VneuWIKI.pdf|pdf-Datei]] | ||
<br><br> | |||
Einheit: '''Bindungsarten''' | |||
*knappe Zusammenfassung und Aufgaben als [[Spezial:FilePath/EK_BC_003_Bindungsarten_V3.pdf|pdf-Datei]] | |||
*Lösung als [[Spezial:FilePath/EK_BC_003_Bindungsarten_ML_V3.pdf|pdf-Datei]] | |||
<br><br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholungsaufgaben zu den verschiedenen Bindungstypen'''</span> | |||
|Inhalt= | |||
'''Aufgaben:'''<br> | |||
* '''Salze 1''' | |||
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen | |||
{{Lösung versteckt| | |||
* Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff. | |||
* Leite daraus ab, welche Ionen diese Stoffe bilden werden | |||
{{Lösung versteckt| | |||
Na --> Na<sup>+</sup> + e<sup>-</sup> <br> | |||
O + 2e<sup>-</sup> --> O<sup>2-</sup> <br> | |||
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt) | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 1|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden? | |||
* Wie formuliert man das als chemische Formel? | |||
{{Lösung versteckt| | |||
2 Na<sup>+</sup> und 1 O<sup>2-</sup> Teilchen ergeben insgesamt die chemische Formel Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört! | |||
* Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte! | |||
{{Lösung versteckt| | |||
4 Na + O<sub>2</sub> --> 2Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 3|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Salze 2''' | |||
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere! | |||
{{Lösung versteckt| | |||
Eine gute Begründung enthält folgende Aspekte: | |||
* Man erklärt zunächst, was "Sieden überhaupt bedeutet"! | |||
{{Lösung versteckt| | |||
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden. | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt! | |||
{{Lösung versteckt| | |||
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
* Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen! | |||
{{Lösung versteckt| | |||
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.<br> | |||
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst. | |||
|Teillösung 3|Lösung ausblenden}}<br> | |||
|Lösungsschema|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Moleküle''' | |||
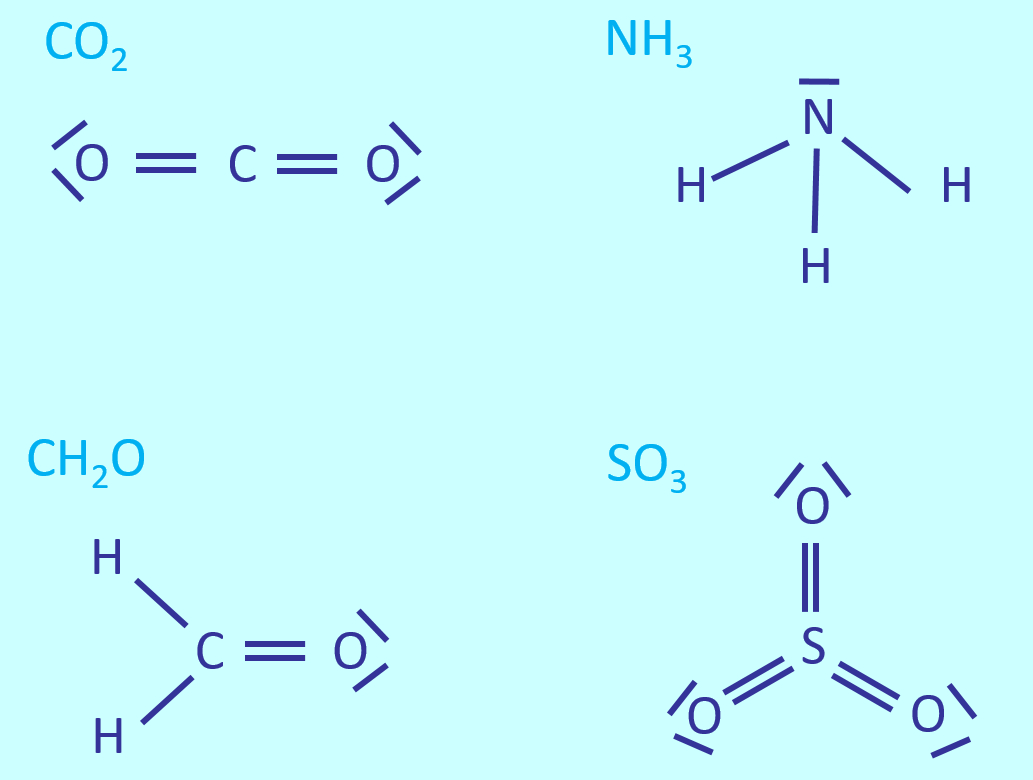
Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
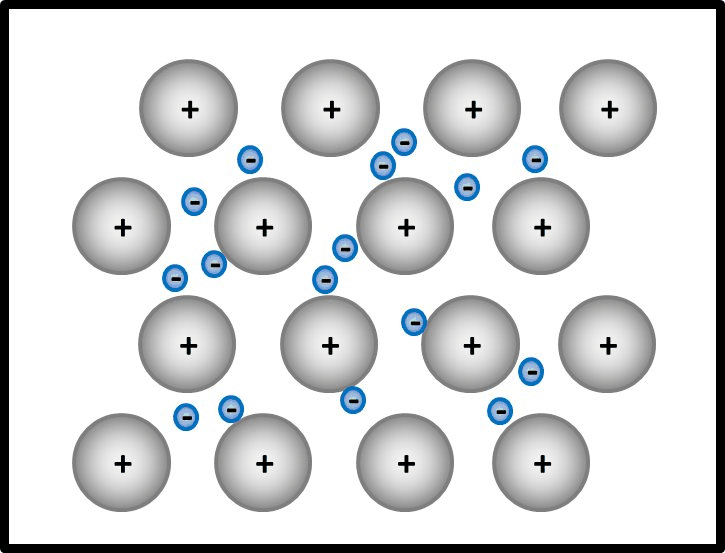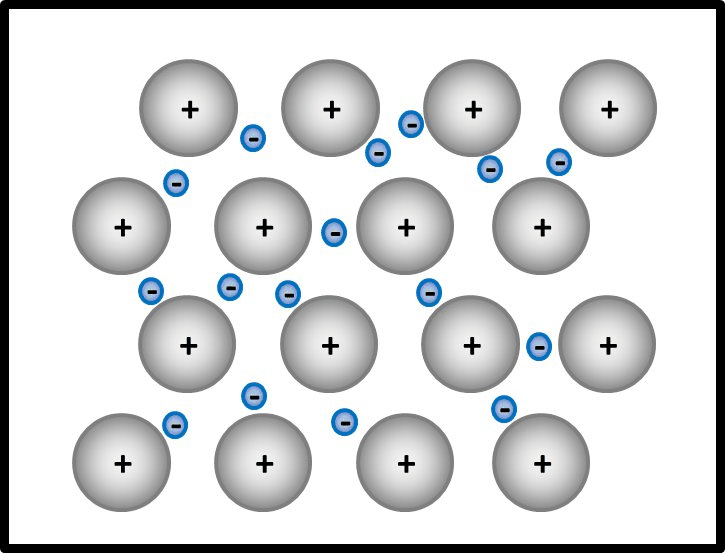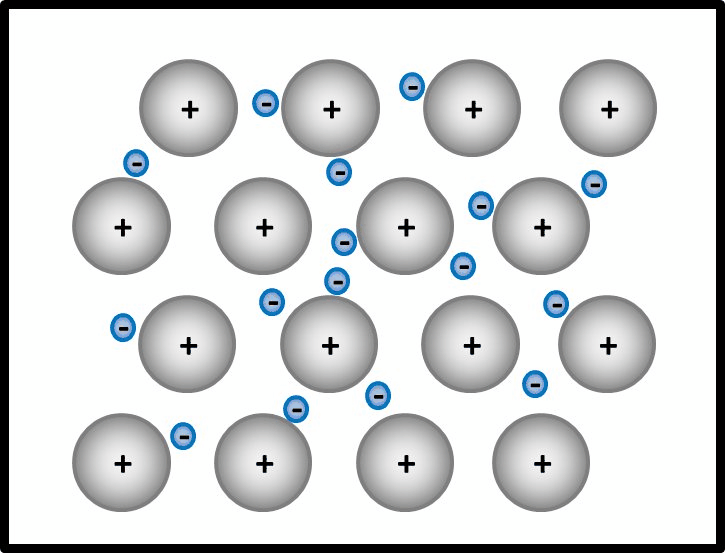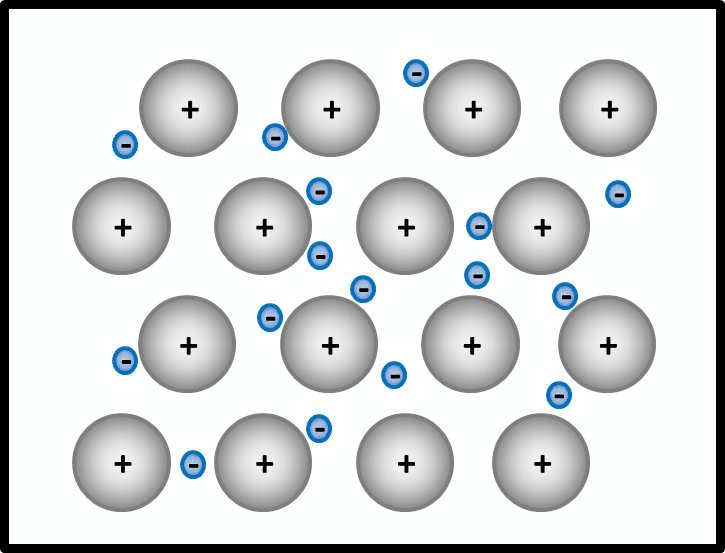
* '''Metalle ''' | |||
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind! | |||
{{Lösung versteckt| | |||
* Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben. | |||
{{Lösung versteckt| | |||
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:<br> | |||
[[Datei:Metallgitter_animiert_1.gif]] | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her! | |||
{{Lösung versteckt| | |||
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}} | |||
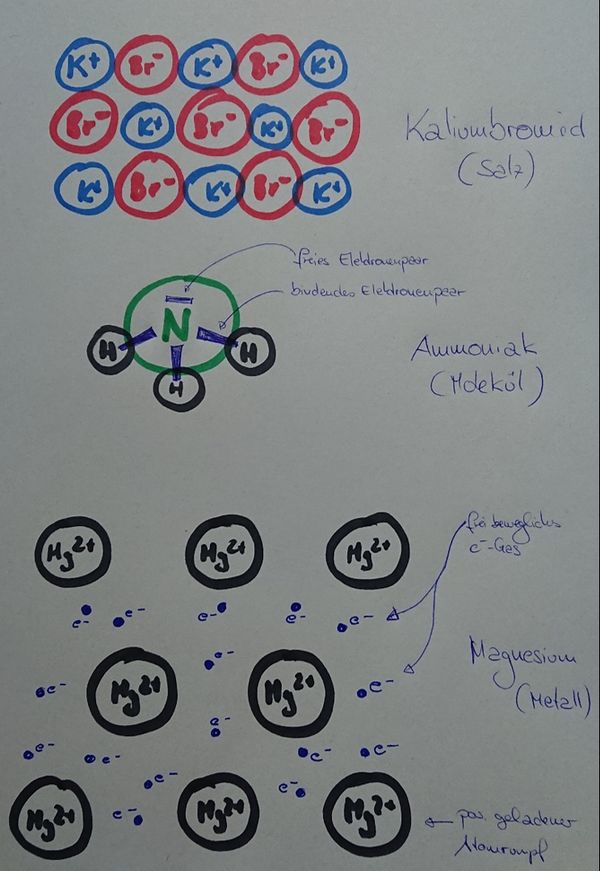
* '''Vergleich der drei Bindungsarten''' | |||
Zeichnet stark vergrößerte, schematische Ausschnitte von den folgenden Stoffen, die erkennen lassen, wie die beteiligten Teilchen zusammenhängen. Alle drei Zeichnungen sollten zusammen auf ein DIN-A4-Blatt passen. Jede Zeichnung müsste also ca. 9cm hoch und ca. 20cm breit sein: | |||
* Kaliumbromid (KBr) | |||
* Ammoniak (NH<sub>3</sub>) | |||
* Magnesium (Mg) | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ZZ_Übersicht_Bindungsarten.jpg|600px]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
=== Skript '''"OC"''' === | |||
<span style="color:#F00;"> Neu, 20.06.22:</span><br> | |||
* Teil 1: '''Die organische Chemie''' [[Spezial:FilePath/C10EK_001_DieOrganischeChemie.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.) | |||
<span style="color:#F00;"> Neu, 27.06.22:</span><br> | |||
* Teil 2: '''Die Welt des Kohlenstoffatoms''' [[Spezial:FilePath/C10EK_002_WeltDesCAtoms.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 91 Rest + 94 | |||
* Teil 3: '''Die einfachsten organischen Moleküle: Kohlenwasserstoffe''' [[Spezial:FilePath/C10EK_003_EinfacheOrg_KWs.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 96 - 97 | |||
* Teil 4: '''Eigenschaften der Alkane''' [[Spezial:FilePath/C10EK_004_Eigenschaften_Alkane.pdf|pdf-Datei]], s. Buch (Galvani S2), S. 100 - 1001 | |||
==Wie man Grafiken interpretiert== | ==Wie man Grafiken interpretiert== | ||
| Zeile 54: | Zeile 160: | ||
3. Verdauungsprozesse im Magen ''als'' [[Spezial:FilePath/Skript Verdauung_1_3.pdf|pdf-Datei]] (Buch, S. 26, Abs. 1-5)<br> | 3. Verdauungsprozesse im Magen ''als'' [[Spezial:FilePath/Skript Verdauung_1_3.pdf|pdf-Datei]] (Buch, S. 26, Abs. 1-5)<br> | ||
* Einschub: Enzympraktikum ''als'' [[Spezial:FilePath/105_GA_EiPrakt_Versuchsprot_V2.pdf|pdf-Datei]] | * Einschub: Enzympraktikum ''als'' [[Spezial:FilePath/105_GA_EiPrakt_Versuchsprot_V2.pdf|pdf-Datei]] | ||
4. Verdauungsprozesse im Dünndarm ''als'' [[Spezial:FilePath/Skript_Verdauung_4.pdf|pdf-Datei]] (Buch, S. 26 ab "Der Dünndarm" - S. 27)<br> | 4. Verdauungsprozesse im Dünndarm ''als'' [[Spezial:FilePath/Skript_Verdauung_4.pdf|pdf-Datei]] (Buch, S. 26 ab "Der Dünndarm" - S. 27)<br> | ||
5. Verdauungsprozesse im Dickdarm ''kein Hefteintrag'' (Buch, S. 28)<br> | 5. Verdauungsprozesse im Dickdarm ''kein Hefteintrag'' (Buch, S. 28)<br> | ||
<br><br> | |||
=== Skript '''"Ökologie"''' === | |||
:: Teil 1: '''"Grundbegriffe"''' als [[Spezial:FilePath/Skript_Öko_001.pdf|pdf-Datei]], Buch S. 62/63 | |||
::Teil 2: '''"Einflussfaktoren auf Lebewesen"''' Buch, S. 64/65 + | |||
::Teil 3: '''"Vitalitätskurven"''' als als [[Spezial:FilePath/Skript_Öko_002.pdf|pdf-Datei]], s. Buch, S. 70 | |||
::Teil 4: '''"Nischenbildung"''' als als [[Spezial:FilePath/Skript_Öko_03.pdf|pdf-Datei]], s. Buch, S. 88/89 | |||
:: Teil 5: '''Tiergeographische Regeln''' als [[Spezial:FilePath/Skript_Öko_004.pdf|pdf-Datei]], s. Buch, S. 66/67 | |||
:: Teil 6: '''Umweltfaktor Licht bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_006.pdf|pdf-Datei]], s. Buch, S. 68 | |||
:: Teil 7: '''Umweltfaktor Wasser bei Pflanzen''' [[Spezial:FilePath/Skript_Öko_007.pdf|pdf-Datei]], nicht explizit im Buch | |||
<span style="color:#F00;"> Neu, 23.06.22:</span><br> | |||
:: Teil 8: '''Beziehungen zwischen Lebewesen''' [[Spezial:FilePath/Skript_Öko_008.pdf|pdf-Datei]], s. Buch, S. 100 | |||
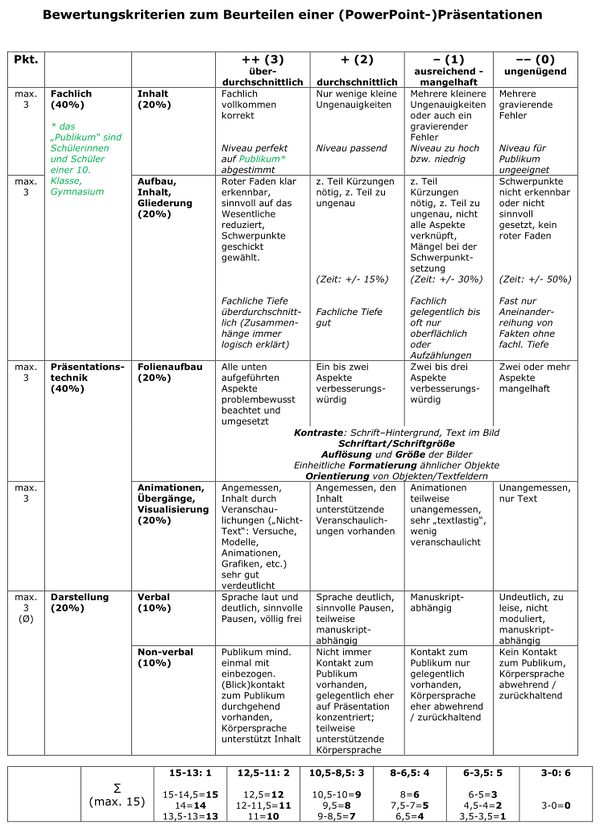
== Referate == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Referatsrunde'''</span> | |||
|Inhalt= | |||
<span style="color:#0A0">'''erfolgreich beendet'''</span><br> | |||
Bewertungskriterien: <br> | |||
[[Datei:2022_Bewkrit_Ref.jpg|600px]] | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
Aktuelle Version vom 25. Juni 2022, 14:24 Uhr
Termine
Grundlagen in Chemie
Einheit: Atombau
Einheit: Aufbau des PSE
Einheit: Bindungsarten
Skript "OC"
Neu, 20.06.22:
- Teil 1: Die organische Chemie pdf-Datei, s. Buch (Galvani S2), S. 90 - 91 (nur 1. Abs.)
Neu, 27.06.22:
- Teil 2: Die Welt des Kohlenstoffatoms pdf-Datei, s. Buch (Galvani S2), S. 91 Rest + 94
- Teil 3: Die einfachsten organischen Moleküle: Kohlenwasserstoffe pdf-Datei, s. Buch (Galvani S2), S. 96 - 97
- Teil 4: Eigenschaften der Alkane pdf-Datei, s. Buch (Galvani S2), S. 100 - 1001
Wie man Grafiken interpretiert
Das Interpretieren von Grafiken (auch Tabellen oder Karikaturen) ist eine oft verlangte Fähigkeit von Oberstufen-Schülern. Ich empfehle folgendes Vorgehen:
- Man beginnt mit einer Beschreibung
- Was zeigt die Grafik? (y-Achse und x-Achse in Beziehung setzen, z.B. mit der Formulierung: "Die Grafik zeigt das was auf der y-Achse steht in Abhängigkeit von dem was auf der x-Achse steht.)
- Welche Zusammenhänge sind zu sehen? Man verzichtet zunächst auf Erklärungen/Begründungen, bleibt zunächst noch bei einer reinen Beschreibung (Schöne Formulierungen: "Je ...größer/kleiner/höher/niedriger/usw. desto ..."
- Erst zum Schluss versucht man die Zusammenhänge zu erklären. Je nach behandeltem Stoff im Unterricht kann diese Erklärung recht umfangreiches Wissen verlangen. Gelegentlich sind hier auch Hypothesen über eine mögliche Begründung verlangt, die noch nicht besprochen wurden.
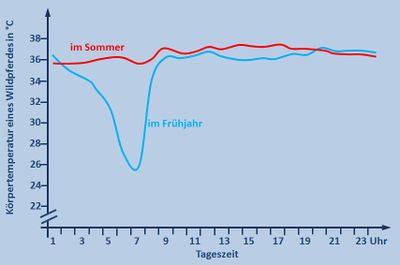
Abb. selbst erstellt, Originalgrafik: Kuntz, Regina; Der versteckte Winterschlaf der Wildpferde; Spektrum der Wissenschaft; August 2008; S. 46 - 53, 2008
Versucht zunächst selbst diese Grafiken zu interpretieren. - Lasst euch dann die Lösung anzeigen.
- Die Grafik zeigt die Körpertemperatur eines Wildpferdes in Abhängigkeit von der Uhrzeit einmal im Sommer und einmal im Winter.
- Im Sommer bleibt die Körpertemperatur den ganzen Tag konstant bei 36°C. Im Frühjahr sinkt die Körpertemperatur nachts und in den frühen Morgenstunden um 10°C auf 26°C ab. Ab 08:00 Uhr steigt sie wieder auf 36°C und bleibt dann konstant.
- Im Unterricht könnte man dazu folgendes besprochen haben: Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.
Skripten
Skript: Verdauung
1. Verdauungsorgane: Überblick kein Hefteintrag
2. Verdauungsprozesse im Mund als pdf-Datei
3. Verdauungsprozesse im Magen als pdf-Datei (Buch, S. 26, Abs. 1-5)
- Einschub: Enzympraktikum als pdf-Datei
4. Verdauungsprozesse im Dünndarm als pdf-Datei (Buch, S. 26 ab "Der Dünndarm" - S. 27)
5. Verdauungsprozesse im Dickdarm kein Hefteintrag (Buch, S. 28)
Skript "Ökologie"
- Teil 1: "Grundbegriffe" als pdf-Datei, Buch S. 62/63
- Teil 2: "Einflussfaktoren auf Lebewesen" Buch, S. 64/65 +
- Teil 3: "Vitalitätskurven" als als pdf-Datei, s. Buch, S. 70
- Teil 4: "Nischenbildung" als als pdf-Datei, s. Buch, S. 88/89
- Teil 5: Tiergeographische Regeln als pdf-Datei, s. Buch, S. 66/67
- Teil 6: Umweltfaktor Licht bei Pflanzen pdf-Datei, s. Buch, S. 68
- Teil 7: Umweltfaktor Wasser bei Pflanzen pdf-Datei, nicht explizit im Buch
Neu, 23.06.22:
- Teil 8: Beziehungen zwischen Lebewesen pdf-Datei, s. Buch, S. 100
Referate