8d 2022 23
Chemie
aktuelle Aufgaben zum Üben
Stelle jeweils die Gleichungen für die folgenden chemischen Reaktionen auf:
Reaktion 1: Bei der positiven Knallgasprobe reagiert das aufgefangene Gas Wasserstoff mit dem Sauerstoff aus der Luft im Zuge einer kleinen Explosion zu gasförmigem Wasser.
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr selbst eine chemische Gleichung auf dem Arbeitsblatt stehen habt!
2 H2 + O2 --> 2 H2O
Reaktion 2: Entzündet man ein Magnesiumband, so reagiert ein Teil der Magnesiumatome mit dem in der Luft enthaltenen Stickstoff zu der Verbindung Magnesiumnitrid.
3 Mg + N2 --> Mg3N2
Reaktion 3: Eine pulverförmige Mischung aus Eisen und Schwefel wird als lange Spur auf eine feuerfeste Platte gestreut. Es genügt nun, diese Spur am einen Ende zu entzünden, um eine Reaktion zu starten, bei der die Verbindung Eisen(II)-sulfid entsteht. Das Gemisch glüht nach und nach vom einen Ende bis zum anderen komplett durch.
Fe + S --> FeS
Reaktion 4: Im Hofmannschen Dreischenkelapparat wird die Verbindung Wasser in die beiden Produkte Wasserstoff und Sauerstoff gespalten, solange die Spannungsquelle angeschaltet ist.
2 H2O --> 2 H2 + O2
Reaktion 5: Quecksilber(II)-oxid ist eine sehr giftige Verbindung. Wenn man sie auf über 500°C erhitzt und diese Temperatur permanent aufrecht erhält, zerfällt sie. Dabei entsteht reines Quecksilber und Sauerstoff.
2 HgO --> 2 Hg + O2
Reaktion 6: Die Verbindung Wasserstoffperoxid (H2O2) zerfällt unter bestimmten Bedingungen schon bei Raumtemperatur zu Wasser und Sauerstoff.
2 H2O2 --> 2 H2O + O2
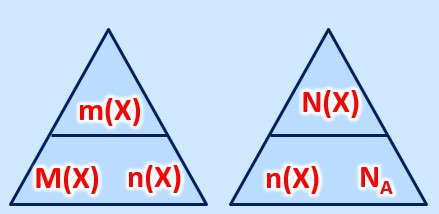
Allgemein müsst ihr mit folgenden Größen umgehen können:
- Masse eines Stoffes:
, Einheit:
(Gramm)
- molare Masse eines Stoffes:
, Einheit
, kann für Atome aus dem PSE abgeleitet werden
- Stoffmenge eines Stoffes:
, Einheit:
- Die tatsächlich Anzahl von Teilchen eines Stoffes:
, keine Einheit
- Die Avogadrokonstante
Es gelten die folgenden Zusammenhänge:
- Stelle die chemische Gleichung auf: Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Das ist eine Verbindung mit der chemischen Formel MgO
2 Mg + O2 --> 2 MgO
- Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 1 Mol Sauerstoffmoleküle (O2) eingesperrt wurden, welche Stoffmenge an Magnesiumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)?
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(Mg), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer zwei Magnesiumteilchen mit einem Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: Zwei Mol Magnesium reagieren mit einem Mol Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen.
Es müssen 2 Mol Magnesium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Magnesium entspricht das?
gesucht:
gegeben: ,
Formel:
Einsetzen der Werte in die Formel:
- Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Der größte je gefundene Roh-Diamant der Welt wog 3107 Karat, das sind 621,4g. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten!
Hier ist die Stoffmenge gesucht, gegeben ist die Masse von Kohlenstoff. Die Molare Masse für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links).
gesucht:
gegeben: ,
Formel:
Einsetzen der Werte in die Formel:
- Berechne die Masse einer Portion Wasser, deren Stoffmenge n(H2O) = 1,0mol beträgt! (Man könnte auch einfacher fragen: Wie viel Gramm wiegt 1 Mol Wasser?)
Hier ist die Massegesucht, gegeben ist die Stoffmenge von Wasser. Die Molare Masse für Moleküle wie H2O kann durch Addition der am Aufbau beteiligten Atome direkt aus dem PSE abgeleitet werden.
gesucht:
gegeben: ,
Formel:
Einsetzen der Werte in die Formel:
- Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid.
4 K + O2 --> 2 K2O
- Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O2) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)?
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer vier Kaliumteilchen mit einem Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: Vier Mol Kalium reagieren mit einem Mol Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen.
Es müssen 4 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das?
gesucht:
gegeben: ,
Formel:
Einsetzen der Werte in die Formel:



