Benutzer:Thomas Lux/Test Oberstufe
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Aufgaben:
- Salze 1
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen
- Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff.
- Leite daraus ab, welche Ionen diese Stoffe bilden werden
Na --> Na+ + e-
O + 2e- --> O2-
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt)
- Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden?
- Wie formuliert man das als chemische Formel?
2 Na+ und 1 O2- Teilchen ergeben insgesamt die chemische Formel Na2O
- Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört!
- Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte!
4 Na + O2- --> 2Na2O
- Salze 2
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere!
Eine gute Begründung enthält folgende Aspekte:
- Man erklärt zunächst, was "Sieden überhaupt bedeutet"!
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden.
- Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt!
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält.
- Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen!
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst.
- Moleküle
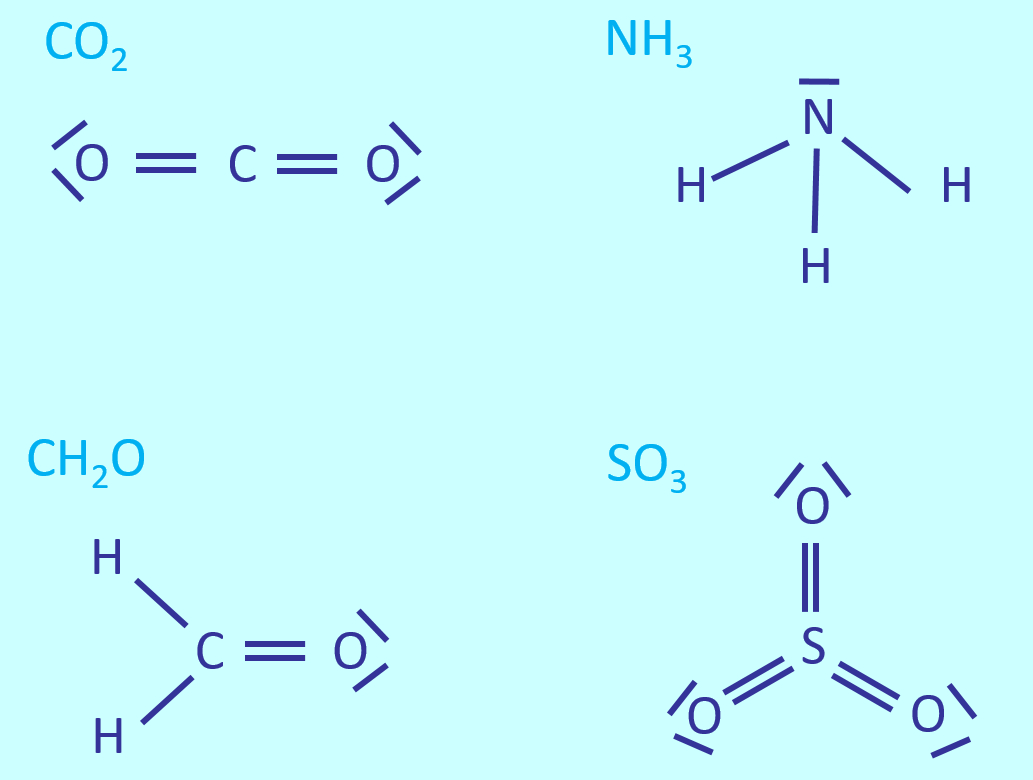
Zeichnet die Valenzstrichformeln für: CO2, NH3, CH2O, SO3
- Metalle
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind!
- Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben.
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:
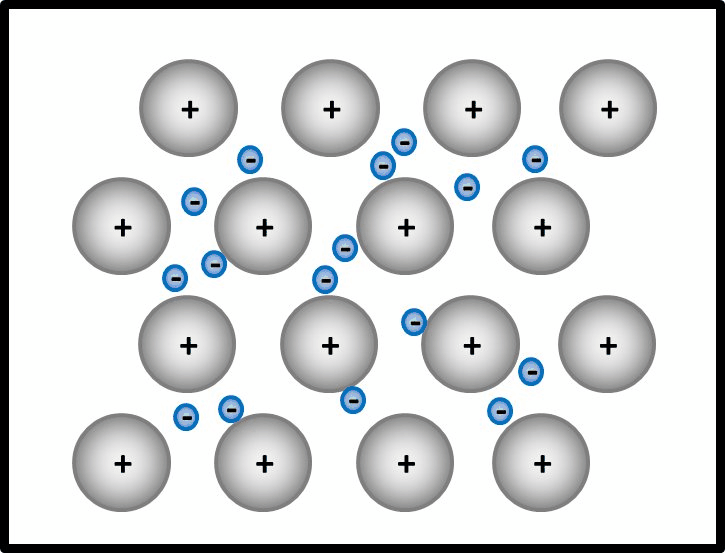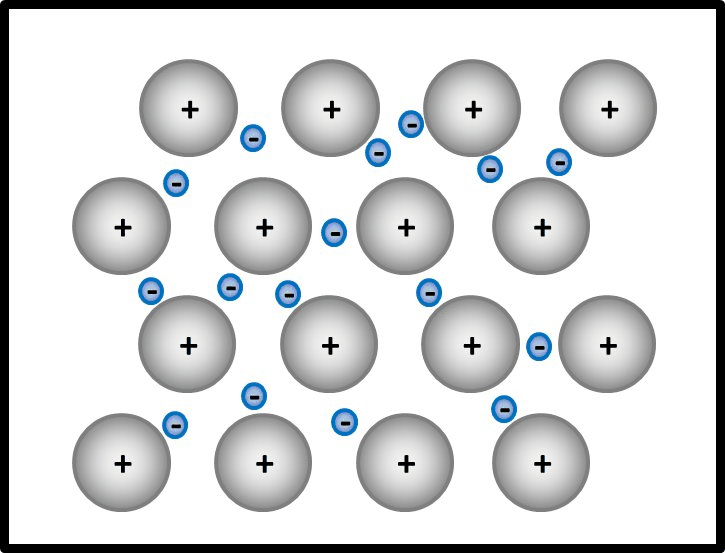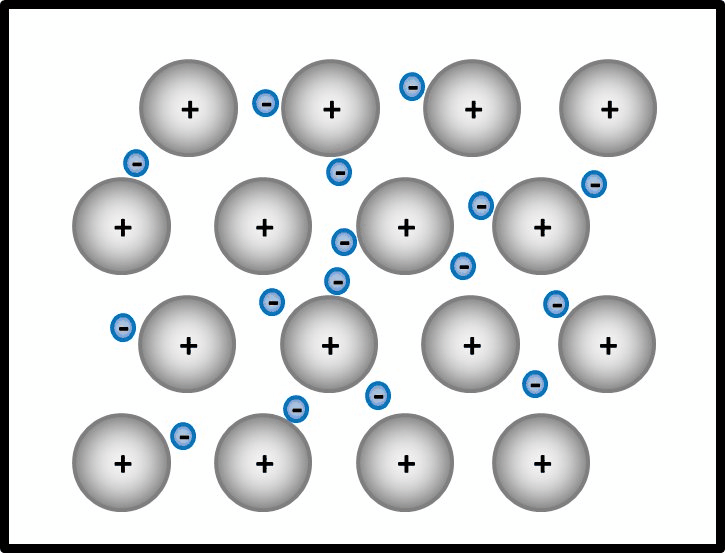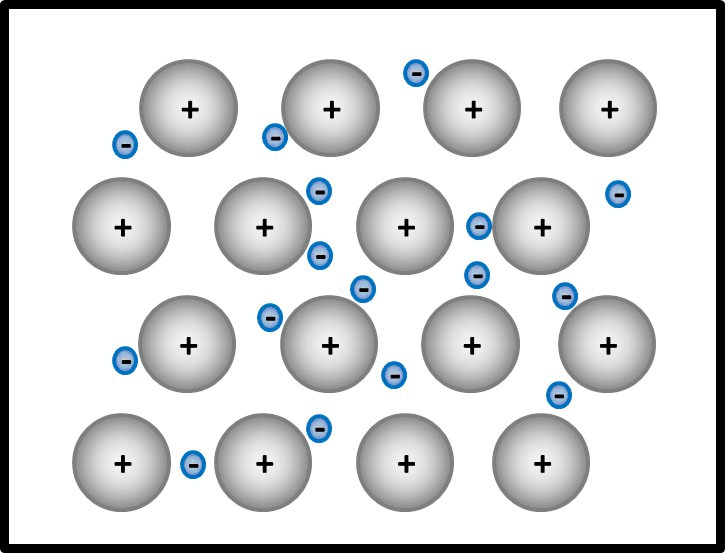
- Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her!
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt.
Distanzunterricht Donnerstag, 14.01. Bio
In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.
Das Wort ist euch sicher geläufig, die genaue Bedeutung wahrscheinlich nicht unbedingt. Ihr seht unten zwei Videos, die sich mit Grundbegriffen der Ökologie beschäftigen. Die Videos besitzen eine hohe Informationsdichte und sind unter Umständen etwas schnell. Trotzdem sind sie ganz gut gelungen und bieten vielleicht etwas Abwechslung. Es werde euch hier Ausschnitte abgespielt. Auf yt direkt könnt ihr die Videos aber auch ganz anschauen.
Schaut beide Videos und bearbeitet anschließend die Aufgaben darunter!
Aufgaben:
Klickt zunächst auf folgenden Link. Ihr gelangt zu einer Seite, die "Eco-Spheres" verkauft. Ein angeblich ursprünglich von der NASA entwickeltes "Ökosystem" für den Schreibtisch. Lest die Produktinformationen und kehrt dann wieder hierher zurück!
Zur Eco-Sphere
Aufgaben:
- Wende die soeben gelernten Fachgriffe an und ordnen ihnen die richtigen Objekte aus der Eco-Sphere zu!
- Was an der Eco-Sphere ist Biotop, was Biozönose?
- Welche Organismen sind Produzenten, Konsumenten und Reduzenten?
- Biotop: Glasgefäß, Steinchen, Muschel-Schalen (Das Gefäß enthält keine lebenden Muscheln) Gorgonie, Wasser; Biozönose: grüne Faden- und braune Flächen-Algen, Garnelen, Mikroorganismen
- Produzenten: grüne Faden- und braune Flächen-Algen, Konsumenten: Garnelen, Reduzenten: Mikroorganismen
Es gibt drei Begriff, die eher aus der Physik stammen und die Wechselwirkung von Systemen mit ihrer Umgebung beschreiben:
- Offene Systeme
Offen bedeutet, dass SOWOHL Energie mit der Umgebung ausgetauscht werden, ALS AUCH Stoffe
- Geschlossene Systeme
Bei geschlossenen System kann zwar Energie mit der Umgebung ausgetauscht werden, allerdings keine Stoffe
- Isolierte Systeme
Isolierte System stehen in überhaupt keinem Austausch mit der Umgebung.
Ökosysteme sind in der Regel offene Systeme. Betrachten wir einen See: Ein im See lebender Frosch könnte den See durchaus verlassen und in den angrenzenden Wald hüpfen und dort Kot absetzen. Damit wären Stoffe aus dem See in die Umgebung gelangt. Umgekehrt könnte auch ein Ente von weit her angeflogen können und Fischeier, die an ihrem Gefieder hingen im See hinterlassen. Damit wären Stoffe in den See aus der Umgebung eingetragen worden.
Auch ein Energieaustausch ist möglich: Wenn die Sonne scheint, können die Sonnen strahlen in den See eindringen und ihn aufheizen. Nachts kann diese Wärme z.B. an die Atmosphäre wieder abgegeben werden.
Beurteile begründet, ob die Eco-Sphere tatsächlich ein Öko-System in diesem Sinne ist.
Ein Energieaustausch ist zwar möglich. Das Glasgefäß lässt ja z.B. Lichtstrahlen ein- und austreten; ein Stoffaustausch ist jedoch mit der Umgebung nicht möglich. Daher ist dieses System geschlossen und unterscheidet sich in diesem Punkt von offenen Ökosystemen in der Natur
Freiwillig:
Vor einigen Jahren versuchte man mit einer Art Gewächshaus die Erde nachzuahmen, um zu testen, ob man in einem geschlossenen System (z.B. auf dem Mars) als Mensch länger überleben könnte. Das Projekt hieß "Biosphäre 2". Wer möchte, kann einen 7min. Film dazu schauen:
Hausaufgabe:
Lest im Buch S. 62 - 63
Lasst euch das, was wir gestern (Montag) besprochen haben noch einmal kurz durch den Kopf gehen. Ihr könnt dazu auf dieser Seite etwas nach unten scrollen und die Fragen überfliegen, die im letzten Arbeitsauftrag behandelt wurden.
Wie würdet ihr in höchstens drei Sätzen zusammenfassen, was ihr aus dieser letzten Einheit mitgenommen habt?
Möglich wäre z.B.:
- Ein Schokokuchen ist schon was leckeres...
- Auf "Vogelhäuschen selber bauen" hätte ich ja gar keinen Bock. Da kauf ich lieber eins.
- Eine Tonne Äpfel auf einem Anhänger??? Auf den Anhänger von meinem Onkel passen 16 Tonnen!
O.k., das könnten zwar auch Dinge gewesen sein, die euch durch den Kopf gegangen sind, aber jetzt mal in Bezug auf Chemie!
Möglich wäre z.B.:
- In chemischen Gleichungen spielt die Anzahl von Teilchen (Atomen, Molekülen, Salzeinheiten) eine Rolle
- Leider kann man solche Teilchen aber nicht abzählen
- Man müsste die Masse von diesen Teilchen wissen, damit man etwas damit anfangen kann
Ihr sollt heute einen kleinen Versuch durchführen, mit dem man die Masse von kleinen Teilchen ziemlich genau bestimmen kann, auch wenn man sie nicht direkt wiegt. Mit einzelnen Atomen oder Molekülen könnt ihr natürlich nicht arbeiten, daher nehmen wir andere "kleine Teilchen". Ihr benötigt also:
- Entweder Reiskörner oder trockene Erbsen oder trockene Linsen oder sonst irgendetwas kleines (Reißnägel, Büroklammern etc.)
- Eine Küchenwaage
- Geduld
Die Objekte, die ihr euch aussucht, sollten so klein (und leicht) sein, dass eine Küchenwaage "nichts" anzeigt, wenn man eins dieser Objekte darauf legt. Zählt jetzt so viele Teilchen ab (z.B. 100, evtl. aber auch 1000), dass eure Küchenwaage einen "vernünftigen Wert" anzeigt, ich würde empfehlen so um die 10 Gramm.
Ihr könnt auch umgekehrt vorgehen: Wiegt exakt 10,0g ab und bestimmt dann die in dieser Menge enthaltene Anzahl an Objekten.
Berechnet aus diesen beiden Werten (Anzahl und Gewicht) das Gewicht eines Teilchens. Recherchiert dann im Internet ob ihr einen Wert findet, der euer Ergebnis bestätigt (oder auch widerlegt). Wenn ihr Pflanzenteile genommen habt, dann werdet ihr wahrscheinlich sehr schnell auf Wikipedia fündig. Als Suchtipp kann ich euch auch den Begriff "Tausendkornmasse" empfehlen.
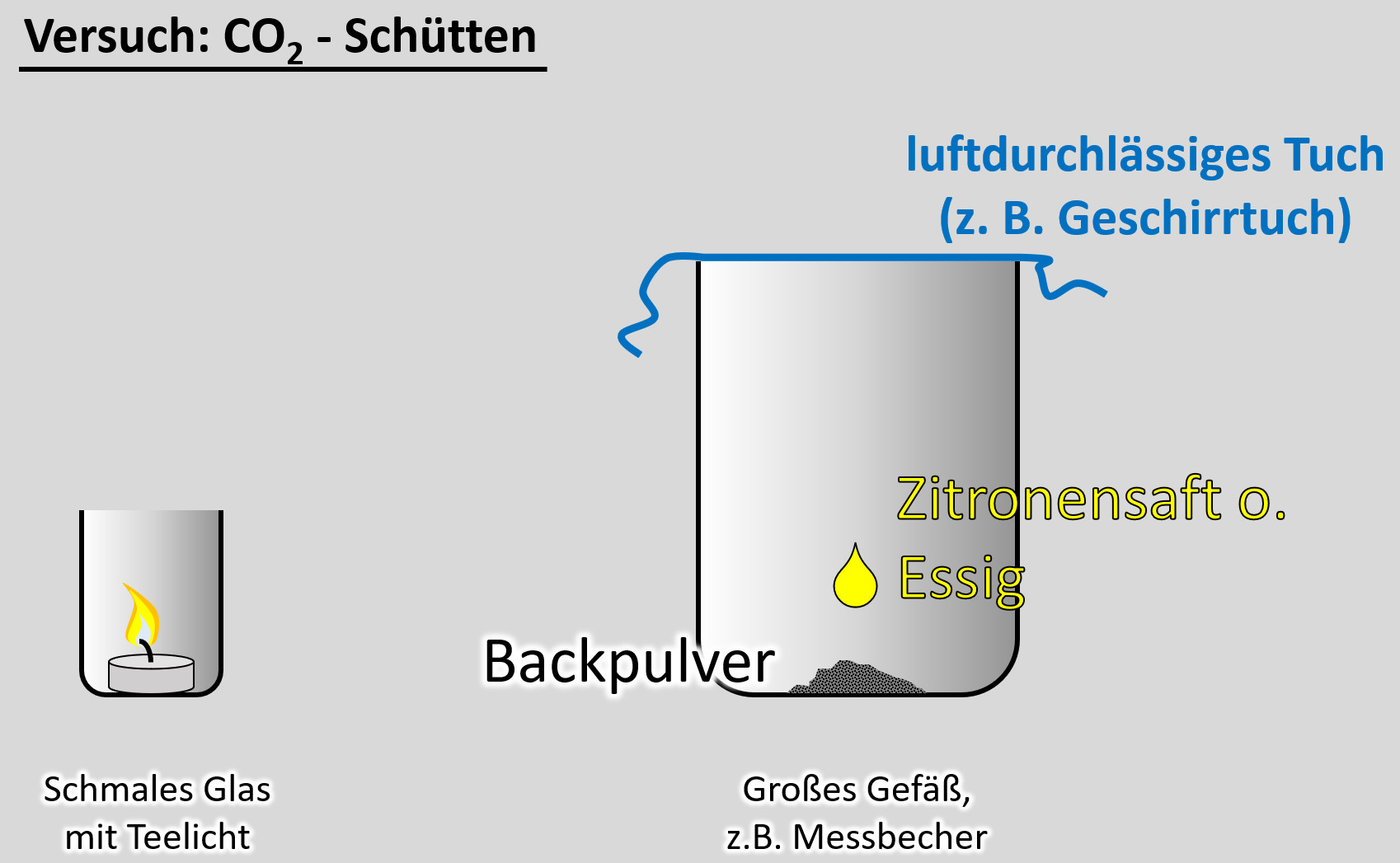
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmale Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.