Benutzer:Thomas Lux/Test Oberstufe
Distanzunterricht Montag, 11.01.
Bitte bearbeitet von 09:45 Uhr bis 10:10 Uhr die folgenden Aufgaben. Ihr benötigt dazu euer Schulbuch! Um 10:15 Uhr starten wir eine Konferenz, um die gestellten Aufgaben zu verbessern! (Den Link für die Konferenz habt ihr per Schulmanager bekommen)
Nehmt an, ihr sei bei Freunden zum Geburtstag eingeladen und es gibt Kuchen (ich gebe zu, in Zeiten von "Corona" kein sehr praxisnahes Beispiel...). Der Kuchen schmeckt sehr lecker und ihr wollt ihn "nachmachen". Dann fragt ihr vermutlich nach dem Rezept (oder ihr recherchiert im Internet).
Anderes Beispiel: Nehmt an, ihr seht beim Spazierengehen in einem Garten ein sehr schönes Vogelhäuschen, in dem viele verschiedene Vogelarten gerade fressen. Ihr wollt dieses Vogelhäuschen nachbauen und recherchiert im Internet nach der Bauanleitung.
Worin unterscheiden sich die Bauanleitung für das Vogelhäuschen von dem Rezept für einen Kuchen?
- Beim Kuchenrezept sind die Angaben für die Zutaten in der Regel in Gramm (also einer Gewichtseinheit) angegeben.
- Bei der Bauanleitung werden eher Stückzahlen genannt.
Wie schaut das bei chemischen Reaktionen aus? Eine chemische Gleichung ist im Prinzip ja auch eine "Anleitung", an die man sich halten kann, wenn man einen bestimmten Stoff herstellen will. Nehmt an, ihr wollt FeS2 (Pyrit) herstellen. Ihr findet im Internet dazu die folgende chemische Gleichung:
Fe + 2 S --> FeS2
Was bedeutet das genau? Sprich diese chemische Gleichung in einem schönen, deutschen Satz aus! Beachte, dass auch der vorkommende Koeffizient (die Zahl 2 vor dem S) in Deinem Satz vorkommt!
Es gibt hier mehrere Möglichkeiten, z.B.: "Ein Eisenatom reagiert mit zwei Schwefelatomen zu einem Pyrit-Teilchen"
Bitte übt dieses "Übersetzen" noch ein paar Mal mit diesen Gleichungen:
- 2 H2 + O2 --> 2 H2O
- 4 Al + 3 O2 --> 2 Al2O3 (Aluminiumoxid)
- 2 H2O2 (Wasserstoffperoxid) --> 2 H2O + O2
- Zwei Wasserstoffmoleküle reagieren mit einem Sauerstoffmolekül zu zwei Wasser-Molekülen.
- Vier Aluminiumatome reagieren mit drei Sauerstoffmolekülen zu zwei Aluminiumoxid-Einheiten. (Aluminiumoxid ist ein Salz, d. h. ganz viele pos. geladene Kationen und ganz viele neg. geladene Anionen finden sich zu einem riesigen Gitter zusammen, ein "einzelnes Al2O3-Teilchen" gibt es nicht.
- Zwei Wasserstoffperoxid-Moleküle zerfallen zu zwei Wassermolekülen und einem Sauerstoffmolekül.
Man sieht, bei chemischen Gleichungen wird eher so vorgegangen, wie bei der Bauanleitung für Vogelhäuschen: Es geht hier um die Anzahl bestimmter Teilchen. Leider nützt einem das im Labor nichts! Nehmen wir wieder die erste Gleichung:
Fe + 2 S --> FeS2
Sie besagt also, dass man pro Eisenatom zwei Schwefelatome verwenden muss, um eine vollständige Reaktion zu Pyrit zu erhalten. Wenn man "mehr" Pyrit haben will, kann man auch 1000 Eisenatome verwenden, dann braucht man eben 2000 Schwefelatome. Reicht das immer noch nicht, kann man auch 80 Quadrillionen Eisenatome nehmen, dann muss man die eben mit 160 Quadrillionen Schwefelatomen reagieren lassen. So weit so gut, aber warum nützen einem diese Überlegungen nichts?
Weil man keine Möglichkeit hat, im Labor Atome (oder Moleküle oder andere Teilchen) abzuzählen!
Nehmt an, ihr habt ein "Häufchen Eisenpulver", welches ihr mit Schwefel komplett zu Pyrit umwandeln wollt. Die Anzahl der Eisenatom in dem Häufchen könnt ihr also nicht abzählen, aber welche Größe lässt sich im Labor oder auch zu Hause sehr leicht bestimmen?
Das Gewicht oder besser: Die Masse!
O.k., man kann das Häufchen Eisenpulver also auf die Waage legen und z.B. feststellen, es wiegt 3,0g. Das ist zwar einfach, nützt einem aber wieder nicht viel! Damit ich mit Hilfe der chemischen Gleichung abschätzen kann, wie viel Schwefel ich für die Reaktion brauche, muss ich wissen, wie viele Eisenatome in diesen 3,0g drin sind! Welche Größe würde dieses Problem lösen?
Habt ihr wirklich schon eine Lösung gefunden? Vielleicht noch ein einfacheres Beispiel: Ein Landwirt lädt im Herbst alle Äpfel seiner Streuobstwiese auf den Anhänger seines Traktors. Alle Äpfel zusammen wiegen genau eine Tonne (1000kg). Er möchte wissen, wie viele Äpfel das ungefähr sind. Welche Größe braucht er für diese Berechnung?
Die Masse eines Apfels! - Oder im ersten Beispiel: Die Masse eines Eisenatoms.
Früher gab es keine Möglichkeit die Masse eines einzelnen Eisenatoms zu bestimmen. Heute geht das. Man verwendet dazu Massenspektrographen. In eurem Buch ist ein solches Gerät schematisch abgebildet. Nehmt euer Buch zur Hand auf S. 34. Betrachtet zunächst die Abbildungen 1 und 2, lest dann den Abschnitt "Wie vergleicht und ermittelt man Atommassen?" ganz unten auf der Seite 34. Lest wirklich nur diesen Absatz, nicht das was vorher steht und auch nicht, was danach kommt!
Beschreibt nun laut mit Worten die Abbildungen!
Wenn ihr das getan habt, solltet ihr euch für die Videokonferenz vorbereiten! Ruft über den Link im Schulmanager den BBB-Raum auf und loggt euch ein. Sollte es noch deutlich vor 10:10 Uhr, dürft ihr euch gerne erst einen Kaffee holen (oder was man als Neuntklässer eben so trinkt zum Frühstück...). Bis gleich!
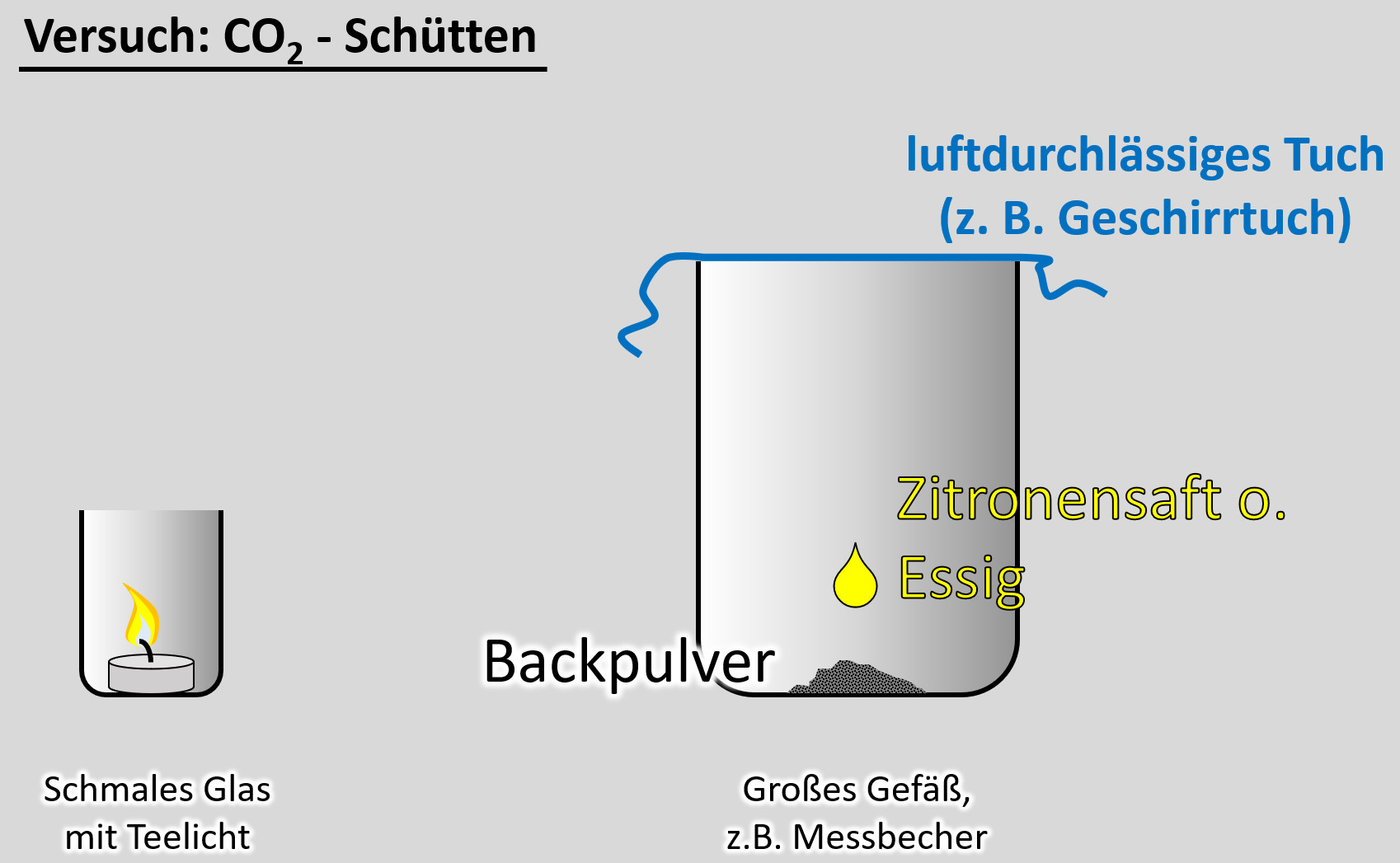
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmale Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.