8a 2022 23
Inhaltsverzeichnis
Chemie
- Schulaufgabe: Freitag, 16.12.
- kleiner angesagter Leistungsnachweis: Fr, 13.01. Lernstoff: Unterricht vom Montag, 09.01.
Online-Unterricht am 09.01.2023
- Arbeitet die folgenden Blöcke der Reihe nach ab.
- Nutzt das ausgeteilte Arbeitsblatt, um eure Lösungsvorschläge zu dokumentieren.
- Vergleicht eure Lösungen mit der angegebenen Musterlösung selbständig!
Stelle jeweils die Gleichungen für die folgenden chemischen Reaktionen auf:
Reaktion 1: Bei der positiven Knallgasprobe reagiert das aufgefangene Gas Wasserstoff mit dem Sauerstoff aus der Luft im Zuge einer kleinen Explosion zu gasförmigem Wasser.
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr selbst eine chemische Gleichung auf dem Arbeitsblatt stehen habt!
2 H2 + O2 --> 2 H2O
Reaktion 2: Entzündet man ein Magnesiumband, so reagiert es ebenfalls mit dem in der Luft enthaltenen Sauerstoff zu der Verbindung Magnesiumoxid (MgO). Bei der Reaktion entsteht ein sehr helles Licht, in das man nicht längere Zeit hinein schauen sollte.
2 Mg + O2 --> 2 MgO
Reaktion 3: Eine pulverförmige Mischung aus Eisen und Schwefel wird als lange Spur auf eine feuerfeste Platte gestreut. Es genügt nun, diese Spur am einen Ende zu entzünden, um eine Reaktion zu starten, bei der die Verbindung Eisensulfid (FeS) entsteht. Das Gemisch glüht nach und nach vom einen Ende bis zum anderen komplett durch.
Fe + S --> FeS
Reaktion 4: Im Hofmannschen Dreischenkelapparat wird die Verbindung Wasser in die beiden Produkte Wasserstoff und Sauerstoff gespalten, solange die Spannungsquelle angeschaltet ist.
2 H2O --> 2 H2 + O2
Reaktion 5: Quecksilberoxid (HgO) ist eine sehr giftige Verbindung. Wenn man sie auf über 500°C erhitzt und diese Temperatur permanent aufrecht erhält, zerfällt sie. Dabei entsteht reines Quecksilber und Sauerstoff.
2 HgO --> 2 Hg + O2
Reaktion 6: Die Verbindung Wasserstoffperoxid (H2O2) zerfällt unter bestimmten Bedingungen schon bei Raumtemperatur zu Wasser und Sauerstoff.
2 H2O2 --> 2 H2O + O2
- Betrachtet nun die chemischen Reaktionsgleichungen der Reaktionen 1-3 und 4-6.
- Die Reaktionen 1-3 haben eine Gemeinsamkeit und die Reaktionen 4-6 haben eine Gemeinsamkeit.
- Formuliert jeweils einen allgemeinen Satz, der die Gemeinsamkeit bei den Reaktionen 1-3 bzw. 4-6 beschreibt.
- Sucht euch dann eine/n Partnerin in der Klasse, der ebenfalls gerade diesen Aufgabenblock bearbeitet. Lest ihr/ihm eure beiden Sätze vor. Hört euch ihre/seine beiden Sätze an. Entscheidet euch für die beste Variante und bessert eure eigenen Sätze eventuell aus.
- Erst jetzt (nachdem ihr euch mit jemandem in der Klasse besprochen habt) dürft ihr euch hier die Musterlösungsvorschläge anschauen.
- Falls eure Lösung zu stark von der Musterlösung abweicht, müsst ihr sie erneut ausbessern
Letzte Warnung: Ihr müsst eure Lösung erst mit jemandem besprochen und evtl. verbessert haben, bevor ihr auf Lösung klickt!
Gemeinsamkeiten bei den Reaktionen 1-3:
Hier entsteht aus zwei Edukten immer ein Produkt.
Gemeinsamkeiten bei den Reaktionen 4-6:
Hier entstehen aus einem Edukt immer zwei Produkte.
- Lest den folgenden Text zu unterschiedlichen Reaktionstypen.
- Füllt auf eurem Arbeitsblatt die noch leeren Lücken auf!
Infotext
Man kann chemische Reaktionen danach einteilen, wie viele Edukte und Produkte daran beteiligt sind. Entsteht bei einer chemischen Reaktion nur ein einziges Produkt aus mehreren Edukten, spricht man von einer Synthese. Umgekehrt spricht man von einer Analyse, wenn aus einem einzigen Edukt mehrere Produkte entstehen. Von einer Umsetzung spricht man, wenn mehrere Edukte und mehrere Produkte auftauchen.
Grundwissen
Folgende Begriffe und Methoden solltest Du bereits erklären können:
- homogen/heterogen
- Legierung, Lösung, Gasgemisch
- Feststoffgemisch (Gemenge), Suspension, Emulsion, Nebel, Rauch, Schaum
- Filtrieren, Destillieren, Chromatographieren
- Zustände: fest (s), flüssig (l), gasförmig (g)
- Zustandsänderungen: schmelzen, erstarren, sieden, kondensieren, sublimieren, resublimieren
Das Interpretieren von Grafiken (auch Tabellen oder Karikaturen) ist eine oft verlangte Fähigkeit von Oberstufen-Schülern. Ich empfehle folgendes Vorgehen:
- Man beginnt mit einer Beschreibung
- Was zeigt die Grafik? (y-Achse und x-Achse in Beziehung setzen, z.B. mit der Formulierung: "Die Grafik zeigt das was auf der y-Achse steht in Abhängigkeit von dem was auf der x-Achse steht.)
- Welche Zusammenhänge sind zu sehen? Man verzichtet zunächst auf Erklärungen/Begründungen, bleibt zunächst noch bei einer reinen Beschreibung (Schöne Formulierungen: "Je ...größer/kleiner/höher/niedriger/usw. desto ..."
- Erst zum Schluss versucht man die Zusammenhänge zu erklären. Je nach behandeltem Stoff im Unterricht kann diese Erklärung recht umfangreiches Wissen verlangen. Gelegentlich sind hier auch Hypothesen über eine mögliche Begründung verlangt, die noch nicht besprochen wurden.
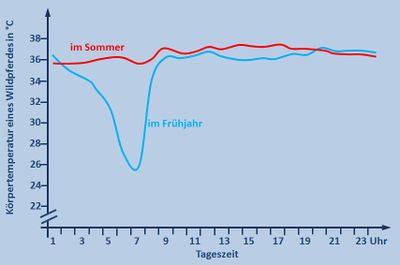
Abb. selbst erstellt, Originalgrafik: Kuntz, Regina; Der versteckte Winterschlaf der Wildpferde; Spektrum der Wissenschaft; August 2008; S. 46 - 53, 2008
Versucht zunächst selbst diese Grafiken zu interpretieren. - Lasst euch dann die Lösung anzeigen.
- Die Grafik zeigt die Körpertemperatur eines Wildpferdes in Abhängigkeit von der Uhrzeit einmal im Sommer und einmal im Winter.
- Im Sommer bleibt die Körpertemperatur den ganzen Tag konstant bei 36°C. Im Frühjahr sinkt die Körpertemperatur nachts und in den frühen Morgenstunden um 10°C auf 26°C ab. Ab 08:00 Uhr steigt sie wieder auf 36°C und bleibt dann konstant.
- Im Unterricht könnte man dazu folgendes besprochen haben: Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.
Versuchsprotokolle
Freitag, 30.09.
- Im Unterricht: Filzstift-Chromatographie
- Versuchsprotokoll zum Herunterladen als .pdf-Datei: Hier klicken
Montag, 10.10.
- Chemie-Übung: Trennung eines Sand-Salz-Gemisches
- Versuchsprotokoll zum Herunterladen als .pdf-Datei: Hier klicken
Montag, 07.11.
- Chemie-Übung: Wasserstoff oder Sauerstoff?
- Versuchsprotokoll zum Herunterladen als .pdf-Datei: Hier klicken
Lernstoff für angekündigte Leistungsnachweise
Schulaufgabe am 16.12.
Neben den Hefteinträgen und dem oben genannten Grundwissen, eignen sich folgende Seiten im Buch (Galvani - Chemie 8) zur Vorbereitung auf die Schulaufgabe:
- S. 10 - 11: Das ist Chemie...
- S. 22 - 24: Aggregatzustände
- S. 26 - 28: Eigenschaften von Stoffen
- S. 44 - 45: Reinstoffe und Stoffgemische
- S. 46 - 48: Homogene und heterogene Stoffgemische
- S. 56 - 58: Trennmethoden
- S. 60 - 62: Luft - Zusammensetzung, Verflüssigung
- S. 64 - 65: Gasnachweise
- S. 92 - 93: (+ S. 94): Atommodelle (Gesetz von der Erhaltung der Masse, Gesetz von den konstanten Proportionen)
- S. 101 + 103: Aufstellen von chemischen Reaktionsgleichungen





