9a 2020 21/Chemie
Inhaltsverzeichnis
Lernen zu Hause
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 30 Minuten nicht wesentlich übersteigen.
In der letzten Online-Einheit habt ihr Belege für das Teilchen-Modell kennengelernt und gesehen, wie man damit bestimmte Beobachtungen erklären kann. Als Hausaufgabe habt ihr zwei Seiten im Buch gelesen, auf denen noch einmal der Unterschied zwischen Stoff-Ebene (Beobachtungs-Ebene) und Teilchen-Ebene (Vorstellungs-Ebene) erklärt wurde. Diese Unterscheidung solltet ihr schon aus der Unterstufe kennen.
Zunächst zur Hausaufgabe: Ihr solltet die in Abb. 4 auf S. 44 im Buch dargestellten Vorgänge „beschreiben“! Wenn ihr euch nicht mehr erinnert, schaut noch einmal nach. Klickt erst auf „Lösung“, wenn ihr eure Beschreibung vollständig laut ausgesprochen habt.
Auf der Stoff-Ebene könnt ihr festhalten: Sobald die Brausetablette ins Wasser fällt, entsteht ein Gas, welches in Form von kleinen Bläschen aufsteigt.
Mehr sieht man auf diesen Bildern nicht…
Auf Teilchen-Ebene laufen mehrere Prozesse ab, aber die kann man alle nicht sehen und wissen könnt ihr sie eigentlich auch nicht, zumindest nicht aus dem bisherigen Chemie-Unterricht. Ich stelle euch die Situation daher mal auf Teilchen-Ebene schematisch dar und ihr versucht sie erneut zu beschreiben!
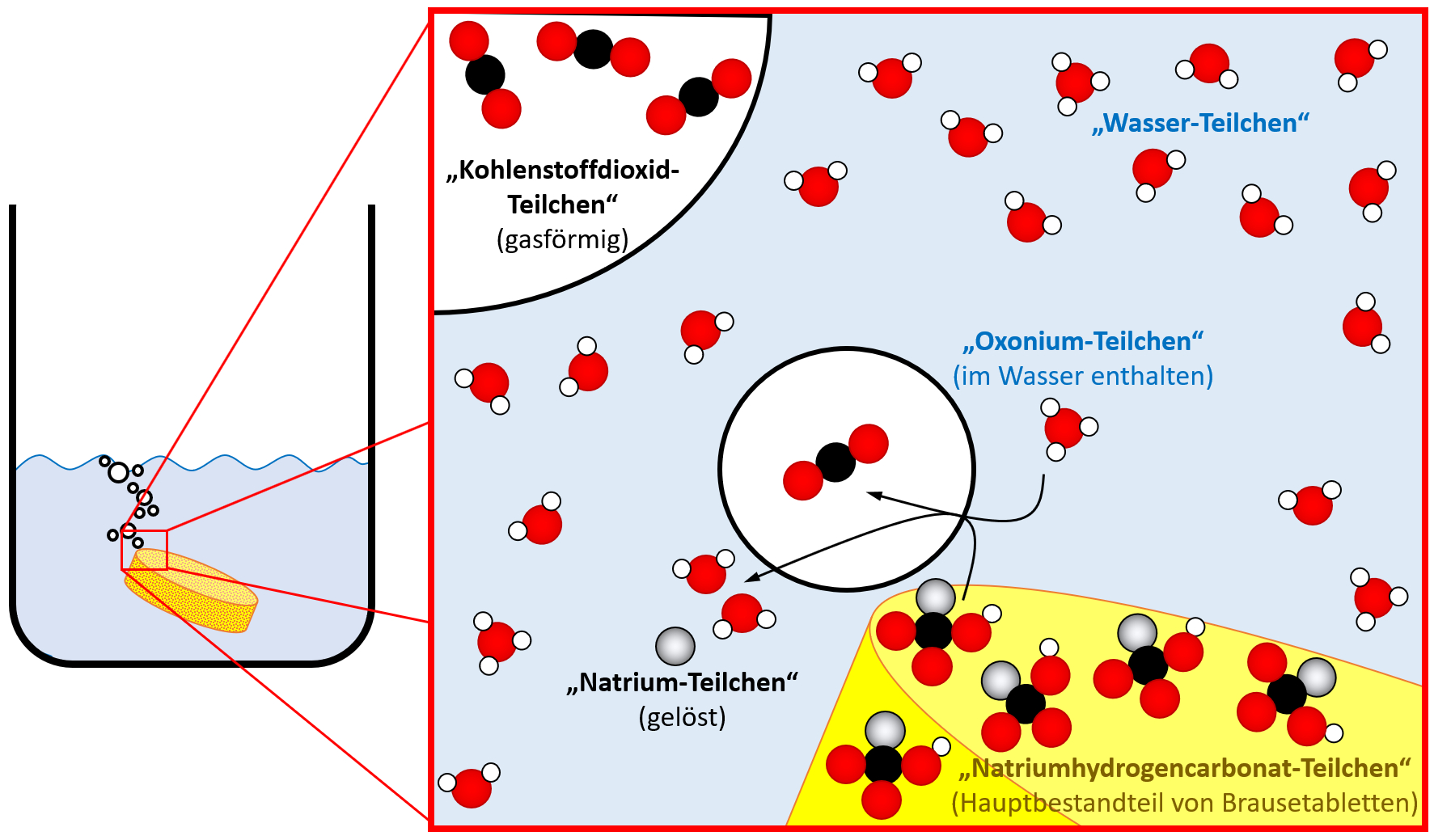
Jetzt könnte man auch auf Teilchen-Ebene etwas beschreiben: Bestimmte Teilchen aus dem Wasser (Oxonium-Teilchen) reagieren mit den Natriumhydrogencarbonat-Teilchen aus der Brausetablette. Dabei entsteht das Gas Kohlenstoffdioxid und Natrium-Teilchen werden im Wasser gelöst.
Wenn ihr auf die Anzahl der Kugeln vor der Reaktion und nach der Reaktion achtet, stellt ihr fest, dass die Anzahl der Kugeln gleich geblieben ist. Das muss so sein. Aus diesem Umstand lässt sich das "Gesetz der konstanten Proportionen" ableiten, um das es in der heutigen Einheit geht.
Die oben dargestellte chemische Reaktion ist schon ziemlich kompliziert. Ihr erkennt in der Abbildung hoffentlich, dass fast alle dort gezeichneten „Teilchen“ sich aus verschiedenen „Kugeln“ zusammensetzen. In der letzten Stunde vor dem Test haben wir darüber bereits gesprochen: Mit einem Hofmannschen Dreischenkelapparat können „Wasser-Teilchen“ zerlegt werden. Es entsteht Sauerstoff und Wasserstoff.
In der oberen Abbildung ist diese Tatsache symbolisch mit unterschiedlichen Kugeln verwirklicht: Sauerstoff wird durch rote Kugeln symbolisiert, Wasserstoff durch weiße. Ein „Wasser-Teilchen“ ist aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen zusammengesetzt.
In der letzten Online-Einheit habt ihr auch schon den Stoff Eisensulfid kennengelernt. Er entsteht, wenn man Eisen mit Schwefel reagieren lässt.
Ein Lehrer hat dazu ein Video ins Netz gestellt, wer es anschauen möchte, bitteschön:
In der schematischen Darstellung ganz am Ende der letzten Online-Einheit habt ihr schon gesehen, dass im Eisensulfid pro Eisen-Atom genau ein Schwefel-Atom vorhanden ist. Wie ihr heute gelernt habt, muss dieses „Teilchen-Verhältnis“ nicht immer so sein: In einem Wasser-Teilchen waren es ja genau zwei Wasserstoff-Atome, die mit einem Sauerstoff-Atom verbunden waren. Dazu in einer späteren Einheit mehr.
Bleiben wir beim Eisensulfid. In eurem Buch auf der Seite 37 seht ihr oben rechts eine Grafik!
Lest zunächst den Text auf S. 36 unten („Stoffe verbinden sich…) bis S. 37 zum ersten blauen Merksatz. Beantwortet dann die folgenden Fragen (schriftlich auf ein Blatt, bitte erst auf „Lösung“ klicken, wenn ihr tatsächlich eine Lösung gefunden habt):
- Wenn man 50g Eisen vollständig mit Schwefel zu Eisensulfid reagieren lassen möchte, braucht man eine bestimmte Menge Schwefel. Wenn man doppelt so Eisen verwendet, braucht man auch genau die doppelte Menge Schwefel. Warum ist das so?
Weil Materie aus kleinsten Teilchen aufgebaut ist. Das Verhältnis der verschiedenen Teilchen in einer bestimmten Verbindung ist immer gleich. Wenn die Anzahl der Teilchen des einen Stoffes erhöht wird, muss die Anzahl der Teilchen des anderen Stoffes um den selben Faktor erhöht werden, wenn die Reaktion vollständig ablaufen soll.
- Welche Masse an Eisen muss man verwenden, um mit exakt 100g Schwefel vollständig zu Eisensulfid zu reagieren?
Laut Text gilt "Die Masse von Eisen verhält sich zur Masse von Schwefel wie 1,75 zu 1,00". Das bedeutet man braucht 175g Eisen, um mit 100g Schwefel eine vollständige Reaktion zu Eisensulfid zu erhalten.
- Die Grafik verdeutlicht das "Gesetz der konstanten Proportionen. Wie würdest Du dieses Gesetz mit eigenen Worten beschreiben?
Im Prinzip müsstet ihr hier mit dem blauen Merksatz aus dem Buch antworten (oder so ähnlich): Zwei Elemente vereinigen sich zu einer bestimmten Verbindung immer im gleichen Massenverhältnis.
Echte Hausaufgabe
Wenn ihr in eurem Heft nachschaut, findet ihr dort vielleicht einen Hinweis darauf, dass bei der Spaltung von Wasser im Hofmannschen Dreischenkelapparat doppelt so viel Wasserstoff wie Sauerstoff entstanden ist. Stellt eine Vermutung an, warum das so ist!
Vorbereitungen für Freitag
Am Freitag würde ich gerne mit euch eine BigBlueButton-Konferenz durchführen. Ihr solltet inzwischen ja schon Erfahrung damit haben. Falls nicht, schicke ich euch zusammen mit dem Link noch einmal eine Anleitung. Link + Anmeldung + Zugangscode erhaltet ihr als Nachricht über den Schulmanager.
Bitte bereitet bis Freitag, 3. Std. folgendes vor: Wenn in den letzten beiden Unterrichtseinheiten noch Fragen offen geblieben sind oder ihr bei den Aufgaben Schwierigkeiten hatten, dann überlegt, wie ihr diese Fragen in der BBB-Konferenz stellen könnt:
- Wenn ihr mit Mikrofon teilnehmen könnt/wollt, dann könnt ihr die Frage einfach verbal stellen.
- Wenn ihr ohne Mikrofon teilnehmen wollt, könnt ihr die Frage auch in den Chat schreiben. Dann überlegt euch bitte schon eine Formulierung!
Quarantäne-Einheit 1
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Wir haben im Unterricht schon ein paar Mal angesprochen, dass Materie aus „Teilchen“ besteht. Bei den Aggregatszuständen zum Beispiel haben wir kleine Kugeln zur Darstellung verwendet. Das ist für euch jetzt wahrscheinlich keine wahnsinnig neue Erkenntnis, denn z. B. die Begriffe „Atom“ und „Molekül“, die eng mit dem Begriff des „Teilchens“ zusammenhängen, habt ihr vermutlich schon oft in den Medien gehört.
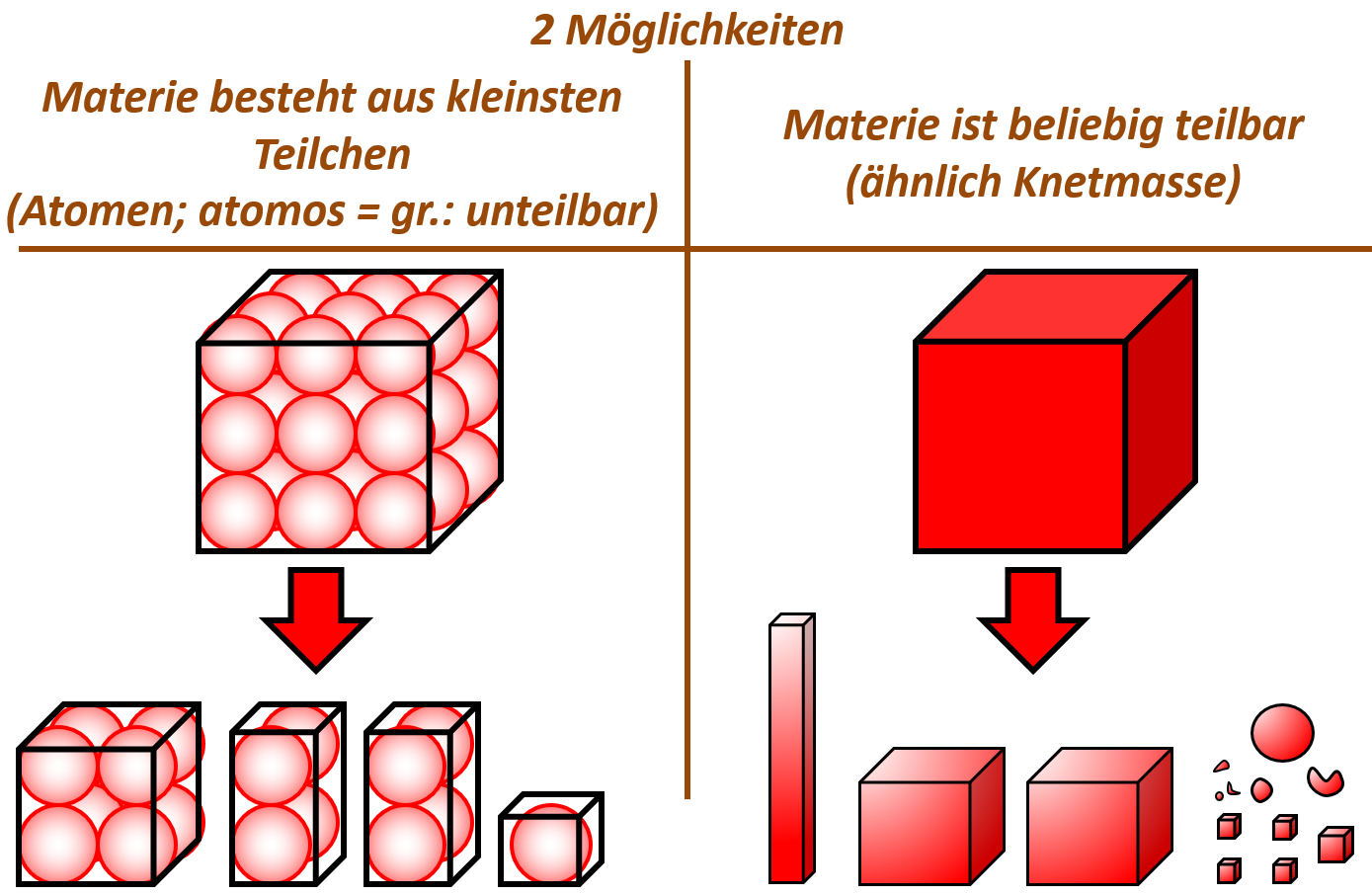
Tatsächlich war schon der griechische Philosoph Demokrit 400 v. Chr. der Meinung, alle Materie bestünde aus winzig kleinen Teilchen. Er nahm an, dass man bei extrem starker Vergrößerung von Materie auf kleine Teilchen stoßen würde, die sich zwar voneinander trennen lassen, selbst aber nicht teilbar sind. Diese Vorstellung nennt man „Teilchen-Modell“. Die unteilbaren, kleinsten Einheiten nannte er „Atome“.
Vielleicht fragt ihr euch jetzt: Na ja klar, wie sollte es denn auch sonst sein?
Tatsächlich gab es noch eine andere Vorstellung: Das „Kontinuums-Modell“. In diesem Modell nahm man an, dass Materie beliebig teilbar ist, ähnlich wie Knetmasse. Nach dieser Vorstellung gibt es keine kleinsten Teilchen, die sich nicht teilen lassen. Jede noch so kleine Stoff-Portion könnte man immer noch weiter teilen.
Schaut das folgende youtube-Video von der vielfach ausgezeichneten Wissenschafts-Journalisten Mai Thi Nguyen-Kim:
In dem Video werden drei Phänomene beschrieben, die wir mit unseren Sinnen wahrnehmen können und die sich mit dem „Teilchen-Modell“ gut erklären lassen. Eure Aufgabe soll es sein, nach dem Video zu überlegen, ob sich die genannten Phänomene auch mit dem Kontinuums-Modell erklären lassen würden.
- Legt Stift und Papier bereit!
- Startet das Video (Dauer: 4:35)!
- Nach dem Video: Fasst zunächst stichpunktartig zusammen, wie die genannten Effekte mit Hilfe des „Teilchen-Modells“ erklärt werden! (Klickt bitte erst auf "Lösung", wenn ihr wirkliche die Aufgabe erledigt habt)
Aggregatszustände:
Zwischen den Teilchen gibt es Anziehungskräfte. Wärme führt dazu, dass sich die Teilchen schneller bewegen, sie schwingen schneller hin- und her. Das erklärt warum bei tiefen Temperaturen die Teilchen eng aneinander "kleben" und ihre Form nicht ändern (ein würfelförmiger Pflasterstein bleibt immer würfelförmig, auch wenn man ihn in ein rundes Gefäß wirft).
Das Modell erklärt auch gut, warum sich eine Flüssigkeit beim Verdampfen so stark ausdehnt: Die Teilchen flitzen nun recht schnell durch die Gegend, und haben einen großen Abstand zueinander.
Wärmeleitfähigkeit:
Bei Stoffen, die sich berühren, stoßen die Teilchen des einen Stoffes an die Teilchen des anderen Stoffes. So werden Schwingungen an benachbarte Gegenstände oder Stoffe weitergegeben. Das erklärt dann auch, warum eine Tasse nach kurzer Zeit heiß wird, wenn man sie mit kochendem Wasser füllt.
Diffusion:
Nachdem Teilchen immer in Bewegung sind (außer am absoluten Nullpunkt), mischen sich zwei nebeneinander vorkommende Stoffe von ganz alleine (das ist nicht ganz korrekt, es kommt schon auch etwas auf die Stoffe an).
Wenn man lange genug warten würde, müsste man z.B. eine Tasse Tee gar nicht umrühren, nachdem man Zucker hinzu gegeben hat. Schon nach wenigen Stunden hätte sich der Zucker von ganz alleine im Tee gleichmäßig verteilt.
Das war ein Witz! Der Tee wäre dann ja eiskalt...
- Überlegt jetzt für alle drei Effekte einzeln, ob auch das „Kontinuums-Modell“ die Beobachtungen erklären könnte! (Klickt erst auf den entsprechenden Begriff, wenn ihr wirklich darüber nachgedacht habt.)
Vor allem die Volumenzunahme beim Verdampfen einer Flüssigkeit wäre mit dem Kontinuums-Modell schwierig zu erklären.
Die Vorstellung von "schwingender Knetmasse" ist eher schwierig. Hier ist das Teilchenmodell wirklich besser: Ihr kennt sicher diese Kugelpendel: Man kann eine Kugel auslenken und loslassen, dann stößt sie an die anderen und gibt so ihre Energie weiter. Das ist einfach einzusehen. Mit Knetmasse würde so etwas nicht funktionieren.
Hier sehe ich eher keine Probleme. Auch mit dem Kontinuums-Modell könnte man sich vorstellen, dass sich unterschiedliche Stoffe nach und nach vermischen.
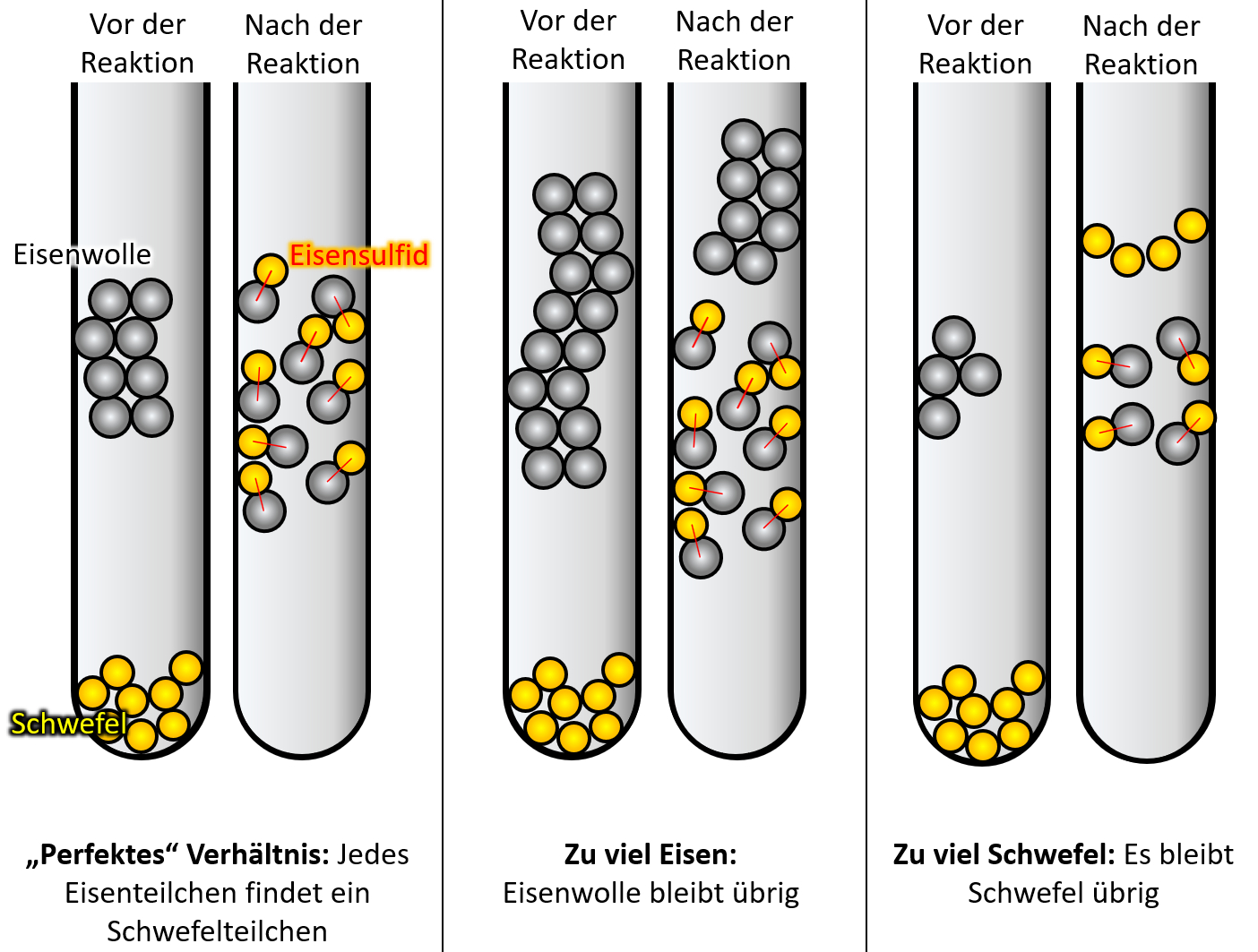
Wenn ihr ganz ehrlich zu euch seid, dann könnte es sein, dass der ein oder andere jetzt noch zweifelt. Sooo wahnsinnig überzeugend ist dieses Teilchen-Modell bis jetzt noch nicht. Der folgende Versuch sollte aber die letzten Zweifel ausräumen. Schlagt euer Buch auf der S. 37 auf. Die Abbildung 3 zeigt einen Versuch, der dreimal mit unterschiedlichen Ausgangsbedingungen durchgeführt wurde: In allen drei Fällen wurde Eisenwolle mit Schwefel in einem Reagenzglas zur Reaktion gebracht. Die Menge an Schwefel war immer gleich, allerdings wurde ist die Menge der Eisenwolle jedesmal anders. In allen drei Fällen entsteht bei der Reaktion ein neuer Reinstoff: Eisensulfid.
Leider ist das Ergebnis auf dem Bild im Buch nicht so schön zu erkennen, deswegen hier noch einmal eine schematische Darstellung:
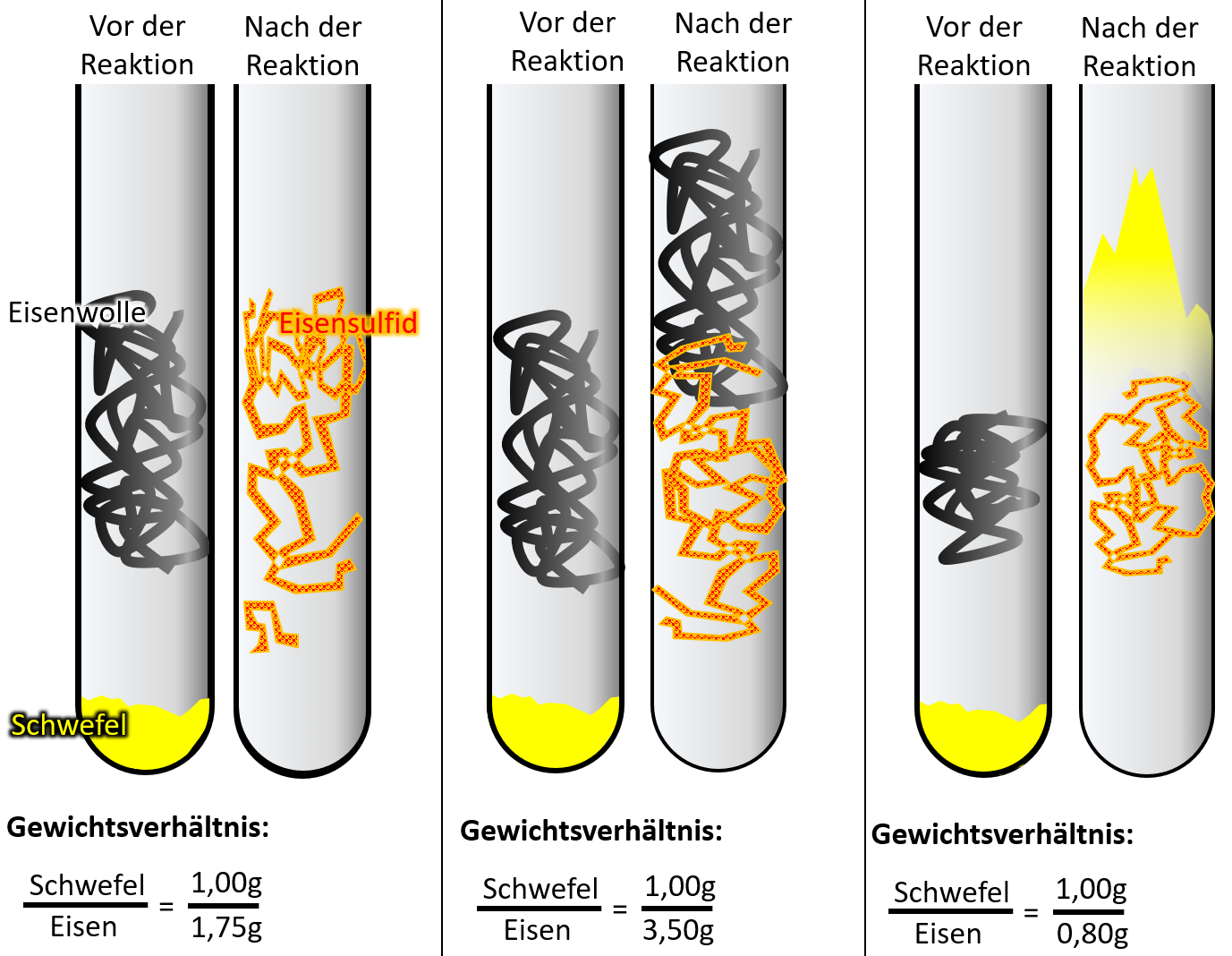
- Beschreibt zunächst kurz das Ergebnis!
- Im ersten Versuch reagiert der gesamte Schwefel mit der gesamten Eisenwolle vollständig zu Eisensulfid.
- Im zweiten Versucht bleibt Eisenwolle übrig.
- Im dritten Versucht bleibt Schwefel übrig.
- Warum ergibt dieses Ergebnis nur Sinn, wenn man annimmt, dass Materie aus kleinsten Teilchen besteht?
- Was müsste man beobachten können, wenn Materie nach dem Kontinuums-Modell aufgebaut wäre, also so etwas wie Knetmasse wäre?
- Versucht Antworten auf diese Fragen zu finden!
Wenn Materie (hier also Eisen und Schwefel) ähnlich wie Knetmasse aufgebaut wären, müsste man jedes beliebige Verhältnis miteinander reagieren lassen können. Nehmen wir an Eisen wäre rote Knetmasse und Schwefel gelbe Knetmassen. Dann müsste es völlig egal sein, wie viel rote Knetmasse ich mit gelber Knetmasse "reagieren lasse" (also durchkneten, bis ein einheitliches Produkt heraus komme. Es sollte immer irgendwas orangefarbenes rauskommen. Mal vielleicht ein bisschen heller, mal ein bisschen dunkler.
Das beobachtet man hier aber nicht!
Nur wenn man ein ganz bestimmtes Verhältnis von Eisen und Schwefel verwendet, reagieren beide Stoffe vollständig miteinander. Ansonsten bleibt einer der Stoffe übrig. Mit dem Teilchen-Modell ergibt die Beobachtung aber hervorragenden Sinn! Denn wenn ein Eisenteilchen immer genau ein Schwefelteilchen als Reaktionspartner benötigt, dann finden nur bei einem bestimmten Verhältnis alle Teilchen ihren Partner. Andernfalls bleiben Teilchen übrig.
Stelle die Situation in den 6 Reagenzgläsern von oben zeichnerisch so dar, dass man die einzelnen Eisen- und Schwefelteilchen erkennen kann!
Versuchsprotokolle
Hier gibt es Beispiele für gelungene Versuchsprotokolle
- Erstes Beispiel: "Trennung eines Salz-Sand-Gemisches": Hier klicken