Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
Zu den Arbeitsaufträgen (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Arbeitsauftrag Chemie2 (verpflichtend)
Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Die Atombindung (auch: kovalente Bindung)
Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen.
Zum Einstieg vielleicht eine kleine Wiederholung (ca. 5 Min.):
- Notiere, was "Valenzelektronen" sind!
Das sind die Elektronen, die sich bei Atomen eines bestimmten Elements auf der äußersten Schale befinden.
- Bestimme die Anzahl der Valenzelektronen (VE) der Atome folgender Elemente mit Hilfe des PSE: Calcium, Lithium, Iod!
Ca: 2 VE, Li: 1 VE, I: 7 VE
- Erkläre, wie Du diese Anzahl bestimmt hast!
Die Anzahl der VE entspricht der Hauptgruppen-Nr. im PSE.
- Bestimme die chemische Formel des Salzes Berylliumbromid!
Beryllium besitzt 2 VE. Um Edelgaskonfiguration zu erreichen, muss es diese beiden abgeben. Es entstehen Be2+-Ionen. Brom besitzt 7 VE. Um Edelgaskonfiguration zu erreichen muss es ein Elektron aufnehmen. Es entstehen Br--Ionen. Damit ein neutrales (nicht geladenes) Salz entsteht und keine Elektronen verloren gehen oder übrig bleiben, müssen immer zwei Bromid-Atome mit einem Beryllium-Atom reagieren. Die Formel des entstehenden Salzes lautet dann BeBr2
Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): Hier klicken
Testet, ob ihr die Inhalte des Videos wiedergeben könnt.
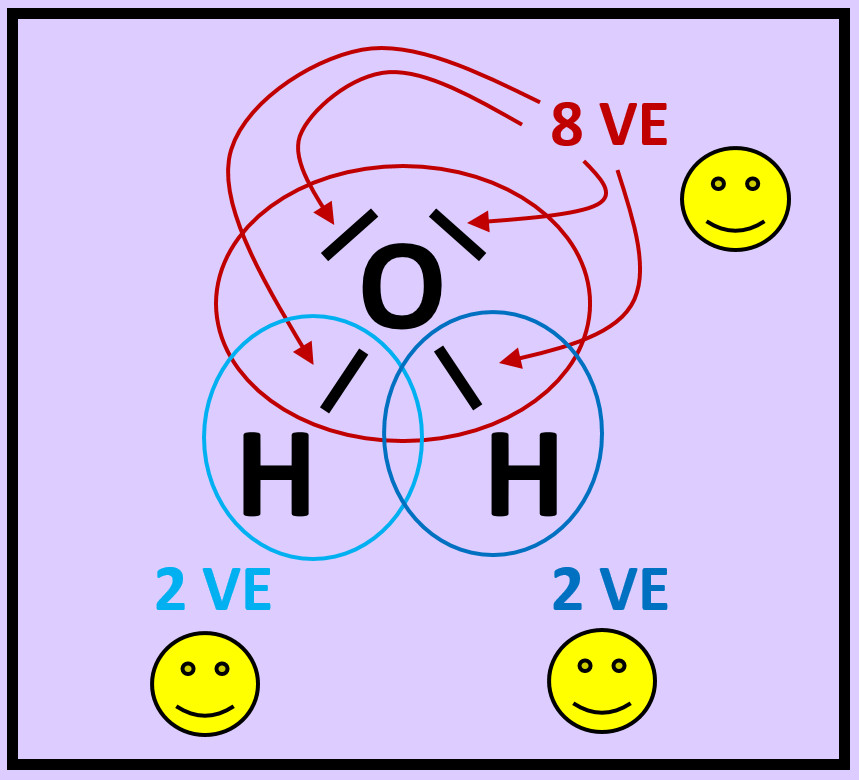
- Das folgende Bild zeigt die Valenzstrichformel des Wassermoleküls. Was bedeuten die mit unterschiedlichen Ziffern markierten Striche?
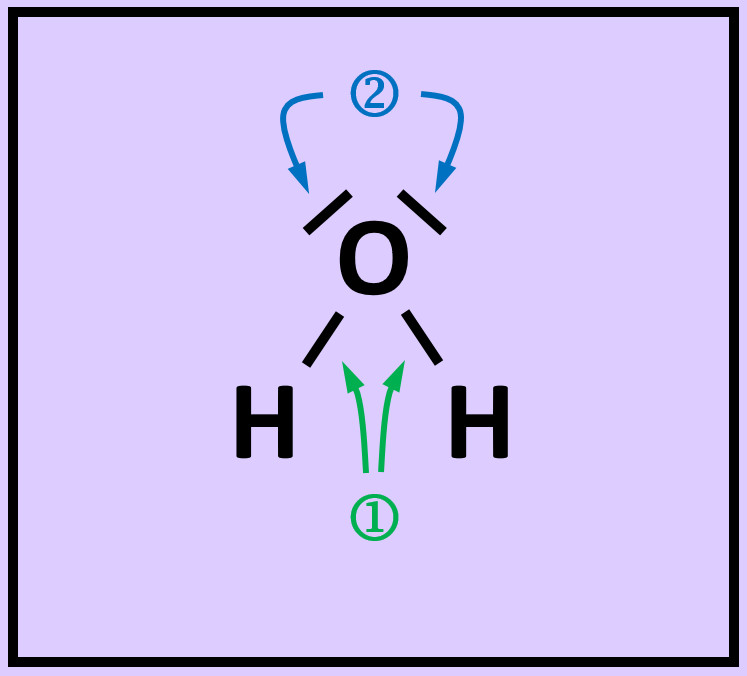
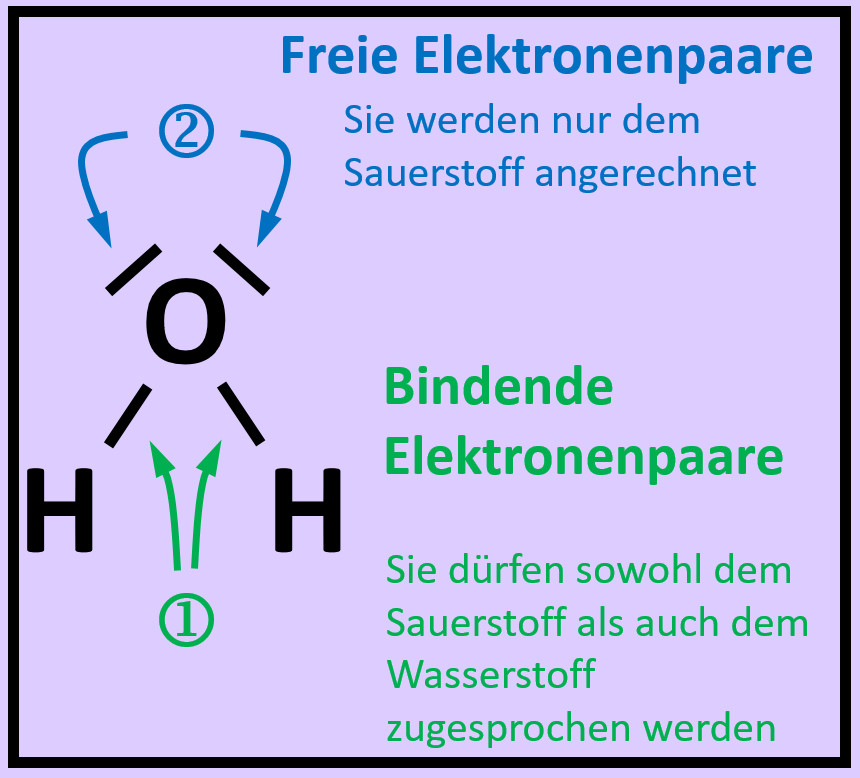
Freie Elektronenpaare stammen nur von dem Atom, das sie umgeben. Bei den bindenden Elektronenpaaren stammt ein Elektron vom einen Partner (hier: Sauerstoff) und das andere Elektron vom anderen Partner (hier: Wasserstoff)
- Zeichnet das Wassermolekül ab. Kreist nun jedes Atom ein. Achtet dabei darauf, dass im Kreis alle Elektronen (freie Elektronenpaare und bindende Elektronenpaare) enthalten sind, die dem Atom zugerechnet werden können!
- Zählt nun die Elektronen, die ihr jedem Atom zugeordnet habt!
- Entscheidet, ob durch diese Anordnung Edelgaskonfiguration erreicht wurde!
- Warum kann man beim Wasserstoff von Edelgaskonfiguration sprechen, obwohl ihm nur zwei Elektronen zugesprochen werden?
Die beiden Elektronen sitzen auf der innersten Schale, der K-Schale. Damit ist diese voll besetzt. Dies entspricht der Konfiguration von Helium und damit einem Edelgas.
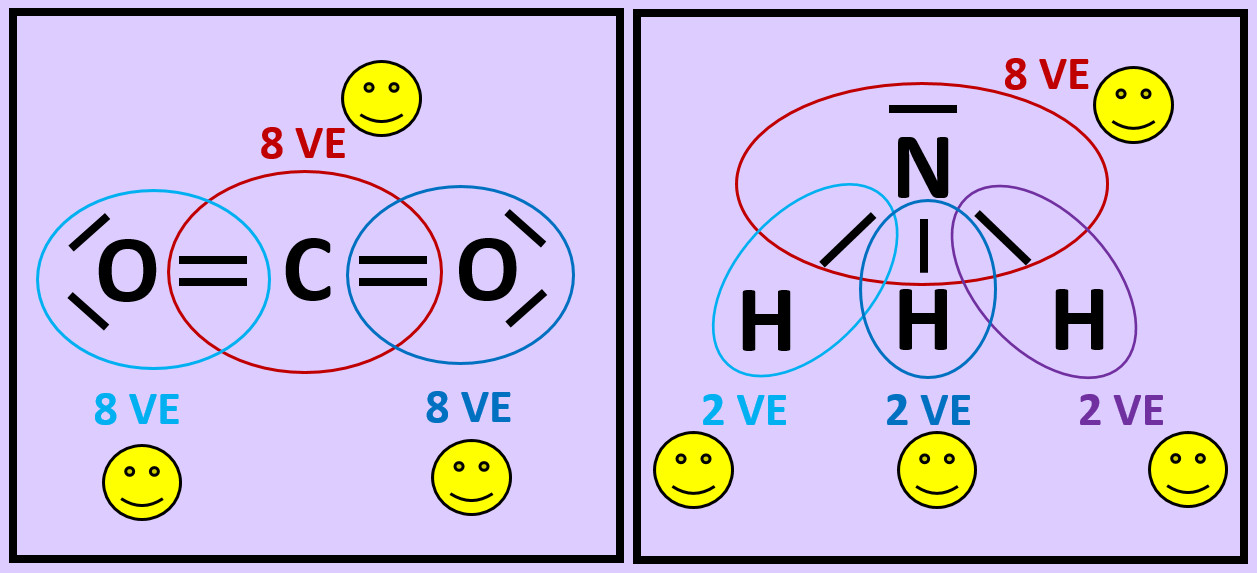
- Wiederholt die vorangegangenen Schritte (Einkreisen der Atome; Zählen der Elektronen; Entscheiden, ob Edelgaskonfiguration vorliegt) für die Moleküle "Kohlenstoffdioxid" (CO2) und "Ammoniak" (NH3)
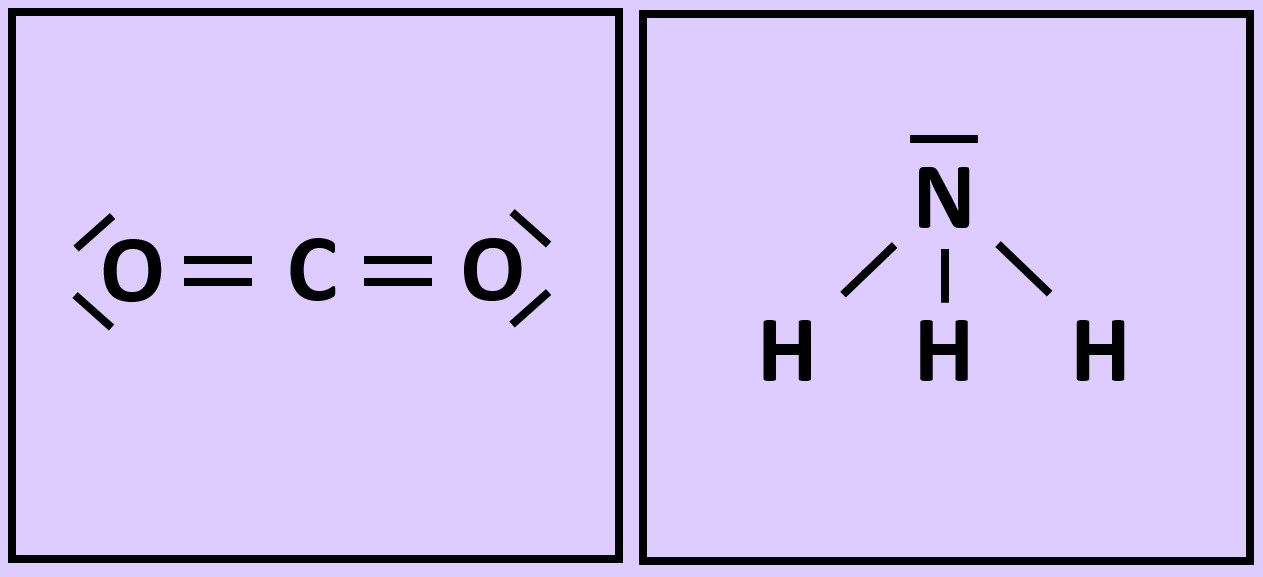
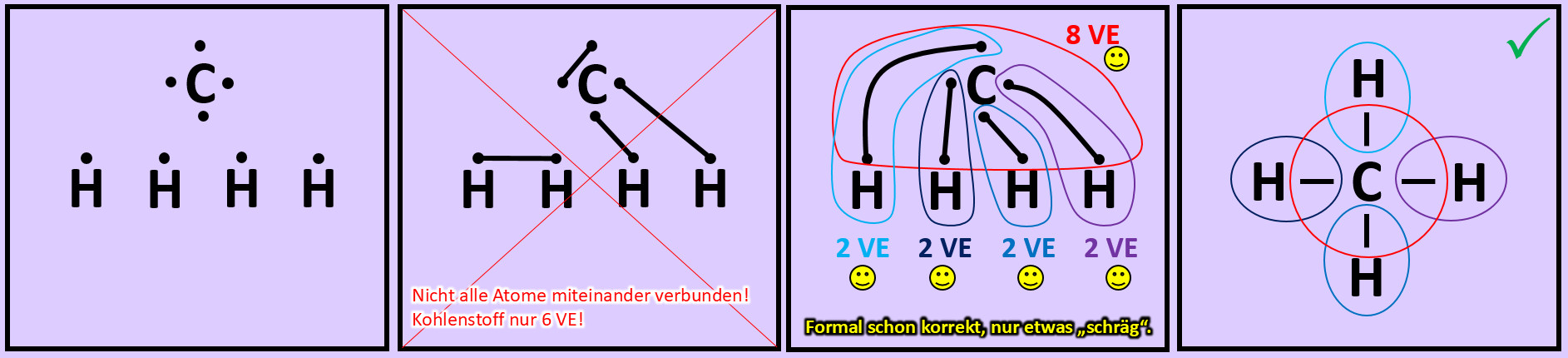
Versucht nun mit Hilfe der Valenzstrichformel selbst ein Molekül zu zeichnen, das ihr noch nicht im Video gesehen habt: "Methan" (CH4). Geht wie folgt vor:
- Zeichnet die Elementsymbole aller fünf Atome auf das Papier. Tipp: Wählt eine möglichst symmetrische Anordnung.
- Zeichnet nun um jeden Atom die richtige Anzahl an Valenzelektronen.
- Versucht nun die Punkte so zu verbinden, dass alle Atome miteinander zusammenhängen und gleichzeitig Edelgaskonfiguration erreicht wird.
- Hinweis: Wenn man die zwei Valenzelektronen von zwei Wasserstoffen miteinander verbindet, dann besitzen zwar diese beiden Edelgaskonfiguration können aber keine weitere Bindung mehr eingehen. Sie können dann mit den restlichen Atomen nicht mehr verknüpft werden. Man muss also nach einer anderen Lösung suchen...
In eurem Buch ist auf der Seite 113 ist ein Verfahren beschrieben, mit dem man die Valenzstrichformeln "berechnen" kann. Ihr dürft das in Zukunft gerne so durchführen. Wenn man etwas übt, dann klappt es aber nach einiger Zeit auch ohne dieses Verfahren. Lest dieses Verfahren jetzt noch nicht, sondern erst als Hausaufgabe.
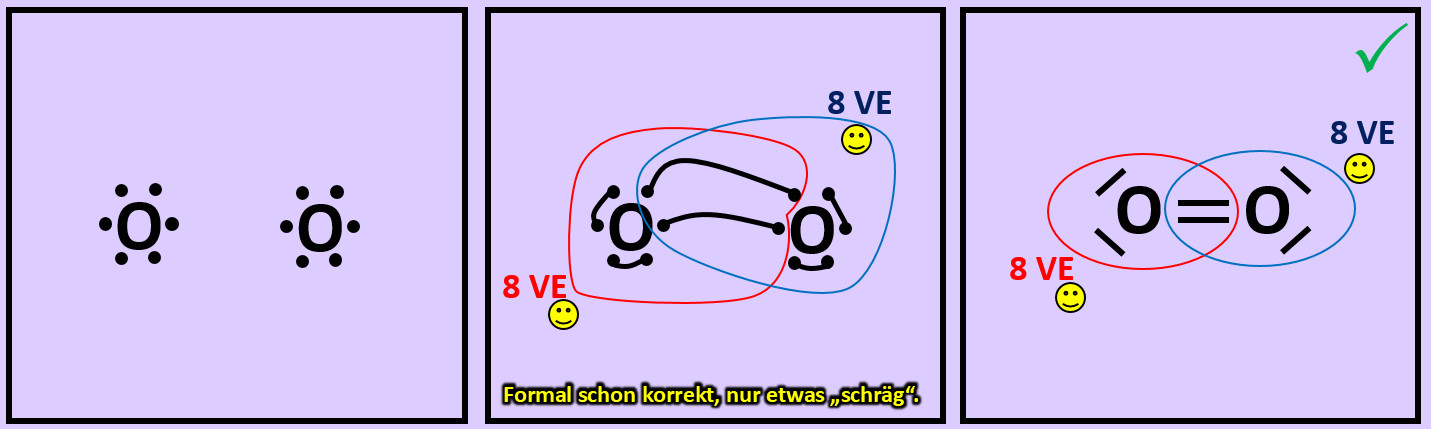
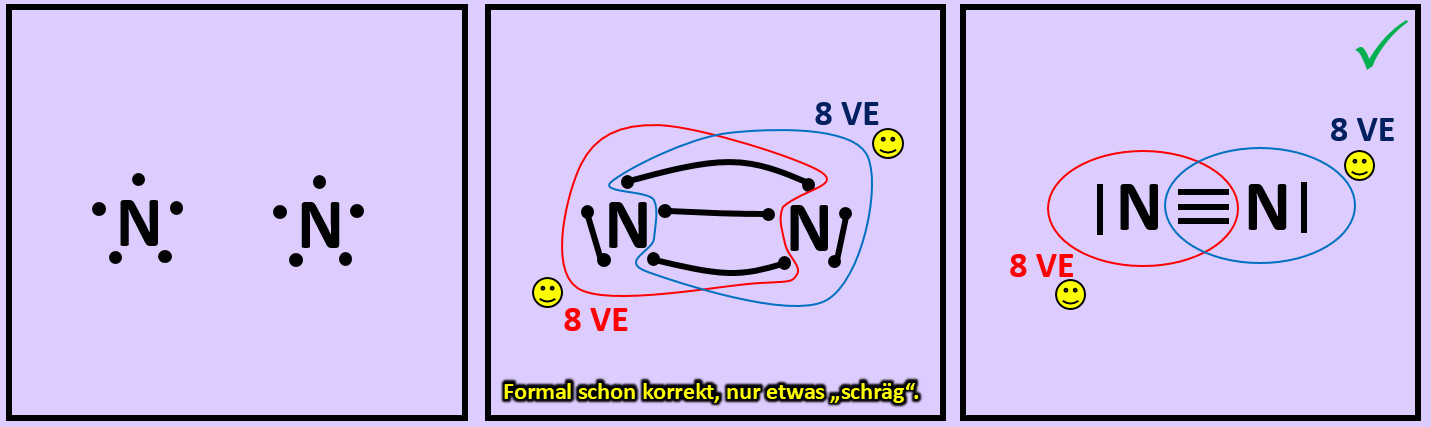
- Versucht erst noch zwei weitere Moleküle mit Hilfe der Valenzstrichformeln darzustellen: "Sauerstoff" (O2) und "Stickstoff" (N2)
- Beim Sauerstoffmolekül sind an der Bindung zwischen den beiden Atomen zwei Elektronenpaare, beim Stickstoffmolekül drei beteiligt. Diese Formen von Bindungen haben eigene Namen. Wie nennt man diese Bindungen?
Beim Sauerstoffmolekül: Doppelbindung, beim Stickstoffmolekül: Dreifachbindung.
Hausaufgabe: Lest im Buch folgende Abschnitte: S. 107 "Das Konzept der Elektronenpaarbindung", S. 108 komplett, S. 109 "Die Molekülformel". (Hinweis: Der Begriff "stöchiometrische Wertigkeit" spielt im meinen Unterricht keine große Rolle.) Bearbeitet die Aufgaben 1 + 3 auf S. 107 und stellt die Valenzstrichformel für Wasserstoffperoxid (H2O2) auf (schwierig).
Bitte macht die Hausaufgabe nicht jetzt sofort, sondern am besten erst morgen. Die Lösung wird am Mittwoch eingestellt.
Error: h5p.org is not an authorized iframe site.<script src="https://h5p.org/sites/all/modules/h5p/library/js/h5p-resizer.js" charset="UTF-8"></script>
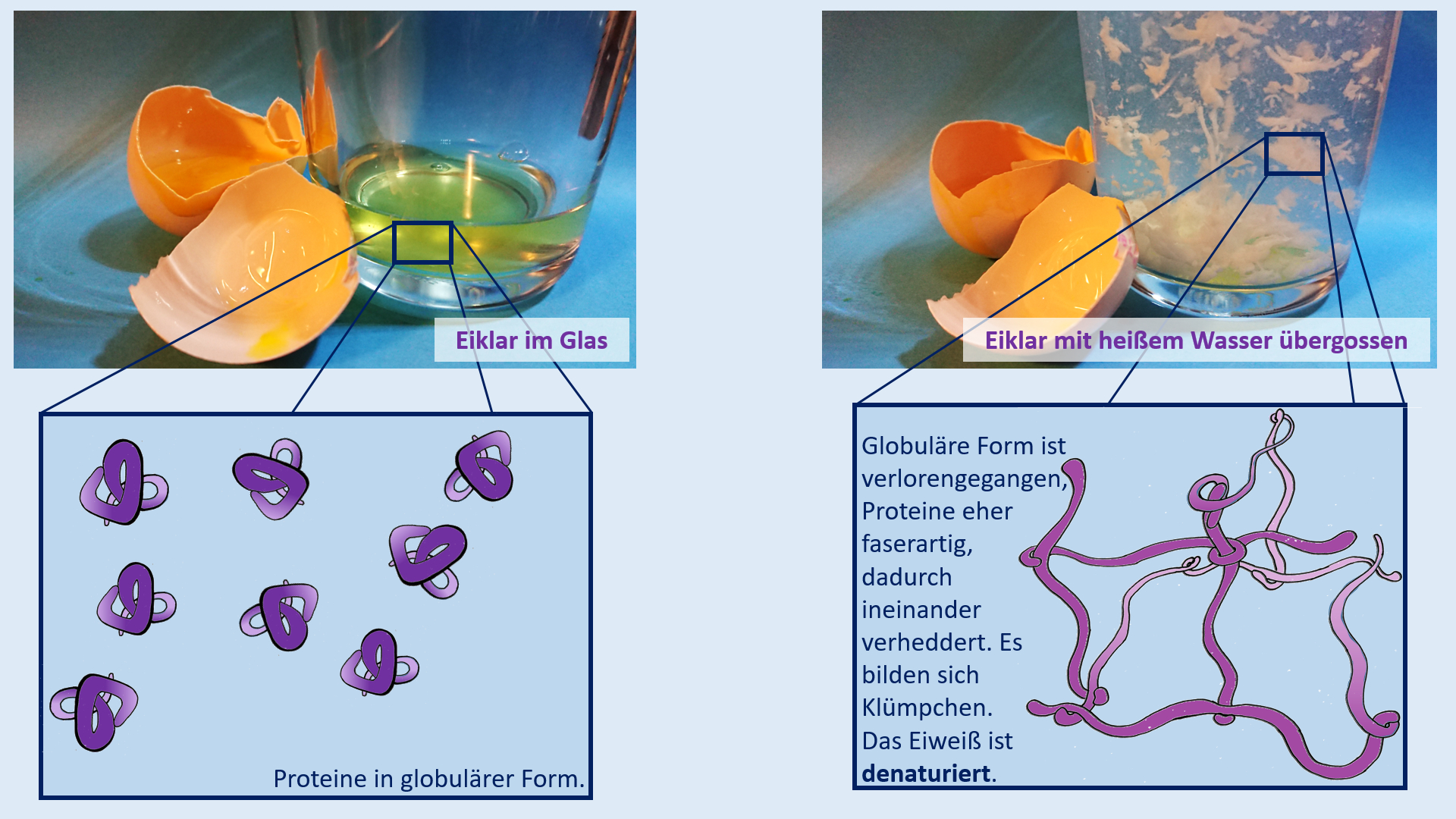
Test. Einheit: Eiweiße
Test Schulentwicklungsteam
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
|
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Biologie
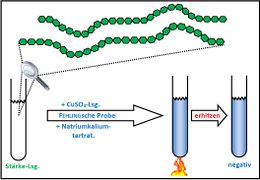
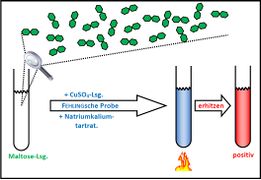
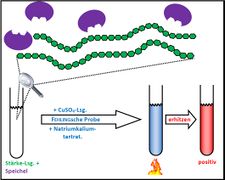
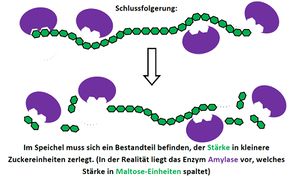
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
Fehling-Probe mit Maltose
Fehling-Probe mit Stärke und Speichel
Chemie
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
Trennung eines Gemisches aus Sand und Salz
neue Überschrift
Termine
- 15.10.: angekündigter, kleiner Leistungsnachweis
- Lernstoff: Unterrichtsinhalte vom Freitag, 11.10.
|
Externe Links
- im Moment keine externen links -
|
Termine
- 15.10.: angekündigter, kleiner Leistungsnachweis
- Lernstoff: Unterrichtsinhalte vom Freitag, 11.10.
|
Externe Links
- - im Moment keine links -
|
Hefteinträge
1. Evolution
1.1 Ein kurzer historischer Abriss zur Entwicklung des Evolutionsgedankens
Neu, 04.10. Buch S. 17, 28-31 (das Buch ist hier sehr ausführlich) + Hefteintrag:
1.4 Darwins Evolutionstheorie +
Stoff aus der 11. Klasse
Eine Übersicht über wichtige Inhalte des Kapitels "Populationswachstum und Biodiversität" aus der 11. Jahrgangsstufe liefern die folgenden Einträge: