Benutzer:Thomas Lux/Test Oberstufe
Distanzunterricht Mittwoch, 13.01.
Mit dem folgenden Video möchte ich eine neue Stoffgruppe einführen. Das Video dauert 15min. Die fachlichen Inhalte findet ihr auch auf den Seiten 80 und 82 im Buch.
Nachdem ihr entweder das Video geschaut oder das Buch gelesen habt (oder beides), solltet ihr die folgenden Aufgaben lösen können. Am nächsten Dienstag findet wieder eine Videokonferenz statt, am Anfang werde ich überprüfen, ob ihr ähnliche Aufgaben tatsächlich lösen könnt!
Aufgaben:
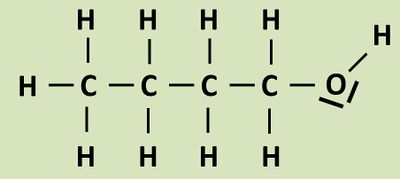
- Zeichne die Valenzstrichformel von Butan-1-ol!
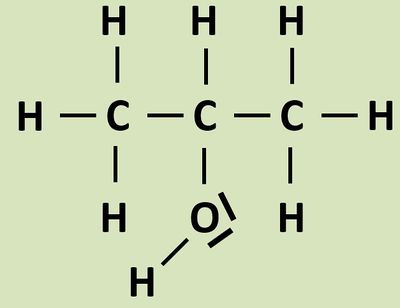
- Benennen das folgende Molekül!
Propan-2-ol
- Nenne alle bei Ethanol-Molekülen auftretenden "zwischenmolekularen Kräfte" und ordne sie nach ihrer Stärke!
- Die stärksten "zwischenmolekularen Kräfte" wären hier: Wasserstoffbrückenbindungen.
Sie können sich ausbilden zwischen Wasserstoffen, die an ein stark elektronegatives Element gebunden sind (ist hier der Fall: Das H-Atom der Hydroxgruppe) und freien Elektronenpaaren eines stark elektronegativen Elements der 2. Periode (ist hier der Fall: Das O-Atom der Hdroxgruppe hat freie Elektronenpaare und ist stark elektronegativ)
- Die zweitstärksten "zwischenmolekularen Kräfte" wären hier: Die Kräfte zwischen den permanenten Dipolen.
- Dann gibt eine Kraft, die aufritt, wenn ein permanenter Dipol in benachbarten Molekülen einen Dipol induziert.
- Die schwächsten Kräfte sind die van-der-Waals-Kraft im engeren Sinne: Durch Fluktuationen in der Elektronenhülle entstehen spontane Dipole, die im Nachbarmolekül ebenfalls kleine Dipole induzieren können.
Lasst euch das, was wir gestern (Montag) besprochen haben noch einmal kurz durch den Kopf gehen. Ihr könnt dazu auf dieser Seite etwas nach unten scrollen und die Fragen überfliegen, die im letzten Arbeitsauftrag behandelt wurden.
Wie würdet ihr in höchstens drei Sätzen zusammenfassen, was ihr aus dieser letzten Einheit mitgenommen habt?
Möglich wäre z.B.:
- Ein Schokokuchen ist schon was leckeres...
- Auf "Vogelhäuschen selber bauen" hätte ich ja gar keinen Bock. Da kauf ich lieber eins.
- Eine Tonne Äpfel auf einem Anhänger??? Auf den Anhänger von meinem Onkel passen 16 Tonnen!
O.k., das könnten zwar auch Dinge gewesen sein, die euch durch den Kopf gegangen sind, aber jetzt mal in Bezug auf Chemie!
Möglich wäre z.B.:
- In chemischen Gleichungen spielt die Anzahl von Teilchen (Atomen, Molekülen, Salzeinheiten) eine Rolle
- Leider kann man solche Teilchen aber nicht abzählen
- Man müsste die Masse von diesen Teilchen wissen, damit man etwas damit anfangen kann
Ihr sollt heute einen kleinen Versuch durchführen, mit dem man die Masse von kleinen Teilchen ziemlich genau bestimmen kann, auch wenn man sie nicht direkt wiegt. Mit einzelnen Atomen oder Molekülen könnt ihr natürlich nicht arbeiten, daher nehmen wir andere "kleine Teilchen". Ihr benötigt also:
- Entweder Reiskörner oder trockene Erbsen oder trockene Linsen oder sonst irgendetwas kleines (Reißnägel, Büroklammern etc.)
- Eine Küchenwaage
- Geduld
Die Objekte, die ihr euch aussucht, sollten so klein (und leicht) sein, dass eine Küchenwaage "nichts" anzeigt, wenn man eins dieser Objekte darauf legt. Zählt jetzt so viele Teilchen ab (z.B. 100, evtl. aber auch 1000), dass eure Küchenwaage einen "vernünftigen Wert" anzeigt, ich würde empfehlen so um die 10 Gramm.
Ihr könnt auch umgekehrt vorgehen: Wiegt exakt 10,0g ab und bestimmt dann die in dieser Menge enthaltene Anzahl an Objekten.
Berechnet aus diesen beiden Werten (Anzahl und Gewicht) das Gewicht eines Teilchens. Recherchiert dann im Internet ob ihr einen Wert findet, der euer Ergebnis bestätigt (oder auch widerlegt). Wenn ihr Pflanzenteile genommen habt, dann werdet ihr wahrscheinlich sehr schnell auf Wikipedia fündig. Als Suchtipp kann ich euch auch den Begriff "Tausendkornmasse" empfehlen.
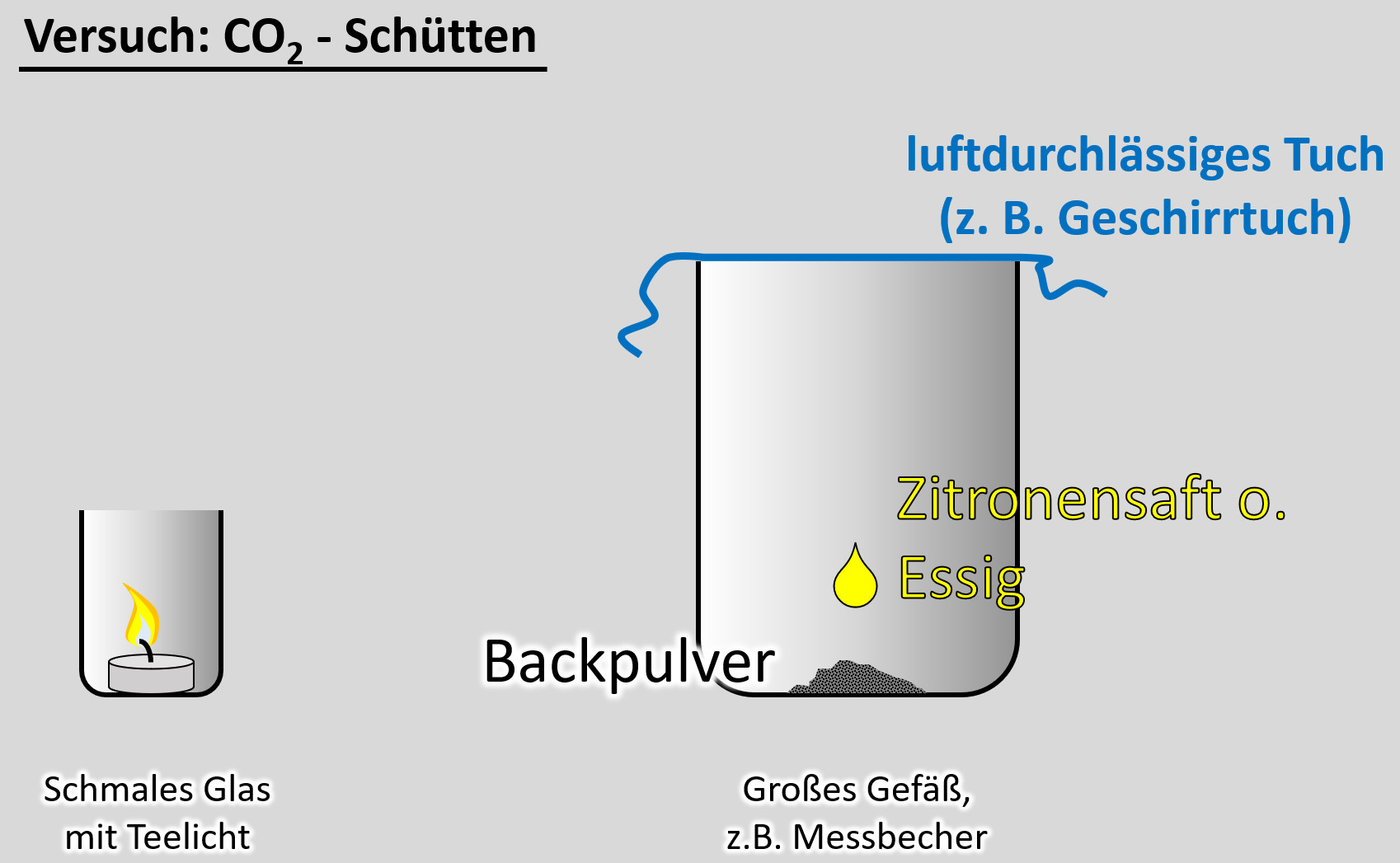
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmale Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.