8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 79: | Zeile 79: | ||
|Inhalt= | |Inhalt= | ||
Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" | Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 408: | Zeile 362: | ||
|Rahmenfarbe= #DFB | |Rahmenfarbe= #DFB | ||
|Hintergrund= #DFB | |Hintergrund= #DFB | ||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wochenaufgabe 1 (20.-24.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut? | |||
* Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
* Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>''' | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid. | |||
{{Lösung versteckt| | |||
* Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht. | |||
* Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup> | |||
* Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>''' | |||
* Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O | |||
* Die chemische Gleichung lautet dann: | |||
4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? | |||
{{Lösung versteckt| | |||
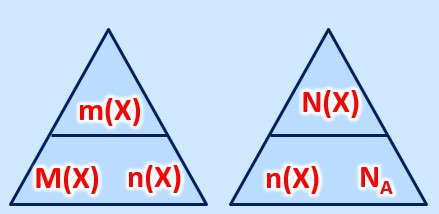
'''gesucht:''' <math>m(K)= ? </math><br> | |||
'''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | }} | ||
Version vom 25. April 2023, 15:11 Uhr
Chemie
aktuelle Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen