8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 41: | Zeile 41: | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
* '''Protonen: 9''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | * '''Protonen: 9''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | ||
* '''Neutronen: 10''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl) | * '''Neutronen: 10''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | ||
* '''Elektronen: 9''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | * '''Elektronen: 9''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | ||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | ||
| Zeile 47: | Zeile 47: | ||
* Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Es soll ein Diamant mit exakt einem Karat betrachtet werden. Das entspricht einer Masse von 0,2 Gramm. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten! | * Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Es soll ein Diamant mit exakt einem Karat betrachtet werden. Das entspricht einer Masse von 0,2 Gramm. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Hier ist die '''Stoffmenge '''gesucht, gegeben ist die '''Masse''' von Kohlenstoff. Die '''Molare Masse''' für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links. | Hier ist die '''Stoffmenge '''gesucht, gegeben ist die '''Masse''' von Kohlenstoff. Die '''Molare Masse''' für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links). | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
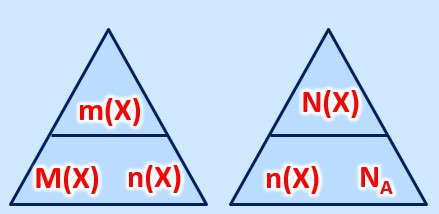
'''gesucht:''' <math>n(C)= ? </math><br> | '''gesucht:''' <math>n(C)= ? </math><br> | ||
| Zeile 55: | Zeile 55: | ||
Einsetzen der Werte in die Formel:<br> | Einsetzen der Werte in die Formel:<br> | ||
<math>n(C)=\frac{m(C)}{M(C)}=\frac{0,2g}{12\frac{g}{mol}}=0,017mol </math> | <math>n(C)=\frac{m(C)}{M(C)}=\frac{0,2g}{12\frac{g}{mol}}=0,017mol </math> | ||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wochenaufgabe 2 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Magnesium-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 12''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 12 oder 13''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 12''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Berechne die Masse einer Portion Wasser, deren Stoffmenge n(H<sub>2</sub>O) = 1,0mol beträgt! (Man könnte auch einfacher fragen: Wie viel Gramm wiegt 1 Mol Wasser?) | |||
{{Lösung versteckt| | |||
Hier ist die '''Masse'''gesucht, gegeben ist die '''Stoffmenge''' von Wasser. Die '''Molare Masse''' für Moleküle wie H<sub>2</sub>O kann durch Addition der am Aufbau beteiligten Atome direkt aus dem PSE abgeleitet werden. | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(H_{2}O)= ? </math><br> | |||
'''gegeben:''' <math>n(H_{2}O)= 1,0mol </math>, <math>M(H_{2}O)= 2 \cdot M(H) + M(O) = 18,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(H_{2}O) = M(H_{2}O) \cdot n(H_{2}O) = 18,0 \frac{g}{mol} \cdot 1,0mol = 18,0g</math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |Alles klar, zeig mir die Lösung|Lösung ausblenden}} | ||
|Tipps|Lösung ausblenden}} | |Tipps|Lösung ausblenden}} | ||
Version vom 26. Februar 2023, 09:42 Uhr
Chemie
Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen