Benutzer:Thomas Lux: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(Beginn mit Arbeit an A3) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
__NOTOC__ | __NOTOC__ | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie3 (verpflichtend) '''</span> | |||
|Inhalt= | |||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel und einen Stift. Und Ruhe. Voraussetzung für die Bearbeitung ist, dass ihr Arbeitsauftrag '''Chemie2''' erledigt habt (vom Mo, 23.03.). Am Ende erhaltet ihr einen Hefteintrag sowohl für die Einheit Chemie2 als auch Chemie3. Den könnt ihr abschreiben (bitte nur im Notfall) oder ausdrucken und einkleben.</span><br> | |||
<span style="color:#607">'''Bitte klickt erst auf "Lösung", wenn ihr die Aufgabe wirklich versucht habt zu lösen.'''</span><br> | |||
<br | |||
'''Verbesserung der Hausaufgabe'''<br> | |||
* Buch S. 107, A1 | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A1.jpg]]<br> | |||
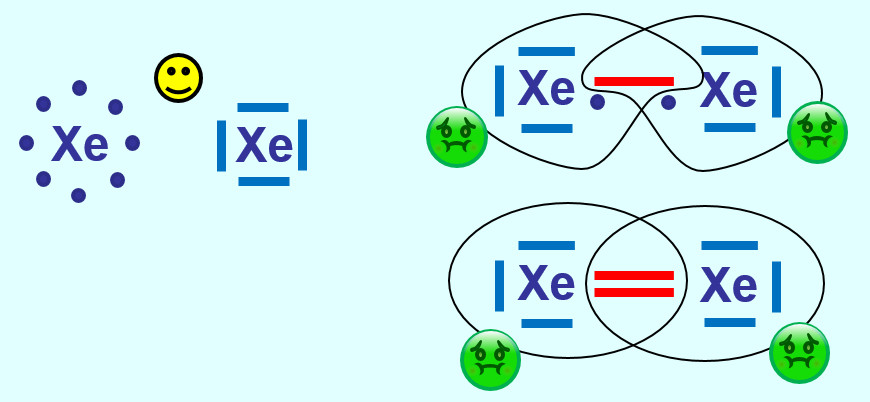
Xenon hat bereit Edelgaskonfiguration (8 VE auf der äußersten Schale). Durch eine (oder mehr) Atombindung(en) mit einem weiteren Xenon-Atom würde dieser energiearme Zustand zerstört werden. Alle Edelgase kommen als einatomige Gase vor, im Gegensatz zu den anderen elementaren Gasen (wie z.B. Sauerstoff, Stickstoff, Wasserstoff...) | |||
|Hausaufgabe 1|Lösung ausblenden}} | |||
* Buch S. 107, A3 | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_S107_A3.jpg]]<br> | |||
Ein Natrium-Atom könnte mit dem '''einen Valenzelektron''' lediglich '''eine Atombindung''' aufbauen. Dadurch käme eine Konfiguration zustanden, bei der dem Atom zwei Elektronen zugeordnet werden können. Das ist weit entfernt von einer Edelgaskonfiguration un daher auch nicht stabil. | |||
|Hausaufgabe 2|Lösung ausblenden}} | |||
<sub>Tiefstellen</sub> | |||
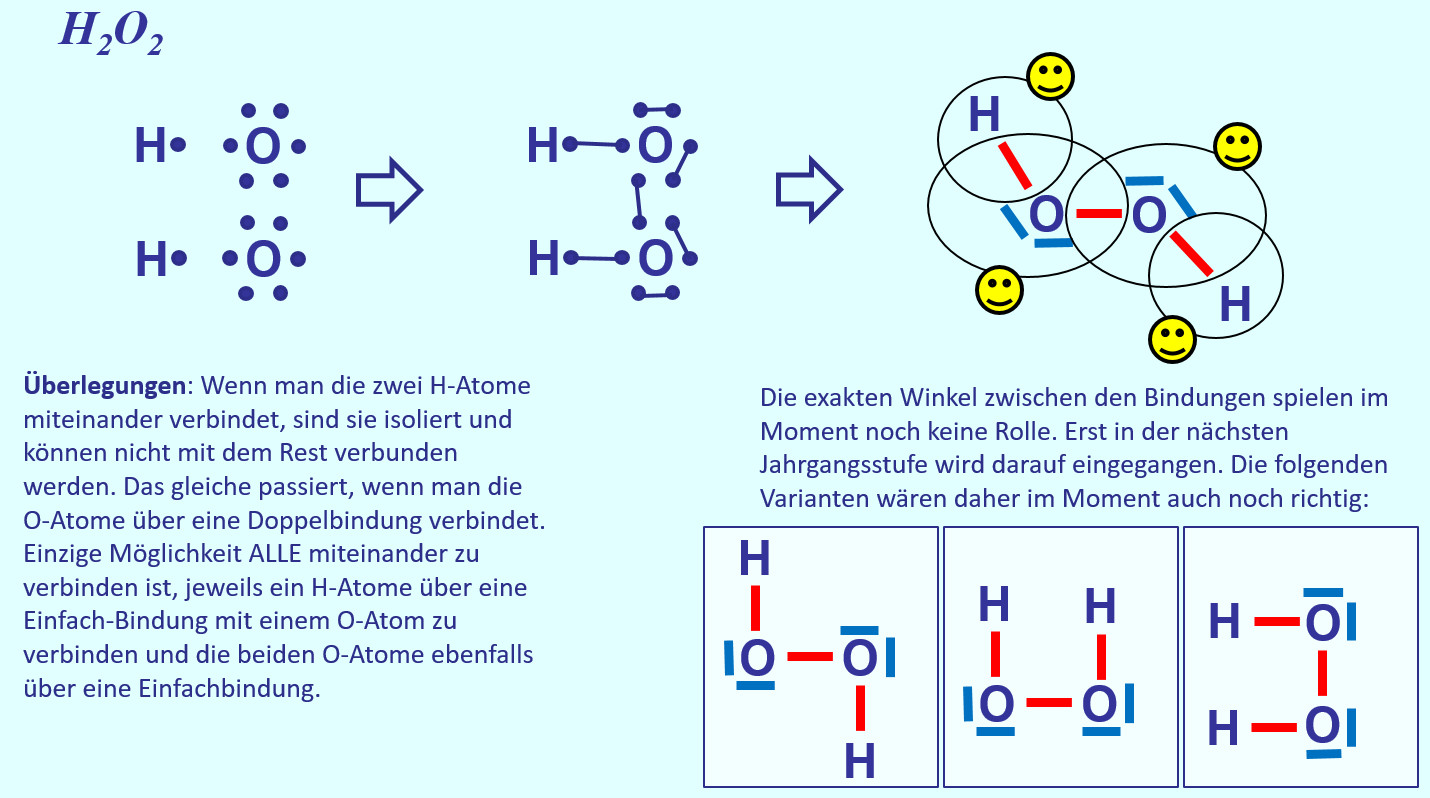
* Zeichne die Valenzstrichformel für Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) | |||
{{Lösung versteckt| | |||
[[Datei:A2_HA_H2O2.jpg]]<br> | |||
|Hausaufgabe 3|Lösung ausblenden}} | |||
Neu: '''Unterschiede zwischen Salzen und Molekülen''' <br> | |||
Bevor wir uns einige Spezialfälle beim Aufstellen von Valenzstrichformeln anschauen, soll hier zunächst noch einmal der Unterschied zwischen Salzen und Molekülen etwas genauer beleuchtet werden: Die chemischen Formeln '''CaF<sub>2</sub>''' und CO<sub>2</sub> sehen sich auf den ersten Blick recht ähnlich: Beide enthalten drei Atome, eines davon kommt doppelt vor. Auf Teilchen-Ebene betrachtet bedeuten sie jedoch etwas völlig anderes. <br> | |||
<br> | |||
'''Zunächst zum Calciumfluorid (CaF<sub>2</sub>)''': Es gibt kein einzelnes CaF<sub>2</sub>-Teilchen. CaF<sub>2</sub> ist ein Salz und besteht aus sehr vielen Ca<sup>2+</sup>- und sehr vielen F<sup>-</sup>-Ionen. Alle ziehen aufgrund der unterschiedlichen Ladungen an ihren entgegen gesetzt geladenen Nachbarn, in alle Richtungen. Es entstehen riesige Gebilde, die Salzkristalle. Insgesamt ist das Verhältnis der vorliegenden Ionen in einem solchen Salzkristall aber immer 1 : 2. Nur so können sich die Ladungen exakt neutralisieren und es entsteht ein ungeladener Stoff (wären Salze geladen, würde man z.B. beim Berühren eine elektrischen Schlag bekommen). Das folgende Bild zeigt den Ausschnitt aus einem CaF<sub>2</sub>-Kristall. Weiß dargestellt sind die Ca<sup>2+</sup>-Ionen, die F<sup>-</sup>-Ionen grün. Man kann erkennen, dass Calcium-Ionen jeweils von acht Fluorid-Ionen als direkte Nachbarn umgeben sind (der graue Würfel links in der Abbildung), während Fluorid-Ionen jeweils nur von vier Calcium-Ionen als direkte Nachbarn umgeben sind (die graue pyramidenähnliche Figur rechts in der Abbildung). Pro Fluorid-Ion sind also doppelt so viele Calcium-Ionen vorhanden. | |||
[[Datei:CaF2_polyhedra.png|300px]]<br> | |||
<br> | |||
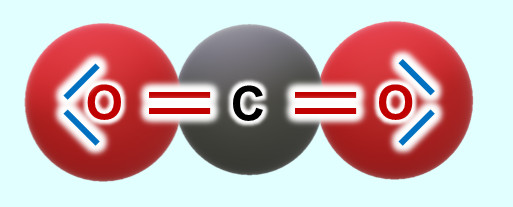
'''Nun zum Kohlenstoffdioxid (CO<sub>2</sub>)''': Hier gibt es tatsächlich einzelne CO<sub>2</sub>Teilchen. Jeweils eine Doppelbindung verbindet genau ein Sauerstoffatom mit dem zentralen Kohlenstoffatom. Diese drei Atome bilden eine Einheit, eben das Molekül. Mit anderen Teilchen tritt zunächst keine Wechselwirkung auf (später werden wir sehen, dass dies nicht korrekt ist, für den Moment bleiben wir aber bei dieser Annahme).<br> | |||
[[Datei:A3_CO2_Einzelmolekül.jpg]]<br> | |||
<br> | |||
Woran erkennt man nun, ob ein Salz oder ein Molekül vorliegt? Im Moment ist auch das noch recht einfach: '''Salze '''liegen vor, wenn es sich um eine Verbindung aus '''einem Metall und einem Nichtmetall''' handelt. '''Moleküle '''liegen vor, wenn es sich um eine Verbindung '''aus Nichtmetallen untereinander''' handelt. <br> | |||
* Entscheidet, ob es sich bei den folgenden Verbindungen um ein Salz oder einen molekularen Stoff handelt (Im PSE in eurem Buch auf der letzten Seite kann man erkennen, ob ein Element zu den Metallen oder Nichtmetallen gezählt wird): NO<sub>2</sub>, K<sub>2</sub>O, Al<sub>2</sub>O<sub>3</sub>, N<sub>2</sub>O<sub>3</sub> | |||
{{Lösung versteckt| | |||
* NO<sub>2</sub>: Stickstoff(N) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: NO<sub>2</sub> ist ein '''molekularer Stoff''' | |||
* K<sub>2</sub>O: Kalium (K) ist ein Metall, Sauerstoff (O) ein Nichtmetall, das bedeutet: K<sub>2</sub>O ist ein '''Salz''' | |||
* Al<sub>2</sub>S<sub>3</sub>: Aluminium (Al) ist ein Metall, Schwefel (S) ein Nichtmetall, das bedeutet: Al<sub>2</sub>S<sub>3</sub> ist ein '''Salz''' | |||
* SO<sub>3</sub>: Schwefel (S) und Sauerstoff (O) sind Nichtmetalle, das bedeutet: SO<sub>3</sub> ist ein '''molekularer Stoff''' | |||
|Lösung 1|Lösung ausblenden}} | |||
'''Zurück zu den Valenzstrichformeln für Moleküle:''' <br> | |||
In der letzten Unterrichtseinheit | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen... | Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen... | ||
Version vom 24. März 2020, 08:09 Uhr
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
Zu den Arbeitsaufträgen in Bio (Corona)
Zu den Arbeitsaufträgen Chemie (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Error: h5p.org is not an authorized iframe site.<script src="https://h5p.org/sites/all/modules/h5p/library/js/h5p-resizer.js" charset="UTF-8"></script>
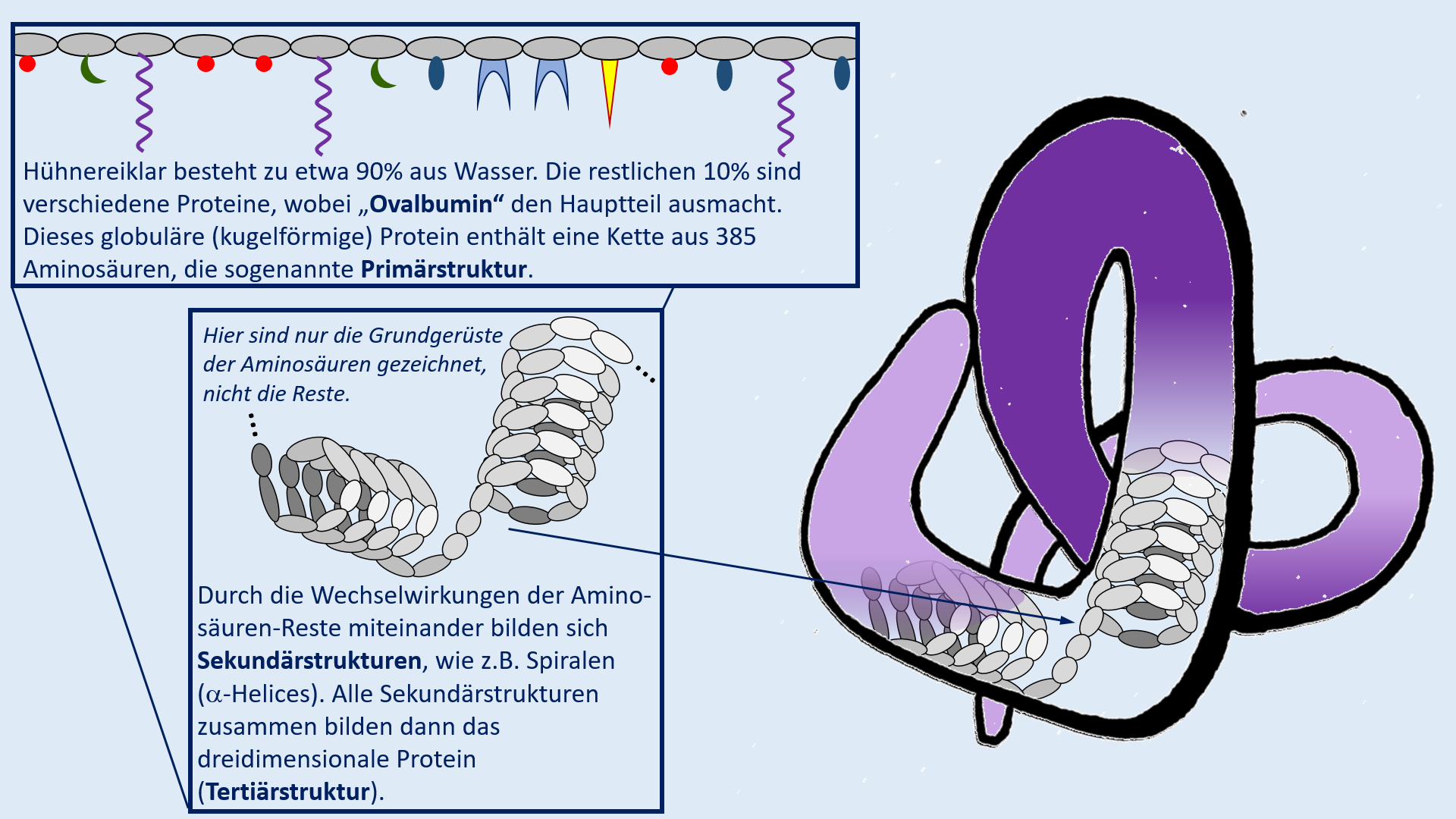
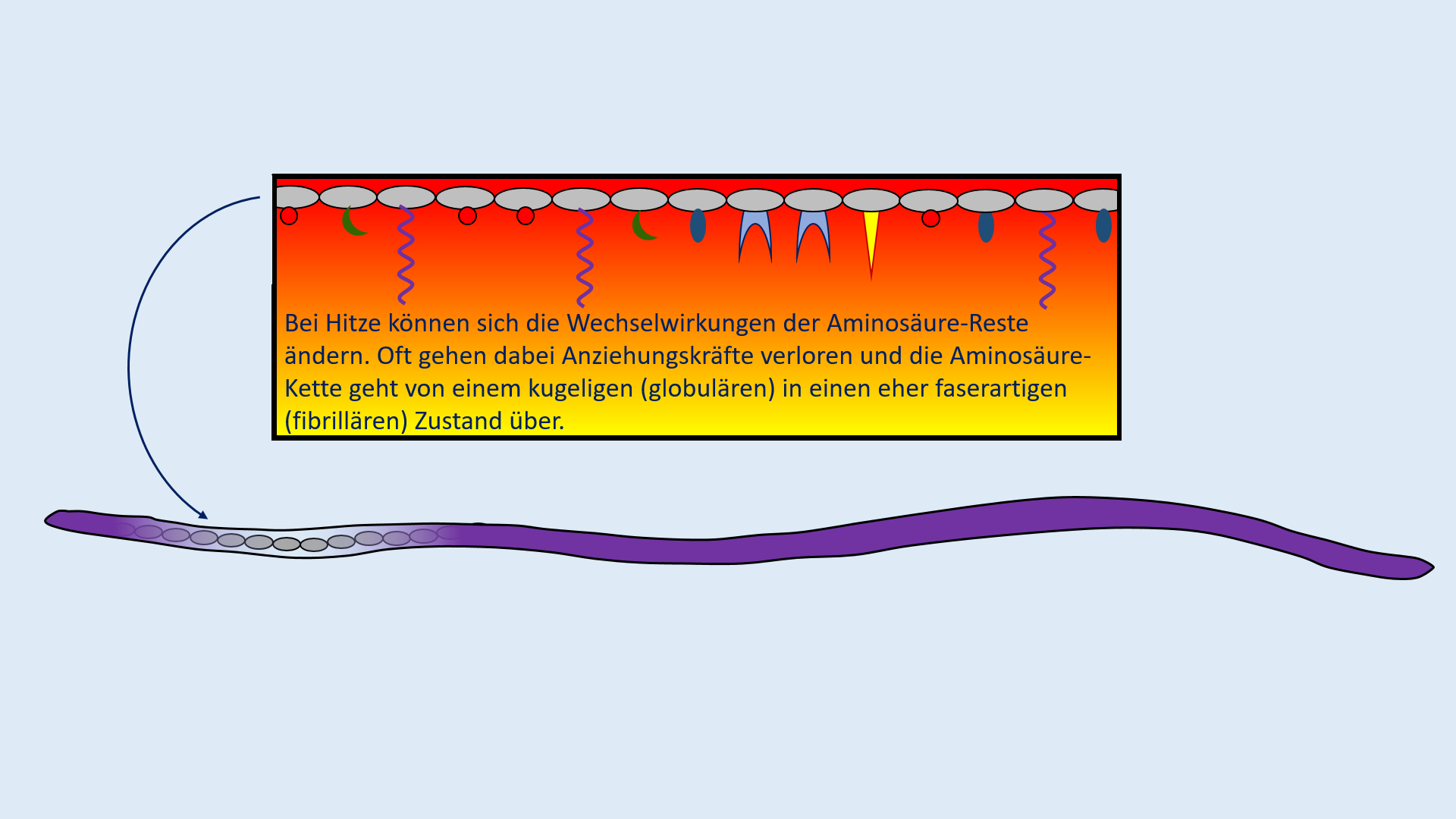
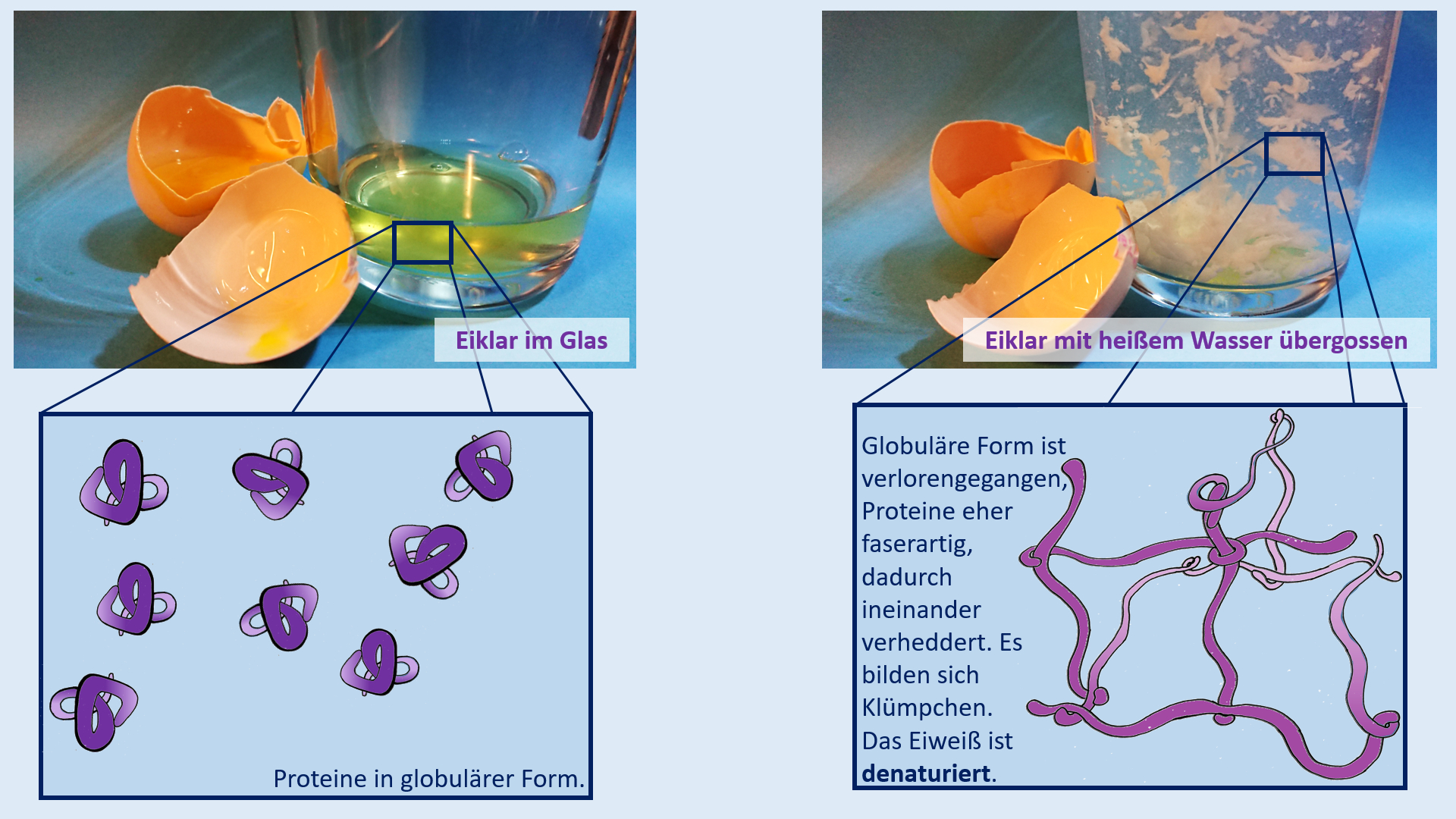
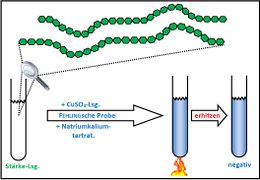
Test. Einheit: Eiweiße
Test Schulentwicklungsteam
|
Respekt und Werte-Erziehung
|
Individuelle Förderung und Individualisierung |
Berufswahlkompetenz
|
Kommunikation
|
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
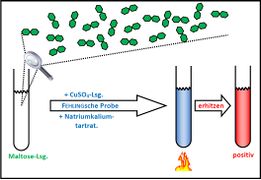
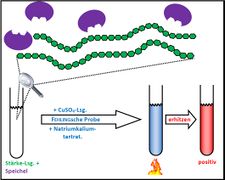
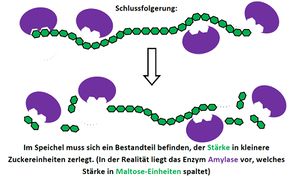
Biologie
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
Chemie
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
neue Überschrift
Termine
|
Externe Links- im Moment keine externen links -
|
Termine
|
Externe Links
|
Hefteinträge
1. Evolution
1.1 Ein kurzer historischer Abriss zur Entwicklung des Evolutionsgedankens
Neu, 04.10. Buch S. 17, 28-31 (das Buch ist hier sehr ausführlich) + Hefteintrag:
1.4 Darwins Evolutionstheorie +
Stoff aus der 11. Klasse
Eine Übersicht über wichtige Inhalte des Kapitels "Populationswachstum und Biodiversität" aus der 11. Jahrgangsstufe liefern die folgenden Einträge: