Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
Aus RMG-Wiki
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(AA 9a C Fr, 18.12. angefangen) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
== Distanzlernen für | === Distanzlernen für Freitag, 18.12. === | ||
Je nachdem, wie viel Zeit euch zur Verfügung steht, könnt ihr im folgenden violetten Kasten Aufgaben zum Ausgleichen von chemischen Reaktionen üben (es handelt sich um die Aufgaben von dem Arbeitsblatt, das ihr im Unterricht bekommen habt). Oder ihr führt den Versuch durch, der im blauen Kasten beschrieben ist. Selbstverständlich dürft ihr auch beides machen :) <br> | |||
Auch wenn ihr die Aufgaben auf dem Arbeitsblatt bereits bearbeitet haben solltet: Macht sie einfach hier noch einmal. In der Regel kann man sich an die Lösung nicht automatisch erinnern. | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">''' | |Titel=<span style="color:#607">'''Übungsaufgaben: Chemische Gleichungen aufstellen'''</span> | ||
|Inhalt= | |Inhalt= | ||
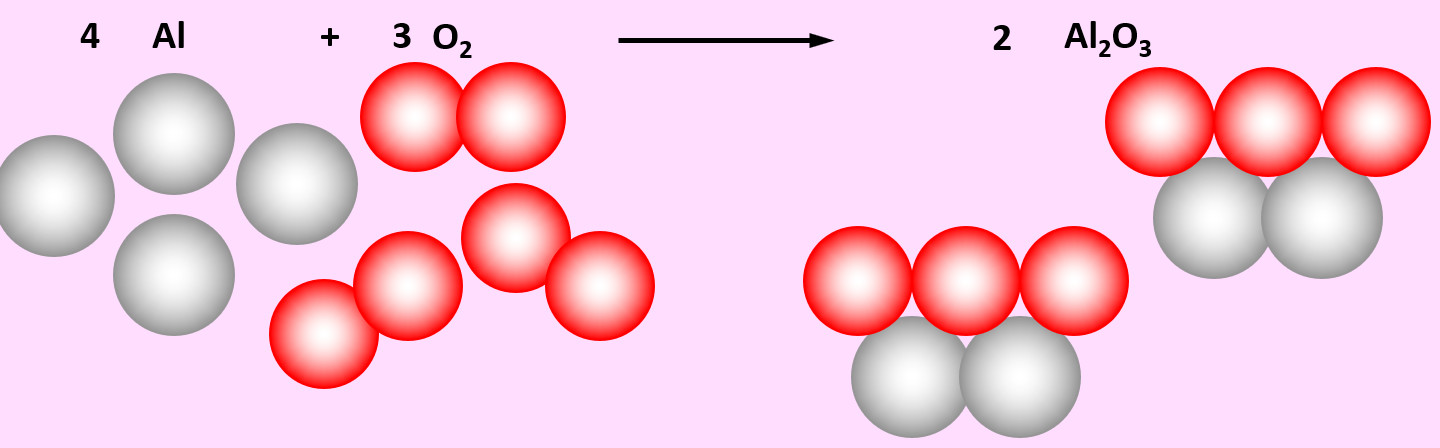
'''Aufgabe 4 (AB-Vorderseite)'''<br> | |||
Zu den heftigsten Reaktionen unter den Elementen zählt die Reaktion von Aluminium mit Sauerstoff. Dabei entsteht Aluminiumoxid (Al<sub>2</sub>O<sub>3</sub>) | |||
<br> | <br> | ||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_4Al3O22Al2O3.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
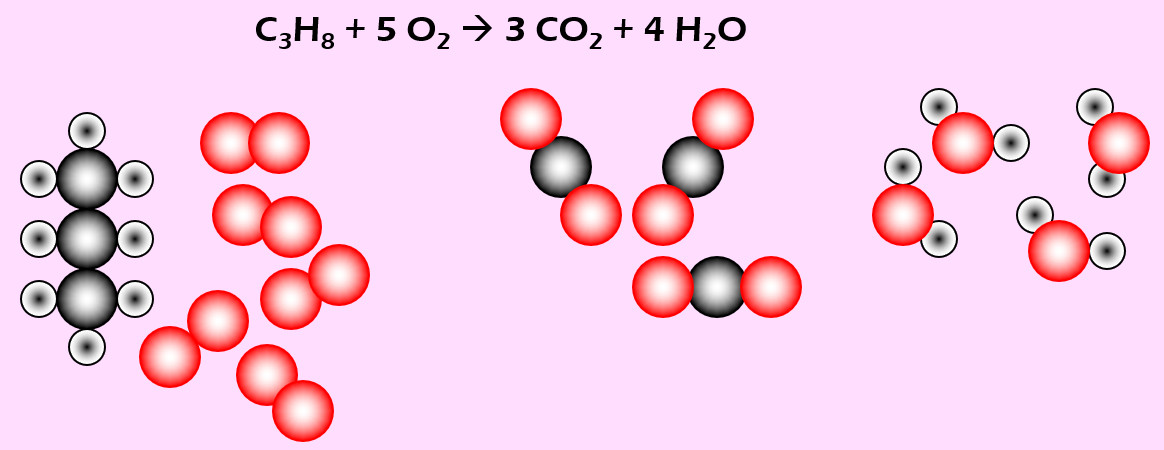
'''Aufgabe 5 (AB-Vorderseite)'''<br> | |||
Feuerzeuge enthalten vielfach Propan (C<sub>3</sub>H<sub>8</sub>). Bei Gebrauch strömt das Gas aus und wird durch einen Funken entzündet. Dabei reagiert es mit Sauerstoff zu Kohlenstoffdioxid (CO<sub>2</sub>) und Wasser (H<sub>2</sub>O) | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_PropanSauerstoff.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
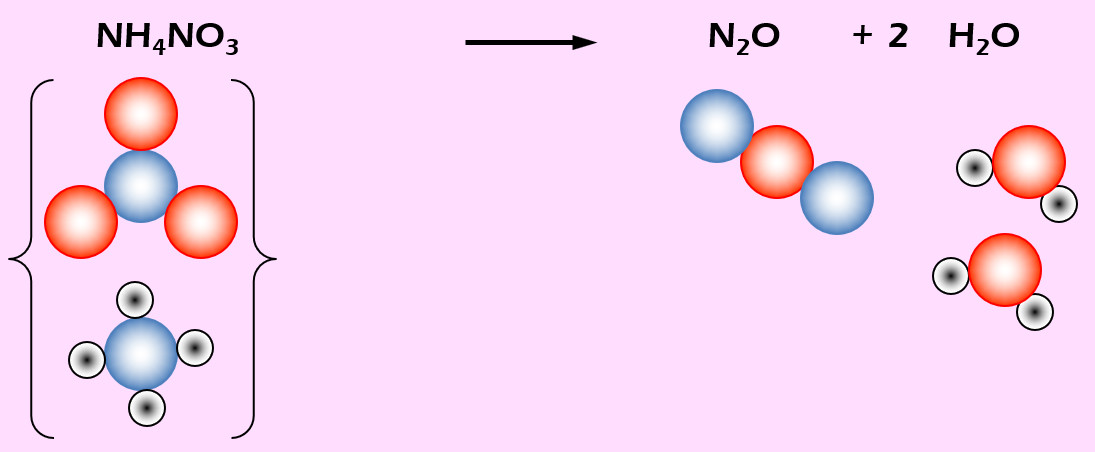
'''Aufgabe 6 (AB-Vorderseite)'''<br> | |||
Lachgas (N<sub>2</sub>O) entsteht beim starken Erhitzen von Ammoniumnitrat (NH<sub>4</sub>NO<sub>3</sub>). Daneben entsteht auch noch Wasser (H<sub>2</sub>O). | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_NH4NO3Zerfall.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
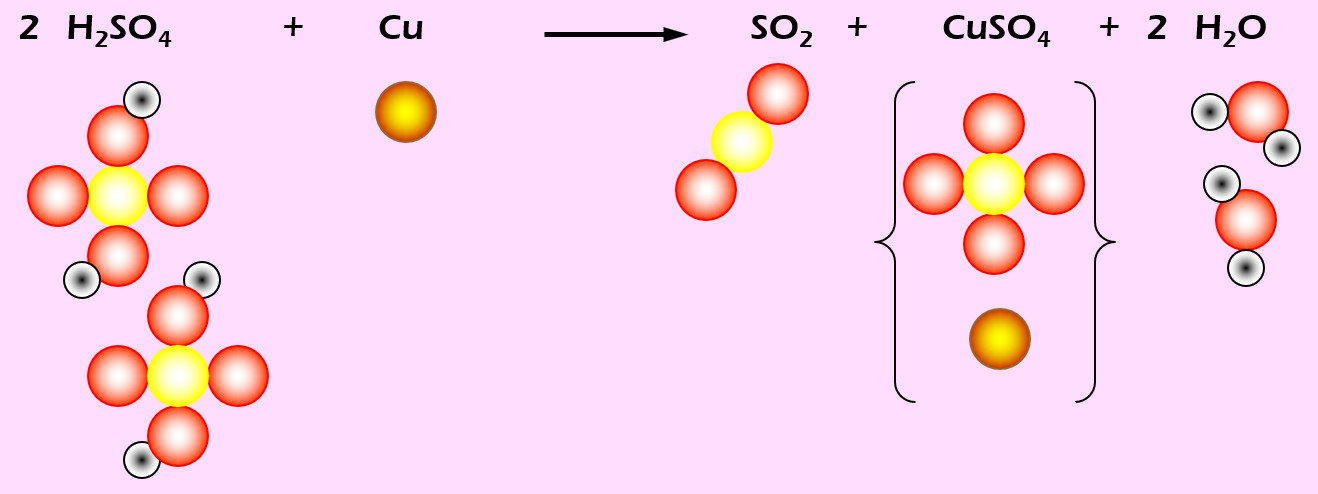
'''Aufgabe 7 (AB-Vorderseite)'''<br> | |||
Kupfer löst sich in erhitzter Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>). Dabei entsteht Schwefeldioxid (SO<sub>2</sub>), Kupfersulfat (CuSO<sub>4</sub>) und Wasser (die chem. Formel f. Wasser müsstet ihr langsam wissen...). | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Ausgleichen_H2SO4Cu.jpg]] | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | <br> | ||
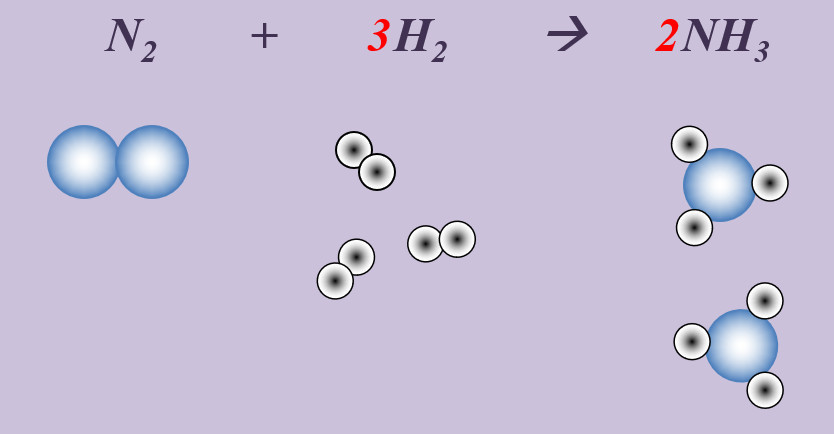
'''Aufgabe 1 (AB-Rückseite)'''<br> | |||
Stickstoff reagiert mit Wasserstoff zu Ammoniak (NH<sub>3</sub>). | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Ausgleichen_N23H22NH3.jpg]] | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | <br> | ||
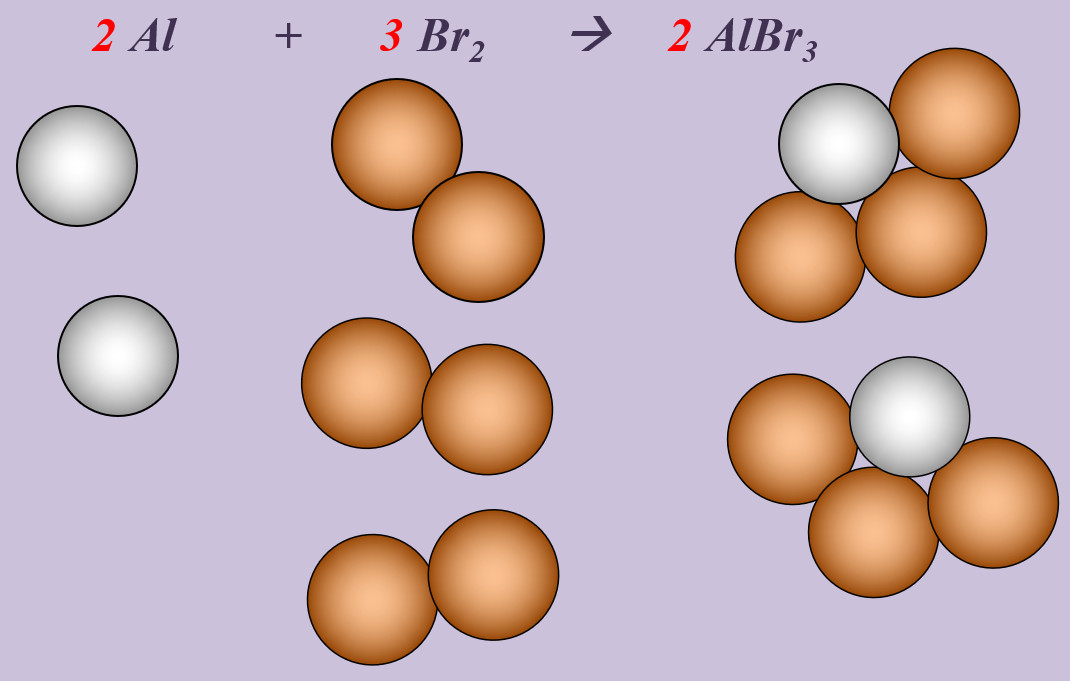
| | '''Aufgabe 2 (AB-Rückseite)'''<br> | ||
Aluminium reagiert mit Brom zu Aluminiumbromid (AlBr<sub>3</sub>). | |||
| | <br> | ||
| | {{Lösung versteckt| | ||
}} | [[Datei:Ausgleichen_2Al3Br2AlBr3.jpg]] | ||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
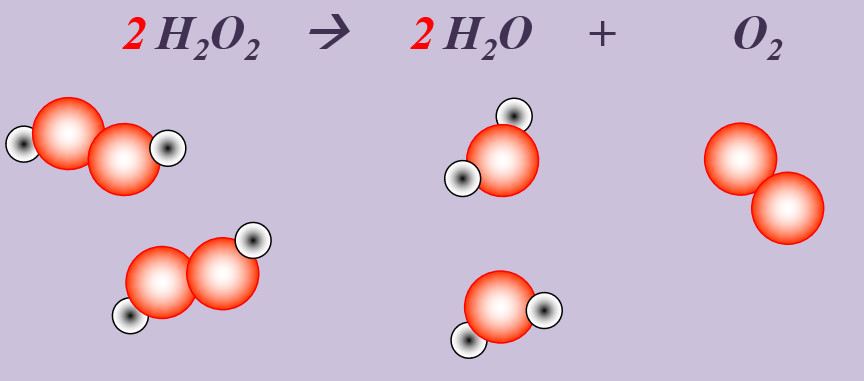
'''Aufgabe 3 (AB-Rückseite)'''<br> | |||
Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) zerfällt an der Luft zu Wasser und Sauerstoff. | |||
<br> | <br> | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Ausgleichen_2H2O22H2OO2.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
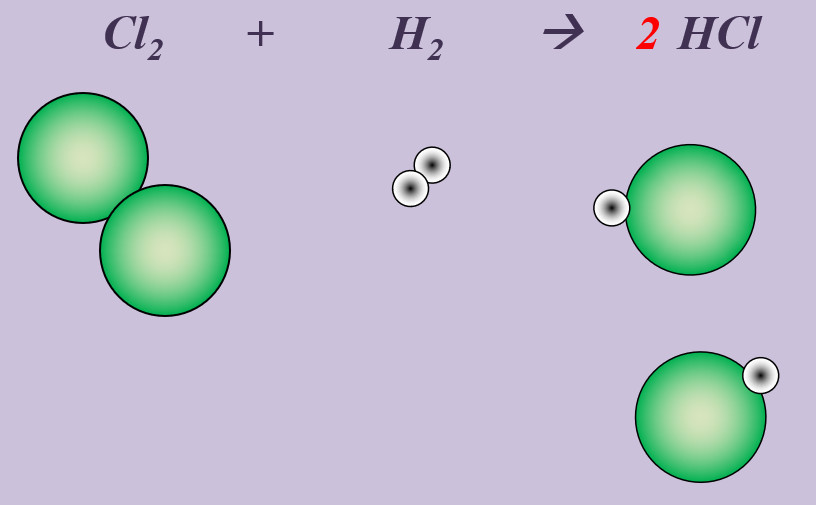
'''Aufgabe 4 (AB-Rückseite)'''<br> | |||
Chlor reagiert in einer heftigen Reaktion mit Wasserstoff zu Hydrogenchlorid (HCl). | |||
<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei: | [[Datei:Ausgleichen_Cl2H22HCl.jpg]] | ||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
'''Aufgabe 5 (AB-Rückseite)'''<br> | |||
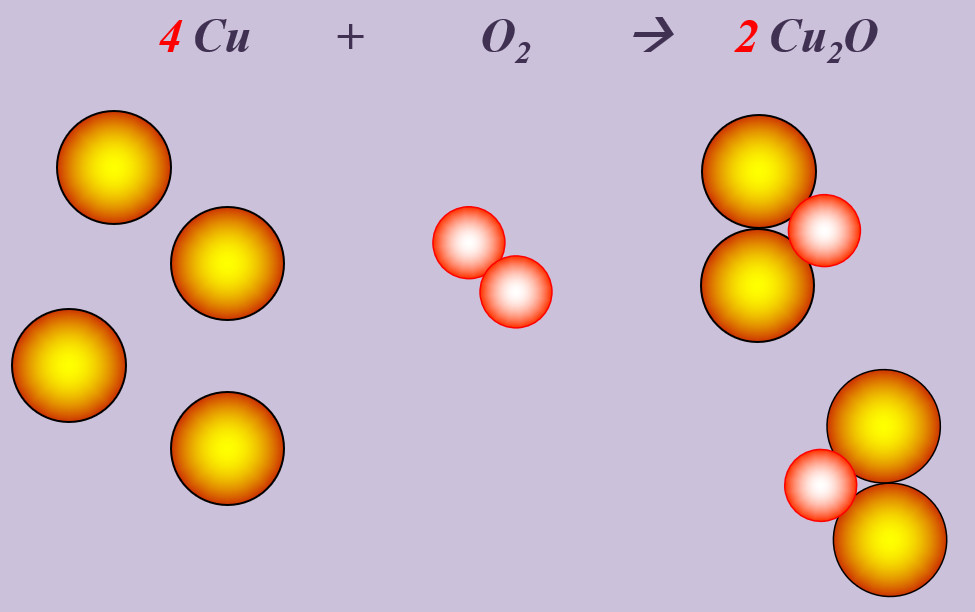
Kupfer kann beim starken Erhitzen mit Sauerstoff zu Kupfer(I)-oxid (Cu<sub>2</sub>O) reagieren. | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Ausgleichen_4CuO22Cu2O.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
<br> | <br> | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 87: | Zeile 76: | ||
}} | }} | ||
<br> | <br> | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 92: | Zeile 82: | ||
|Inhalt= | |Inhalt= | ||
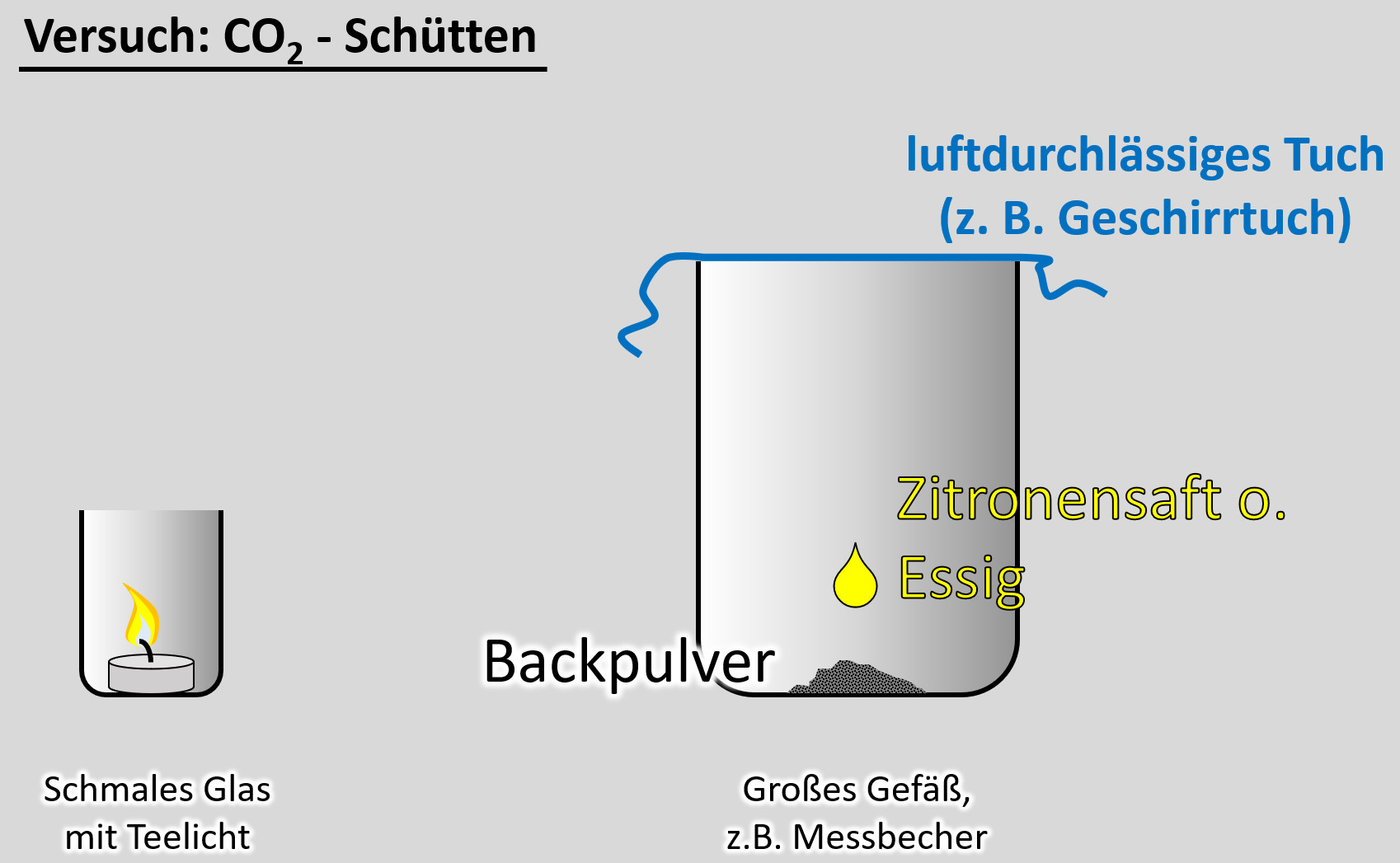
Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' | Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' | ||
* | * ein schmale Glas, in das gerade so ein Teelicht passt | ||
* | * ein Teelicht | ||
* | * ein größeres Gefäß, z.B. Messbecher | ||
* ein Geschirrtuch (o.ä.) | |||
* ein Päckchen Backpulver | |||
* Essig oder besser: Essigessenz | |||
<br> | <br> | ||
'''Durchführung''': | '''Durchführung''':<br> | ||
* | [[Datei:CO2Schütten_V.jpg]]<br> | ||
* | * Entzündet das Teelicht im schmalen Glas | ||
* | * Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit | ||
* | * Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden. | ||
* Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann). | |||
* Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen! | |||
<br> | <br> | ||
'''Beobachtung/Erklärung''':<br> | |||
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:CO2Schütten_V1.gif]] | |||
|Video|Lösung ausblenden}} | |||
| | |||
<br> | <br> | ||
| Zeile 118: | Zeile 110: | ||
|Rahmenfarbe= #DFF | |Rahmenfarbe= #DFF | ||
|Hintergrund= #DFF | |Hintergrund= #DFF | ||
}} | }} | ||
<br> | <br> | ||
Version vom 17. Dezember 2020, 09:20 Uhr
Distanzlernen für Freitag, 18.12.
Je nachdem, wie viel Zeit euch zur Verfügung steht, könnt ihr im folgenden violetten Kasten Aufgaben zum Ausgleichen von chemischen Reaktionen üben (es handelt sich um die Aufgaben von dem Arbeitsblatt, das ihr im Unterricht bekommen habt). Oder ihr führt den Versuch durch, der im blauen Kasten beschrieben ist. Selbstverständlich dürft ihr auch beides machen :)
Auch wenn ihr die Aufgaben auf dem Arbeitsblatt bereits bearbeitet haben solltet: Macht sie einfach hier noch einmal. In der Regel kann man sich an die Lösung nicht automatisch erinnern.