|
|
| Zeile 11: |
Zeile 11: |
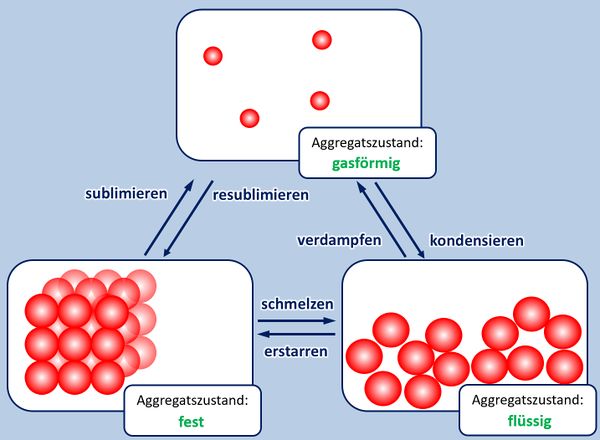
| Zu Beginn der 9. Jahrgangsstufe in Chemie wurden die Aggregatszustände von Stoffen besprochen. Ebenso die Fachbegriffe für die Vorgänge wenn ein Stoff von einem in einen anderen Aggregatszustand wechselt. Zur Auffrischung dieser Inhalte noch einmal die entsprechende Abbildung: | | Zu Beginn der 9. Jahrgangsstufe in Chemie wurden die Aggregatszustände von Stoffen besprochen. Ebenso die Fachbegriffe für die Vorgänge wenn ein Stoff von einem in einen anderen Aggregatszustand wechselt. Zur Auffrischung dieser Inhalte noch einmal die entsprechende Abbildung: |
| [[Datei:A5_Aggregatszustände_GIF.gif]]<br> | | [[Datei:A5_Aggregatszustände_GIF.gif]]<br> |
| (Eigentlich ist dieses Bild animiert - die Teilchen bewegen sich - im alten Wiki klappt das auch, im neuen bekomme ich es irgendwie nicht hin. Ist auch nicht so wichtig, aber wer es dennoch sehen will: Bild anklicken und dann auf "Im Medienbetrachter öffnen" klicken) <br>
| |
| <br> | | <br> |
| * Ergänzt die fehlenden Fachbegriffe! | | * Ergänzt die fehlenden Fachbegriffe! |
| Zeile 50: |
Zeile 49: |
| Calcium besitzt 2 VE, wird diese in Verbindungen abgeben (Ca -> Ca<sup>2+</sup> + 2e<sup>-</sup>. Sauerstoff besitzt 6 VE, wird in Verbindungen also 2 aufnehmen (O + 2e<sup>-</sup> -> O<sup>2-</sup>. Damit aus diesen Ionen eine neutrales Salz entsteht, muss jeweils ein O-Atom mit einem Ca-Atom reagieren. Die chemische Formel für das Salz lautet daher CaO. Ein Ausschnitt aus dem Kristallgitter könnte so aussehen: <br> | | Calcium besitzt 2 VE, wird diese in Verbindungen abgeben (Ca -> Ca<sup>2+</sup> + 2e<sup>-</sup>. Sauerstoff besitzt 6 VE, wird in Verbindungen also 2 aufnehmen (O + 2e<sup>-</sup> -> O<sup>2-</sup>. Damit aus diesen Ionen eine neutrales Salz entsteht, muss jeweils ein O-Atom mit einem Ca-Atom reagieren. Die chemische Formel für das Salz lautet daher CaO. Ein Ausschnitt aus dem Kristallgitter könnte so aussehen: <br> |
| [[Datei:A5_CaO_Gitter.jpg|300px]] | | [[Datei:A5_CaO_Gitter.jpg|300px]] |
| |Lösung 2|Lösung ausblenden}} | | |Lösung 3|Lösung ausblenden}} |
|
| |
|
| Warum Sauerstoff bei Raumtemperatur gasförmig vorliegt, solltet ihr inzwischen auch gut nachvollziehen können: Über das Sauerstoffmolekül habt ihr gelernt, dass sich zwei Sauerstoffatome über eine Doppelbindung zwei Elektronenpaare teilen und zusammen mit ihren freien Elektronenpaaren jeweils 8 VE zugerechnet bekommen und damit Edelgaskonfiguration vorliegt. Es gibt zum jetzigen Zeitpunkt für euch keinen Grund anzunehmen, dass zu benachbarten Sauerstoffmolekülen irgendwelche Anziehungskräfte ausgebildet werden. Die Moleküle sind also voneinander getrennt und damit gasförmig: <br> | | Warum Sauerstoff bei Raumtemperatur gasförmig vorliegt, solltet ihr inzwischen auch gut nachvollziehen können: Über das Sauerstoffmolekül habt ihr gelernt, dass sich zwei Sauerstoffatome über eine Doppelbindung zwei Elektronenpaare teilen und zusammen mit ihren freien Elektronenpaaren jeweils 8 VE zugerechnet bekommen und damit Edelgaskonfiguration vorliegt. Es gibt zum jetzigen Zeitpunkt für euch keinen Grund anzunehmen, dass zu benachbarten Sauerstoffmolekülen irgendwelche Anziehungskräfte ausgebildet werden. Die Moleküle sind also voneinander getrennt und damit gasförmig: <br> |
| Zeile 57: |
Zeile 56: |
| '''Das Problem:'''<br> | | '''Das Problem:'''<br> |
| Ihr habt auch des Stoff Wasser als Molekül kennengelernt. Auch hier könnt ihr erklären, warum ein Sauerstoff-Atom mit genau zwei Wasserstoffatomen eine Bindung eingeht. Mehr aber auch nicht. Auch hier sollte es keinen Grund geben, warum sich diese Moleküle untereinander anziehen sollten. '''Offensichtlich tun sie es aber doch.''' Denn bei Raumtemperatur ist Wasser flüssig, die Moleküle hängen also irgendwie aneinander. Erst bei 100°C "lassen sie sich offenbar los": | | Ihr habt auch des Stoff Wasser als Molekül kennengelernt. Auch hier könnt ihr erklären, warum ein Sauerstoff-Atom mit genau zwei Wasserstoffatomen eine Bindung eingeht. Mehr aber auch nicht. Auch hier sollte es keinen Grund geben, warum sich diese Moleküle untereinander anziehen sollten. '''Offensichtlich tun sie es aber doch.''' Denn bei Raumtemperatur ist Wasser flüssig, die Moleküle hängen also irgendwie aneinander. Erst bei 100°C "lassen sie sich offenbar los": |
| [[Datei:A5_H2O_Valenz_u_Aggregatszusatnd.jpg|600px]]<br> | | [[Datei:A5_H2O_Valenz_u_Aggregatszusatnd.jpg|600px]]<br> |
| <br> | | <br> |
| '''Das Lösung:'''<br> | | '''Das Lösung:'''<br> |
| Zeile 63: |
Zeile 62: |
| Das einzige, was ihr aus dieser Unterrichtsstunde mitnehmen sollt, lautet: <br> | | Das einzige, was ihr aus dieser Unterrichtsstunde mitnehmen sollt, lautet: <br> |
| <br> | | <br> |
| <span style="color:#607">Auch '''zwischen''' Molekülen existieren '''Anziehungskräfte'''. Man nennt sie... (Spannung, Trommelwirbel):</span><br>
| | Auch '''zwischen''' Molekülen existieren '''Anziehungskräfte'''. Man nennt sie... (Spannung, Trommelwirbel):<br> |
| <span style="color:#607">'''Zwischenmolekulare Kräfte'''</span> Wahnsinn, oder? | | <span style="color:#800">'''Zwischenmolekulare Kräfte'''</span> Wahnsinn, oder? |
| * Lest jetzt auf der Seite 109 den letzten Absatz "Moleküle bilden Molekülgitter" | | * Lest jetzt auf der Seite 109 den letzten Absatz "Moleküle bilden Molekülgitter"! |
| | * Legt das Buch jetzt beiseite! |
| | * Was bedeuten im folgenden Bild die durchgezogenen (dunkelroten) Linien und was bedeuten die gestrichelten Linien? |
| | [[Datei:A5_I2_Molekülgitter.jpg|600px]] |
| | {{Lösung versteckt| |
| | Die '''durchgezogen Linien sind <span style="color:#800">Atombindungen</span>''', die '''gestrichelten symbolisieren die zwischenmolekularen Kräfte''', welche die Moleküle untereinander zusammenhalten. Diese zwischenmolekularen Kräfte muss man überwinden, wenn man einen molekularen festen (oder flüssigen) Stoff in den gasförmigen Zustand überführen will. |
| | |Lösung 4|Lösung ausblenden}} |
| | |
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 89: |
Zeile 95: |
| |Rahmenfarbe= #DFC | | |Rahmenfarbe= #DFC |
| |Hintergrund= #DFC | | |Hintergrund= #DFC |
| }}
| |
| <br>
| |
|
| |
|
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#070">'''optional (freiwillig) '''</span>
| |
| |Inhalt=
| |
|
| |
| |Farbe= #070
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFC
| |
| |Hintergrund= #DFC
| |
| }}
| |
| <br>
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Aufgabe'''</span>
| |
| |Inhalt=
| |
|
| |
|
| |
| {{Lösung versteckt|
| |
| [[Datei:A4_E_Abstandsdiagramm_A1_ML.jpg|600px]]
| |
| |Lösung 3|Lösung ausblenden}}
| |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }} | | }} |
| <br> | | <br> |
| Zeile 123: |
Zeile 101: |
| |Titel=<span style="color:#070">'''Hausaufgabe '''</span> | | |Titel=<span style="color:#070">'''Hausaufgabe '''</span> |
| |Inhalt= | | |Inhalt= |
| Als Hausaufgabe bearbeitet ihr bitte S. 107 A4. Die Lösung wird erst am Mittwoch hochgeladen.
| | Keine Hausaufgabe, da das die letzte Stunde vor den Ferien war. Erhohlt euch gut trotz Ausgangsbegrenzungen und auch wenn ihr vielleicht unter Quarantäne steht. |
| |Farbe= #070 | | |Farbe= #070 |
| |Rahmen= 0 | | |Rahmen= 0 |
Arbeitsauftrag Chemie5 (verpflichtend)
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Wiederholung: Aggregatszustände
Zu Beginn der 9. Jahrgangsstufe in Chemie wurden die Aggregatszustände von Stoffen besprochen. Ebenso die Fachbegriffe für die Vorgänge wenn ein Stoff von einem in einen anderen Aggregatszustand wechselt. Zur Auffrischung dieser Inhalte noch einmal die entsprechende Abbildung:
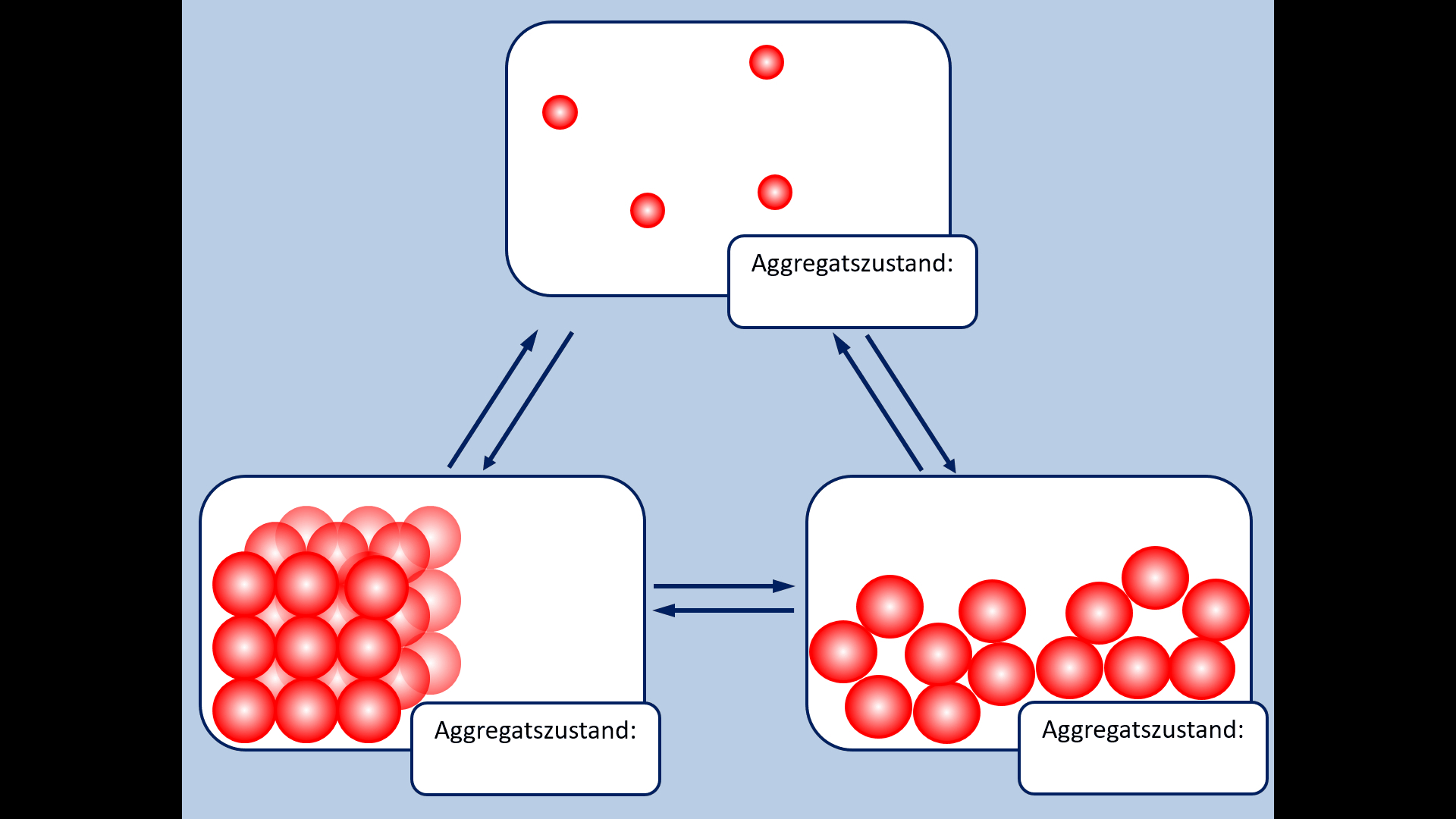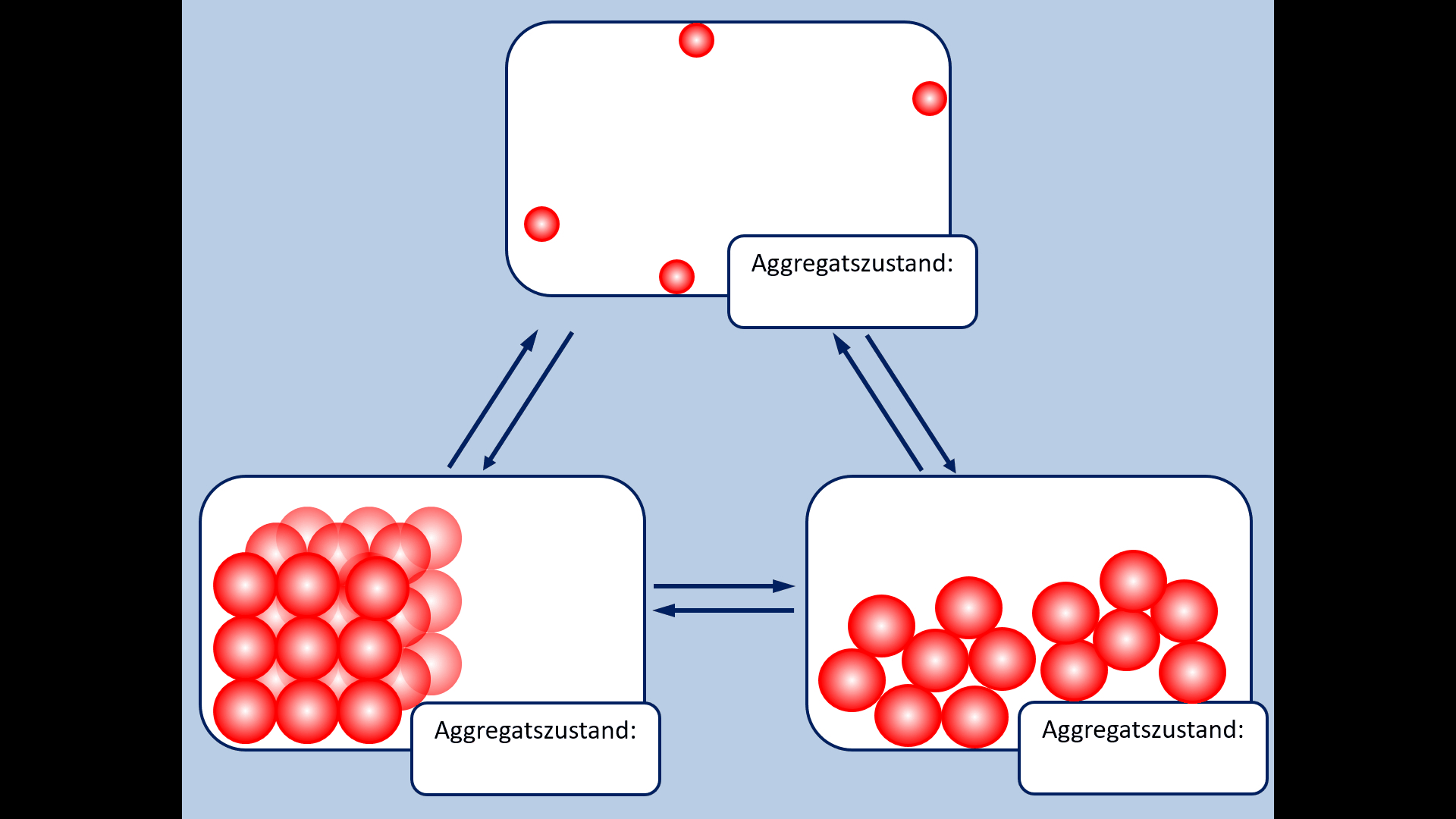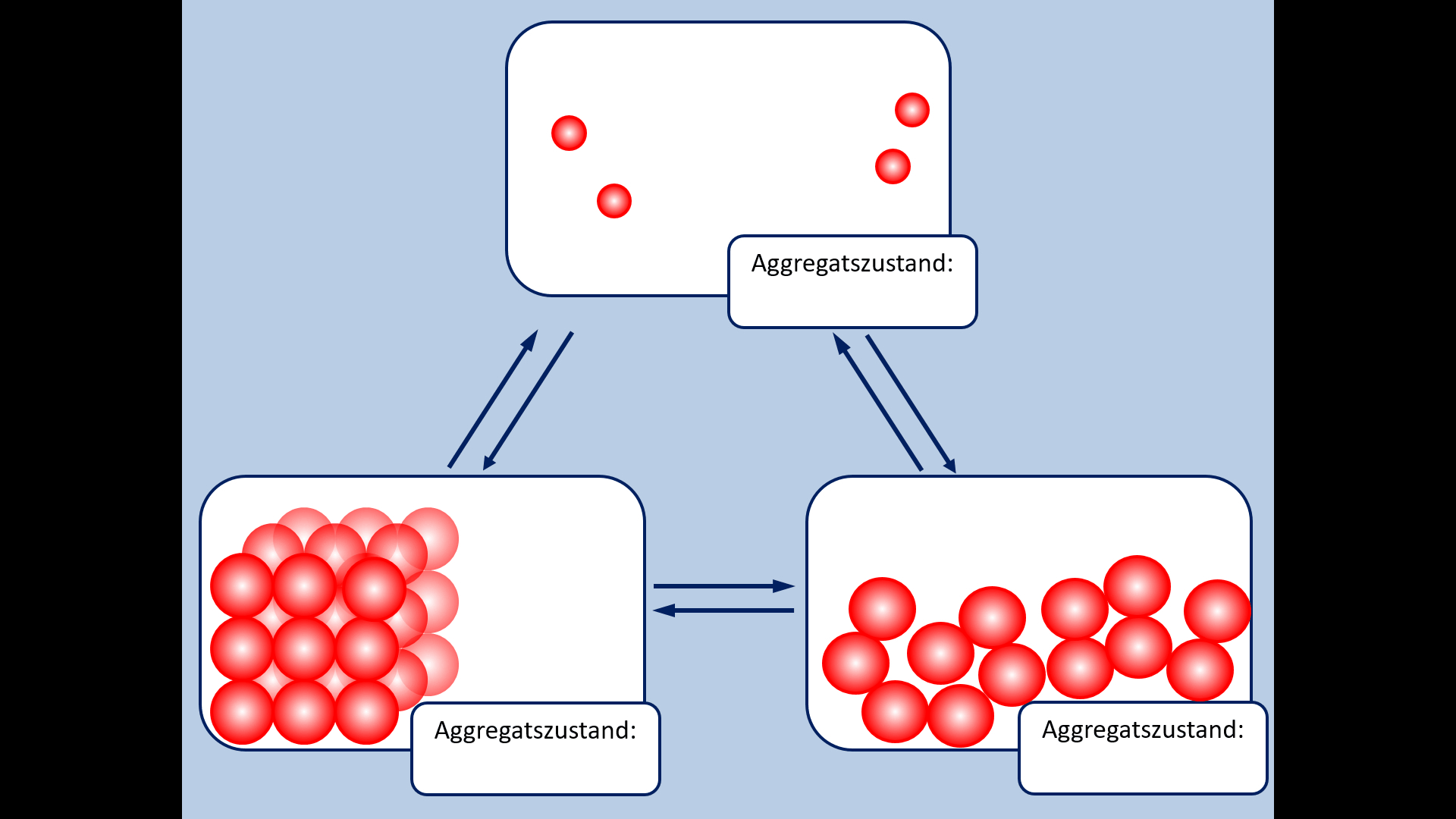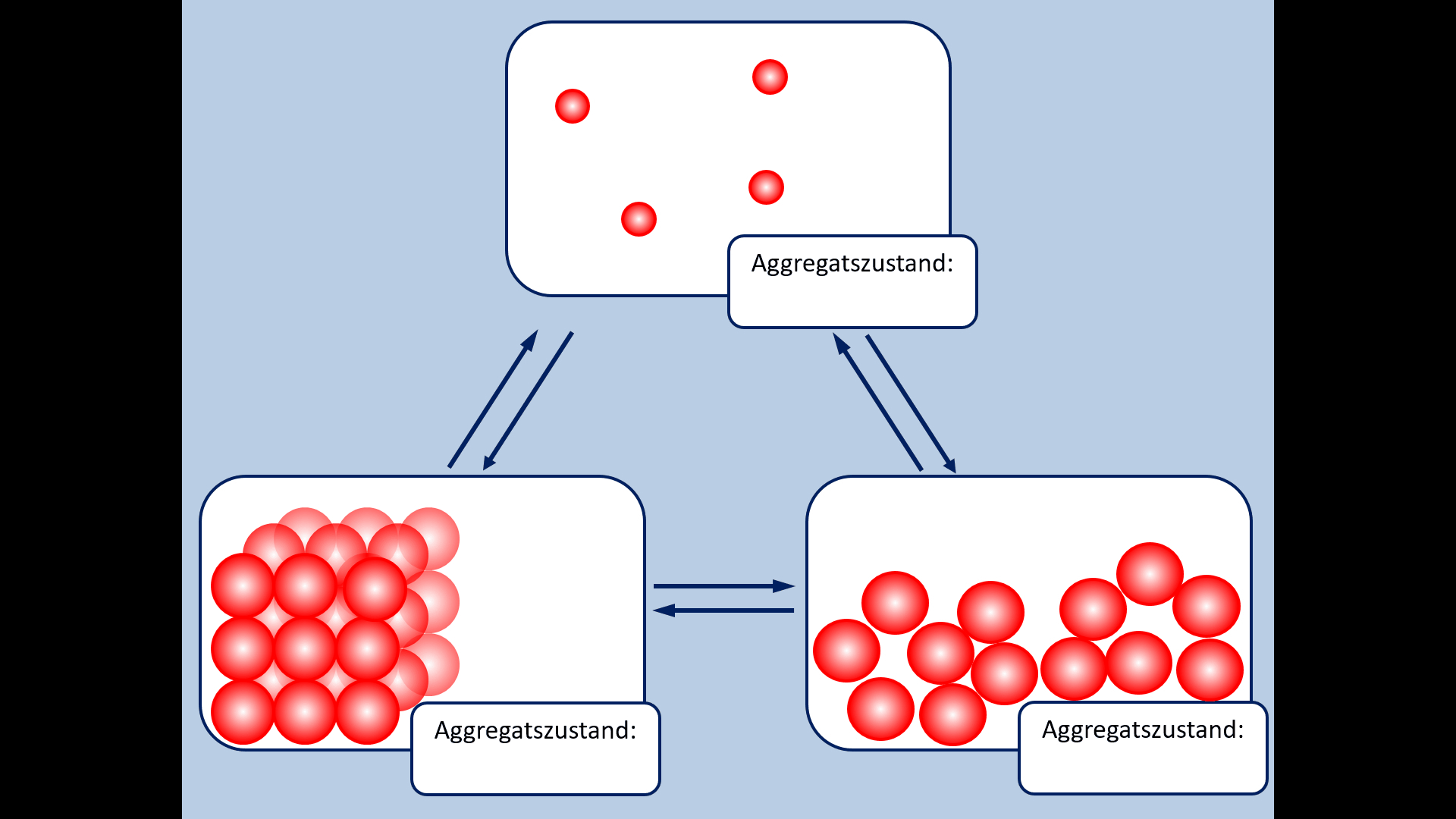
- Ergänzt die fehlenden Fachbegriffe!
Anziehungskräfte
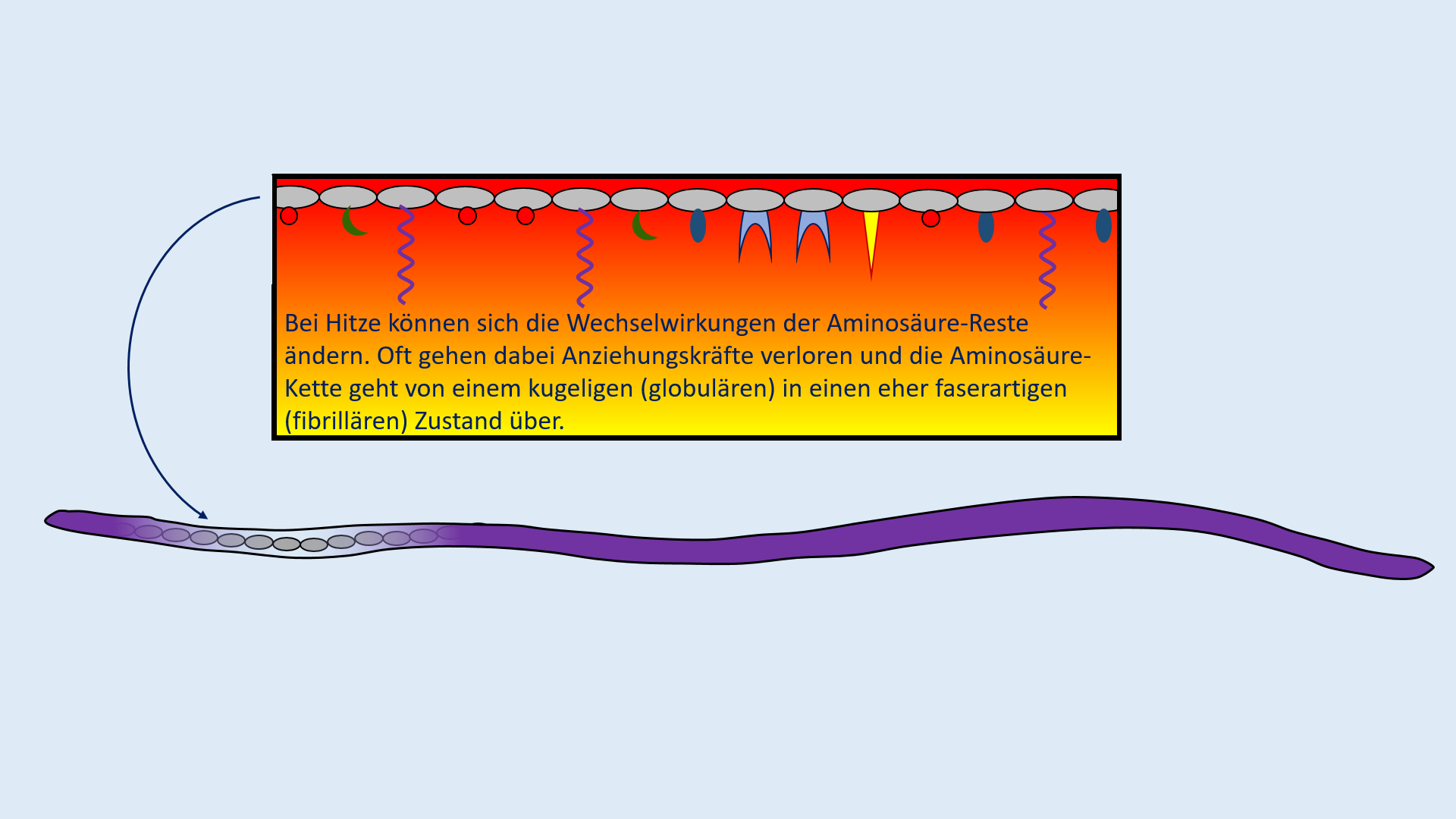
Bei Raumtemperatur (und "normalem" Druck) liegen verschiedene Stoffe in verschiedenen Aggregatszuständen vor, z.B. ist Sauerstoff gasförmig, Wasser flüssig und Wachs fest. Um auch Wasser und Wachs bei Raumtemperatur in den gasförmigen Zustand zu überführen, muss man Energie zuführen, am einfachsten in Form von Wärme (es ginge auch z.B. durch "Mikrowellen").
Bei 100° schafft man es zwar Wasser zu verdampfen, also die Wasserteilchen voneinander zu trennen, mit Wachs klappt das bei dieser Temperatur aber noch nicht.
Stelle eine begründete Vermutung auf, woran das liegen könnte! (Schreibe einen kurzen, vernünftigen Satz.)
Die Kräfte, die die Wasserteilchen zusammenhalten und verhindern, dass sie sich bei Raumtemperatur voneinander lösen sind nicht so stark wie die Kräfte, die die Wachsteilchen zusammenhalten.
Kräfte bei Salzen
Inzwischen wisst ihr bereits einiges über den Aufbau von bestimmten Stoffen, z.B. Salzen. Ihr wisst, dass die festen Salzkristalle aus einer großen Menge unterschiedlich geladener Ionen zusammengesetzt sind, die sich alle gegenseitig anziehen. Es gibt also einen logischen Zusammenhang zwischen dem Bau und dem Aggregatszustand dieser Stoffe: Alle am Aufbau beteiligten Teilchen sind geladen, ziehen sich gegenseitig an und das entspricht starken Anziehungskräften. Es ist daher sehr viel Energie nötig, um diese Kräfte zu überwinden und Salze zu schmelzen oder zu verdampfen (z.B. Sdp.(NaCl): 1461°C).
- Zur Wiederholung: Zeichnet den Ausschnitt aus einem Calciumoxid-Kristall (CaO)!
Calcium besitzt 2 VE, wird diese in Verbindungen abgeben (Ca -> Ca2+ + 2e-. Sauerstoff besitzt 6 VE, wird in Verbindungen also 2 aufnehmen (O + 2e- -> O2-. Damit aus diesen Ionen eine neutrales Salz entsteht, muss jeweils ein O-Atom mit einem Ca-Atom reagieren. Die chemische Formel für das Salz lautet daher CaO. Ein Ausschnitt aus dem Kristallgitter könnte so aussehen:
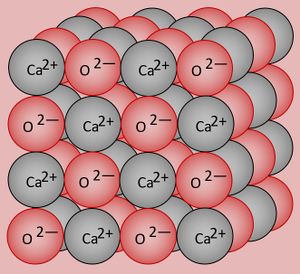
Warum Sauerstoff bei Raumtemperatur gasförmig vorliegt, solltet ihr inzwischen auch gut nachvollziehen können: Über das Sauerstoffmolekül habt ihr gelernt, dass sich zwei Sauerstoffatome über eine Doppelbindung zwei Elektronenpaare teilen und zusammen mit ihren freien Elektronenpaaren jeweils 8 VE zugerechnet bekommen und damit Edelgaskonfiguration vorliegt. Es gibt zum jetzigen Zeitpunkt für euch keinen Grund anzunehmen, dass zu benachbarten Sauerstoffmolekülen irgendwelche Anziehungskräfte ausgebildet werden. Die Moleküle sind also voneinander getrennt und damit gasförmig:
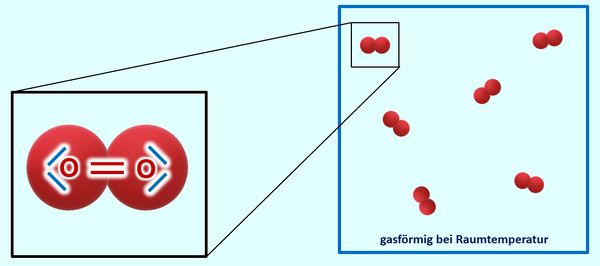
Das Problem:
Ihr habt auch des Stoff Wasser als Molekül kennengelernt. Auch hier könnt ihr erklären, warum ein Sauerstoff-Atom mit genau zwei Wasserstoffatomen eine Bindung eingeht. Mehr aber auch nicht. Auch hier sollte es keinen Grund geben, warum sich diese Moleküle untereinander anziehen sollten. Offensichtlich tun sie es aber doch. Denn bei Raumtemperatur ist Wasser flüssig, die Moleküle hängen also irgendwie aneinander. Erst bei 100°C "lassen sie sich offenbar los":
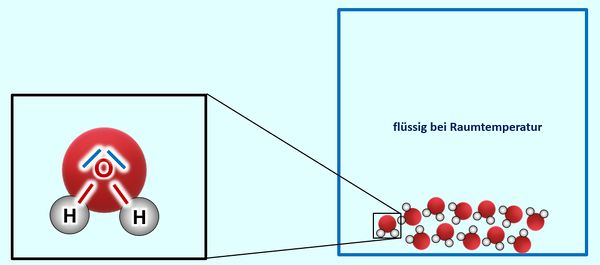
Das Lösung:
Ich muss euch enttäuschen... Oder zumindest "vertrösten". Die genaue Begründung, warum sich Wassermoleküle auch gegenseitig anziehen, werdet ihr erst in der nächsten Jahrgangsstufe kennenlernen.
Das einzige, was ihr aus dieser Unterrichtsstunde mitnehmen sollt, lautet:
Auch zwischen Molekülen existieren Anziehungskräfte. Man nennt sie... (Spannung, Trommelwirbel):
Zwischenmolekulare Kräfte Wahnsinn, oder?
- Lest jetzt auf der Seite 109 den letzten Absatz "Moleküle bilden Molekülgitter"!
- Legt das Buch jetzt beiseite!
- Was bedeuten im folgenden Bild die durchgezogenen (dunkelroten) Linien und was bedeuten die gestrichelten Linien?
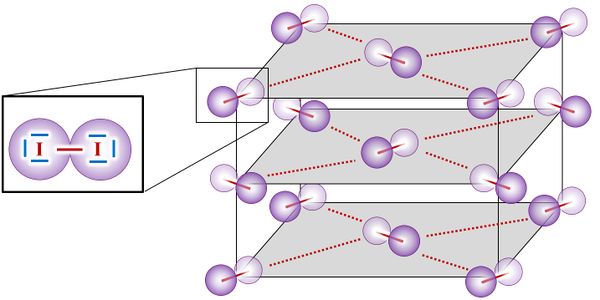
Lösung 4
optional (freiwillig)
Durftet ihr als Kinder "Wachstropfen" machen? Falls nicht, hier eine kurze Anleitung:
Nehmt ein Schälchen mit Wasser und stellt ein Plätzchen-Ausstech-Förmchen hinein. Das Förmchen sollte zur Hälfte ins Wasser eintauchen. Zündet eine Kerze an und lasst das Wachs ins Förmchen tropfen. (Der Zusammenhang mit dieser Unterrichtseinheit ist: Durch die Flamme überführt ihr die Moleküle des Wachses zunächst in den flüssigen Zustand, ein Teil verdampft sogar und verbrennt. Das flüssige Wachs tropft ins Förmchen und erstarrt im kalten Wasser recht schnell.
Ihr erhaltet dann eine Fachsfigur in der Form der Ausstech-Figur:

- Ihr könnt natürlich farbige (auch mehrere verschiedene) Kerzen nehmen.
- Ihr müsst kein Herz nehmen! Es geht alles, von mir aus auch ein Totenkopf (wenn ihr so etwas als Plätzchen-Ausstech-Förmchen habt.
- Fertigt eine solche Figur an und schenkt sie einem Familienmitglied oder eurer besten Freundin / bestem Freund.
Hausaufgabe
Keine Hausaufgabe, da das die letzte Stunde vor den Ferien war. Erhohlt euch gut trotz Ausgangsbegrenzungen und auch wenn ihr vielleicht unter Quarantäne steht.
Arbeitsauftrag Chemie4 (verpflichtend)
- Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten.
- Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein Video zu schauen. Und Ruhe.
- Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Das Energie-Abstands-Diagramm
Ihr habt sicher im Buch gesehen, dass ich einen Abschnitt im Buch zum Kapitel Atombindung ausgelassen habe: Das Diagramm auf der S. 106. Dieses Diagramm soll heute besprochen werden. Ihr braucht das Diagramm jetzt noch nicht anschauen, zunächst möchte ich euch sagen, welche Fragen dieses Diagramm beantworten kann:
- Untersucht man ein Wasserstoff-Molekül (H2) genauer, stellt man fest, dass sich die beiden Atomkerne in einem ganz bestimmten Abstand zueinander aufhalten. Dieser Abstand wird Bindungsabstand genannt. Er ist bei allen Wasserstoffmolekülen gleich. Warum? - Das ist eine Frage, auf die das Diagramm eine Antwort geben kann.
- Wasserstoff kommt immer als "Pärchen" vor, also als Molekül (H2). Ihr habt in der letzten Einheit gelernt, dass durch das Teilen von Elektronen über eine Atombindung Edelgaszustand erreicht werden kann. Man kann mit sehr viel Aufwand die beiden Wasserstoff-Atome eines Moleküls schon voneinander trennen. Aber sie finden sich sofort wieder zum Molekül zusammen. Dabei wird eine große Menge Energie frei, die Bindungsenergie. Das Diagramm im Buch kann auch erklären, warum das so ist.
Beginnen wir mit dem letzten Punkt: Die folgende Abbildung zeigt schematisch eine Langmuir-Fackel, benannt nach einem US-amerikanischen Physiker und Chemiker, der diese Apparatur 1924 entwickelte. Man kann damit metallische Werkstücke verschweißen. Beschreibe diese Grafik: Mache Dir Stichpunkte auf einem Zettel.
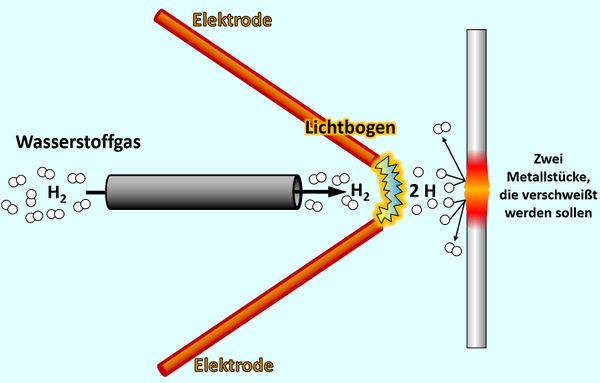
Über ein Röhrchen strömt Wassserstoff-Gas (besteht aus H2-Molekülen) zwischen zwei Elektroden hindurch. Von der einen zur anderen Elektrode spannt sich ein Lichtbogen (der wird durch eine sehr hohe Spannung erzeugt, die man an den Elektroden anlegt). Beim Durchtritt durch den Lichtbogen werden die Wasserstoff-Moleküle in einzelne Wasserstoff-Atome gespalten. Diese prasseln auf zwei metallische Werkstücke, die verschweißt werden sollen. Beim Auftreffen verbinden sich jeweils zwei Wasserstoff-Atome wieder zu einem Wasserstoff-Molekül. Dabei werden große Energiemengen frei, welche die metallischen Werkstücke so stark erhitzen, dass sie miteinander verschmelzen.
optional (freiwillig)
Je nachdem, ob ein Familienmitglied gerade Zeit hat oder nicht, kannst Du folgendes probieren: Gehe mit Deinem Zettel zu einem Familienmitglied. Erkläre ihm, wie eine Langmuir-Fackel funktioniert. Lass das Familienmitglied die Langmuir-Fackel nach Deinen Anweisungen zeichnen. Vergleicht dann die Zeichnung mit der Skizze hier.
Das geht auch "fernmündlich": Ruft jemanden an, der nach euren Anweisungen am Telefon die Skizze anfertigt. Anschließend soll euch derjenige ein Foto von seiner Zeichnung schicken.
Das Diagramm
Was für euch an dieser Langmuir-Fackel wichtig ist, sind die Prozesse nach dem Lichtbogen: Zwei Wasserstoff-Atome verbinden sich wieder zu einem Wasserstoff-Molekül. Dabei werden große Energiemengen frei.
Es handelt sich um eine exotherme Reaktion: Das "System" aus zwei Wasserstoff-Atomen enthält viel Energie, wenn sich beide zu einem Wasserstoff-Molekül vereinigen enthält dieses "System" weniger Energie. Die Energiedifferenz wird in diesem Beispiel als Wärme frei und erhitzt die metallischen Werkstücke. Als chemische Gleichung könnte man das z.B. so darstellen:
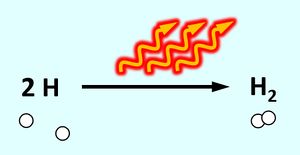
Es ist für zwei Wasserstoff-Atome also energetisch günstiger, wenn sie als Molekül vorkommen. In der letzten Stunde haben wir das auch anschaulich begründet: Durch das Teilen von Elektronen über die Atombindung können jedem Wasserstoff-Atom zwei Valenzelektronen zugeordnet werden, was einer Edelgaskonfiguration entspricht.
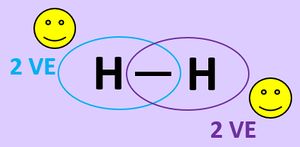
Die Grafik in eurem Buch versucht diese Bindung noch etwas genauer zu erklären.
- Lest jetzt im Buch auf den S. 106 - 107 die Abschnitte mit den Überschriften "Nichtmetalle reagieren miteinander", "Warum ist das Wasserstoffmolekül so stabil" und "Das bindende Elektronenpaar"
- Versucht die Grafik (S. 106) zu interpretieren (1. Die Grafik zeigt... in Abhängigkeit von..., 2. Verlauf beschreiben, 3. Verlauf erklären)
Ich glaube, dass anhand des Textes die Grafik schwierig zu verstehen ist. Vielleicht täusche ich mich aber auch. Falls ihr die Grafik nicht interpretieren könnt, hier ein Hilfsvideo:
- Das Video ist mit Absicht ohne Ton.
- Am oberen Bildrand wird immer erst ein Text eingeblendet, nach kurzer Verzögerung erfolgt (meist) eine Animation.
- Wenn es euch zu schnell geht, dann drückt immer wenn sich der Text ändert kurz auf Pause, lest den Text in Ruhe und schaut euch dann die Animation an.
Jetzt sollte die Interpretation besser klappen, also los:
- Die Grafik zeigt... in Abhängigkeit von...
- Beschreibung des Verlaufs
- Erklärung
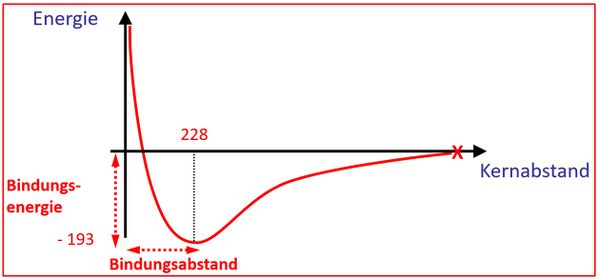
- Die Grafik zeigt den Energiegehalt von zwei Wasserstoffatomen, die sich annähern in Abhängigkeit vom Abstand der Atomkerne.
- Sind die beiden Kerne sehr weit voneinander entfernt, ist die Energie dieses Systems 0. Nähern sich die Atomkerne an, nimmt die Energie des Systems ab, bis zu einem Minimum. Nähert man die Kerne noch näher an, steigt der Energiegehalt des Systems sehr rasch an.
- Begründung: Durch die Annäherung der Atome aneinander können die Elektronenhüllen sich immer besser überlappen. Das Teilen der Elektronen wird dadurch immer einfacher, das erklärt die Abnahme der Energie des Systems bis zu einem bestimmten Punkt. Nähert man die Atome noch näher an, beginnt nun die Abstoßung der positiv geladenen Kerne relevant zu werden und man muss Energie in das System hineinstecken. Der Kern-Abstand an dem der Energiegehalt des Systems am niedrigsten ist, nennt man Bindungsabstand, die Energiedifferenz zwischen diesem Punkt und der "0-Linie" nennt man Bindungsenergie.
optional (freiwillig)
Wie oben: Je nachdem, ob ein Familienmitglied gerade Zeit hat oder nicht, kannst Du folgendes probieren: Gehe mit Deiner schriftlichen Lösung zu einem Familienmitglied. Beschreibe ihm die Grafik anhand Deiner Notizen, nach denen es die Grafik nachzeichnen soll. Vergleicht dann die Zeichnung mit der Grafik im Buch.
Das geht auch "fernmündlich": Ruft jemanden an, der nach euren Anweisungen am Telefon die Grafik anfertigt. Anschließend soll euch derjenige ein Foto von seiner Zeichnung schicken.
Aufgabe
- Bei einem Brom-Molekül (Br2) beträgt der Bindungsabstand 228pm (Pikometer) und die Bindungsenergie beträgt 193kJ/mol (Kilojoule pro Mol). Zeichne ein vollständig beschriftetes Energie-Abstands-Diagramm für die theoretische Annäherung zweier Brom-Atome aneinander! Achte darauf, dass sich auch die eingangs genannten Werte in der Zeichnung wiederfinden!
Hausaufgabe
Als Hausaufgabe bearbeitet ihr bitte S. 107 A4. Die Lösung wird erst am Mittwoch hochgeladen.
Arbeitsauftrag Biologie5 (verpflichtend)
Damit ihr nicht ganze fünf Wochen ohne Biologie-Unterricht gewesen sein, bekommt ihr zum Auffrischen der Thematik in dieser Woche zwei kleine, verpflichtende Unterrichtseinheiten zur Verfügung gestellt.
- Die Einheit sollte ca. 30 Minuten dauern.
- Für die Bearbeitung benötigt ihr: Das Schulbuch, einen Zettel, einen Stift und Ruhe.
Wiederholung
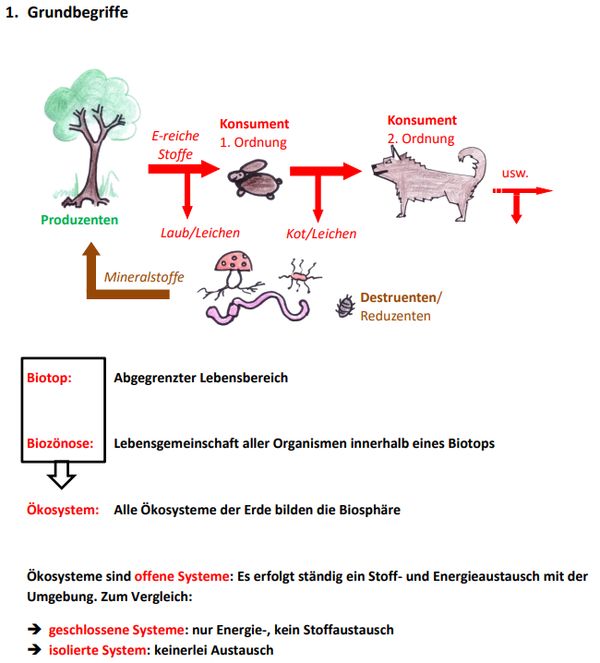
Um wieder in die Thematik hineinzukommen, zunächst eine kleine Wiederholung. In einer der letzten Stunden vor den Ferien wurden Fachbegriffe zum Thema "Ökologie" eingeführt. Im Hefteintrag findet ihr folgendes Bild:
Zu diesem Thema hattet ihr auch schon einmal eine Hausaufgabe auf: Buch S. 63, Aufgabe 1. Wiederholt diese Aufgabe. Dazu müsst ihr auf der linken Seite (S. 62) den blauen "Zettelkasten" lesen. Klickt erst auf "Lösung 1" wenn ihr tatsächlich eine Lösung habt!
Bei dieser Art der Aufgabenstellung macht es Sinn, zunächst die enthaltenen Fachbegriffe (Ökosystem und offen) zu definieren und anschließend die im konkreten Beispiel enthaltenen Elemente den entsprechenden Begriffen zuzuordnen. In diesem Fall also:
Ein Ökosystem setzt sich zusammen aus dem unbelebten Lebensraum, dem Biotop und der Gemeinschaft aller Lebewesen darin, der Biozönose. Ökosysteme sind offene Systeme, das bedeutet, dass sowohl ein Energie- als auch ein Stoffaustausch mit der Umgebung möglich sein muss.
Konkret: Zum Biotop zählen hier das Glas, das Wasser, die Erde (ohne Kleinstlebewesen). Zur Biozönose zählen Bakterien, Kleinstlebewesen (Bärtierchen, Milben), Insekten und Spinnentiere, Moose und evtl. größere Pflanzen.
Wenn man noch genauer vorgehen möchte, könnte man nun noch die Begriffe Produzenten (Moose, Pflanzen), Konsumenten ("Tierchen") und Destruenten (Baterien, Pilze) erwähnen.
Das System ist offen. Energie kann in Form von Sonnenlicht und Wäre durch das Glas ins System hinein und heraus. Auch Stoffe können (wenn die Folie entfernt wird) ausgetauscht werden: Wasser, Gase.
Einflussfaktoren auf Lebewesen
Soviel zur Wiederholung der Grundbegriffe. Analysiert nun die folgenden Bildpaare. Auf beiden sind Lebewesen der selben Art zu sehen, die sich jedoch in gewisser Weise unterscheiden. Überlegt, welcher Faktor diese Unterschiede hervorgerufen haben könnte!
Buchenwald bei Marburg im Winter
Buchenwald bei Marburg im Frühjahr
Viele Laubbäume werfen im Winter all ihre Blätter gleichzeitig ab. Grund dafür ist die Wasserverfügbarkeit. Aufgrund von Frost steht den Bäumen kein flüssiges Wasser mehr im Boden zur Verfügung. Über die Blätter würde aber weiterhin Wasser verdunsten, was Probleme verursacht. Außerdem würden die Zellen des Blattes beim Gefrieren platzen und das Gewebe wäre zerstört (ähnliches passiert z.B. wenn man eine Erdbeere einfriert. Nach dem Auftauchen ist sie quasi Matsch).
Was könnte hier das unterschiedliche Aussehen hervorgerufen haben? (Zum Vergrößern der Bilder anklicken)
Kiefern in Kultur. Alle Bäume wurden gleichzeitig dicht an dicht gepflanzt
Die dicht an dicht stehenden Kiefern wachsen alle gleich schnell in die Höhe. Im unteren Bereich lohnt es sich keine Äste mit Nadeln zu erzeugen, weil dort kein Licht hinkommt. Daher sind diese Bäume nur an der Spitze benadelt, während die freistehende Kiefer bis auf den Boden grüne Nadeln erzeugt.
Letzer Vergleich: Welcher Faktor hat hier Einfluss genommen?
Das Blatt der Kastanie im rechten Bild ist von einem Parasiten befallen: Einer Miniermotte. Die Raupe dieses kleinen Schmetterlings frisst sich durch die mittleren Schichten des Blattes, das an dieser Stelle dann welkt.
Die oberen Bilder zeigen drei Beispiele für Faktoren, die ein Lebewesen beeinflussen können. Schreibt diese auf ein Blatt Papier und findet noch fünf weitere! Denkt dabei an Tiere, Pflanzen, Pilze, Einzeller und Bakterien!
- Temperatur, Licht, Parasiten,
- z.B.: Wasserverfügbarkeit (bzw. Feuchtigkeit),
- Mineralstoffgehalt (gedüngter Boden oder nicht),
- Räuber-Beute-Verhältnis (wie viele Feinde gibt es in dem Revier, in dem ein Tier lebt),
- Konkurrenz (wie viele andere Tiere/Pflanzen leben im gleichen Gebiet)
- Krankheitserreger
Diese Parameter kann man in zwei Gruppen einteilen. Macht das und überlegt euch Überbegriffe für beide Gruppen!

Die richtigen Fachbegriffe biotisch' und abiotisch habt ihr vielleicht nicht gewusst, aber den Unterschied beschreiben konntet ihr wahrscheinlich ganz gut: Die eine Gruppe enthält Faktoren, die mit Lebewesen zusammenhängen (deswegen 'biotisch). Die andere Gruppe eher physikalische, chemische Parameter (deswegen abiotisch; die Vorsilbe a bedeutet oft eine Umkehrung des Begriffs: Wenn sich jemand asozial verhält, dann verhält er sich nicht sozial)
Das WW auf dem Doppelpfeil steht für "Wechselwirkungen". Das bedeutet: Ein Parameter der einen Gruppe kann Einfluss haben auf einen Parameter der anderen Gruppe. Überlegt euch zwei solche Fälle und skizziert diese! ("Skizzieren" heißt hier nicht "zeichnen", sondern "mit Worten grob umschreiben".)
- Zum Beispiel: Eine Pflanzen ist von Blattläusen befallen. Wenn es wärmer wird, vermehren sich diese schneller und schaden der Pflanze stärker. Der Faktor Temperatur hat hier Einfluss auf den Faktor Parasit.
- Misteln sind Pflanzen (vielleicht bekannt aus Asterix und Obelix), die auf den Ästen von Bäumen wachsen und dessen Wasserleitungsbahnen anzapfen. Selbst wenn für den Baum genügend Wasser vorhanden wäre, könnte es sein, dass durch die Mistel die Verfügbarkeit knapp wird. Hier hat also der Faktor Parasit einen Einfluss auf den Faktor Wasserverfügbarkeit.
Anwendung an konkretem Beispiel
- Lest nun die Seiten 64 - 65 im Buch!
- Wenn ihr fertig seid, schließt das Buch und legt es beiseite!
- Klickt auf "Fragen anzeigen" und überprüft, ob ihr die Inhalte des Textes anhand der Fragen wiedergeben könnt!
- Lösung 8 sagt euch, ob ihr richtig gelegen habt.
- Das folgende Bild zeigt die Blättchen eines Waldsauerklees. Sie hängen teilweise nach unten, so als ob die Pflanze welken würde. Dies ist jedoch nicht der Fall. Zeige auf, welcher Umweltfaktor dafür verantwortlich ist!

- Nenne drei weitere Faktoren, die in der oberen Aufzählung noch nicht vorkommen, für den Sauerklee aber laut Text eine wichtige Rolle spielen! Orden die Faktoren den Begriffen "biotisch" oder "abiotisch" zu.
- Pflanzen scheinen ihren Fressfeinden oft hilflos ausgeliefert zu sein. Das stimmt nicht immer. Es gibt viele Strategien, wie sich Pflanzen vor dem Gefressenwerden schützen können. Beschreibe die Strategie des Sauerklees!
- Erkläre, was man unter dem Begriff "Mykorrhiza" versteht!
- Der Wald-Sauerklee ist sehr empfindlich was Sonneneinstrahlung angeht. Um sich vor einer Überlastung zu schützen klappt der seine Blättchen bei zu starkem Lichteinfall nach unten
- Abiotisch: pH-Wert (wie sauer / alkalisch ist der Boden), mechanische Kräfte, wie z.B. Wind; Biotisch: Symbiose mit Pilzen
- Der Wald-Sauerklee produziert spitze Oxalat-Kristalle. Die erschweren das Fressen der Blätter durch Schnecken oder andere Pflanzenfresser
- Als Mykorrhiza bezeichnet man das Zusammenleben einer Pflanze mit einem Pilz zum gegenseitigen Nutzen (Symbiose). Der Pilz besitzt ein großes Netzwerk an Hyphen, mit denen er Wasser und Mineralstoffe aus einem großen Bereich des Bodens aufnehmen kann. Über eine Verbindung mit dem Pilz können diese Stoffe zum Waldsauerklee gelangen. Umgekehrt liefert der Waldsauerklee organische Stoffe (wie. z.B. Zucker), die der Pilz nicht selbst herstellen kann.
Diese Einheit endet hier. Am Ende der nächsten Einheit wird es einen Hefteintrag geben, den ihr euch hier herunterladen und ins Heft kleben bzw. in eurem Ordner abheften könnt.
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
Zu den Arbeitsaufträgen in Bio (Corona)
Zu den Arbeitsaufträgen Chemie (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Error: h5p.org is not an authorized iframe site.<script src="https://h5p.org/sites/all/modules/h5p/library/js/h5p-resizer.js" charset="UTF-8"></script>
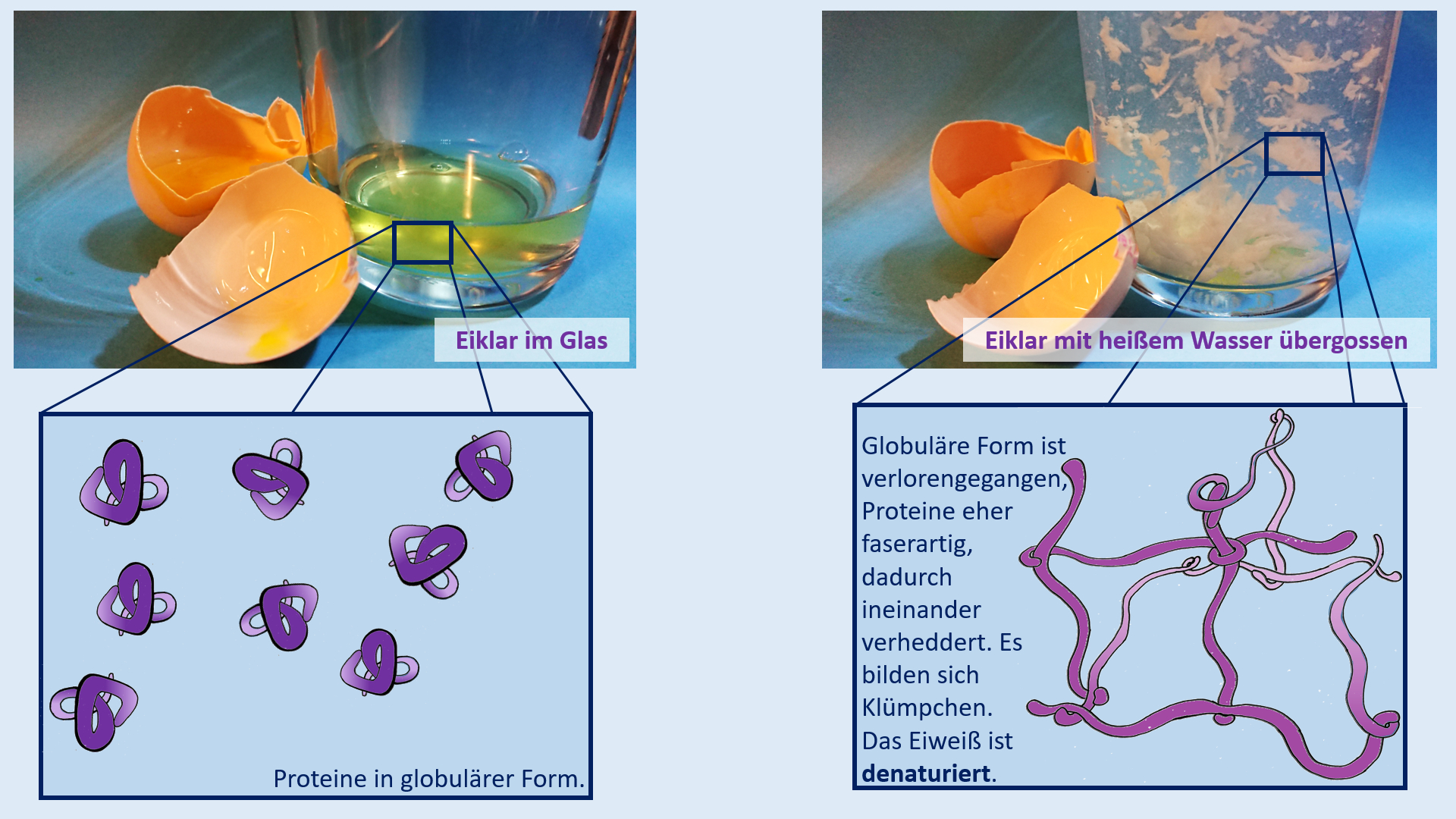
Test. Einheit: Eiweiße
Test Schulentwicklungsteam
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
|
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
|
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Biologie
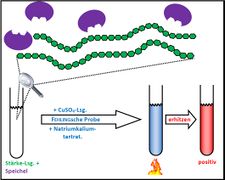
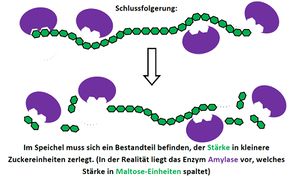
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
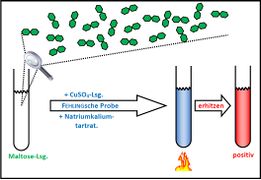
Fehling-Probe mit Maltose
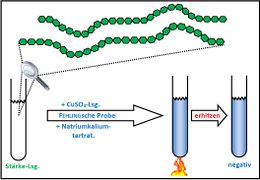
Fehling-Probe mit Stärke und Speichel
Chemie
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
Trennung eines Gemisches aus Sand und Salz
neue Überschrift
Termine
- 15.10.: angekündigter, kleiner Leistungsnachweis
- Lernstoff: Unterrichtsinhalte vom Freitag, 11.10.
|
Externe Links
- im Moment keine externen links -
|
Termine
- 15.10.: angekündigter, kleiner Leistungsnachweis
- Lernstoff: Unterrichtsinhalte vom Freitag, 11.10.
|
Externe Links
- - im Moment keine links -
|
Hefteinträge
1. Evolution
1.1 Ein kurzer historischer Abriss zur Entwicklung des Evolutionsgedankens
Neu, 04.10. Buch S. 17, 28-31 (das Buch ist hier sehr ausführlich) + Hefteintrag:
1.4 Darwins Evolutionstheorie +
Stoff aus der 11. Klasse
Eine Übersicht über wichtige Inhalte des Kapitels "Populationswachstum und Biodiversität" aus der 11. Jahrgangsstufe liefern die folgenden Einträge: