Benutzer:Thomas Lux: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 13: | Zeile 13: | ||
|Titel=<span style="color:#607">'''Arbeitsauftrag Chemie2 (verpflichtend) '''</span> | |Titel=<span style="color:#607">'''Arbeitsauftrag Chemie2 (verpflichtend) '''</span> | ||
|Inhalt= | |Inhalt= | ||
<span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Bitte bearbeitet die | <span style="color:#607">Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!</span><br> | ||
<br> | <br> | ||
'''Die Atombindung (auch: kovalente Bindung)'''<br> | '''Die Atombindung (auch: kovalente Bindung)'''<br> | ||
Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen. <br> | Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen. <br> | ||
Zum Einstieg vielleicht eine kleine Wiederholung: | Zum Einstieg vielleicht eine kleine Wiederholung (ca. 5 Min.): | ||
* Notiere, was "Valenzelektronen" sind! | * Notiere, was "Valenzelektronen" sind! | ||
| Zeile 39: | Zeile 39: | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Beryllium besitzt 2 VE. Um Edelgaskonfiguration zu erreichen, muss es diese beiden abgeben. Es entstehen Be<sup>2+</sup>-Ionen. Brom besitzt 7 VE. Um Edelgaskonfiguration zu erreichen muss es ein Elektron aufnehmen. Es entstehen Br<sup>-</sup>-Ionen. Damit ein neutrales (nicht geladenes) Salz entsteht und keine Elektronen verloren gehen oder übrig bleiben, müssen immer zwei Bromid-Atome mit einem Beryllium-Atom reagieren. Die Formel des entstehenden Salzes lautet dann BeBr<sub>2</sub> | |||
|Lösung 4|Lösung ausblenden}} | |Lösung 4|Lösung ausblenden}} | ||
Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): [https://www.youtube.com/watch?v=PsR-HRiGAzA Hier klicken] | Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): [https://www.youtube.com/watch?v=PsR-HRiGAzA Hier klicken] | ||
<br><br> | |||
Testet, ob ihr die Inhalte des Videos wiedergeben könnt. <br> | |||
<br> | |||
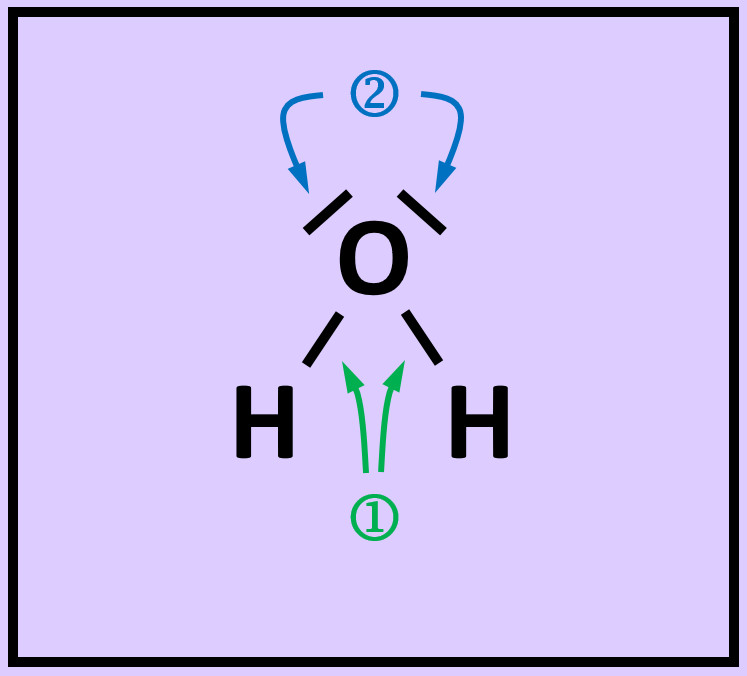
* Das folgende Bild zeigt die Valenzstrichformel des Wassermoleküls. Was bedeuten die mit unterschiedlichen Ziffern markierten Striche? | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_F.jpg]] | |||
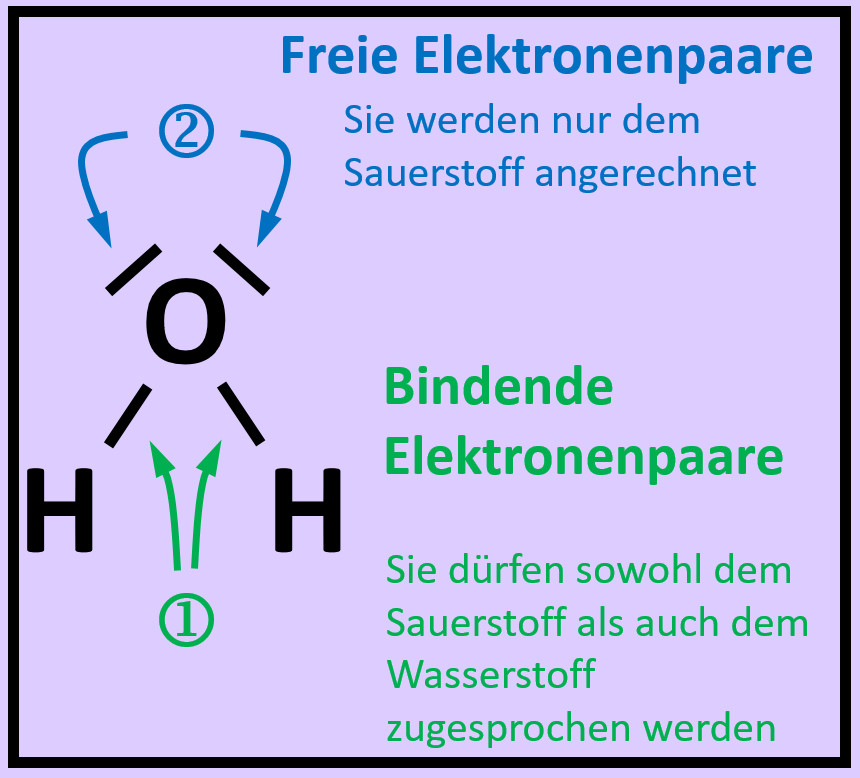
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_ML.jpg]]<br> | |||
Freie Elektronenpaare stammen nur von dem Atom, das sie umgeben. Bei den bindenden Elektronenpaaren stammt ein Elektron vom einen Partner (hier: Sauerstoff) und das andere Elektron vom anderen Partner (hier: Wasserstoff) | |||
|Lösung 5|Lösung ausblenden}} | |||
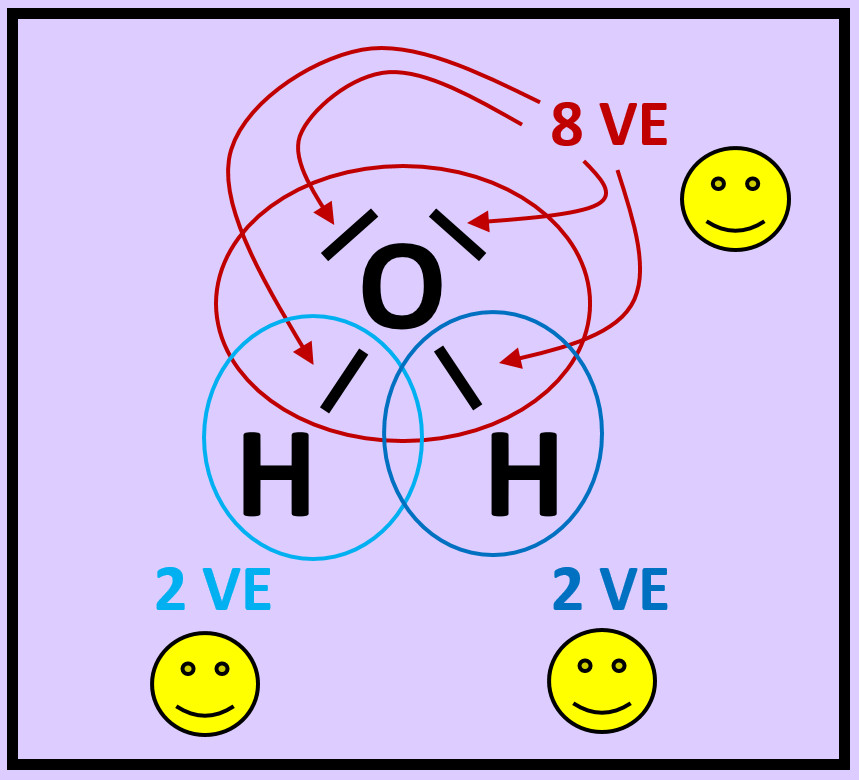
* Zeichnet das Wassermolekül ab. Kreist nun jedes Atom ein. Achtet dabei darauf, dass im Kreis alle Elektronen (freie Elektronenpaare und bindende Elektronenpaare) enthalten sind, die dem Atom zugerechnet werden können! | |||
* Zählt nun die Elektronen, die ihr jedem Atom zugeordnet habt! | |||
* Entscheidet, ob durch diese Anordnung Edelgaskonfiguration erreicht wurde! | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_ePaare_Unterschied_ML2.jpg]]<br> | |||
|Lösung 6|Lösung ausblenden}} | |||
* Warum kann man beim Wasserstoff von Edelgaskonfiguration sprechen, obwohl ihm nur zwei Elektronen zugesprochen werden? | |||
{{Lösung versteckt| | |||
Die beiden Elektronen sitzen auf der innersten Schale, der K-Schale. Damit ist diese voll besetzt. Dies entspricht der Konfiguration von Helium und damit einem Edelgas. | |||
|Lösung 7|Lösung ausblenden}} | |||
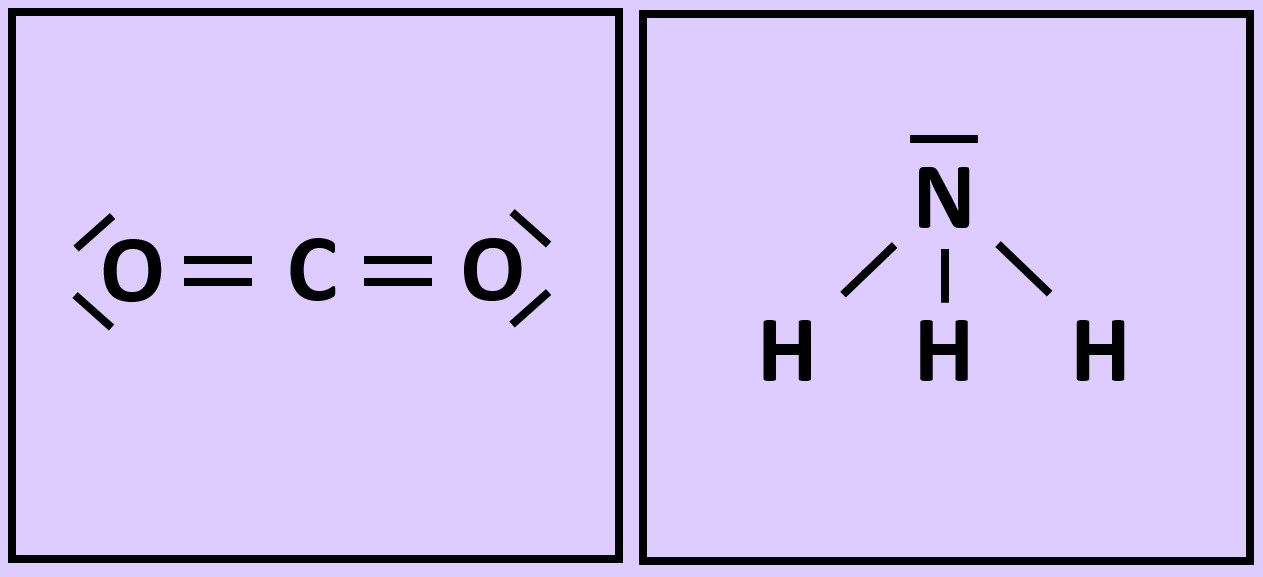
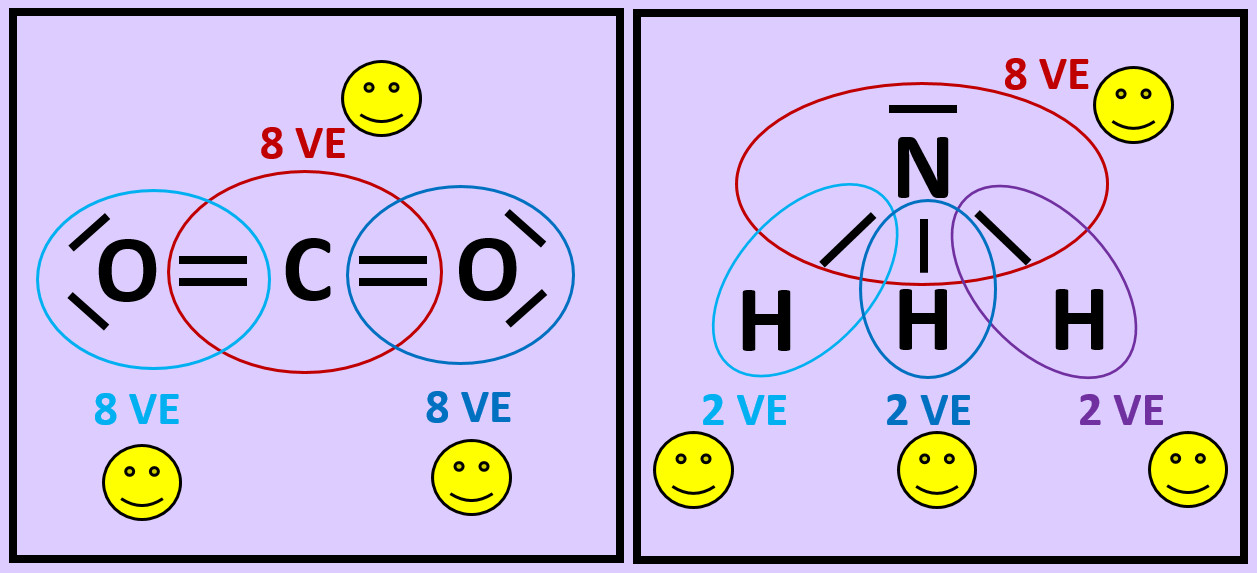
* Wiederholt die vorangegangenen Schritte (Einkreisen der Atome; Zählen der Elektronen; Entscheiden, ob Edelgaskonfiguration vorliegt) für die Moleküle '''"Kohlenstoffdioxid" (CO<sub>2</sub>)''' und '''"Ammoniak" (NH<sub>3</sub>)''' <br> | |||
[[Datei:A2_Atombdg_Co2_NH3_A.jpg]] | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_Co2_NH3_ML.jpg]]<br> | |||
|Lösung 8|Lösung ausblenden}} | |||
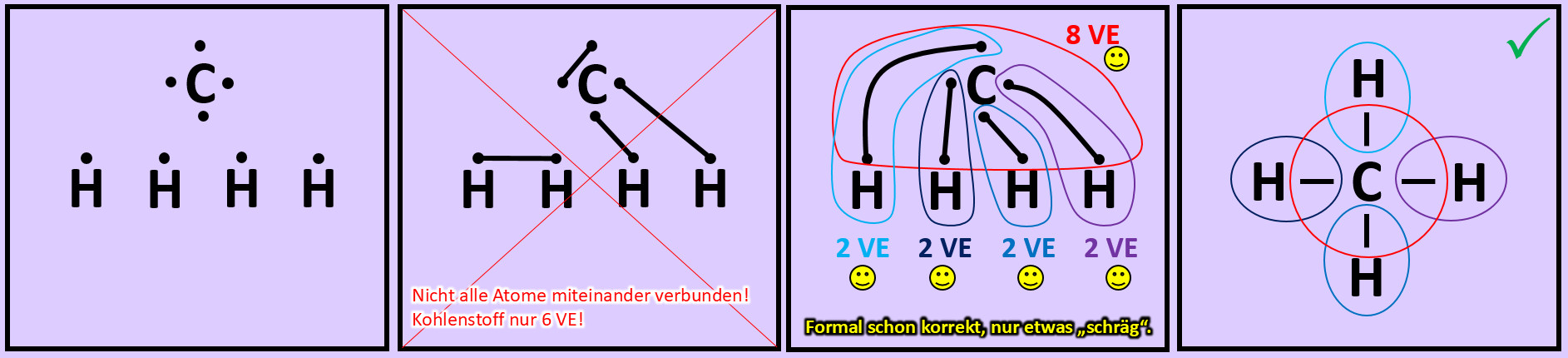
Versucht nun mit Hilfe der Valenzstrichformel selbst ein Molekül zu zeichnen, das ihr noch nicht im Video gesehen habt: '''"Methan" (CH<sub>4</sub>)'''. Geht wie folgt vor: | |||
* Zeichnet die Elementsymbole aller fünf Atome auf das Papier. Tipp: Wählt eine möglichst symmetrische Anordnung. | |||
* Zeichnet nun um jeden Atom die richtige Anzahl an Valenzelektronen. | |||
* Versucht nun die Punkte so zu verbinden, dass alle Atome miteinander zusammenhängen und gleichzeitig Edelgaskonfiguration erreicht wird. | |||
* Hinweis: Wenn man die zwei Valenzelektronen von zwei Wasserstoffen miteinander verbindet, dann besitzen zwar diese beiden Edelgaskonfiguration können aber keine weitere Bindung mehr eingehen. Sie können dann mit den restlichen Atomen nicht mehr verknüpft werden. Man muss also nach einer anderen Lösung suchen... | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_CH4_ML.jpg]]<br> | |||
|Lösung 9|Lösung ausblenden}} | |||
In eurem Buch ist auf der Seite 113 ist ein Verfahren beschrieben, mit dem man die Valenzstrichformeln "berechnen" kann. Ihr dürft das in Zukunft gerne so durchführen. Wenn man etwas übt, dann klappt es aber nach einiger Zeit auch ohne dieses Verfahren. Lest dieses Verfahren jetzt noch nicht, sondern erst als Hausaufgabe. | |||
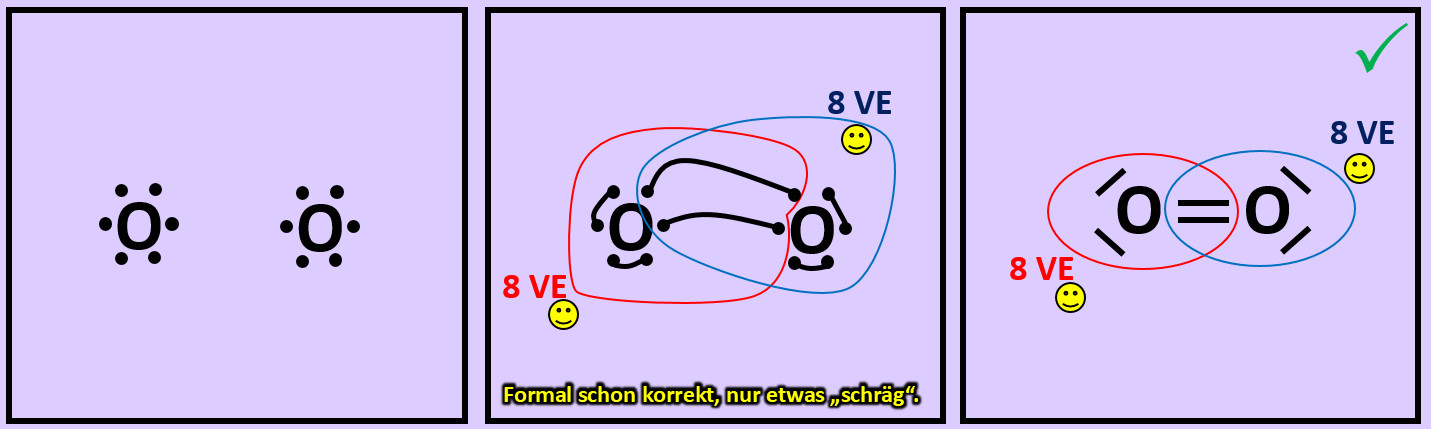
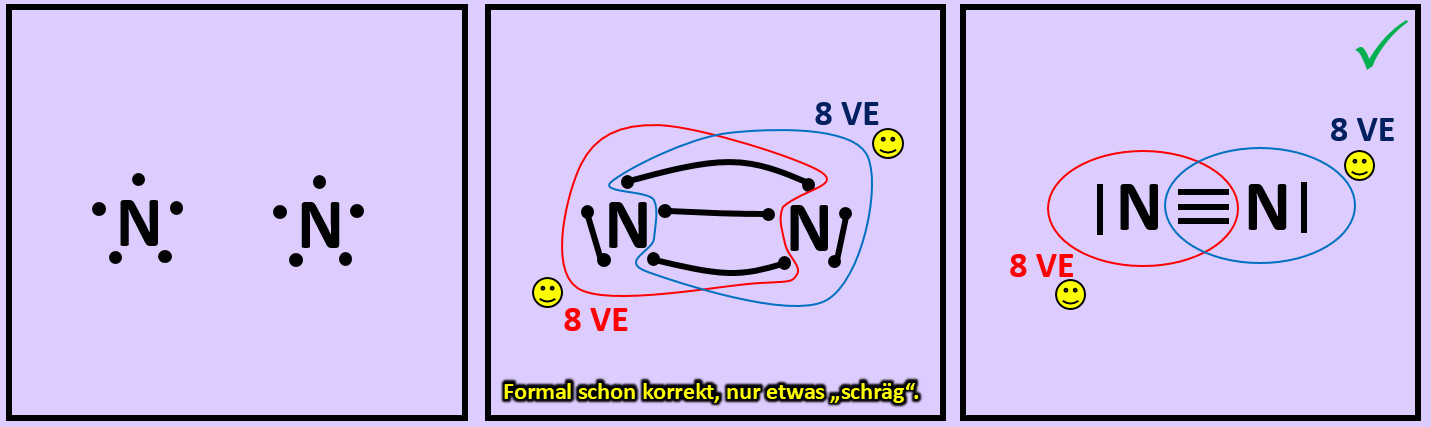
* Versucht erst noch zwei weitere Moleküle mit Hilfe der Valenzstrichformeln darzustellen: '''"Sauerstoff" (O<sub>2</sub>)''' und '''"Stickstoff" (N<sub>2</sub>)''' | |||
{{Lösung versteckt| | |||
[[Datei:A2_Atombdg_O2_ML.jpg]]<br> | |||
[[Datei:A2_Atombdg_N2_ML.jpg]]<br> | |||
|Lösung 10|Lösung ausblenden}} | |||
* Beim Sauerstoffmolekül sind an der Bindung zwischen den beiden Atomen zwei Elektronenpaare, beim Stickstoffmolekül drei beteiligt. Diese Formen von Bindungen haben eigene Namen. Wie nennt man diese Bindungen? | |||
{{Lösung versteckt| | |||
Beim Sauerstoffmolekül: Doppelbindung, beim Stickstoffmolekül: Dreifachbindung. | |||
|Lösung 11|Lösung ausblenden}} | |||
<span style="color:#607">'''Hausaufgabe''': Lest im Buch folgende Abschnitte: S. 107 "Das Konzept der Elektronenpaarbindung", S. 108 komplett, S. 109 "Die Molekülformel". (Hinweis: Der Begriff "stöchiometrische Wertigkeit" spielt im meinen Unterricht keine große Rolle.) Bearbeitet die Aufgaben 1 + 3 auf S. 107<br> | |||
Bitte macht die Hausaufgabe nicht jetzt sofort, sondern am besten erst morgen. Die Lösung wird am Mittwoch eingestellt. </span> | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 48: | Zeile 107: | ||
|Hintergrund= #DCF | |Hintergrund= #DCF | ||
}} | }} | ||
Version vom 21. März 2020, 14:20 Uhr
Hallo! Meine Benutzer-Seite ist eine Art Steinbruch, in der hauptsächlich für mich wichtige Vorlagen liegen und einige Tests laufen...
Zu den Arbeitsaufträgen (Corona)
Zur Schulentwicklungs-Testseite
Zur Studien- und Berufsorientierung
Zur Studien- und Berufsorientierung der Mittelstufe
Biologie-Rätsel des Monats
Error: h5p.org is not an authorized iframe site.<script src="https://h5p.org/sites/all/modules/h5p/library/js/h5p-resizer.js" charset="UTF-8"></script>
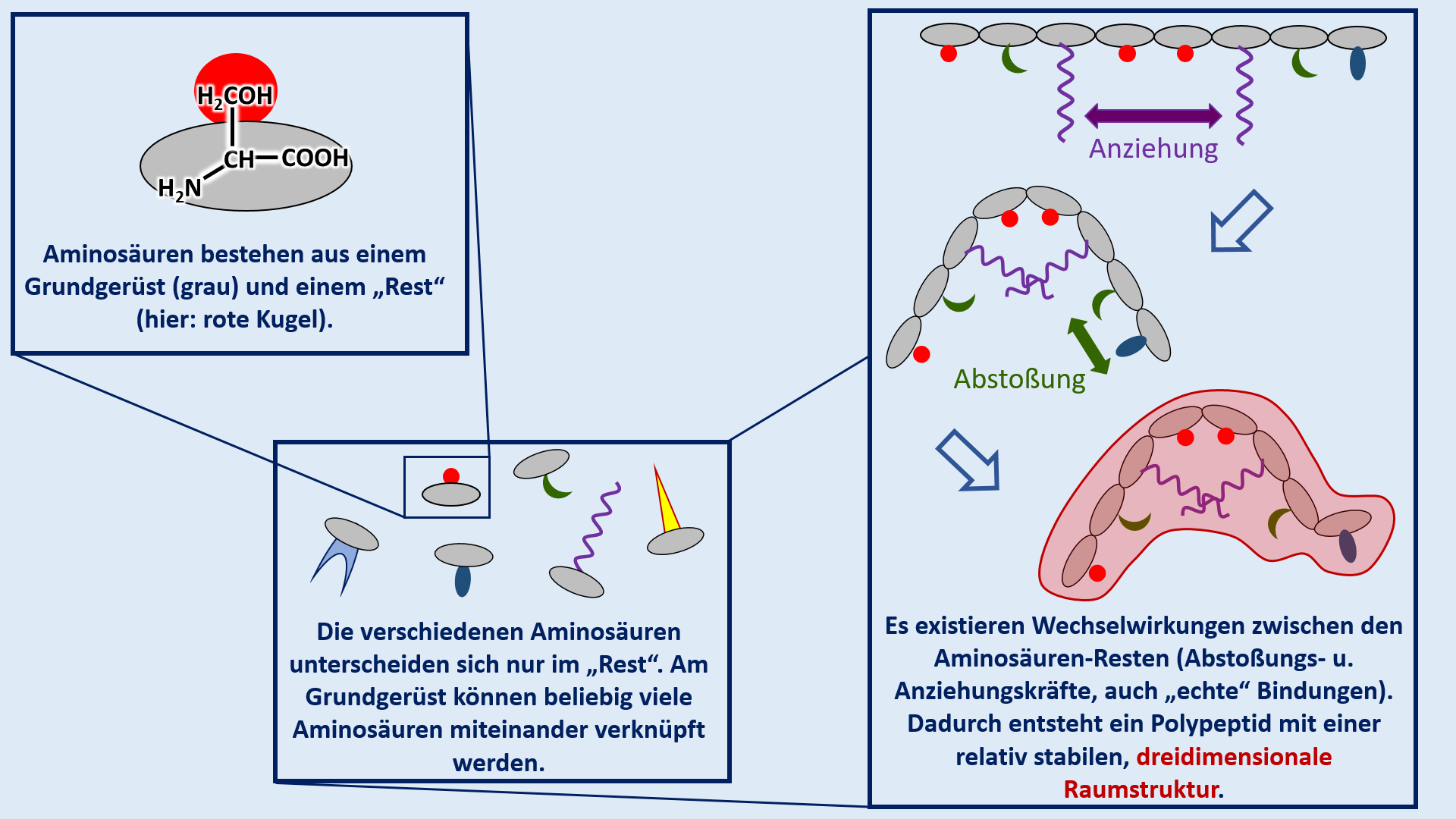
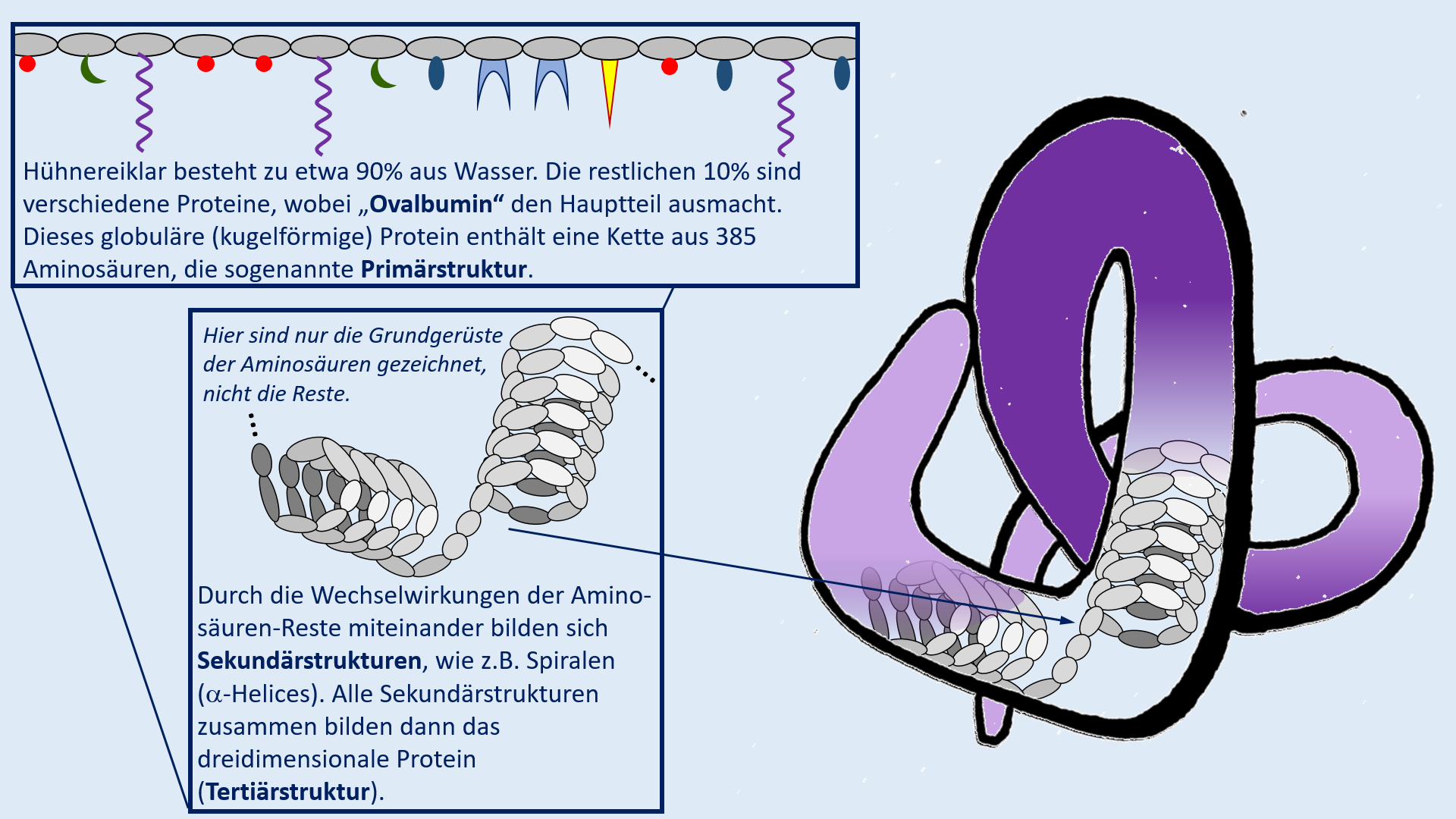
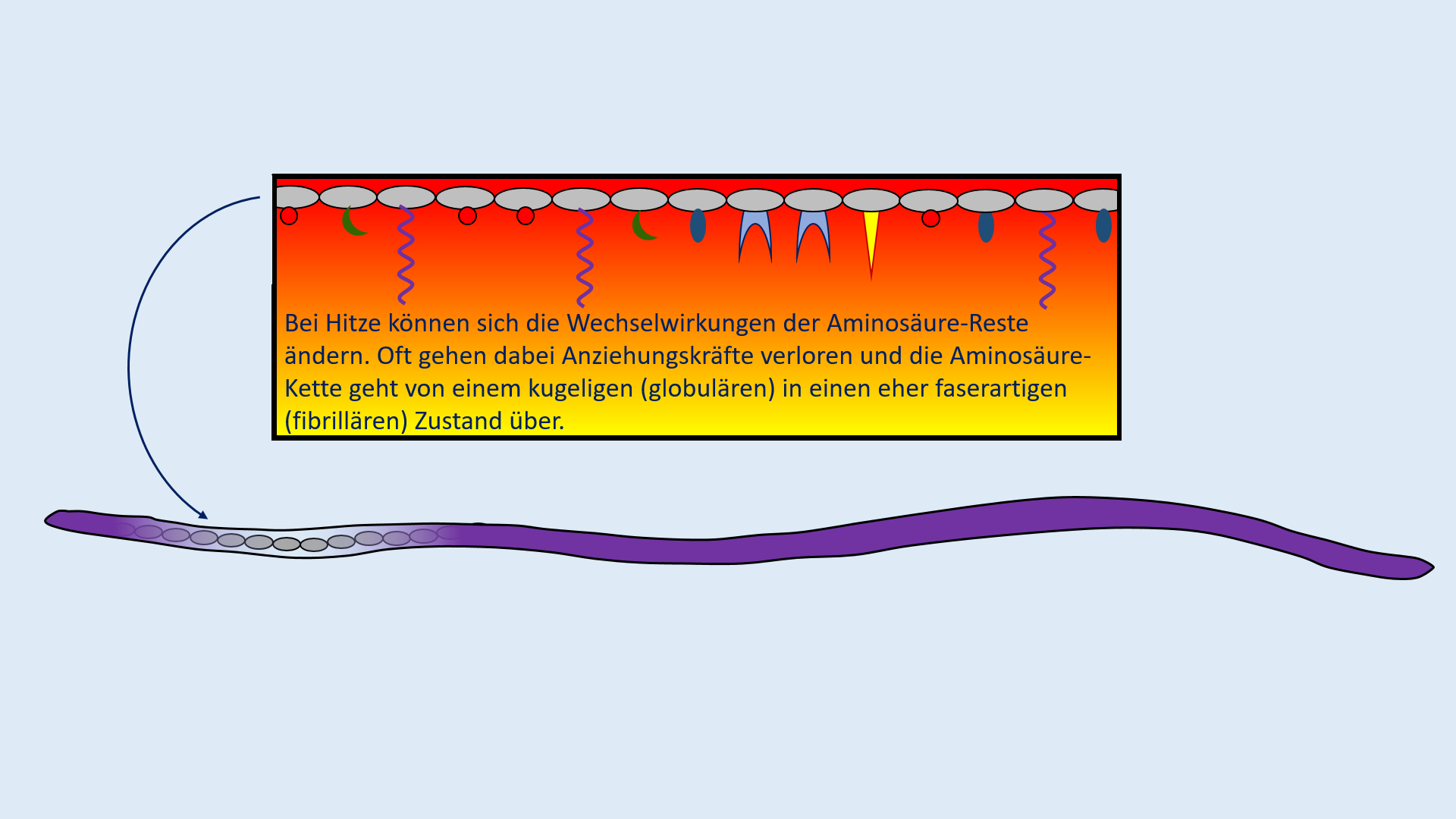
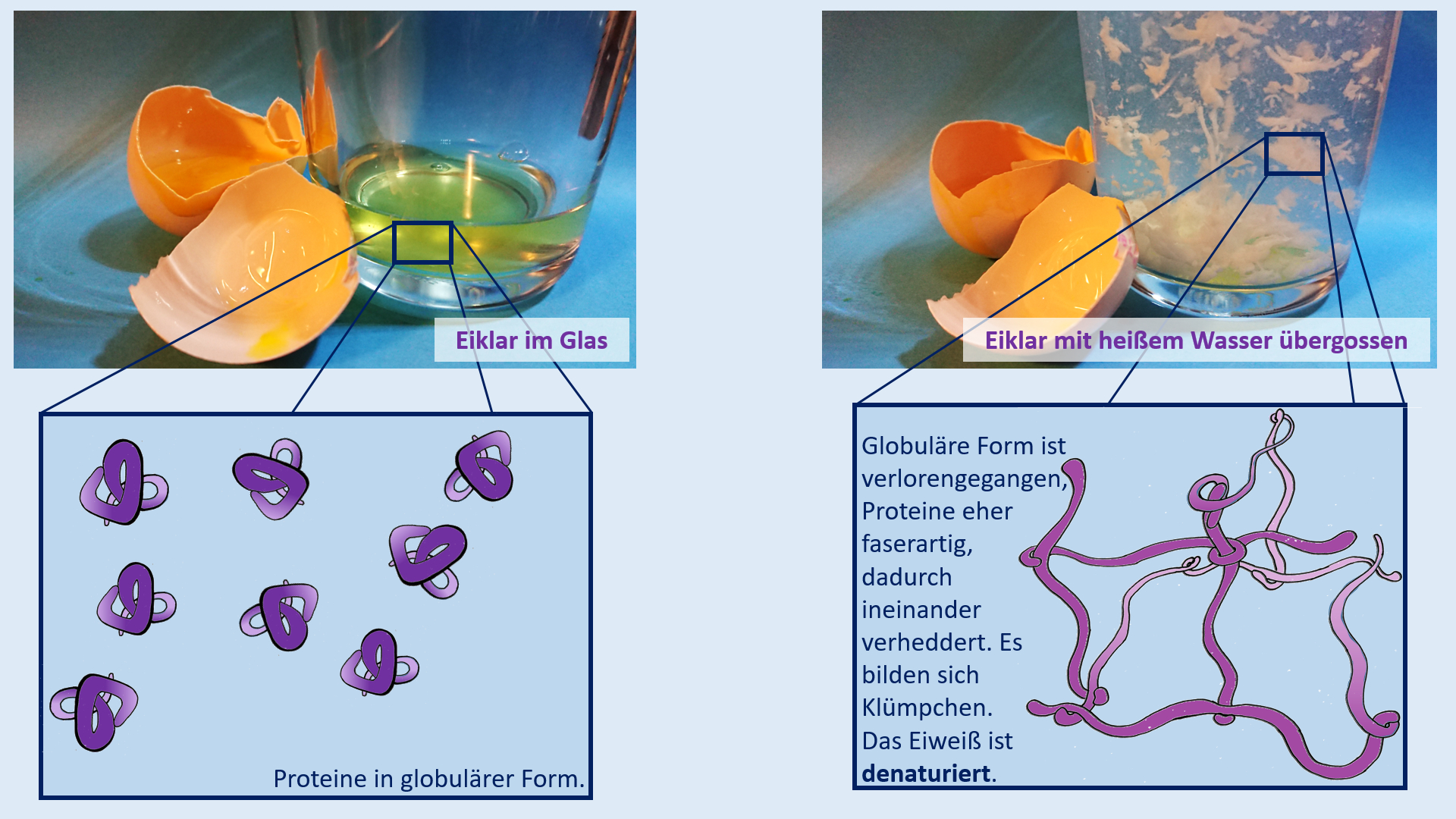
Test. Einheit: Eiweiße
Test Schulentwicklungsteam
|
Respekt und Werte-Erziehung
|
Individuelle Förderung und Individualisierung |
Berufswahlkompetenz
|
Kommunikation
|
Respekt und Werte-Erziehung
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Individuelle Förderung und Individualisierung
- im Moment keine interessanten Fortbildungen zu diesem Thema -
Berufswahlkompetenz
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Kommunikation
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
- Hochinteressante Fortbildung zum Thema Resilienz, bei uns am RMG! 24.10., 19:00 Uhr
- Klicke hier auf diesen [link]
Biologie
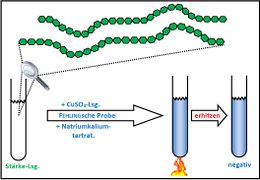
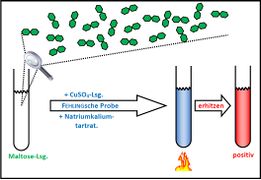
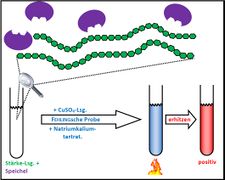
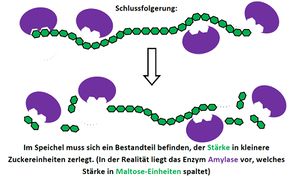
Visualisierung der Unterrichtsversuche zum Thema "Verdauungsprozesse im Mund".
Chemie
Das Anfertigen eines Versuchsprotokolls stellt eine wichtige Grundfertigkeit dar. Auch im Hinblick auf das spätere Erstellen einer Seminararbeit. In den naturwissenschaftlichen Fächern ist die typische Gliederung einer Arbeit nämlich einem Versuchsprotokoll ganz ähnlich. Hier zwei gelungene Beispiele:
neue Überschrift
Termine
|
Externe Links- im Moment keine externen links -
|
Termine
|
Externe Links
|
Hefteinträge
1. Evolution
1.1 Ein kurzer historischer Abriss zur Entwicklung des Evolutionsgedankens
Neu, 04.10. Buch S. 17, 28-31 (das Buch ist hier sehr ausführlich) + Hefteintrag:
1.4 Darwins Evolutionstheorie +
Stoff aus der 11. Klasse
Eine Übersicht über wichtige Inhalte des Kapitels "Populationswachstum und Biodiversität" aus der 11. Jahrgangsstufe liefern die folgenden Einträge: