Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 9: | Zeile 9: | ||
|Titel=<span style="color:#607">'''Wiederholung: Die Bestimmung der absoluten Atommasse'''</span> | |Titel=<span style="color:#607">'''Wiederholung: Die Bestimmung der absoluten Atommasse'''</span> | ||
|Inhalt= | |Inhalt= | ||
Ihr solltet in der letzten Einheit bemerkt haben, dass die "frühen Chemiker" sehr daran interessiert waren, die Masse von einzelnen Atomen zu bestimmen. Diese Atommasse spielt eine wichtige Rolle bei der Berechnung von Mengeneinheiten, um chemische Reaktionen vollständig durchführen zu können. Nachdem es keine Waage gab, mit der man so kleine Massen bestimmen konnte, behalf man sich mit einer willkürlichen Größe: Die atomare Masseneinheit u wurde eingeführt. Man wusste zwar nicht, wie viel Gramm ein Teilchen wog, welches | Ihr solltet in der letzten Einheit bemerkt haben, dass die "frühen Chemiker" sehr daran interessiert waren, die Masse von einzelnen Atomen zu bestimmen. Diese Atommasse spielt eine wichtige Rolle bei der Berechnung von Mengeneinheiten, um chemische Reaktionen vollständig durchführen zu können. Nachdem es keine Waage gab, mit der man so kleine Massen bestimmen konnte, behalf man sich mit einer willkürlichen Größe: Die '''atomare Masseneinheit''' '''''u''''' wurde eingeführt. Man wusste zwar nicht, wie viel Gramm ein Teilchen wog, welches 1'''''u''''' schwer war, aber man konnte bestimmen wie viel '''''u''''' z.B. ein Sauerstoffatom und wie viel '''''u''''' ein Wasserstoffatom wog. So konnte man die Atome von unterschiedlichen Elementen vergleichen.<br> | ||
Mit Hilfe von Massenspektrometern gelang es irgendwann, für die atomare Masseneinheit u einen Wert in Gramm zu bestimmen, es gilt:<br> | Mit Hilfe von Massenspektrometern gelang es irgendwann, für die '''atomare Masseneinheit''' '''''u''''' einen Wert in Gramm zu bestimmen, es gilt:<br> | ||
<br> | <br> | ||
1u = 1,66 x 10<sup>-24</sup>g <br> | ''1u = 1,66 x 10<sup>-24</sup>g'' <br> | ||
<br> | <br> | ||
Damit lassen sich nun schon ein paar einfache Aufgaben rechnen. Um zu unterscheiden, ob man von der Masse eines Teilchens in g oder der atomaren Masseneinheit in u spricht, gibt es die zwei Variablen m(X) und m<sub>a</sub>(X). X steht dabei für | Damit lassen sich nun schon ein paar einfache Aufgaben rechnen. Um zu unterscheiden, ob man von der '''Masse''' eines Teilchens in '''''g''''' oder der '''atomaren Masseneinheit''' in '''''u''''' spricht, gibt es die zwei Variablen '''m(X)''' für die "normale" '''Masse '''und '''m<sub>a</sub>(X)''' für die '''atomare Masseneinheit'''. X steht dabei für die Teilchen, das man betrachtet. Die folgenden Ausdrücke bedeuten dann folgendes:<br> | ||
<br> | <br> | ||
m(O) = 2,658 x 10<sup>-23</sup>. | m(O-Atom) = 2,658 x 10<sup>-23</sup>g. | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Die Masse eines Sauerstoffatoms beträgt zwei Komma sechs fünf acht mal zehn hoch minus dreiundzwanzig Gramm. | Die Masse eines Sauerstoffatoms beträgt zwei Komma sechs fünf acht mal zehn hoch minus dreiundzwanzig Gramm. | ||
| Zeile 36: | Zeile 36: | ||
|Lösung|Lösung ausblenden}}<br> | |Lösung|Lösung ausblenden}}<br> | ||
<br> | <br> | ||
Mit Hilfe des oben beschriebenen Zusammenhangs zwischen der Masse in g und der atomaren Masseneinheit in u lassen sich die beiden Größen auch leicht ineinander umwandeln: <br> | Mit Hilfe des oben beschriebenen Zusammenhangs zwischen der '''Masse in ''g''''' und der '''atomaren Masseneinheit in ''u''''' lassen sich die beiden Größen auch leicht ineinander umwandeln: <br> | ||
<br> | <br> | ||
<br> | <br> | ||
<br> | <br> | ||
Berechne die Masse eines Sauerstoffmoleküls in u! (Die Masse in Gramm ist oben bereits angegeben) | Berechne die Masse eines Sauerstoffmoleküls in '''''u'''''! (Die Masse in Gramm ist oben bereits angegeben) | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
| Zeile 50: | Zeile 50: | ||
|Lösung|Lösung ausblenden}}<br> | |Lösung|Lösung ausblenden}}<br> | ||
<br> | <br> | ||
Man sollte meinen, nachdem man jetzt die atomare Masseneinheit auch in Gramm bestimmen kann, ist die Angabe in u doch nicht mehr nötig. Es war doch nur eine Hilfsgröße, solange man das Gewicht von Atomen noch nicht direkt bestimmen konnte. Die Einheit hat sich aber gehalten, denn sie ist (unter anderem) in folgendem Punkt ganz praktisch: Sie lässt sich einfacher schreiben! Nehmt an, ihr habt ein Molekül "XYZ", für das gilt: m<sub>a</sub>(XYZ) = 212,3u und m(XYZ) = 3,5 x 10<sup>-24</sup>g <br>. Versucht beide Angaben | Man sollte meinen, nachdem man jetzt die atomare Masseneinheit auch in Gramm bestimmen kann, ist die Angabe in '''''u''''' doch nicht mehr nötig. Es war doch nur eine Hilfsgröße, solange man das Gewicht von Atomen noch nicht direkt bestimmen konnte. Die Einheit hat sich aber gehalten, denn sie ist (unter anderem) in folgendem Punkt ganz praktisch: Sie lässt sich einfacher schreiben! Nehmt an, ihr habt ein Molekül "XYZ", für das gilt: m<sub>a</sub>(XYZ) = 212,3u und m(XYZ) = 3,5 x 10<sup>-24</sup>g <br>. Versucht beide Angaben in einem Word-Dokument zu schreiben! Das geht mit der atomaren Masseneinheit sehr leicht, mit der "normalen" Masse tut man sich deutlich schwerer. Dieses "Zehn hoch irgendwas" ist einfach umständlich.<br> | ||
<br> | <br> | ||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 61: | Zeile 61: | ||
|Titel=<span style="color:#607">'''Molekül- und Formelmassen'''</span> | |Titel=<span style="color:#607">'''Molekül- und Formelmassen'''</span> | ||
|Inhalt= | |Inhalt= | ||
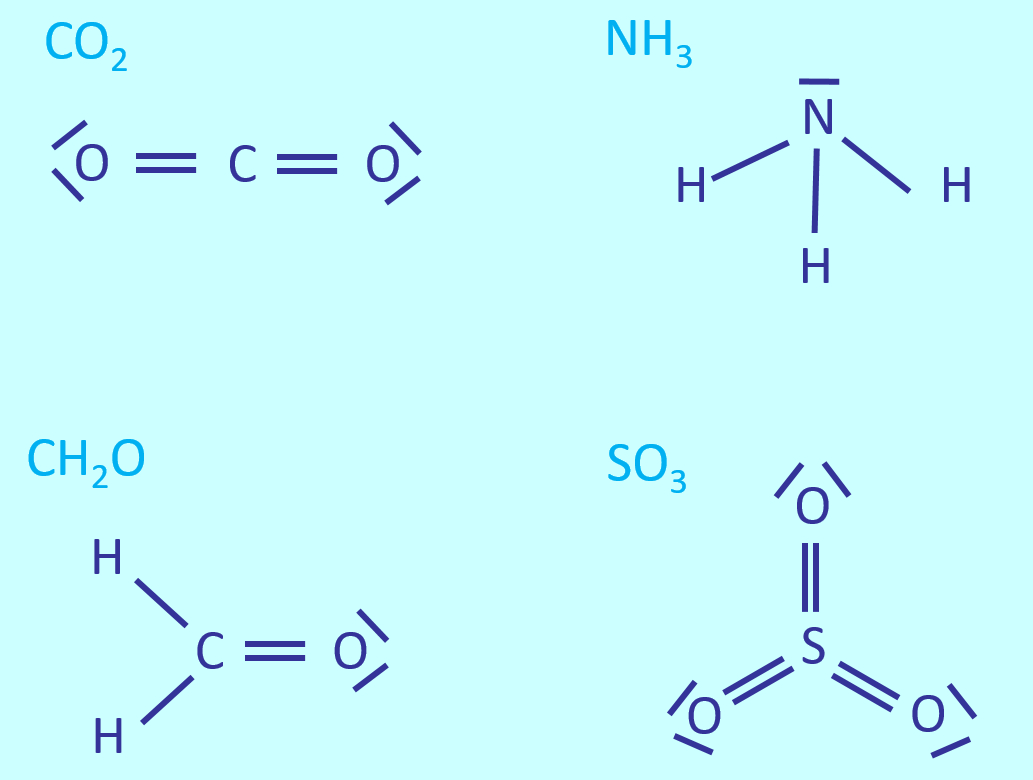
Wenn ihr eure Hausaufgabe gemacht habt und das Buch auf den Seiten 34 - 35 gelesen habt, dann wisst ihr schon, dass man die Masse von Molekülen oder die Formelmasse von Salzen, gemessen in der atomaren Masseneinheit u, ganz einfach bestimmen kann, indem man die | Wenn ihr eure Hausaufgabe gemacht habt und das Buch auf den Seiten 34 - 35 gelesen habt, dann wisst ihr schon, dass man die Masse von Molekülen oder die Formelmasse von Salzen, gemessen in der atomaren Masseneinheit '''''u''''', ganz einfach bestimmen kann, indem man die Masseneinheiten der einzelnen Atome, die am Aufbau des Moleküls oder der Formelmasse beteiligt sind, zusammenzählt. Bsp.: Möchte man die Masse eines Schwefelsäure-Moleküls (H<sub>2</sub>SO<sub>4</sub>) wissen (in '''''u'''''), dann addiert man einfach die Masseneinheiten der am Aufbau beteiligten Atome, also: 2 x m<sub>a</sub>(H) + m<sub>a</sub>(S) + 4 x m<sub>a</sub>(O). <br> | ||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]]<br> | [[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]]<br> | ||
<br> | <br> | ||
Das leuchtet vermutlich den meisten ein, aber die große Frage ist doch: Woher weiß man die Werte für die einzelnen Atome? - Sie stehen im Periodensystem! Nehmt das Periodensystem im Buch auf der letzten Seite zur Hand. Ihr erkennt im oberen weißen Feld "Erklärungen", dass die Zahl links oberhalb des Elementsymbols die Atommasse in u angibt.<br> | Das leuchtet vermutlich den meisten ein, aber die große Frage ist doch: Woher weiß man die Werte für die einzelnen Atome? - Sie stehen im Periodensystem! Nehmt das Periodensystem im Buch auf der letzten Seite zur Hand. Ihr erkennt im oberen weißen Feld "Erklärungen", dass die Zahl links oberhalb des Elementsymbols die Atommasse in '''''u''''' angibt.<br> | ||
Berechnet nun mit Hilfe des PSEs die Molekülmassen von: <br> | Berechnet nun mit Hilfe des PSEs die Molekülmassen von: <br> | ||
* Adrenalin (ein Hormon, welches euer Körper in stressigen Situationen ausschüttet), chem. Formel: C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub> | * Adrenalin (ein Hormon, welches euer Körper in stressigen Situationen ausschüttet), chem. Formel: C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub> | ||
| Zeile 82: | Zeile 82: | ||
|Titel=<span style="color:#607">'''Das Mol'''</span> | |Titel=<span style="color:#607">'''Das Mol'''</span> | ||
|Inhalt= | |Inhalt= | ||
Mit dem nun verfügbaren Atomgewicht könnte man theoretisch schon arbeiten. Betrachten wir noch einmal das Beispiel aus der letzten Einheit | Mit dem nun verfügbaren Atomgewicht könnte man theoretisch schon arbeiten. Betrachten wir noch einmal das Beispiel aus der letzten Einheit. Es ging um die chemische Reaktion: Eisen reagiert mit Schwefel zu Pyrit: <br> | ||
<br> | |||
Fe + 2 S --> FeS<sub>2</sub><br> | |||
<br> | |||
Diese chemische Gleichung sagt aus, dass man doppelt so viele Schwefel-Atome wie Eisenatome braucht, damit alles miteinander reagiert und nichts übrig bleibt. Angenommen ihr habt einen Teelöffel voll Eisenpulver und wollte exakt die Menge Schwefel dazugeben, die nötig ist, um alles vollständig in Pyrit umzuwandeln. Dann könnte man jetzt die Portion Eisen wiegen, mit Hilfe der Atommasse von Eisen ausrechnen, wie viele Atome das sind. Diese Anzahl verdoppeln und dann ausrechnen, welche Masse diese Anzahl an Schwefelatomen hat. Diese Menge könnte man dann abwiegen. Das folgende Bild veranschaulicht den Rechenweg: <br> | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]]<br> | [[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]]<br> | ||
Das wirkt noch etwas umständlich... <br> | Das wirkt noch etwas umständlich... <br> | ||
Bei dieser Berechnung tauchen wieder sehr große Zahlen auf: Die Anzahl der Teilchen | Bei dieser Berechnung tauchen nämlich wieder sehr große, unhandliche Zahlen auf: Die Anzahl der Teilchen. Diese wird in der Chemie mit einem N(X) gekennzeichnet. Also z.B. kann man den Satz: "In meinem Zimmer liegen 3208 Legosteine auf dem Boden mathematisch so formulieren: <br> | ||
<br> | <br> | ||
N(Legosteine) = 3208<br> | N(Legosteine) = 3208<br> | ||
| Zeile 91: | Zeile 95: | ||
Weil Atome so klein sind, befinden sich in den 6,0g Eisen einfach unglaublich viele Atome: Die Anzahl beträgt N(Fe) = 6,0 x 10<sup>22</sup>. Eine Zahl mit dreiundzwanzig Stellen (!), in Worten also ungefähr 600 Trilliarden Atome...<br> | Weil Atome so klein sind, befinden sich in den 6,0g Eisen einfach unglaublich viele Atome: Die Anzahl beträgt N(Fe) = 6,0 x 10<sup>22</sup>. Eine Zahl mit dreiundzwanzig Stellen (!), in Worten also ungefähr 600 Trilliarden Atome...<br> | ||
Daher hat man sich etwas einfacheres ausgedacht: Man betrachtet einfach eine sehr große Menge an Teilchen und gibt dieser Anzahl einen bestimmten Namen. Das ist nicht so ungewöhnlich, wie es vielleicht im ersten Moment klingt. Ihr kennt z.B. sicher den Ausdruck "ein Dutzend" für die Anzahl 12. (Wo jetzt genau der Sinn darin liegt zu sagen, "Ich hole beim Bauern ein Dutzend Eier" anstatt "Ich hole beim Bauern zwölf Eier", kann ich euch auch nicht genau sagen. Aber das Phänomen gibt es eben. Fragt mal eure Oma ob sie den Begriff "Schock" noch kennt, für eine Anzahl an z.B. Eiern).<br> | Daher hat man sich etwas einfacheres ausgedacht: Man betrachtet einfach eine sehr große Menge an Teilchen und gibt dieser Anzahl einen bestimmten Namen. Das ist nicht so ungewöhnlich, wie es vielleicht im ersten Moment klingt. Ihr kennt z.B. sicher den Ausdruck "ein Dutzend" für die Anzahl 12. (Wo jetzt genau der Sinn darin liegt zu sagen, "Ich hole beim Bauern ein Dutzend Eier" anstatt "Ich hole beim Bauern zwölf Eier", kann ich euch auch nicht genau sagen. Aber das Phänomen gibt es eben. Fragt mal eure Oma ob sie den Begriff "Schock" noch kennt, für eine Anzahl an z.B. Eiern).<br> | ||
In der Chemie hat man nun den Begriff "Mol" eingeführt. Das ist die Bezeichnung für eine bestimmte Anzahl an Teilchen, nämlich 6,022 x 10<sup>23</sup>.<br> | In der Chemie hat man nun den Begriff '''"Mol"''' eingeführt. Das ist die Bezeichnung für eine bestimmte Anzahl an Teilchen, nämlich 6,022 x 10<sup>23</sup>. Man nennt diesen Wert auch Avogadro-Konstante N<sub>A</sub> = 6,022 x 10<sup>23</sup> '''''1/mol'''''<br> | ||
<br> | <br> | ||
'''Freiwilliger Test:'''<br> | '''Freiwilliger Test:'''<br> | ||
| Zeile 99: | Zeile 103: | ||
Ergebnis? - Seht ihr, die Einheit "Mol" ist eben praktisch. | Ergebnis? - Seht ihr, die Einheit "Mol" ist eben praktisch. | ||
<br> | <br> | ||
Warum jetzt ausgerechnet 6,022 x 10<sup>23</sup>? - Das ist genialer Schachzug der Chemiker gewesen. Diese Zahl wurde deshalb gewählt, weil dann die im PSE angegebene atomare Masseneinheit genau übereinstimmt mit der Masse in g, die ein Mol dieser Teilchen wiegt. <br> | Warum jetzt ausgerechnet 6,022 x 10<sup>23</sup>? - Das ist genialer Schachzug der Chemiker gewesen. Diese Zahl wurde deshalb gewählt, weil dann die im PSE angegebene atomare Masseneinheit genau übereinstimmt mit der Masse in '''''g''''', die ein Mol dieser Teilchen wiegt. <br> | ||
Nochmal langsam, zum mitschreiben: Die Zahl, die oben links bei den Elementsymbolen im PSE steht, gibt also nicht nur die Masse eines Atoms dieses Elements in u an, sondern gleichzeitig entspricht dieser Wert der Masse in g von einem Mol dieser Atome. - Wahnsinn! Diese Chemiker..., das sind vielleicht Teufelskerle!<br> | Nochmal langsam, zum mitschreiben: Die Zahl, die oben links bei den Elementsymbolen im PSE steht, gibt also nicht nur die Masse eines Atoms dieses Elements in '''''u''''' an, sondern gleichzeitig entspricht dieser Wert der Masse in '''''g''''' von einem Mol dieser Atome. - Wahnsinn! Diese Chemiker..., das sind vielleicht Teufelskerle!<br> | ||
Und jetzt wieder ernst: Diese Größe, also die Masse, die ein Mol eines Stoffes in g wiegt, nennt man Molare Masse M(X). Ein Beispiel: "Die molare Masse von Wasser, also diejenige Masse in Gramm, die ein Mol Wassermoleküle wiegen, beträgt 18 g/mol." oder in Form einer mathematischen Gleichung: M(H<sub>2</sub>O) = 18 g/mol.<br> | Und jetzt wieder ernst: Diese Größe, also die Masse, die ein Mol eines Stoffes in '''''g''''' wiegt, nennt man '''Molare Masse M(X)'''. Ein Beispiel: "Die molare Masse von Wasser, also diejenige Masse in Gramm, die ein Mol Wassermoleküle wiegen, beträgt 18'''''g/mol'''''." oder in Form einer mathematischen Gleichung: M(H<sub>2</sub>O) = 18'''''g/mol'''''.<br> | ||
Die Variable, um eine Anzahl in Mol zu messen, nennt man "Stoffmenge", sie wird mit einem kleinen n(X) gekennzeichnet, die Einheit Mol wird abgekürzt mit mol. Wenn man also sagen möchte: " | Die Variable, um eine Anzahl in Mol zu messen, nennt man '''"Stoffmenge"''', sie wird mit einem kleinen '''n(X)''' gekennzeichnet, die Einheit Mol wird abgekürzt mit '''''mol'''''. Wenn man also sagen möchte: "Ich habe heute 2 Mol Erdbeeren gepflückt, dann kann man das so formulieren: <br> | ||
n(Erdbeeren) = 2mol (Dieser Wert ist völlig unrealistisch. So viele Erdbeeren gibt es auf der ganzen Welt nicht) | n(Erdbeeren) = 2mol (Dieser Wert ist völlig unrealistisch. So viele Erdbeeren gibt es auf der ganzen Welt nicht) | ||
'''Test''':<br> | '''Test''':<br> | ||
| Zeile 116: | Zeile 120: | ||
'''Einfache Aufgaben'''<br> | '''Einfache Aufgaben'''<br> | ||
* Es liegen 14, | * Es liegen 14,007'''''g''''' Stickstoffatome vor. Wie viel Mol sind das? | ||
* Wie viel Gramm wiegen 2 Mol Kohlenstoffatome? | * Wie viel Gramm wiegen 2 Mol Kohlenstoffatome? | ||
* Im Jahr 2018 wurden grob geschätzt 4 x 10<sup>11</sup> Äpfel auf der ganzen Welt geerntet. Wie viel Mol sind das? | * Im Jahr 2018 wurden grob geschätzt 4 x 10<sup>11</sup> Äpfel auf der ganzen Welt geerntet. Wie viel Mol sind das? | ||
| Zeile 122: | Zeile 126: | ||
|Lösung|Lösung ausblenden}}<br> | |Lösung|Lösung ausblenden}}<br> | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 137: | Zeile 136: | ||
|Inhalt= | |Inhalt= | ||
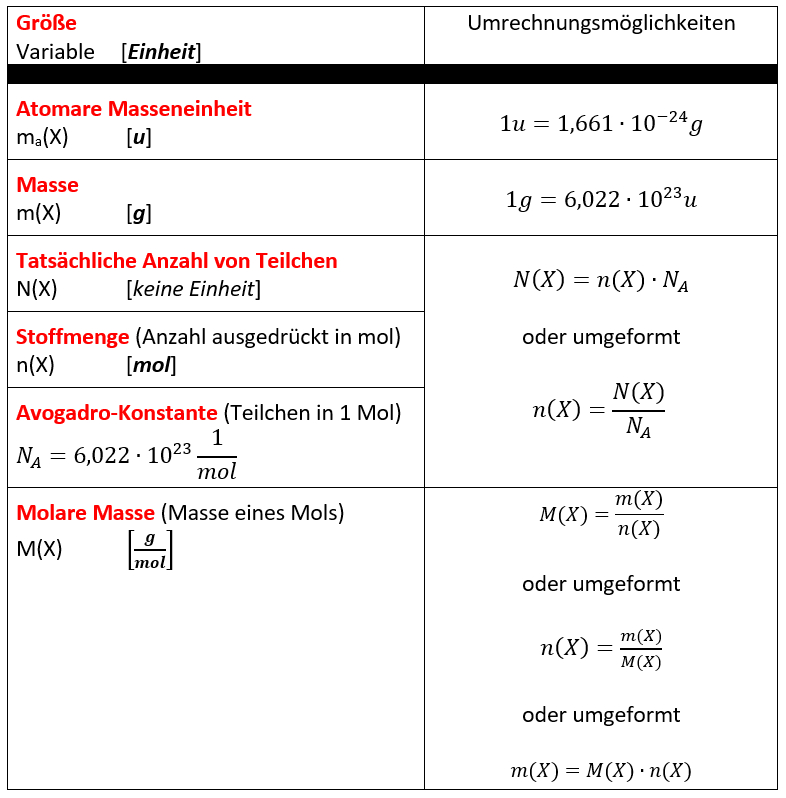
Die einfachen Berechnungen in den oberen Kästen waren mehr so... "freestyle". Viele von euch werden die Aufgaben relativ problemlos lösen können. Manche brauchen aber vielleicht etwas mehr Struktur. Deswegen hier eine ganz klare Übersicht über die bisher besprochenen Größen und ein paar Gleichungen zum Umrechnen: <br> | Die einfachen Berechnungen in den oberen Kästen waren mehr so... "freestyle". Viele von euch werden die Aufgaben relativ problemlos lösen können. Manche brauchen aber vielleicht etwas mehr Struktur. Deswegen hier eine ganz klare Übersicht über die bisher besprochenen Größen und ein paar Gleichungen zum Umrechnen: <br> | ||
[[Datei:Übersicht_Größen1.jpg]] | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
| Zeile 146: | Zeile 146: | ||
|Lösung|Lösung ausblenden}}<br> | |Lösung|Lösung ausblenden}}<br> | ||
Als Hausaufgabe lest ihr im Buch die folgenden Absätze in eurem Buch: | |||
* Die Teilchenzahl (S. 36) | |||
* Die Stoffmenge (S. 36-37) | |||
* Teilchenzahl und Stoffmenge (S. 37) | |||
* Teilchenzahl und Masse (S. 37) | |||
* Molare Masse und molares Volumen (S. 38) | |||
* Die molare Masse (S. 38) | |||
Zusätzlich erhaltet ihr hier ein Arbeitsblatt mit Übungsaufgaben. Bitte haltet dieses Übungsblatt für morgen, Dienstag in der Nachmittagsstunde bereit. Wir werden eine Videokonferenz durchführen. | |||
* Hefteinträge zu dieser und letzter Stunde: [[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
* Arbeitsblatt mit Übungsaufgaben: [[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
Version vom 17. Januar 2021, 10:08 Uhr
Distanzunterricht Montag, 18.01.
In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:
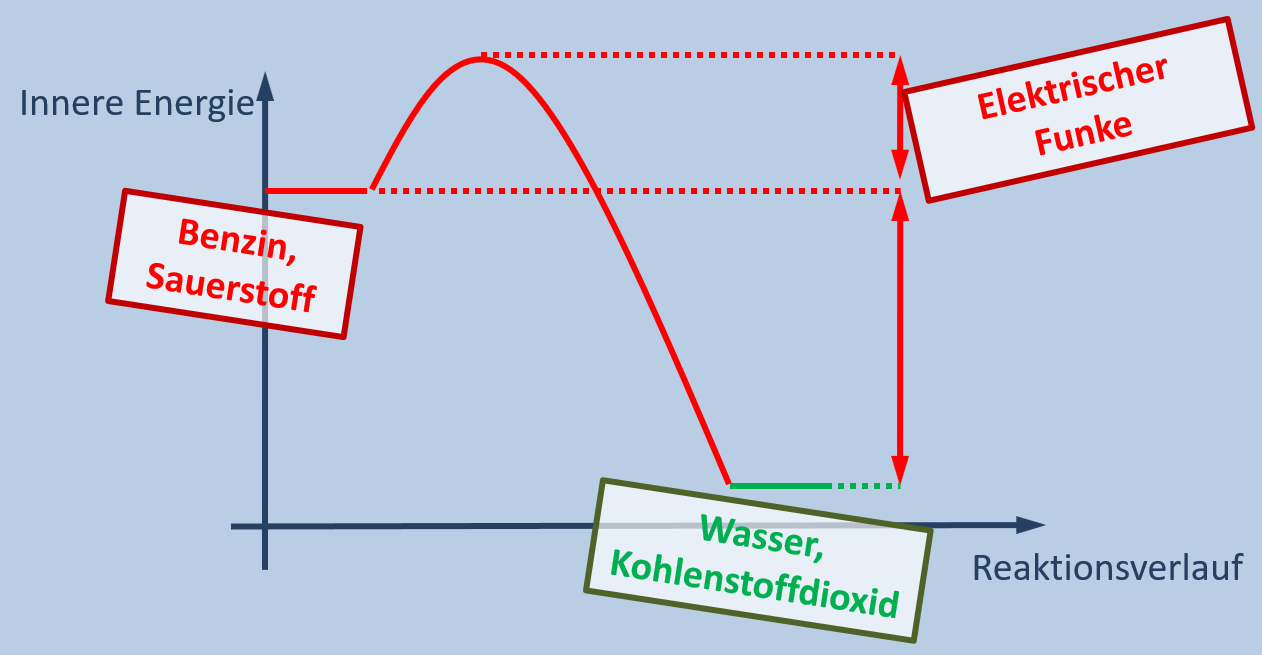
"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."
Bis dahin müssen jedoch noch einige geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an.
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Freitag, 15.01. Chemie
Bitte bearbeitet die folgende Einheit am besten in der eigentlichen Unterrichtszeit von 08:45 - 09:30 Uhr. Ihr benötigt das Arbeitsblatt, welches ihr vor den Ferien erhalten habt und auf dem die Vorderseite bereits ausgefüllt ist. Solltet ihr das AB nicht mehr finden, könnt ihr es hier noch einmal herunterladen:
pdf-Datei
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Donnerstag, 14.01. Bio