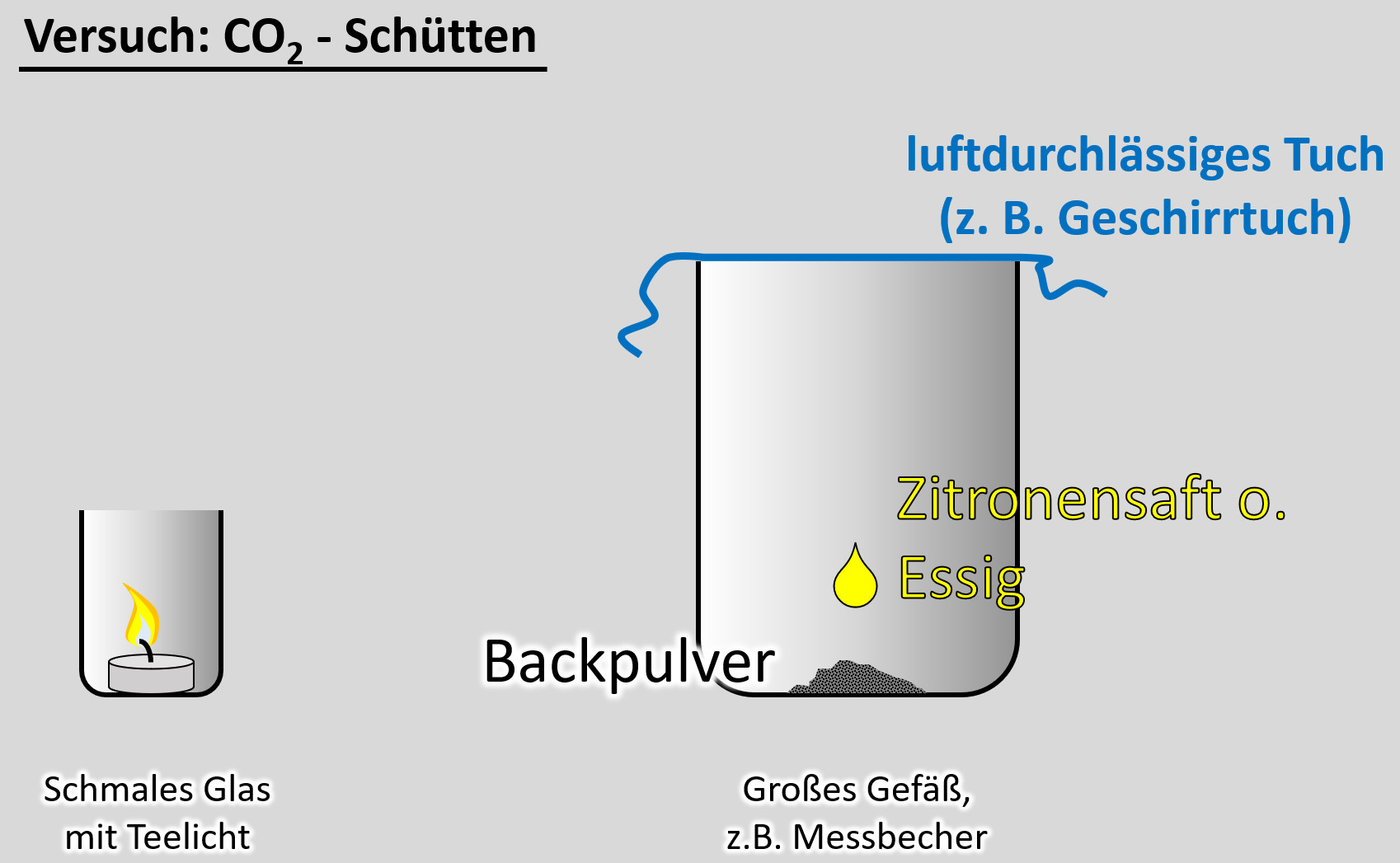
|
|
| Zeile 1: |
Zeile 1: |
| === Distanzunterricht Dienstag, 12.01. ===
| |
| Bearbeitet diese Einheit bitte möglichst während der "normalen Unterrichtszeit", also von 14:45 - 15:30 Uhr. Zunächst sollt ihr hier im WIKI alleine die Inhalte aus dem Unterricht vor Weihnachten auffrischen. Gegen Ende der normalen Unterrichtszeit möchte ich mit euch in einer Videokonferenz diese Wiederholungseinheit gemeinsam besprechen. Habt daher etwas die Zeit im Auge oder stellt euch einen Wecker. Wir beginnen mit der Video-Konferenz um 15:15 Uhr. Den Link habt ihr in einer Nachricht über den Schulmanager erhalten.
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#007">'''Wiederholung'''</span>
| |
| |Inhalt=
| |
| Wir haben uns vor Weihnachten mit den Einteilungsmöglichkeiten von chemischen Reaktionen beschäftigt. Es gibt viele Möglichkeiten, chemische Reaktionen einzuteilen. Eine davon betrachtet die beteiligte Energie. Im Unterricht haben wir ein Stück Magnesium-Band (Mg) in Salzsäure (HCl) geworfen. Bei dieser chemischen Reaktion entsteht Magnesiumchlorid (MgCl<sub>2</sub>) und Wasserstoff. Die Temperatur steigt während der Reaktion stark an.
| |
| <br>
| |
| Stellt zunächst die chemische Gleichung für die beschriebene Reaktion auf!
| |
| {{Lösung versteckt|
| |
| Mg + 2 HCl --> MgCl<sub>2</sub> + H<sub>2</sub>
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
|
| Im Heft haben wir eine zu dieser Reaktion passende Grafik gezeichnet, die wie folgt aussieht:<br>
| |
| [[Datei:ExoEndo_ExoDiagramm.jpg]]<br>
| |
|
| |
| Beschreibt diese Grafik! Geht dazu wie folgt vor:
| |
| * Zunächst zeigt man auf, welche Parameter überhaupt dargestellt sind ("Was steht auf der Y-Achse, was auf der X-Achse")
| |
| {{Lösung versteckt|
| |
| Die sprachlich wohl schönste Lösung wäre:
| |
| '''Die Grafik zeigt''' die innere Energie der Stoffe '''in Abhängigkeit vom''' Reaktionsverlauf.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| * Als nächstes beschreibt man den Verlauf. Hier bietet es sich auch an, die Fachbegriffe und eine Erklärung gleich mit einzubauen. Versucht es! Klickt erst auf "Lösung", wenn ihr eure Lösung laut ausgesprochen habt!
| |
| {{Lösung versteckt|
| |
| Die '''Edukte '''besitzen eine relativ hohe '''innere Energie'''. Das ist eine Form von Energie, die in einem Stoff chemisch gespeichert ist. Die '''Produkte '''besitzen eine niedrigere innere Energie. Im Verlauf der Reaktion, wenn die Edukte in die Produkte umgewandelt werden, '''wird diese Energie frei''' und sie wird an die Umgebung abgegeben. Daher erwärmt sich das Gemisch und das Thermometer zeigt eine hohe Temperatur an.<br>
| |
| Damit die Reaktion allerdings abläuft, muss zunächst etwas Energie hineingesteckt werden. Die so genannte '''Aktivierungsenergie'''. Im Beispiel von Magnesium und Salzsäure reicht die Raumtemperatur bereits aus, um die Reaktion zu starten.<br>
| |
| Da in diesem Beispiel "das System" Energie verliert (die vorher in Form von innerer Energie vorhandene Energie wird als Wärme an die Umgebung abgegeben), spricht man von einer '''exothermen Reaktion'''.<br>
| |
| <br>
| |
| Die '''fett gedruckten''' Begriffe sollten in euren Ausführungen enthalten gewesen sein. Falls nicht, klappt diese Lösung ein und versucht es nochmal.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| Um das folgende Video aufzunehmen, habe ich ein paar Tropfen Ethanol (C<sub>2</sub>H<sub>6</sub>O) entzündet. Dabei reagiert die Flüssigkeit mit dem Sauerstoff aus der Luft. Es entsteht Wasser und Kohlenstoffdioxid (CO<sub>2</sub>). <br>
| |
| * Stellt die chemische Gleichung für diese Reaktion auf!
| |
| * Übertragt dieses Beispiel auf das obere Diagramm. Versucht alles, was in dem Versuch vorkommt einer Stelle im Diagramm zuzuordnen!
| |
| {{Lösung versteckt|
| |
| [[Datei:EtOH_Zünden.gif]]
| |
| |Video|Lösung ausblenden}}
| |
| <br>
| |
| {{Lösung versteckt|
| |
| C<sub>2</sub>H<sub>6</sub>O + 3 O<sub>2</sub> --> 3 H<sub>2</sub>O + 2 CO<sub>2</sub>
| |
| |chemische Gleichung|Lösung ausblenden}}
| |
|
| |
| {{Lösung versteckt|
| |
| [[Datei:ExoEndo_ExoDiagramm_EtOHZünden_ML.jpg]]<br>
| |
| |beschriftetes Diagramm|Lösung ausblenden}}
| |
|
| |
|
| |
| |Farbe= #007
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFF
| |
| |Hintergrund= #DFF
| |
| }}
| |
| <br>
| |
|
| |
|
| === Distanzunterricht Dienstag, 12.01. === | | === Distanzunterricht Dienstag, 12.01. === |