8d 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 147: | Zeile 147: | ||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es müssen | Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
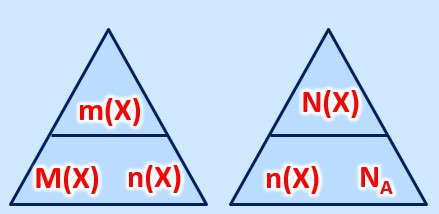
'''gesucht:''' <math>m(K)= ? </math><br> | '''gesucht:''' <math>m(K)= ? </math><br> | ||
'''gegeben:''' <math>n(K)= | '''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> | ||
'''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | '''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | ||
<br> | <br> | ||
Einsetzen der Werte in die Formel:<br> | Einsetzen der Werte in die Formel:<br> | ||
<math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot | <math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math> | ||
|Lösung 2|Lösung ausblenden}} | |Lösung 2|Lösung ausblenden}} | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
Aktuelle Version vom 30. März 2023, 08:19 Uhr
Chemie
aktuelle Aufgaben zum Üben