8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| (40 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
==Chemie== | ==Chemie== | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#900">'''Termine'''</span> | |Titel=<span style="color:#900">'''Termine'''</span> | ||
|Inhalt= | |Inhalt= | ||
* '''Schulaufgabe''': | * '''2. Schulaufgabe''': Montag, 19.06.23 <br> | ||
|Farbe= #900 | |Farbe= #900 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 11: | Zeile 11: | ||
}} | }} | ||
<br> | <br> | ||
=== aktuelle Aufgaben zum Üben === | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Rechnen mit molaren Größen '''</span> | |||
|Inhalt= | |||
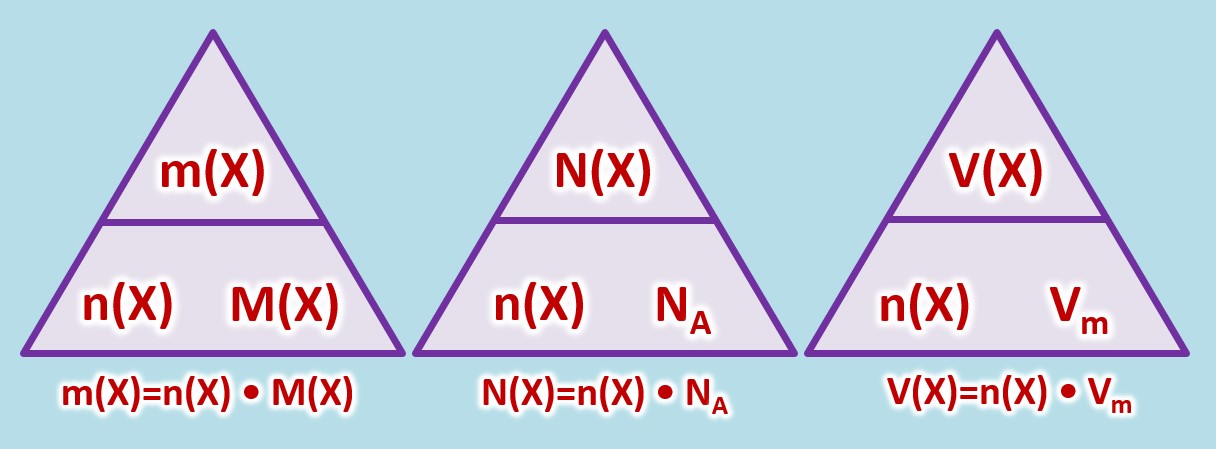
Allgemein müsst ihr mit folgenden Größen umgehen können: | |||
* Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | |||
* Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit | |||
* Das Volumen eines (gasförmigen) Stoffes: <math>V(X)</math>, Einheit: <math>L</math> (Liter) | |||
* Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math> | |||
* molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | |||
* Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | |||
* molares Volumen eines (gasförmigen) Stoffes bei Standardbedingungen (273°C und 1013hPa): <math>V_m = 22,4</math>, Einheit <math>\frac{L}{mol} </math> | |||
<br> | |||
Es gelten die folgenden Zusammenhänge: | |||
[[Datei:C8NTG_ReMiMoGr_3ZH_3ecke.jpg]]<br> | |||
<br><br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Ältere Aufgaben'''</span> | |||
|Inhalt= | |||
Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Online-Unterricht am 09.01.2023 === | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Einteilung von chemischen Reaktionen (Teil 3)'''</span> | |||
|Inhalt= | |||
* Arbeitet die folgenden Blöcke der Reihe nach ab. | |||
* Nutzt das ausgeteilte Arbeitsblatt, um eure Lösungsvorschläge zu dokumentieren. | |||
* Vergleicht eure Lösungen mit der angegebenen Musterlösung selbständig! | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Aufstellen von Reaktionsgleichungen'''</span> | |||
|Inhalt= | |||
Stelle jeweils die Gleichungen für die folgenden chemischen Reaktionen auf: <br> | |||
'''Reaktion 1''': Bei der positiven Knallgasprobe reagiert das aufgefangene Gas Wasserstoff mit dem Sauerstoff aus der Luft im Zuge einer kleinen Explosion zu gasförmigem Wasser. | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr selbst eine chemische Gleichung auf dem Arbeitsblatt stehen habt! | |||
{{Lösung versteckt| | |||
2 H<sub>2</sub> + O<sub>2</sub> --> 2 H<sub>2</sub>O | |||
|Ja, ich habe eine Lösung auf dem Arbeitsblatt stehen|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
'''Reaktion 2''': Entzündet man ein Magnesiumband, so reagiert es ebenfalls mit dem in der Luft enthaltenen Sauerstoff zu der Verbindung Magnesiumoxid (MgO). Bei der Reaktion entsteht ein sehr helles Licht, in das man nicht längere Zeit hinein schauen sollte. | |||
{{Lösung versteckt| | |||
2 Mg + O<sub>2</sub> --> 2 MgO | |||
|Lösung|Lösung ausblenden}} | |||
'''Reaktion 3''': Eine pulverförmige Mischung aus Eisen und Schwefel wird als lange Spur auf eine feuerfeste Platte gestreut. Es genügt nun, diese Spur am einen Ende zu entzünden, um eine Reaktion zu starten, bei der die Verbindung Eisensulfid (FeS<sub>2</sub>) entsteht. Das Gemisch glüht nach und nach vom einen Ende bis zum anderen komplett durch. | |||
{{Lösung versteckt| | |||
Fe + 2 S --> FeS<sub>2</sub> | |||
|Lösung|Lösung ausblenden}} | |||
'''Reaktion 4''': Im Hofmannschen Dreischenkelapparat wird die Verbindung Wasser in die beiden Produkte Wasserstoff und Sauerstoff gespalten, solange die Spannungsquelle angeschaltet ist. | |||
{{Lösung versteckt| | |||
2 H<sub>2</sub>O --> 2 H<sub>2</sub> + O<sub>2</sub> | |||
|Lösung|Lösung ausblenden}} | |||
'''Reaktion 5''': Quecksilberoxid (HgO) ist eine sehr giftige Verbindung. Wenn man sie auf über 500°C erhitzt und diese Temperatur permanent aufrecht erhält, zerfällt sie. Dabei entsteht reines Quecksilber und Sauerstoff. | |||
{{Lösung versteckt| | |||
2 HgO --> 2 Hg + O<sub>2</sub> | |||
|Lösung|Lösung ausblenden}} | |||
'''Reaktion 6''': Die Verbindung Wasserstoffperoxid (H<sub>2</sub>O<sub>2</sub>) zerfällt unter bestimmten Bedingungen schon bei Raumtemperatur zu Wasser und Sauerstoff. | |||
{{Lösung versteckt| | |||
2 H<sub>2</sub>O<sub>2</sub> --> 2 H<sub>2</sub>O + O<sub>2</sub> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Gemeinsamkeiten und Unterschiede der Reaktionen 1 - 6'''</span> | |||
|Inhalt= | |||
* Betrachtet nun die chemischen Reaktionsgleichungen der Reaktionen 1-3 und 4-6. | |||
* Die Reaktionen 1-3 haben eine Gemeinsamkeit und die Reaktionen 4-6 haben eine Gemeinsamkeit. | |||
* Formuliert jeweils einen allgemeinen Satz, der die Gemeinsamkeit bei den Reaktionen 1-3 bzw. 4-6 beschreibt. | |||
* Sucht euch dann eine/n Partnerin in der Klasse, der ebenfalls gerade diesen Aufgabenblock bearbeitet. Lest ihr/ihm eure beiden Sätze vor. Hört euch ihre/seine beiden Sätze an. Entscheidet euch für die beste Variante und bessert eure eigenen Sätze eventuell aus. | |||
* Erst jetzt (nachdem ihr euch mit jemandem in der Klasse besprochen habt) dürft ihr euch hier die Musterlösungsvorschläge anschauen. | |||
* Falls eure Lösung zu stark von der Musterlösung abweicht, müsst ihr sie erneut ausbessern | |||
{{Lösung versteckt| | |||
Letzte Warnung: Ihr müsst eure Lösung erst mit jemandem besprochen und evtl. verbessert haben, bevor ihr auf Lösung klickt! | |||
{{Lösung versteckt| | |||
'''Gemeinsamkeiten bei den Reaktionen 1-3''': <br> | |||
Hier entsteht aus zwei Edukten immer ein Produkt. | |||
<br><br> | |||
'''Gemeinsamkeiten bei den Reaktionen 4-6''': <br> | |||
Hier entstehen aus einem Edukt immer zwei Produkte. | |||
|Ja, ich habe meine Lösung mit jemandem besprochen.|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Infotext'''</span> | |||
|Inhalt= | |||
* Lest den folgenden Text zu unterschiedlichen Reaktionstypen. | |||
* Füllt auf eurem Arbeitsblatt die noch leeren Lücken auf! | |||
<br><br> | |||
'''Infotext'''<br> | |||
Man kann chemische Reaktionen danach einteilen, wie viele Edukte und Produkte daran beteiligt sind. Entsteht bei einer chemischen Reaktion nur ein einziges Produkt aus mehreren Edukten, spricht man von einer '''Synthese'''. Umgekehrt spricht man von einer '''Analyse''', wenn aus einem einzigen Edukt mehrere Produkte entstehen. Von einer '''Umsetzung''' spricht man, wenn mehrere Edukte und mehrere Produkte auftauchen. | |||
{{Lösung versteckt| | |||
[[Datei:C8_SynAnaUms_AB_T3_ML.jpg]] | |||
|Lösung für das Arbeitsblatt |Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Aufgaben'''</span> | |||
|Inhalt= | |||
* Löst mit eurem heute erlernten Wissen die Aufgaben auf der Rückseite des Arbeitsblattes. | |||
* Wenn ihr fertig seid oder spätestens 10 Minuten vor Unterrichtsschluss, vergleicht hier mit der Musterlösung. | |||
{{Lösung versteckt| | |||
[[Datei:C8_SynAnaUms_AB_T4_ML.jpg]] | |||
|Lösung für das Arbeitsblatt |Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
===Grundwissen=== | ===Grundwissen=== | ||
| Zeile 63: | Zeile 214: | ||
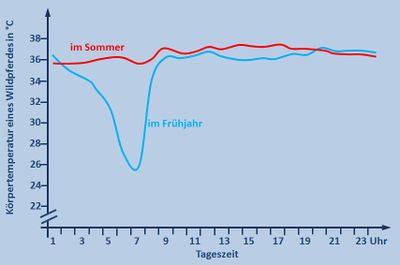
# ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} | # ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} | ||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Fluor-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 9''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 10''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 9''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Es soll ein Diamant mit exakt einem Karat betrachtet werden. Das entspricht einer Masse von 0,2 Gramm. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten! | |||
{{Lösung versteckt| | |||
Hier ist die '''Stoffmenge '''gesucht, gegeben ist die '''Masse''' von Kohlenstoff. Die '''Molare Masse''' für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links). | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>n(C)= ? </math><br> | |||
'''gegeben:''' <math>m(C)= 0,2g </math>, <math>M(C)= 12,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>n(x)=\frac{m(X)}{M(X)} </math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>n(C)=\frac{m(C)}{M(C)}=\frac{0,2g}{12\frac{g}{mol}}=0,017mol </math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 2 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Magnesium-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 12''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 12 oder 13''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 12''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Berechne die Masse einer Portion Wasser, deren Stoffmenge n(H<sub>2</sub>O) = 1,0mol beträgt! (Man könnte auch einfacher fragen: Wie viel Gramm wiegt 1 Mol Wasser?) | |||
{{Lösung versteckt| | |||
Hier ist die '''Masse'''gesucht, gegeben ist die '''Stoffmenge''' von Wasser. Die '''Molare Masse''' für Moleküle wie H<sub>2</sub>O kann durch Addition der am Aufbau beteiligten Atome direkt aus dem PSE abgeleitet werden. | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(H_{2}O)= ? </math><br> | |||
'''gegeben:''' <math>n(H_{2}O)= 1,0mol </math>, <math>M(H_{2}O)= 2 \cdot M(H) + M(O) = 18,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(H_{2}O) = M(H_{2}O) \cdot n(H_{2}O) = 18,0 \frac{g}{mol} \cdot 1,0mol = 18,0g</math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (06.03.-10.03)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Schwefel-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 16''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 16''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 16''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Das ist eine Verbindung mit der chemischen Formel '''MgO''' | |||
{{Lösung versteckt| | |||
2 Mg + O<sub>2</sub> --> 2 MgO | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 1 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Magnesiumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(Mg), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''zwei''' Magnesiumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Zwei Mol''' Magnesium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 2 Mol Magnesium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Magnesium entspricht das? | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(Mg)= ? </math><br> | |||
'''gegeben:''' <math>n(Mg)= 2,0mol </math>, <math>M(Mg)= 24,3 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(Mg) = M(Mg) \cdot n(Mg) = 24,3 \frac{g}{mol} \cdot 2,0mol = 48,6g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (20.-24.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut? | |||
* Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
* Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>''' | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid. | |||
{{Lösung versteckt| | |||
* Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht. | |||
* Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup> | |||
* Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>''' | |||
* Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O | |||
* Die chemische Gleichung lautet dann: | |||
4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(K)= ? </math><br> | |||
'''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Abschlussaufgaben zum Thema Salze'''</span> | |||
|Inhalt= | |||
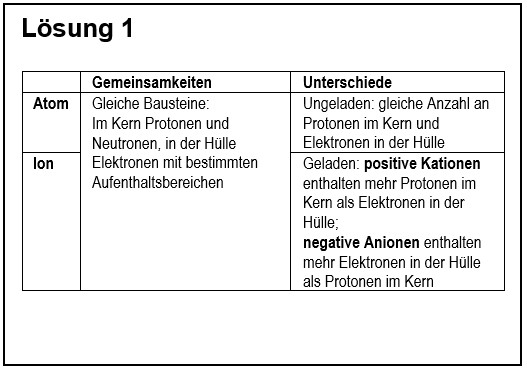
1. Vergleiche in übersichtlicher Form ein '''Atom''' mit einem '''Ion'''! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg1.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg2.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen: Verformbarkeit - große Bindungskräfte - Löslichkeit - elektrische Leitfähigkeit - Sprödigkeit - niedrige Siedetemperatur - Reaktionsträgheit. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg3.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg4.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
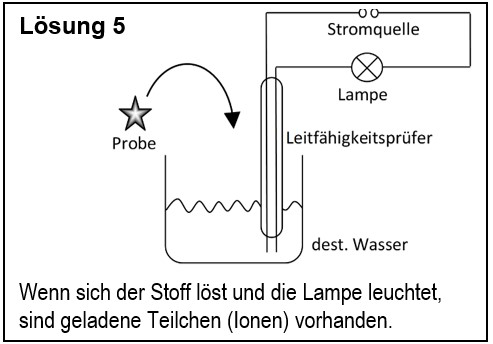
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg5.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg<sub>3</sub>N<sub>2</sub>, CaO, KI, BaCl<sub>2</sub> und Aluminiumfluorid | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg6.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li<sup>+</sup>, K, S<sup>2-</sup>, Na<sup>+</sup> | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg7.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg8.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 83: | Zeile 426: | ||
* Chemie-Übung: Wasserstoff oder Sauerstoff? | * Chemie-Übung: Wasserstoff oder Sauerstoff? | ||
* Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_H2oderO2.pdf| Hier klicken]] | * Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_H2oderO2.pdf| Hier klicken]] | ||
'''Montag, 27.02. und 06.03 | |||
* Chemie-Übung: Flammenfärbung | |||
* 1. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung.pdf| Hier klicken]] | |||
* 2. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung2.pdf| Hier klicken]] | |||
'''20.03. - 08.05.: Fällungsreaktionen''' | |||
* Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_ClBrI_V2.pdf| Hier klicken]] <span style="color:#F00">neue Version hochgeladen am 14.04., Fehler ausgebessert</span><br> | |||
* Erklärung der Fällungsreaktion auf Teilchenebene als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_Teilchenebene.pdf| Hier klicken]] | |||
* Unterscheidung von Silberchlorid-, Silberbromid und Silberiodid-Niederschlag als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung2_U_ClBrI.pdf| Hier klicken]] | |||
* Fällung und Unterscheidung von Carbonat- und Sulfat-Ionen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_CarboSulf.pdf| Hier klicken]] | |||
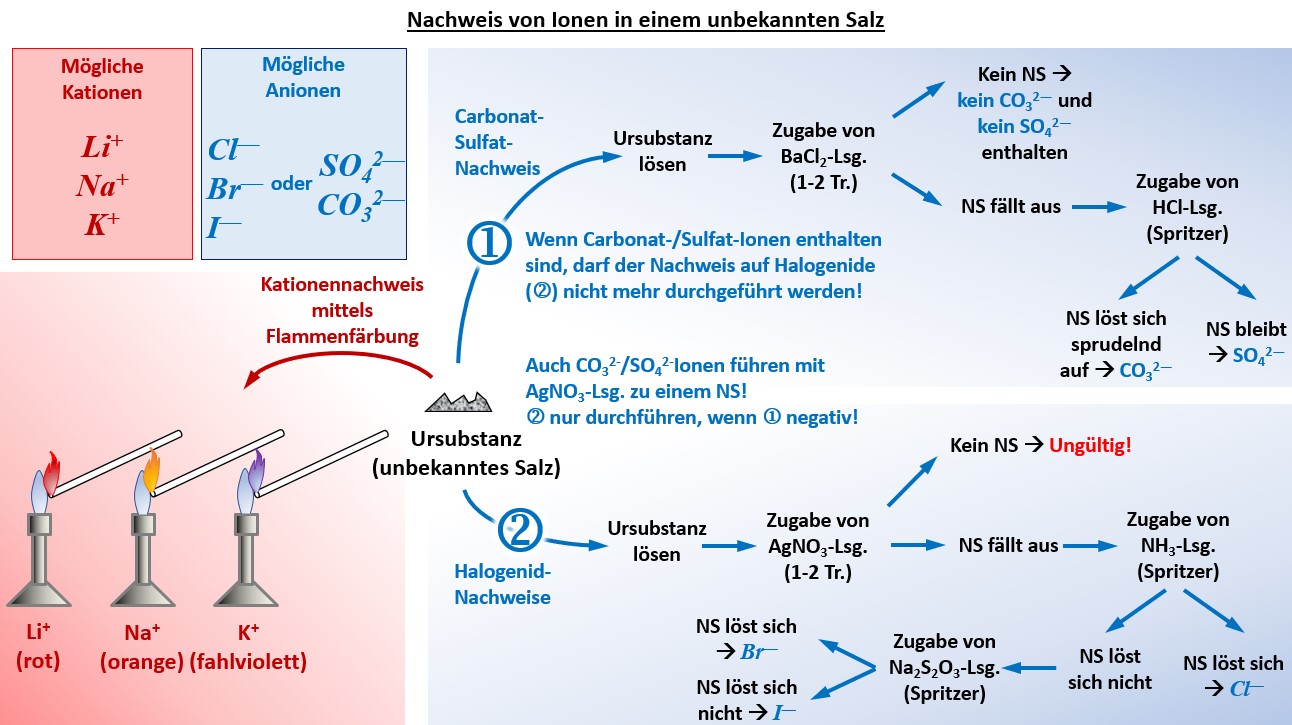
'''15.05-22.05.: Ionenlotto''' | |||
* Im Unterricht gestellte Aufgabe: "Identifiziere in der unbekannten Salzprobe die vorhanden Kationen und Anionen! Die Salzprobe enthält eines der folgenden Kationen: K<sup>+</sup>, Na<sup>+</sup>, Li<sup>+</sup> und eines der folgenden Anionen: Cl<sup>-</sup>, Br<sup>-</sup>, I<sup>-</sup>, CO<sub>3</sub><sup>2-</sup>, SO<sub>4</sub><sup>2-</sup>. Fertige ein sauberes Protokoll an, in dem vor allem die Durchführung und das Ergebnis dargestellt wird!" | |||
* Zwei zu dieser Aufgabe passende Muster-Protokoll als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Ionenlotto_ML.pdf| Hier klicken]] | |||
* Übersicht über die praktisch durchzuführenden Schritte: | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_Ü_011_NachweisGesamt_V2.jpg]]<br> | |||
|Grafische Darstellung einblenden|Lösung ausblenden}} | |||
<br> | |||
'''Montag, 03.07.''' | |||
* Eigenschaften von Alkanen (einfache Kohlenwasserstoffe) | |||
* Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_EigenschaftenAlkane.pdf| Hier klicken]] | |||
|Farbe= #30F | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
===Lernstoff für angekündigte Leistungsnachweise=== | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= Schulaufgabe am 19.06. | |||
Neben den Hefteinträgen und dem oben genannten Grundwissen, eignen sich folgende Seiten im Buch (Galvani - Chemie 8) zur Vorbereitung auf die Schulaufgabe: | |||
* S. 146 - 147: Aufbau von Salzen | |||
* S. 150 - 151: Verhältnisformeln | |||
* S. 152 - 153: Periodensystem der Atome und Ionen | |||
* S. 154 - 155: Eigenschaften von Salzen | |||
* S. 162 - 163 : Ionennachweise | |||
* S. 164: Flammenfärbung | |||
* S. 174 - 176: Metalle und ihre Eigenschaften | |||
* S. 120 - 121: Atommasse | |||
* S. 122 - 124: Stoffmenge, molare Masse und molares Volumen | |||
|Farbe= #30F | |Farbe= #30F | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 89: | Zeile 474: | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= | ||
| Zeile 103: | Zeile 488: | ||
* S. 60 - 62: Luft - Zusammensetzung, Verflüssigung | * S. 60 - 62: Luft - Zusammensetzung, Verflüssigung | ||
* S. 64 - 65: Gasnachweise | * S. 64 - 65: Gasnachweise | ||
* | * S. 92 - 93: (+ S. 94): Atommodelle (Gesetz von der Erhaltung der Masse, Gesetz von den konstanten Proportionen) | ||
* | * S. 101 + 103: Aufstellen von chemischen Reaktionsgleichungen | ||
|Farbe= #30F | |Farbe= #30F | ||
Aktuelle Version vom 3. Juli 2023, 13:23 Uhr
Chemie
aktuelle Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen
Versuchsprotokolle
Lernstoff für angekündigte Leistungsnachweise