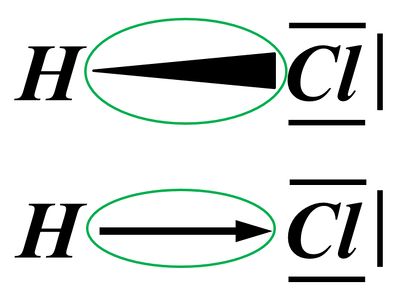10d 2019 20/Chemie: Unterschied zwischen den Versionen
(AA f. 04.05. hierher verschoben) Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| (9 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 2: | Zeile 2: | ||
<br> | <br> | ||
<br> | <br> | ||
==Arbeitsauftrag Chemie für den 27.05.== | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
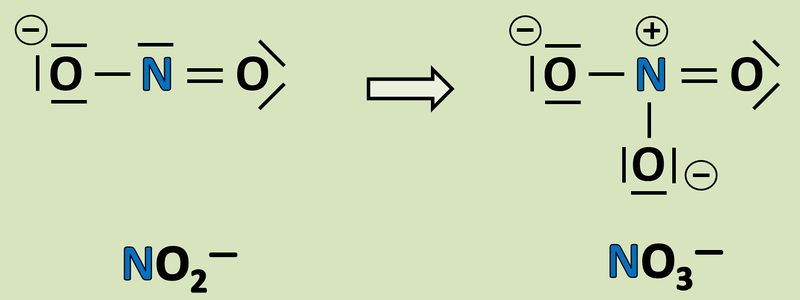
Wendet das gelernte Verfahren zur Bestimmung der Oxidationszahlen auf folgende Reaktion an und gebt an, wie viele Elektronen hier frei werden oder aufgenommen werden! <br> | |||
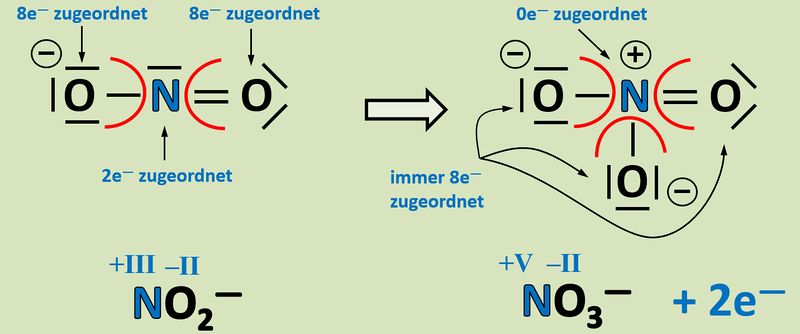
[[Datei:Redox1_AA1_NO2_NO3.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
'''Oxidation''': Es werden zwei Elektronen abgegeben.<br> | |||
[[Datei:Redox1_ML1_Nitrit_Nitrat.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
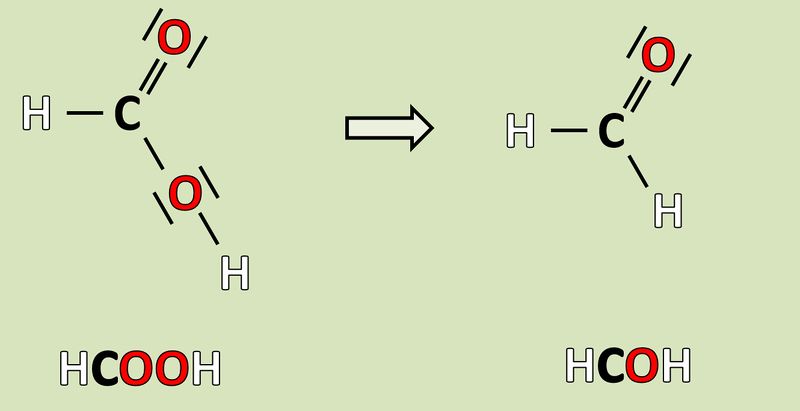
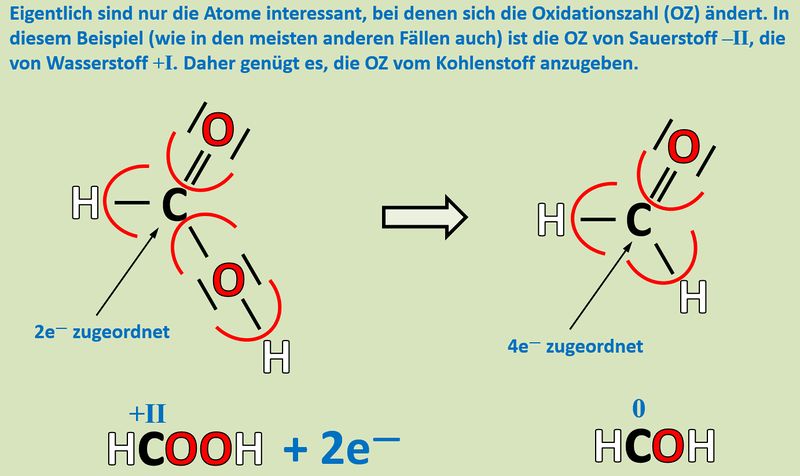
[[Datei:Redox1_AA1_HCOOH_HCOH.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
'''Reduktion''': Es werden zwei Elektronen aufgenommen.<br> | |||
[[Datei:Redox1_ML3_Säure_Aldehy.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
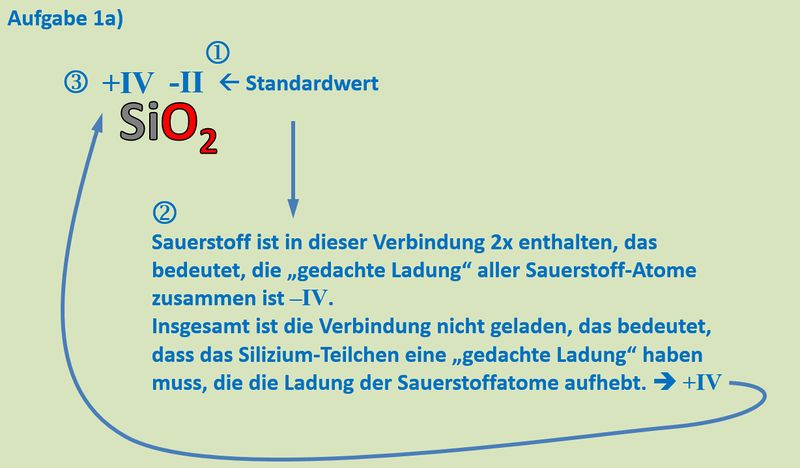
Buch, S. 75 Aufgabe 1a<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_MLHA_1a.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
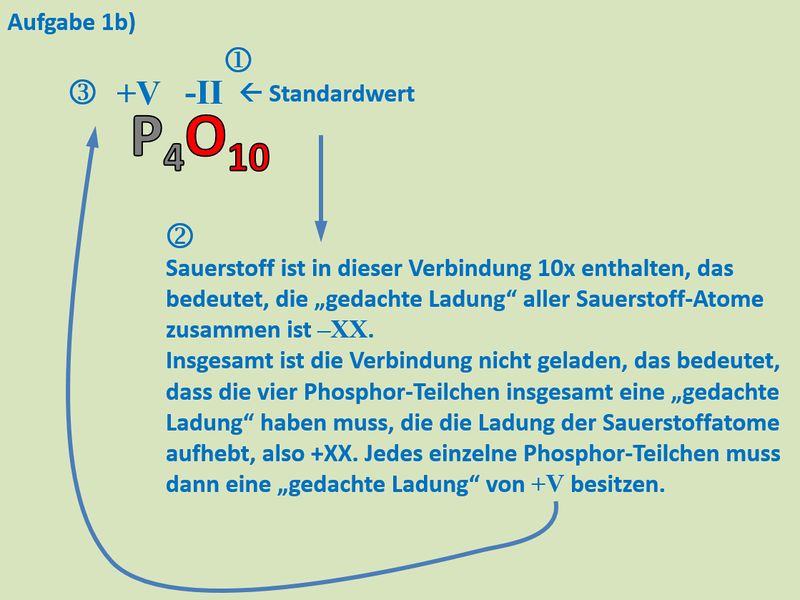
Buch, S. 75 Aufgabe 1b<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_MLHA_1b.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
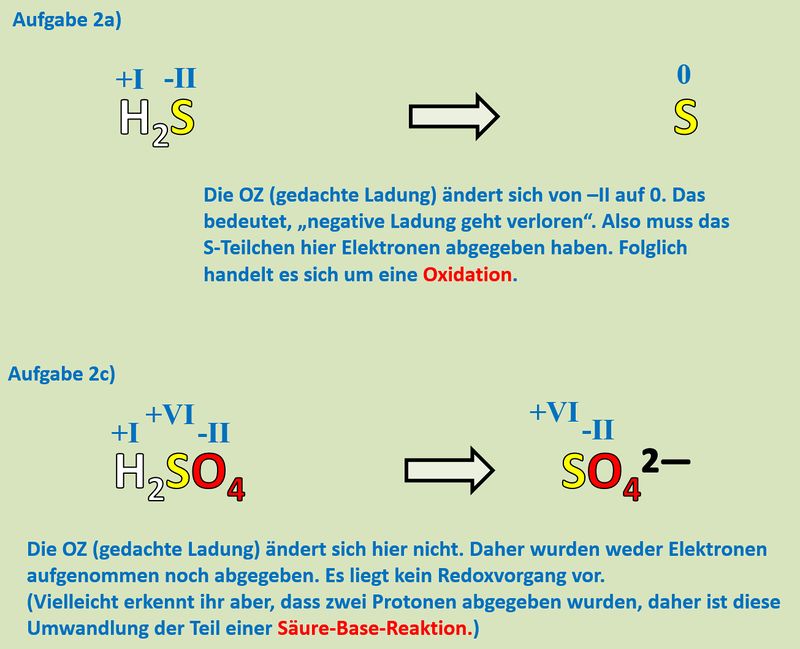
Buch, S. 75 Aufgabe 2a und c<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_MLHA_2ac.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
==Arbeitsauftrag Chemie für den 25.05.== | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Redox-Reaktionen'''</span> | |||
|Inhalt= | |||
In der letzten Einheit habt ihr einen typischen Reaktionstyp kennengelernt: Die '''Säure-Base-Reaktion'''. Dabei wird ein '''Proton''' von einem Teilchen auf ein anderes übertragen. Heute soll es um einen Reaktionstyp gehen, bei dem '''Elektronen''' von einem Teilchen auf ein anderes übertragen werden. Ihr kennt solche Reaktionen bereits von der Bildung von Salzen aus den Elementen. Dabei gibt das Metall Elektronen ab. Diese Teilreaktion wird als '''Oxidation''' bezeichnet. Das Nichtmetall nimmt die Elektronen auf. Diese Teilreaktion wird als '''Reduktion''' bezeichnet. Beide Teilreaktionen können ähnlich wie bei Säure-Base-Reaktionen nur gemeinsam ablaufen. Die Elektronen können nicht irgendwo hin ins Nirvana abgegeben werden oder "aus der Luft" aufgenommen werden. Es muss immer der passende Partner vorhanden sein. Beide Teilreaktionen, die also immer zusammen ablaufen werden als '''Redox-Reaktion''' bezeichnet. <br> | |||
Zur Vereinfachung ist es aber tatsächlich üblich, beide Teilreaktionen getrennt voneinander zu betrachten, mit Elektronen die bei der Oxidation "herauskommen" und Elektronen, die bei der Reduktion "irgendwoher" aufgenommen werden.<br> | |||
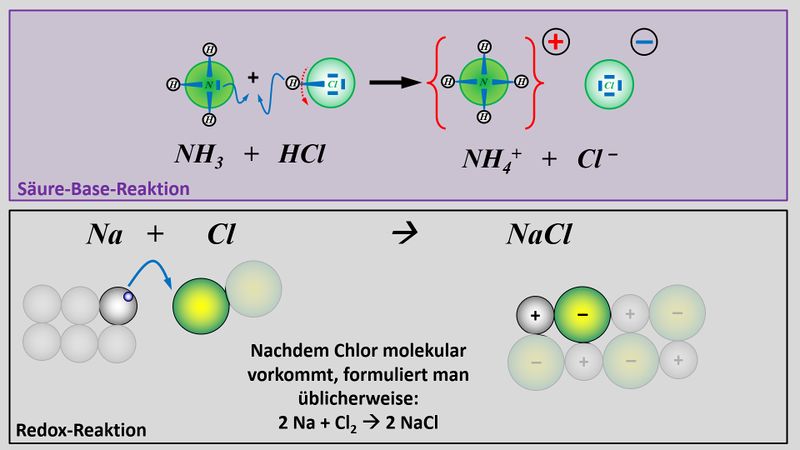
Zum Vergleich hier noch einmal eine Säure-Base-Reaktion und eine Redoxreaktion in bildlicher Darstellung:<br> | |||
[[Datei:Redox1_VGL_SäBa_Redox.jpg|800px]]<br> | |||
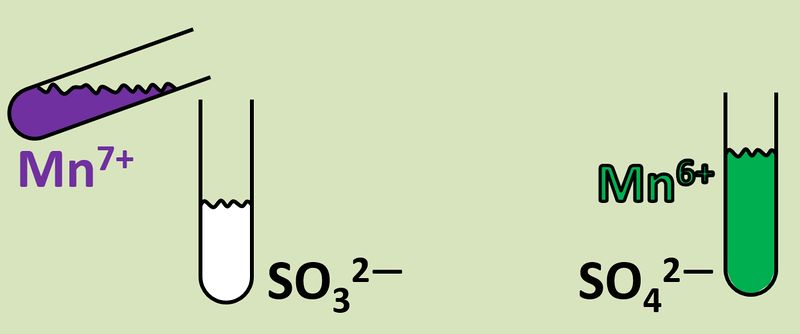
Im oberen Beispiel ist bei der Bildung von Natriumchlorid sehr einfach zu erkennen, wer die Elektronen abgibt (das Na-Atom) und wer sie aufnimmt (das Cl-Atom). Im folgenden Beispiel ist das nicht so einfach: Eine violette Permanganat-Lsg. (die vereinfacht Mn<sup>7+</sup>-Ionen enthält), die man in eine bestimmte Sulfit-Lsg. tropft, färbt sich grün (was auf Mn<sup>6+</sup>-Ionen zurückzuführen ist). Gleichzeitig tauchen im Reagenzglas Sulfat-Ionen auf: <br> | |||
[[Datei:Redox1_VMn7zuMn6.jpg|800px]]<br> | |||
Dass die Mn<sup>7+</sup>-Ionen offensichtlich ein Elektron aufgenommen haben (also eine Reduktion vorliegt), ist leicht an der Ladung zu erkennen. Aber woher kommt dieses Elektronen?<br> | |||
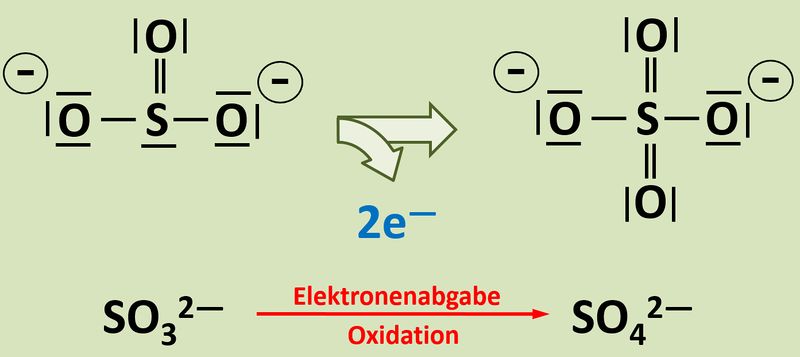
Zunächst einmal: In dem dargestellten Versuch sind noch eine Reihe weiterer Teilchen beteiligt, aber die spielen hier keine Rolle. Das Elektron stammt tatsächlich aus der Reaktion vom Sulfit zum Sulfat: <br> | |||
[[Datei:Redox1_So3zuSo4_Blanc.jpg|800px]]<br> | |||
Woher soll man erkennen, dass diese Reaktion Elektronen liefert, also eine Oxidation stattfindet?<br> | |||
Der Trick besteht nun darin auch Moleküle formal (also "nicht in echt") in Ionen zu zerlegen. Denn bei Ionen zeigt eine sich verändernde Ladung sehr klar an, ob Elektronen aufgenommen oder abgegeben wurden.<br> | |||
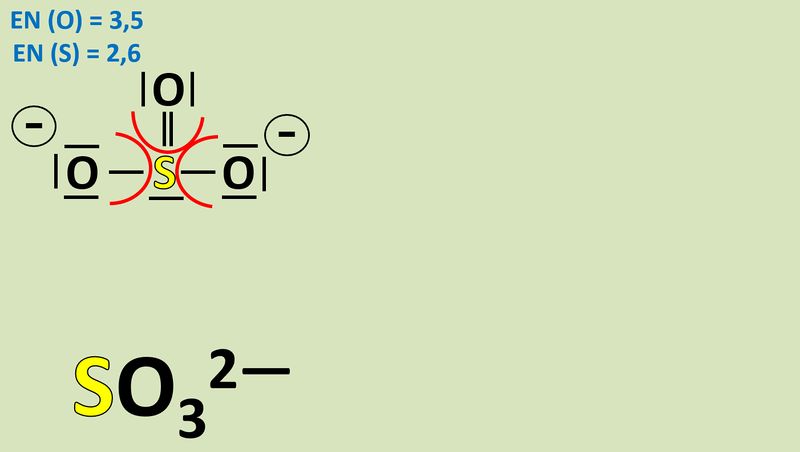
Um diese Zerlegung vorzunehmen, betrachtet man alle bindenden Elektronenpaare in einem Molekül und teilt sie formal demjenigen Bindungspartner zu, der die höhere Elektonegativität (EN) hat. Nur bei exakt gleichen Partnern bekommt jeder ein Elektron des Paares zugeordnet.<br> | |||
Bsp.: Sulfit-Ion:<br> | |||
[[Datei:Redox1_Sulfit_OZbestimmen_1.jpg|800px]]<br> | |||
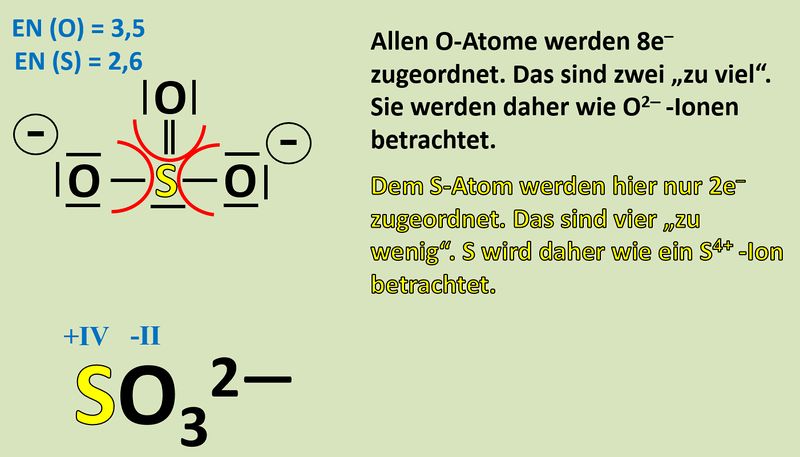
Nun zählt man die Elektronen, die jedem Atom auf diese Weise zugeordnet wurden und vergleicht diese Anzahl mit der Anzahl an Valenzelektronen, die dieses Atom laut PSE haben sollte. Liegen mehr Elektronen vor als "normal" entspricht die überschüssige Anzahl einer negativen Ladung, liegen weniger Elektronen vor, entspricht die fehlende Anzahl einer positiven Ladung. Man spricht allerdings nicht von einer "Ladung", sondern von der Oxidationszahl, die in der Schule üblicherweise als römische Ziffer angegeben wird (mit dem entsprechenden Vorzeichen).<br> | |||
Bsp.: Sulfit-Ion:<br> | |||
[[Datei:Redox1_Sulfit_OZbestimmen_2.jpg|800px]]<br> | |||
<br> | |||
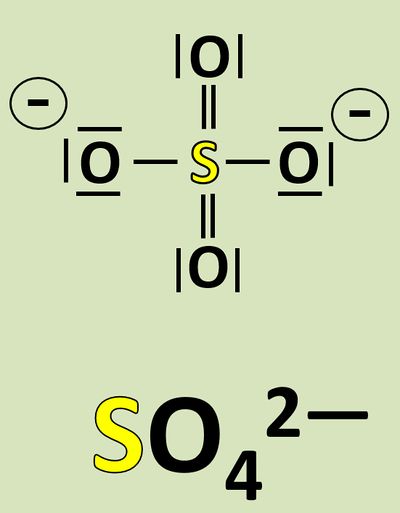
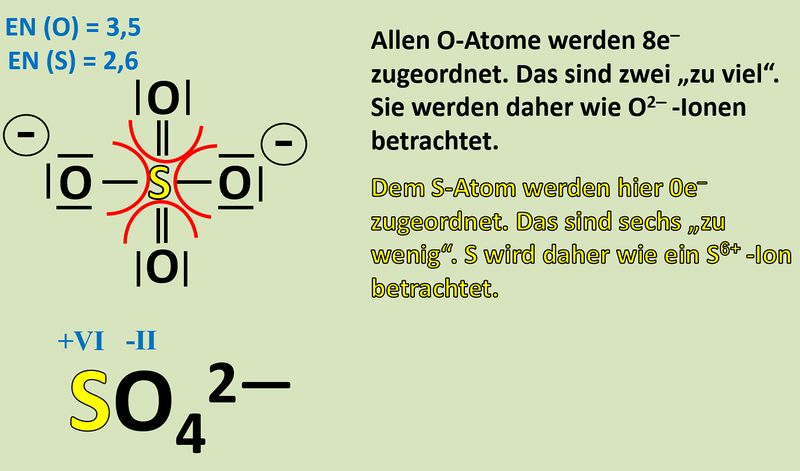
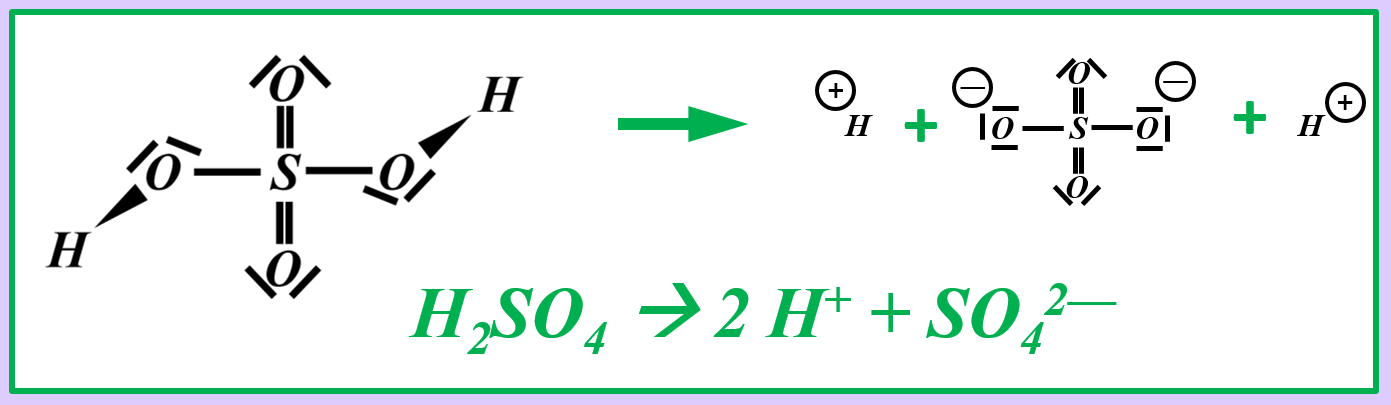
Wendet dieses Verfahren auf das Sulfat-Teilchen an:<br> | |||
[[Datei:Redox1_Sulfat_OZbestimmen_0.jpg|400px]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_Sulfat_OZbestimmen.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
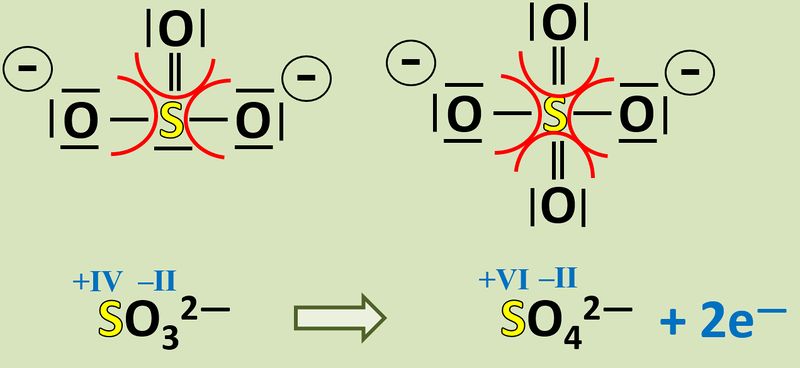
Vergleicht nun Sulfit mit Sulfat. Jetzt kann man besser erkennen, woher die Elektronen für die Reduktion von Mn<sup>7+</sup>-Ionen zu Mn<sup>6+</sup>-Ionen gekommen sind! | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_Sulfit_zzu_Sulfat_EFluss.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
Manche von euch werden jetzt sagen: "Ja gut... aber woher kommt denn das vierte Sauerstoff-Atom beim Sulfat?<br> | |||
<br> | |||
Sehr gute Frage! - Das ist aber eine andere Baustelle. Wir bleiben heute nur bei dem Problem: Woran erkennt man, wie viele Elektronen bei der Reaktion von Molekülen frei werden (Oxidation) oder aufgenommen werden (Reduktion).<br> | |||
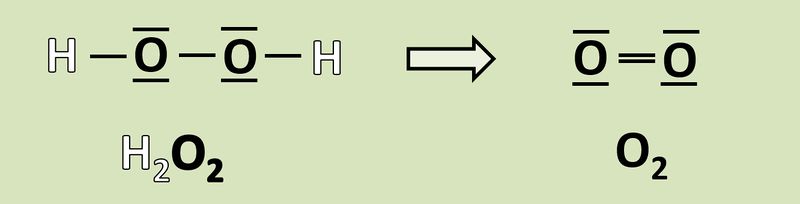
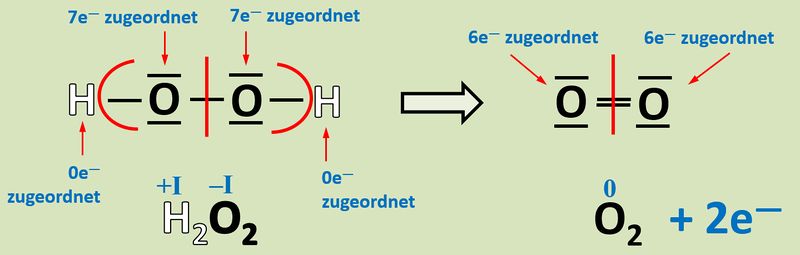
Wendet das heute gelernte Verfahren auf folgende Reaktion an und gebt an, wie viele Elektronen hier frei werden oder aufgenommen werden! <br> | |||
[[Datei:Redox1_AA1_H2O2_O2.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:Redox1_ML1_H2O2_O2.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
[[Datei:Redox1_AA1_NO2_NO3.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Noch nicht vorhanden! - Wird am Mittwoch hochgeladen!<br> | |||
|Lösung|Lösung ausblenden}} | |||
[[Datei:Redox1_AA1_HCOOH_HCOH.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Noch nicht vorhanden! - Wird am Mittwoch hochgeladen!<br> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
In eurem Buch ist die Bestimmung der Oxidationszahlen völlig anders erklärt. Das hat Gründe. Ich möchte, dass ihr die Seiten 74 - 75 lest und die Aufgabe 1 a+b und die Aufgabe 2 a+c löst. Schickt mir eure Lösung bitte über den Schulmanager! | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie für den 20.05. == | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
Lest im Buch die S. 56-57 (Galvani, Chemie S2). Die Inhalte sind hier meiner Meinung nach schön erklärt. Bearbeitet anschließend die... | |||
* Aufgabe 1 | |||
{{Lösung versteckt| | |||
[[Datei:SäBa5_Verb_HA1a.jpg|800px]]<br> | |||
<br> | |||
[[Datei:SäBa5_Verb_HA1b.jpg|800px]]<br> | |||
<br> | |||
[[Datei:SäBa5_Verb_HA1c.jpg|800px]]<br> | |||
<br> | |||
[[Datei:SäBa5_Verb_HA1d.jpg|800px]]<br> | |||
<br> | |||
|Lösung zur Aufgabe 1|Lösung ausblenden}} | |||
* Aufgabe 2 | |||
{{Lösung versteckt| | |||
[[Datei:SäBa5_Verb_HA2.jpg|800px]]<br> | |||
<br> | |||
|Lösung zur Aufgabe 2|Lösung ausblenden}} | |||
* Aufgabe 3 | |||
{{Lösung versteckt| | |||
[[Datei:SäBa5_Verb_HA3.jpg|800px]]<br> | |||
<br> | |||
|Lösung zur Aufgabe 3|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Redoxreaktionen'''</span> | |||
|Inhalt= | |||
Wenn ihr die Hausaufgabe ordentlich verbessert habt, seid ihr für heute mit Chemie fertig. Wenn ihr Probleme mit der Hausaufgabe hattet, schreibt mir bitte möglichst konkret über den Schulmanager, was euch schwer gefallen ist.<br> | |||
Das nächste Thema, welches ich in der kommenden Woche mit euch behandeln möchte heißt '''"Redox-Reaktionen"'''. Diese sind den '''"Säure-Base-Reaktionen"''' teilweise ähnlich. Nur werden hier nicht '''Protonen '''von einem Stoff auf den anderen übertragen, sondern '''Elektronen'''. Doch dazu in der nächsten Einheit mehr... | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
== Arbeitsauftrag Chemie für den 18.05. == | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
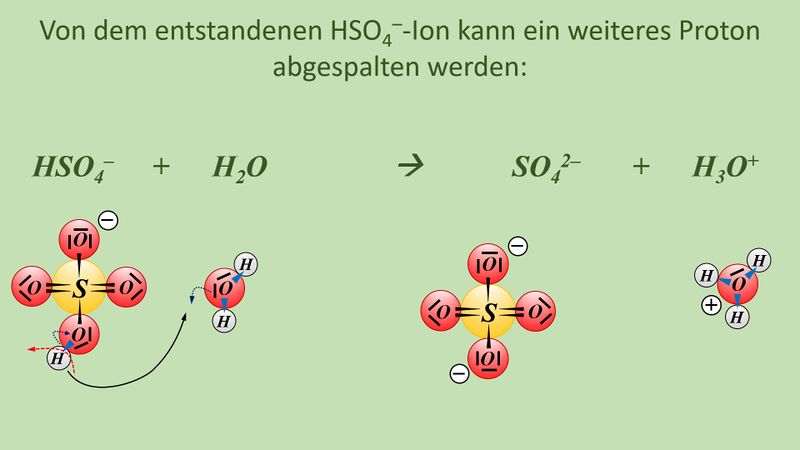
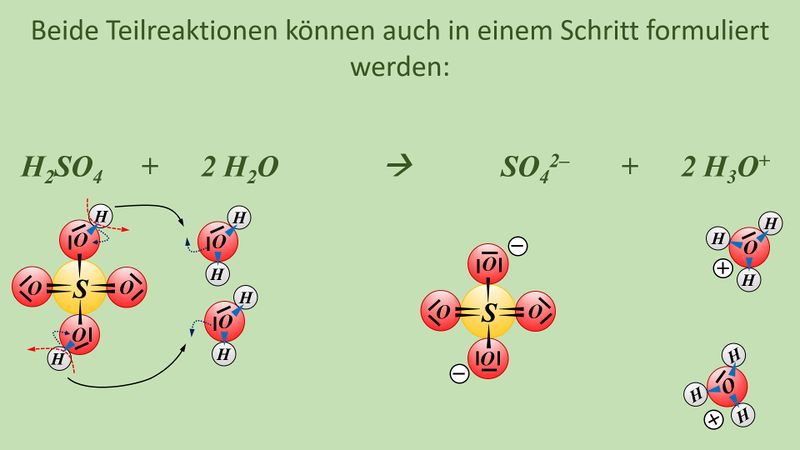
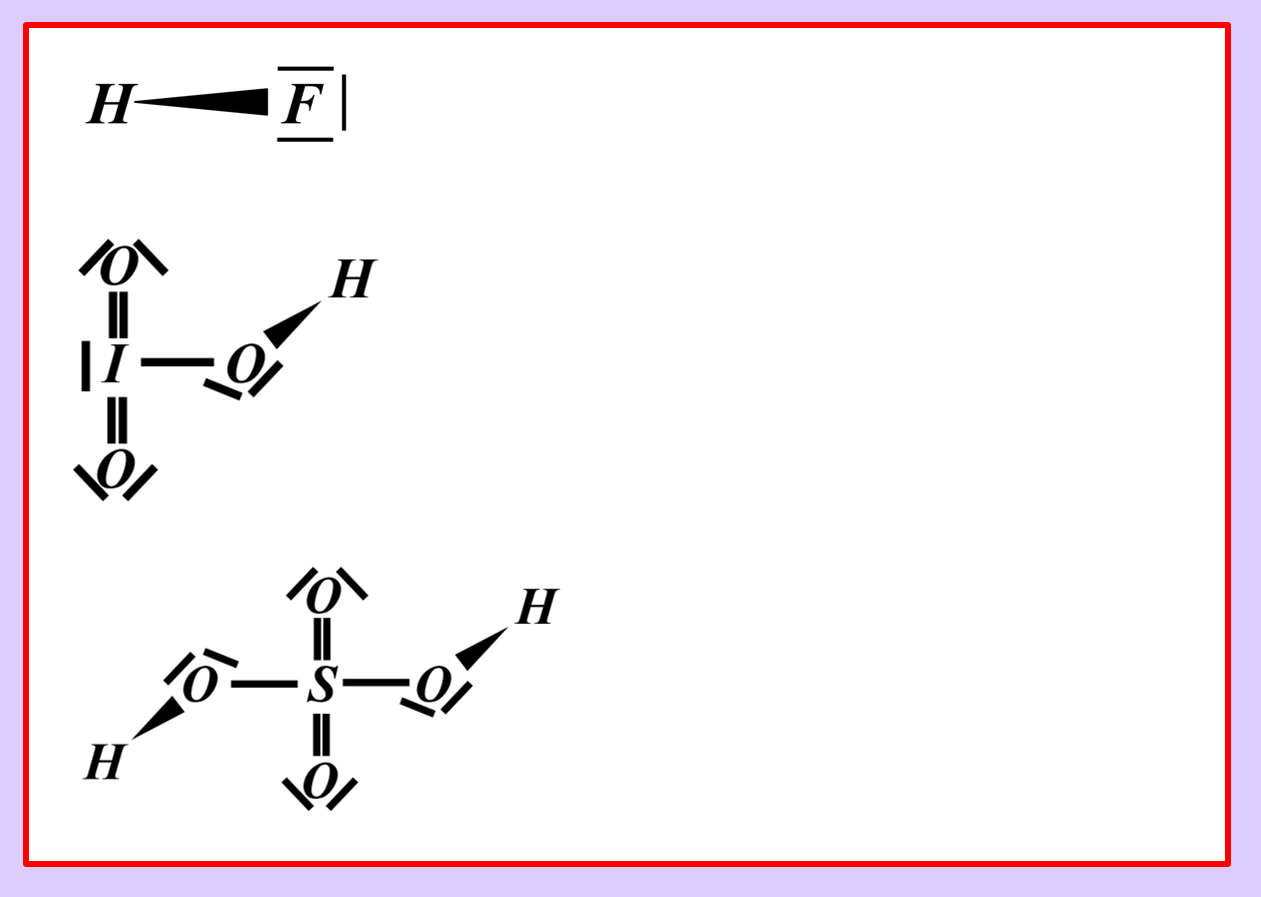
Formuliert die Reaktion von folgenden Stoffen mit Wasser: | |||
* Schwefelsäure | |||
* Iodsäure (HIO<sub>3</sub>) | |||
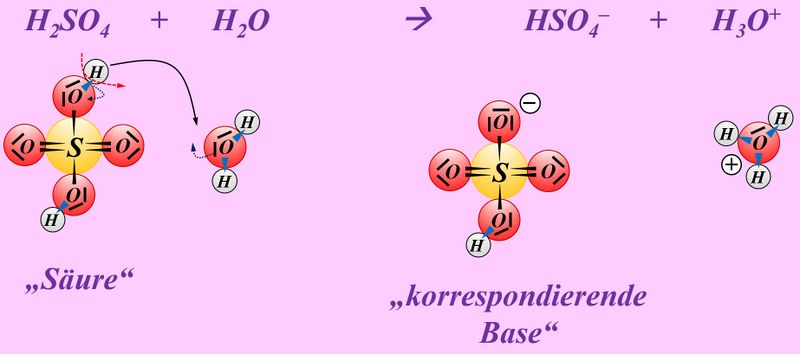
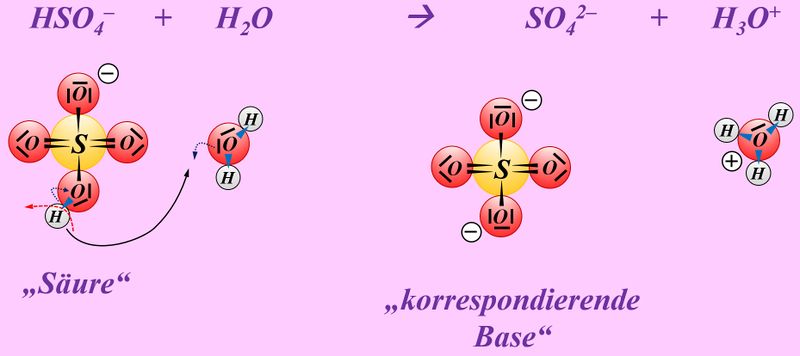
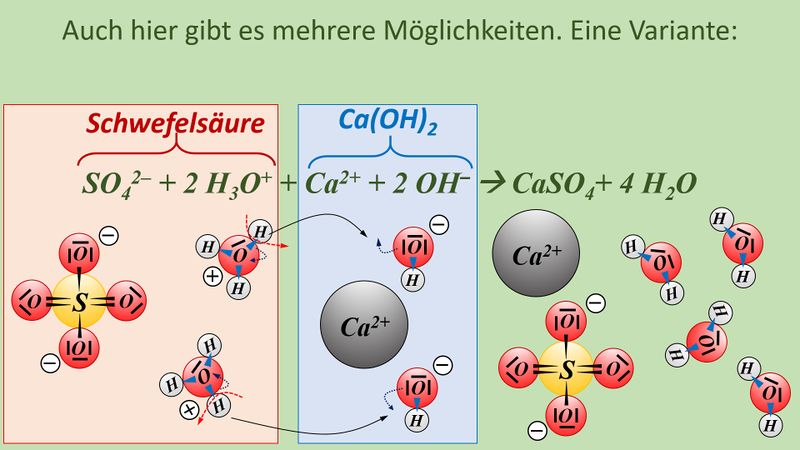
Formuliert die Neutralisationsreaktion von Schwefelsäure H<sub>2</sub>SO<sub>4</sub> mit Calciumhydroxid Ca(OH)<sub>2</sub> | |||
{{Lösung versteckt| | |||
* Schwefelsäure mit Wasser: | |||
[[Datei:SäBa4_Verb_HA1.jpg|800px]]<br> | |||
<br> | |||
[[Datei:SäBa4_Verb_HA2.jpg|800px]]<br> | |||
<br> | |||
[[Datei:SäBa4_Verb_HA3.jpg|800px]]<br> | |||
<br> | |||
* Iodsäure (HIO<sub>3</sub>) mit Wasser | |||
[[Datei:SäBa4_Verb_HA4.jpg|800px]]<br> | |||
<br> | |||
* Neutralisationsreaktion von Schwefelsäure H<sub>2</sub>SO<sub>4</sub> mit Calciumhydroxid Ca(OH)<sub>2</sub> | |||
[[Datei:SäBa4_Verb_HA5.jpg|800px]]<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Indikatoren'''</span> | |||
|Inhalt= | |||
Heute ein Versuch! (Die praktische Durchführung ist freiwillig)<br> | |||
Ihr wisst sicherlich, dass es '''Farbstoffe '''gibt, die durch eine '''Farbänderung '''anzeigen können, ob eine wässrige Lösung eher sauer oder basisch ist. Solche Farbstoffe nennt man '''Säure-Base-Indikatoren'''. Viele farbige Stoffe, die in der Natur vorkommen, sind zu einem solchen säureabhängigen Farbumschlag fähig. Probiert es aus! <br> | |||
<br> | |||
Ihr benötigt: | |||
* Blaukraut/Rotkohl (frisch oder aus der Konserve) | |||
* Zitronensaft | |||
* Natron oder Kernseife | |||
<br> | |||
Zupft ein paar Blätter vom Rotkohl ab, schneidet sie sehr klein und gebt die Schnipsel in ein Glas mit Wasser. Wartet 5 min.<br> | |||
[[Datei:SäBa4_Indikator_Blaukraut_V.jpg|800px]]<br> | |||
Verteilt den so erzeugten violetten "Blaukraut-Saft" auf drei Gläser und verdünnt ihn mit Wasser. Gebt zum einen Glas Zitronensaft, zum anderen Natron oder Kernseife. Vergleicht die drei Gläser! | |||
{{Lösung versteckt| | |||
[[Datei:SäBa4_Indikator_Blaukraut_E.jpg|800px]]<br> | |||
|Ergebnis|Lösung ausblenden}} | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Lest im Buch die S. 56-57 (Galvani, Chemie S2). Die Inhalte sind hier meiner Meinung nach schön erklärt. Bearbeitet anschließend die Aufgaben 1, 2, und 3 auf der S. 57 | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie für den 11.05. == | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Die Säure-Base-Reaktion'''</span> | |||
|Inhalt= | |||
Ihr habt in den letzten beiden Einheiten '''Säuren''' und '''Basen '''kennengelernt. Hier noch einmal eine Kurz-Zusammenfassung über deren typische Eigenschaften auf molekularer Ebene: | |||
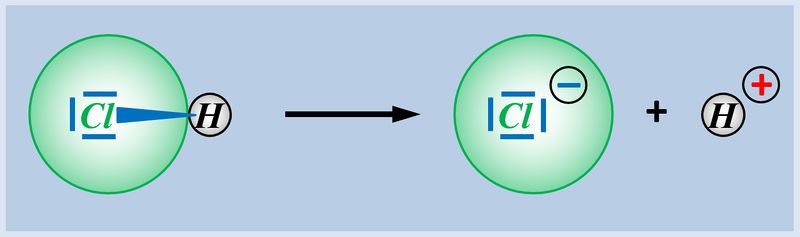
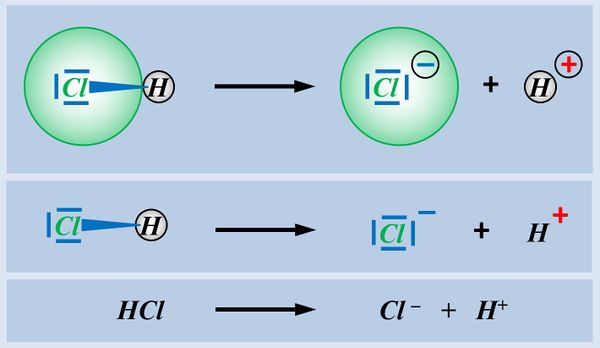
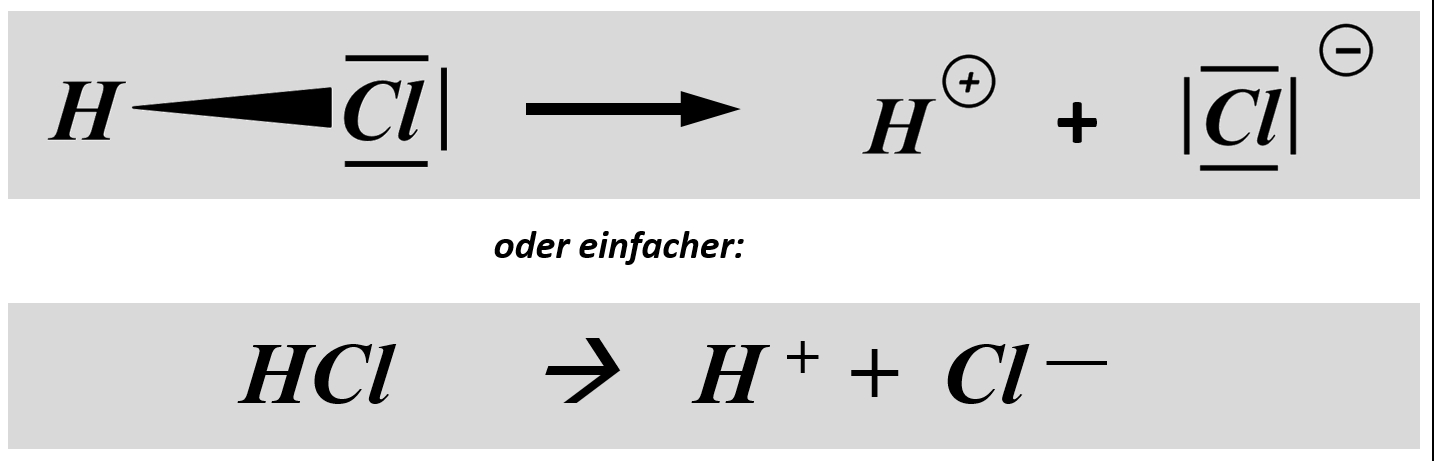
* Säuren können aus einer heterolytischen Bindung zwischen einem Wasserstoff-Atom und einem anderen Atom ein '''Proton abspalten''', z.B. HCl (Hydrogenchlorid):<br> | |||
[[Datei:SäBa3_HCl_alleine.jpg|800px]] | |||
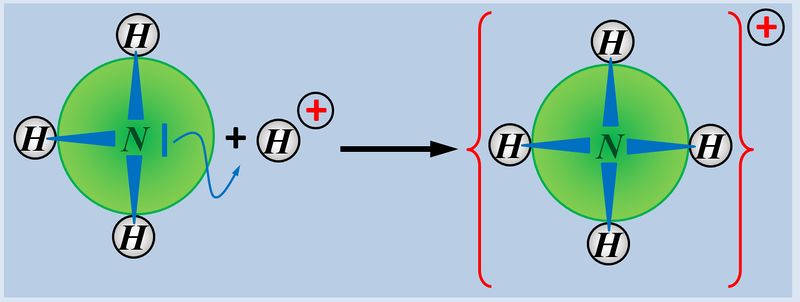
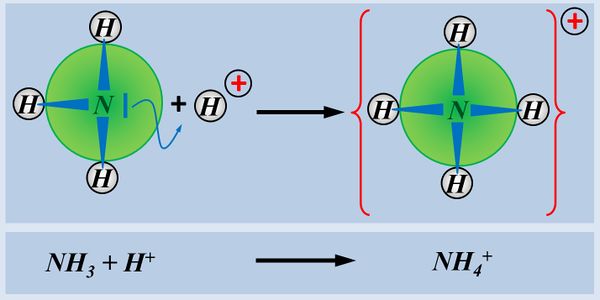
* Basen können ein Proton über ein freies Elektronenpaar ein Proton binden, also aufnehmen, z.B. NH<sub>3</sub> (Ammoniak) | |||
[[Datei:SäBa3_NH3_alleine.jpg|800px]] | |||
<br> | |||
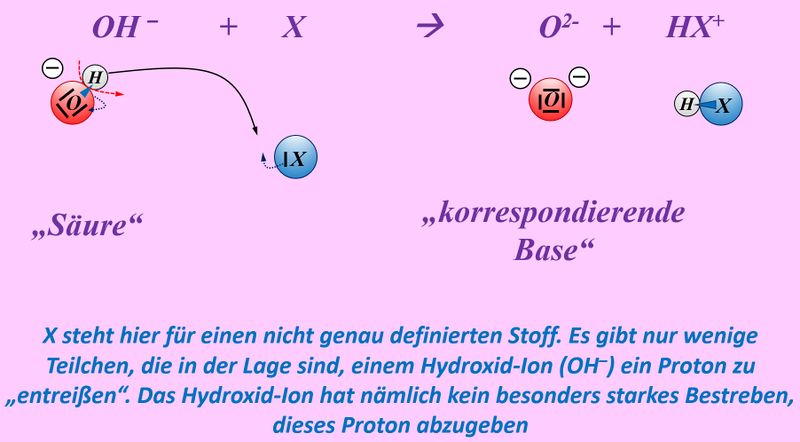
Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.<br> | |||
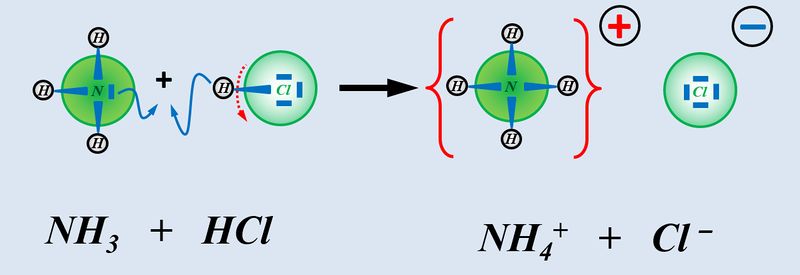
Insofern sind '''Säuren und Basen''' hervorragende '''Reaktionspartner''' und reagieren in einer typischen '''"Säure-Base-Reaktion"''' miteinander:<br> | |||
[[Datei:SäBa3_HCl_mit_NH3.jpg|800px]]<br> | |||
<br> | |||
Wie ihr sehen könnt, entsteht bei dieser Reaktion ein Salz. Also ein Stoff, der aus positiv geladenen Teilchen (hier NH<sub>4</sub><sup>+</sup>) und negativ geladenen Teilchen (hier: Cl<sup>-</sup>) aufgebaut ist. Salze entstehen auch bei der Reaktion von Metallen mit Nichtmetallen, z.B. von Natrium mit Chlor. | |||
* Vergleicht diese beiden Reaktionstypen miteinander! "Vergleichen" heißt: Gemeinsamkeiten und Unterschiede herausstellen. | |||
{{Lösung versteckt| | |||
* Bei der Salzbildung aus '''Metall und Nichtmetall''' gibt das Metall '''Elektronen '''ab, das Nichtmetall nimmt Elektronen auf. | |||
* Bei der Salzbildung aus '''Säure und Base''' gibt die Säure ein '''Proton '''ab, die Base nimmt ein Proton auf. | |||
* Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden. | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft. <br> | |||
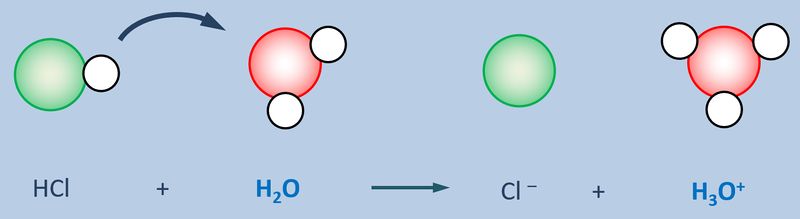
Betrachtet zunächst die hier stark vereinfacht dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_HCl_mit_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr wahrscheinlich noch nicht, auch "H<sub>3</sub>O<sup>+</sup>-Teilchen" wäre o.k. gewesen. | |||
|Lösung|Lösung ausblenden}} | |||
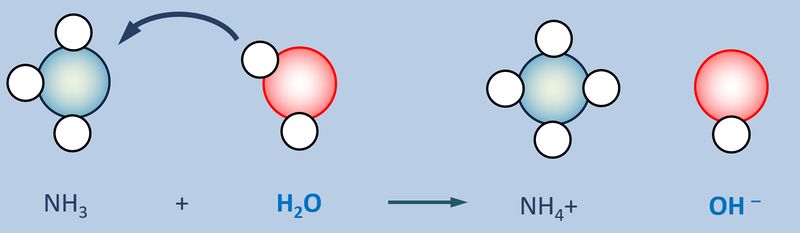
Betrachtet nun die stark vereinfacht dargestellte Reaktion, die beim Einleiten von NH<sub>3</sub>-Gas in Wasser abläuft und beschreibt sie mit Worten:<br> | |||
[[Datei:SäBa3_NH3_und_H2O.jpg|800px]]<br> | |||
{{Lösung versteckt| | |||
Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH<sub>4</sub><sup>+</sup>-Teilchen) und ein Hydroxid-Ion (OH<sup>-</sup>-Teilchen) | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
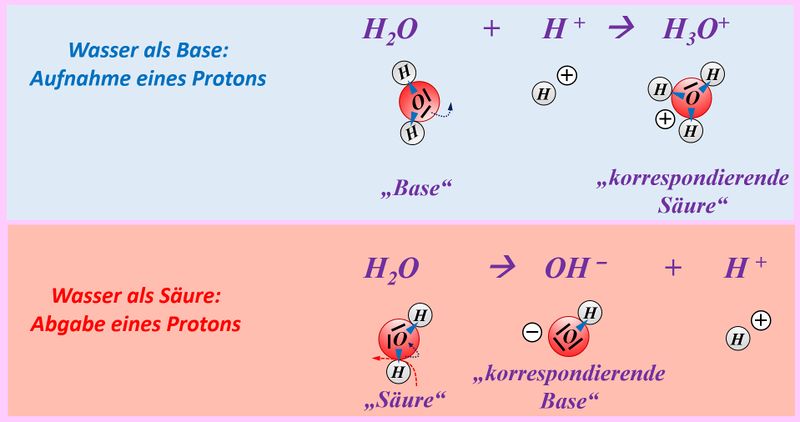
Legt nun den Fokus eurer Betrachtung auf das Wassermolekül. Zunächst zur oberen Gleichung: Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton aufgenommen. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Basen. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Jetzt zur unteren Gleichung: Was hat das Wassermolekül hier "gemacht"? | |||
{{Lösung versteckt| | |||
Es hat ein Proton abgegeben. | |||
* Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind? | |||
{{Lösung versteckt| | |||
Säuren. | |||
|Lösung|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
Wasser ist also ein Stoff, der je nach Partner wie eine Säure oder eine Base reagieren kann. Solche Stoffe nennt man '''Ampholyte'''. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Der Einfluss des Wassers'''</span> | |||
|Inhalt= | |||
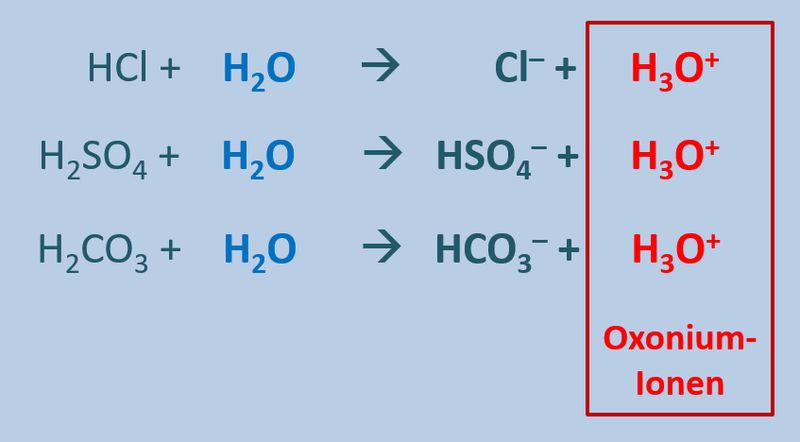
Diese Eigenschaft von Wasser führt dazu, dass beim Zugeben von '''Säuren '''(egal welcher) zu Wasser '''saure Lösungen''' entstehen, die alle eine Gemeinsamkeit haben: Sie enthalten das Oxonium-Ion H<sub>3</sub>O<sup>+</sup>:<br> | |||
[[Datei:SäBa3_divSä_undH2O.jpg|800px]]<br> | |||
<br> | |||
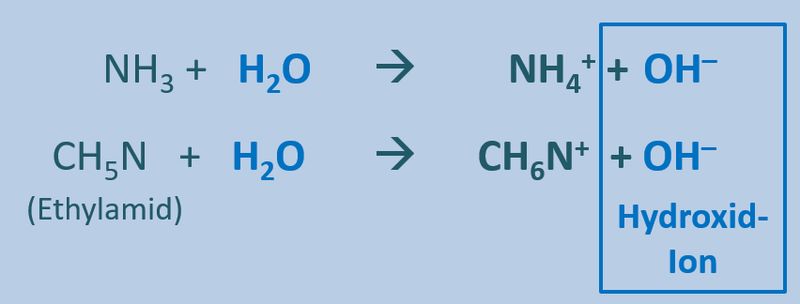
Ähnliches gilt für Basen. Egal welche Basen man in Wasser gibt, es entstehen immer basische Lösungen, die das Hydroxid-Ion enthalten OH<sup>-</sup>:<br> | |||
[[Datei:SäBa3_divBa_undH2O.jpg|800px]]<br> | |||
<br> | |||
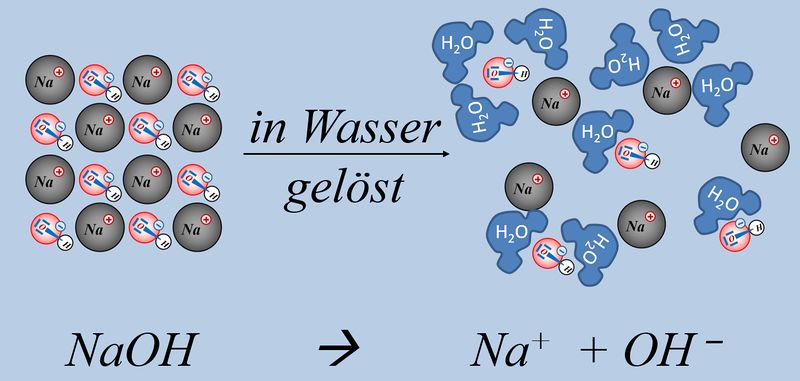
Allerdings gibt es noch eine andere Stoffgruppe, die zu basischen Lösungen führt, in denen OH<sup>-</sup>-Ionen enthalten sind: Nämlich Hydroxid-Salze, wie z.B. NaOH oder KOH oder Ca(OH)<sub>2</sub>. All diese Salze lösen sich in Wasser und setzen dabei Hydroxid-Ionen frei, ohne dass eine chemische Reaktion mit Wasser stattfinden müsste. Das Ergebnis ist aber ein ähnliches wie mit NH<sub>3</sub>, es entsteht eine basische Lösung, die Hydroxid-Ionen enthält:<br> | |||
[[Datei:SäBa3_NaOH_und_H2O.jpg|800px]]<br> | |||
<br> | |||
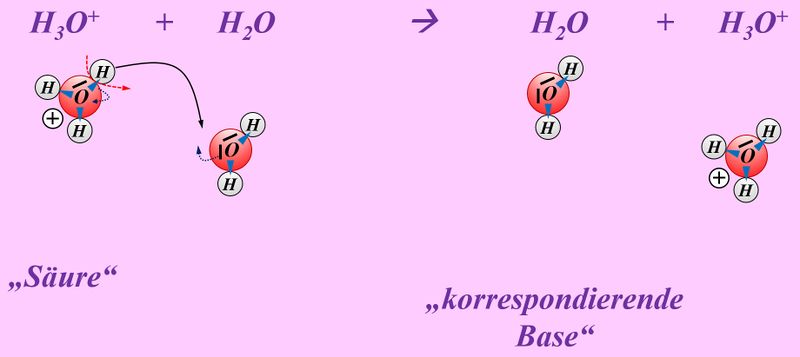
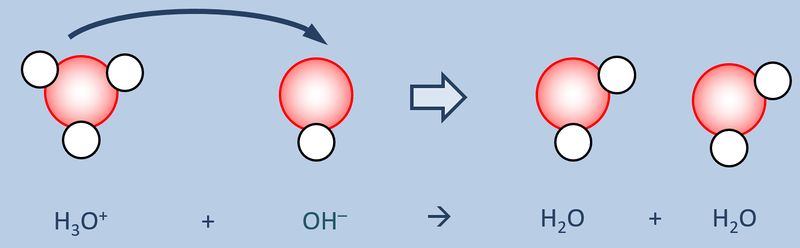
Schüttet man nun eine saure Lösung und eine basische Lösung zusammen, so reagieren eigentlich nicht die Säure und die Base direkt miteinander, sondern die bereits vorher durch den Kontakt mit Wasser gebildeten Oxonium-Ionen H<sub>3</sub>O<sup>+</sup> mit den Hydroxid-Ionen OH<sup>-</sup>:<br> | |||
[[Datei:SäBa3_H3O_und_OH.jpg|800px]]<br> | |||
<br> | |||
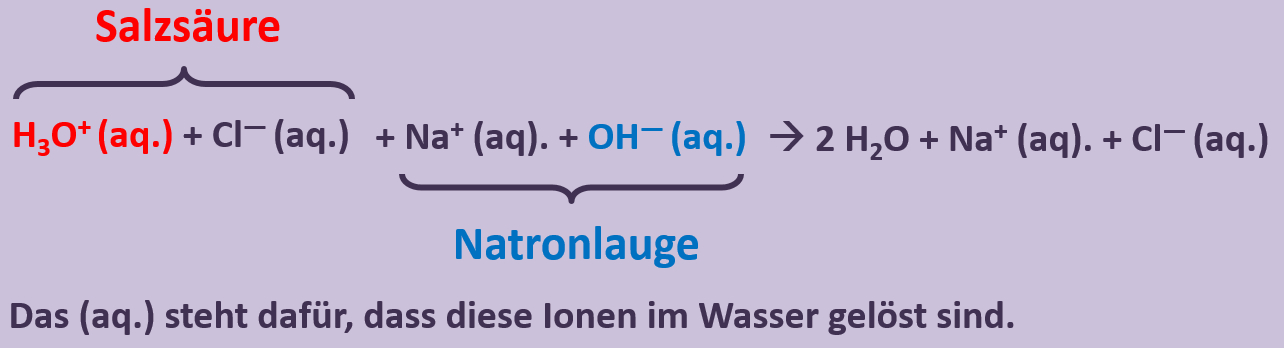
Diese Reaktion führ zu einer Verringerung der Oxonium- bzw. Hydroxid-Ionen, die für den sauren bzw. basischen Charakter verantwortlich waren. Die entstehende Lösung ist also weder sauer noch basisch sondern neutral. '''Man kann also sagen, Säuren und Basen neutralisieren sich gegenseitig.''' | |||
<br> | |||
Schüler formulieren folgende Aufgabe oft "stark vereinfacht": | |||
* Formuliere die Neutralisationsgleichung für die Reaktion von Natronlauge mit Salzsäure: | |||
<br> | |||
Lösung der Schüler: HCl + NaOH --> H<sub>2</sub>O + NaCl<br> | |||
<br> | |||
Was dabei übersehen wird: Salzsäure ist nicht das selbe wie HCl. HCl ist ein Gas. Wenn dieses in Wasser gelöst wird, entsteht erst die "Salzsäure". Formuliert die Gleichung für diese Reaktion! | |||
{{Lösung versteckt| | |||
HCl + H<sub>2</sub>O --> H<sub>3</sub>O<sup>+</sup> + Cl<sup>-</sup> | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
Auch NaOH ist nicht das gleiche wie Natronlauge. Diese entsteht erst durch Lösen von NaOH in Wasser. Formuliert die Gleichung für diese Reaktion! | |||
{{Lösung versteckt| | |||
NaOH --> Na<sup>+</sup> + OH<sup>-</sup> | |||
|Lösung|Lösung ausblenden}} | |||
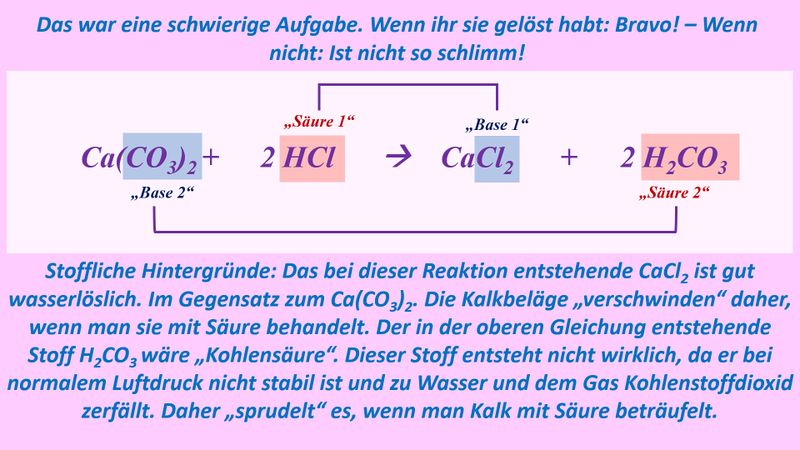
Man sollte also besser formulieren: <br> | |||
[[Datei:SäBa3_NaOH_und_HCl_mit_H2O.jpg]]<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Formuliert die Reaktion von folgenden Stoffen mit Wasser: | |||
* Schwefelsäure | |||
* Iodsäure (HIO<sub>3</sub>) | |||
Formuliert die Neutralisationsreaktion von Schwefelsäure H<sub>2</sub>SO<sub>4</sub> mit Calciumhydroxid Ca(OH)<sub>2</sub> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
== Arbeitsauftrag Chemie für den 04.05. == | == Arbeitsauftrag Chemie für den 04.05. == | ||
| Zeile 82: | Zeile 437: | ||
'''Durchführung''': | '''Durchführung''': | ||
* Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Pulver oder einen halben Teelöffel Backpulver. | * Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Bullrich-Salz-Pulver oder einen halben Teelöffel Backpulver. | ||
* Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um. | * Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um. | ||
* Probiert von jeder Lösung | * Probiert von jeder Lösung indem ihr euren Finger eintaucht und ihn ableckt. (Falls ihr Backpulver verwendet habt, dürft ihr das nur '''einmal''' machen, Backpulver kann im Magen zur Bildung großer Mengen Gas führen.) | ||
<br> | <br> | ||
Beschreibt das '''Ergebnis''' in Form eurer Geschmacks-Empfindung | Beschreibt das '''Ergebnis''' in Form eurer Geschmacks-Empfindung | ||
| Zeile 129: | Zeile 483: | ||
}} | }} | ||
<br> | <br> | ||
== Arbeitsauftrag 27.04. == | == Arbeitsauftrag 27.04. == | ||
Aktuelle Version vom 15. Februar 2021, 06:08 Uhr
Diejenigen unter euch, die in der Oberstufe Chemie belegt haben, sollten diese Aufgaben wirklich bearbeiten. Bitte meldet mir Unklarheiten auch möglichst zeitnah zurück. Für diejenigen, die kein Chemie belegt haben, können die Aufgaben trotzdem ganz nützlich sein. Vor allem in der ersten Hälfte der elften Klasse in Biologie wird oft auf die chemischen Grundlagen bestimmter Stoffwechselreaktionen zurückgegriffen.
Arbeitsauftrag Chemie für den 27.05.
Arbeitsauftrag Chemie für den 25.05.
Arbeitsauftrag Chemie für den 20.05.
Arbeitsauftrag Chemie für den 18.05.
Arbeitsauftrag Chemie für den 11.05.
Arbeitsauftrag Chemie für den 04.05.
Arbeitsauftrag 27.04.
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.
Die eingekreisten Symbole stehen für eine "polare Atombindung".
Beide Begriffe, polar und Atombindung, sollte man nun erklären.
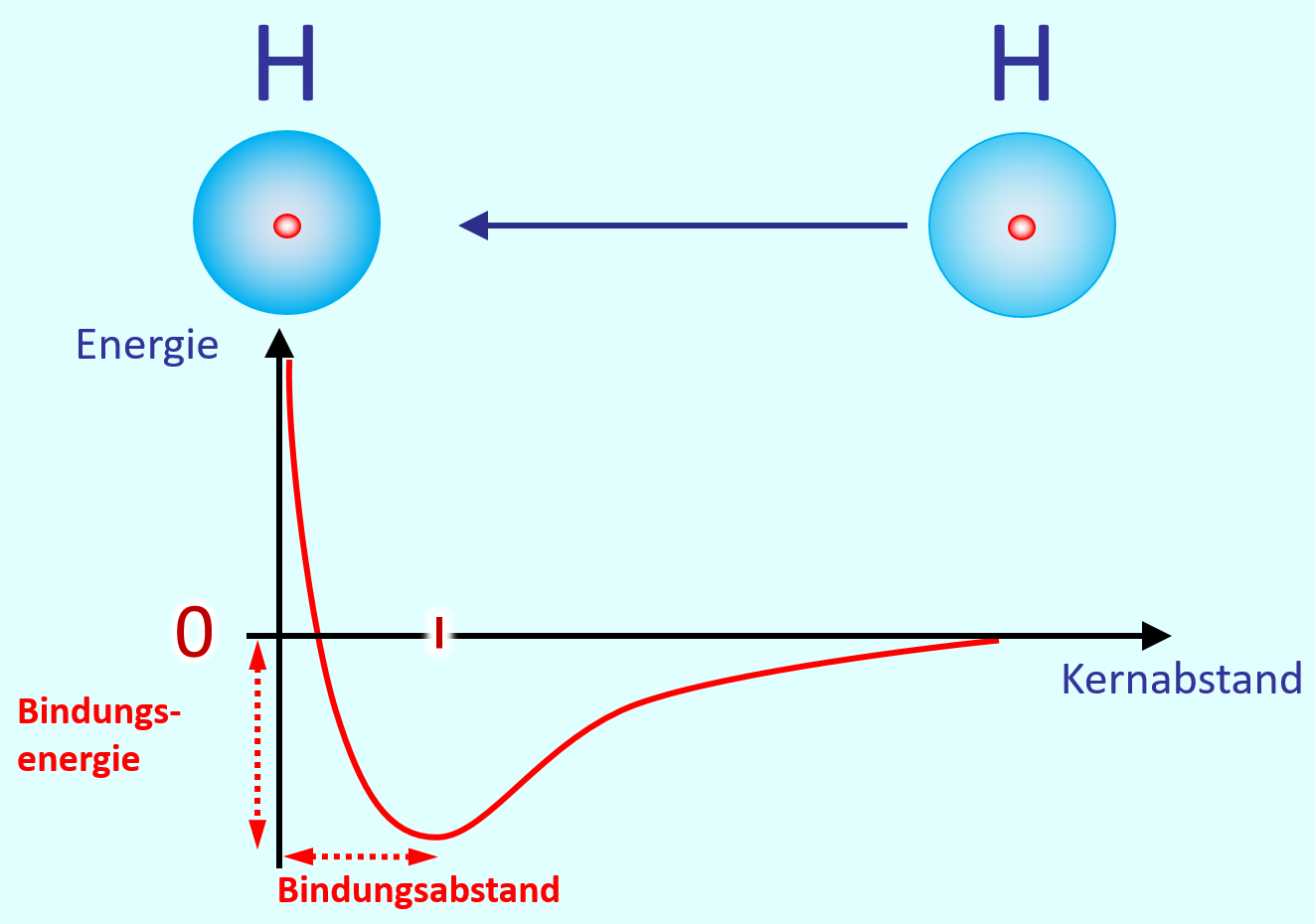
Eine Atombindung entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt.
Polar sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an.
- Ein Chlor-Atom besitzt insgesamt 17 Elektronen
- Sieben davon sitzen auf der äußersten Schale, sind also Valenzelektronen
- Chlor muss ein Elektron aufnehmen
- Ein Wasserstoff-Atom besitzt ein Elektron
- ...sehr witzig...
- Es muss eins aufnehmen, um die Edelgas-Konfiguration von Helium zu erreichen (Zwei Elektronen auf der innersten Schale, die damit voll besetzt ist und einen sehr energiearmen Zustand darstellt)
- Das haben wir noch nicht besprochen: Wasserstoff könnte das eine Elektron auch abgeben. Dann hat es überhaupt keins mehr. Vom Wasserstoffatom bliebe dann nur das eine Proton im Kern übrig. Das ist zwar keine klassische Edelgaskonfiguration, aber dennoch auch ein sehr energiearmer Zustand.
Das bindende Elektronenpaar (Playmobil-Pferd + Playmobil-Cowboy) wird komplett auf das Chlor-Atom (euer Geschwister) übertragen. Es entsteht ein positiv geladenes Wasserstoff-Teilchen (vorher: ein positiv geladenes Proton im Kern, ein negatives Elektron in der Hülle; jetzt; nur noch ein Proton) und ein negativ geladenes Chlor-Teilchen (vorher: 17 Protonen im Kern, 17 Elektronen in der Hülle; jetzt: 17 Protonen im Kern, 18 Elektronen in der Hülle.
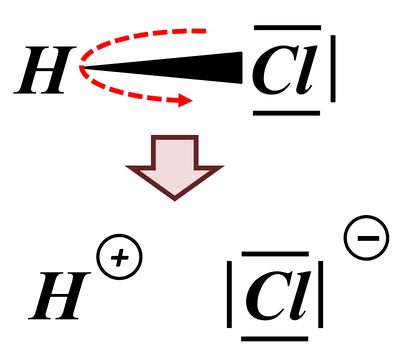
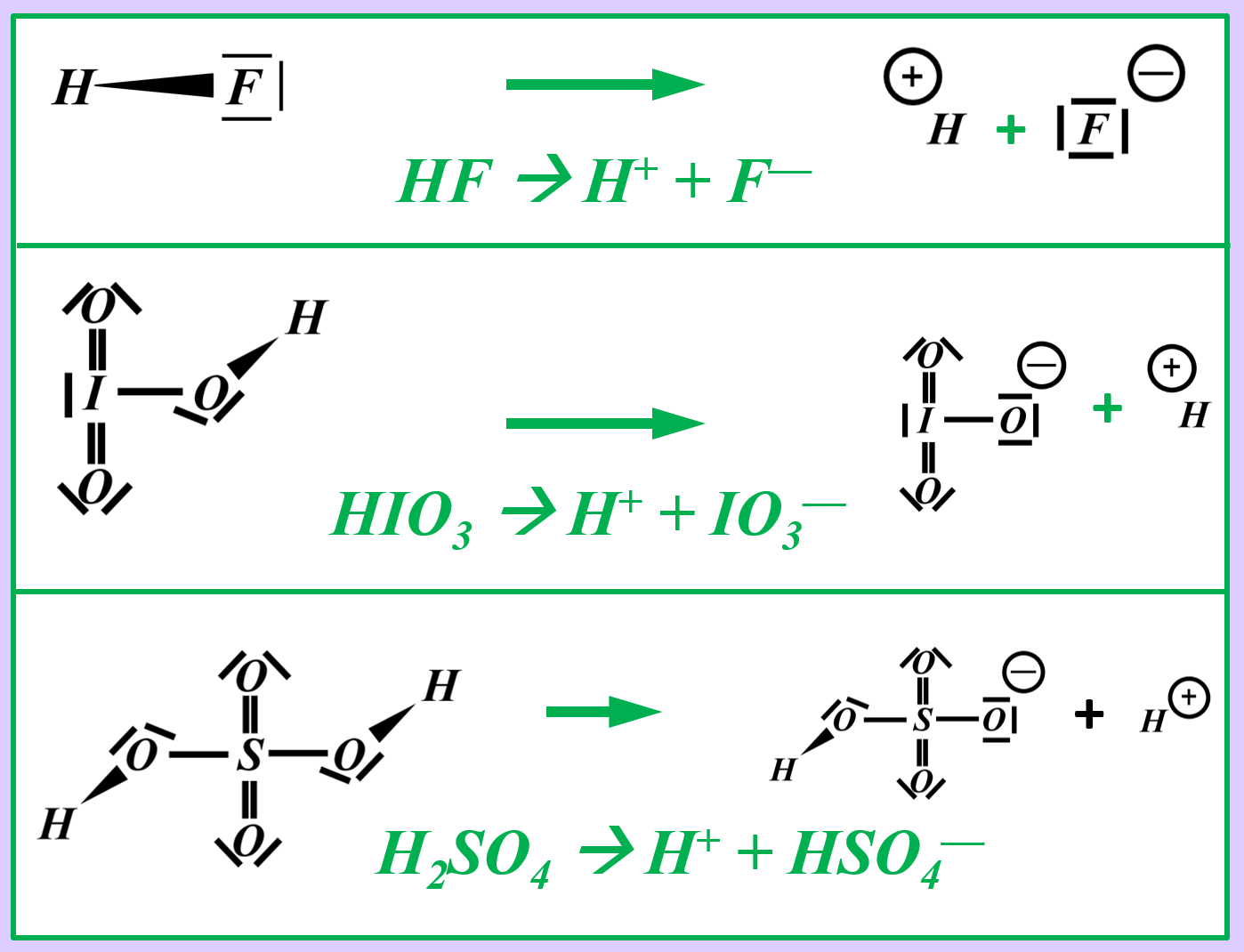
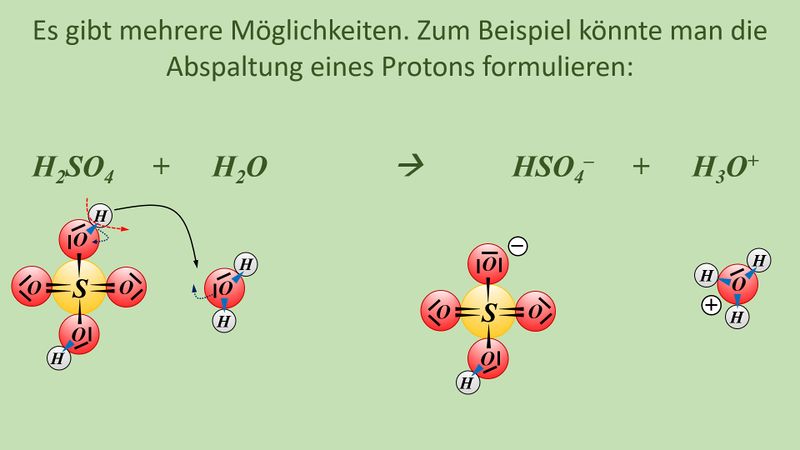
Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
Arbeitsauftrag 20.04.