|
|
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) |
| Zeile 1: |
Zeile 1: |
| ==Chemie== | | ==Chemie== |
| === Chemie: chemische Reaktionsgleichungen aufstellen ===
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">'''Nr. 1''': Ammoniak reagiert mit Sauerstoff zu Stickstoffmonooxid und Wasser.</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Ammoniak + Sauerstoff --> Stickstoffmonooxid + Wasser
| |
|
| |
| {{Lösung versteckt|
| |
| * Ammoniak (Trivialname, muss man auswendig wissen): '''NH<sub>3</sub>'''
| |
| * Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>'''
| |
| * Stickstoffmonooxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''NO'''
| |
| * Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O'''
| |
| * NH<sub>3</sub> + O<sub>2</sub> --> NO + H<sub>2</sub>O
| |
| {{Lösung versteckt|
| |
| '''4 NH<sub>3</sub> + 5 O<sub>2</sub> --> 4 NO + 6 H<sub>2</sub>O'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Ammoniak''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Stickstoff- und drei Wasserstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
| <br>
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">'''Nr. 2''': Benzol (C<sub>6</sub>H<sub>6</sub>) verbrennt (reagiert mit Sauerstoff) zu Kohlenstoffdioxid und Wasser</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Benzol + Sauerstoff --> Kohlenstoffdioxid + Wasser
| |
|
| |
| {{Lösung versteckt|
| |
| * Benzol (Trivialname, müsst ihr aktuell noch nocht wissen, daher ist chem. Formel angegeben): '''C<sub>6</sub>H<sub>6</sub>'''
| |
| * Sauerstoff (Element und steht im HOFBrINCl): '''O<sub>2</sub>'''
| |
| * Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>'''
| |
| * Wasser (Trivialname, muss man auswendig wissen): '''H<sub>2</sub>O'''
| |
| * C<sub>6</sub>H<sub>6</sub> + O<sub>2</sub> --> CO<sub>2</sub> + H<sub>2</sub>O
| |
| {{Lösung versteckt|
| |
| '''2 C<sub>6</sub>H<sub>6</sub> + 15 O<sub>2</sub> --> 12 CO<sub>2</sub> + 6 H<sub>2</sub>O'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Kohlenstoffdioxid''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus einem Kohlenstoff- und zwei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#080">'''Nr. 3''': Phosphortribromid und Wasser reagieren zu Diphosphortrioxid und Wasserstoffbromid.</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Phosphortribromid + Wasser --> Diphosphortrioxid + Wasserstoffbromid
| |
|
| |
| {{Lösung versteckt|
| |
| * Phosphortribromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''PBr<sub>3</sub>'''
| |
| * Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O'''
| |
| * Diphosphortrioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''P<sub>2</sub>O<sub>3</sub>'''
| |
| * Wasserstoffbromid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''HBr'''
| |
| * PBr<sub>3</sub> + H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + HBr
| |
| {{Lösung versteckt|
| |
| '''2 PBr<sub>3</sub> + 3 H<sub>2</sub>O --> P<sub>2</sub>O<sub>3</sub> + 6 HBr'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Disphosphortrioxid''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um einen molekularen Stoff. Die einzelnen Moleküle bestehen aus zwei Phosphor- und drei Sauerstoff-Atomen, die fest miteinander verbunden sind. Die einzelnen Moleküle sind frei gegeneinander beweglich.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #080
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFB
| |
| |Hintergrund= #DFB
| |
| }}
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#007">'''Nr. a)''' Aluminium und Chlor reagieren zu Aluminiumchlorid</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Aluminium + Chlor --> Aluminiumchlorid
| |
|
| |
| {{Lösung versteckt|
| |
| * Aluminium (Element, nicht Bestandteil von HONClBrIF): '''Al'''
| |
| * Chlor (Element, Bestandteil von HONClBrIF): '''Cl<sub>2</sub>'''
| |
| * Aluminiumchlorid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153):
| |
| ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup>
| |
| ** Chlor steht in der 7. Hauptgruppe --> bildet in Salzen immer 1fach negativ geladene Anionen: Cl<sup>-</sup>
| |
| ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei Cl<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''AlCl<sub>3</sub>'''
| |
| * Al + Cl<sub>2</sub> --> AlCl<sub>3</sub>
| |
|
| |
| {{Lösung versteckt|
| |
| '''2 Al + 3 Cl<sub>2</sub> --> 2 AlCl<sub>3</sub>'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Aluminiumchlorid''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 1fach negativ geladenen Chlorid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #007
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFF
| |
| |Hintergrund= #DFF
| |
| }}
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#007">'''Nr. d)''' Zink(II)-oxid reagiert mit Kohlenstoff zu Zink und Kohlenstoffdioxid</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 2 ZnO + C --> 2 Zn + CO<sub>2</sub>
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Zink(II)-oxid + Kohlenstoff --> Zink + Kohlenstoffdioxid
| |
|
| |
| {{Lösung versteckt|
| |
| * Zink(II)-oxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153):
| |
| ** Zink steht in einer Nebengruppe. Welche Ionen Zink bildet ist daher nicht ganz klar. Die römische Zahl in der runden Klammer gibt aber die Ladung des Zink-Kations im Salz an: 2fach positiv --> Zn<sup>2+</sup>
| |
| ** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>
| |
| ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, muss pro Zn<sup>2+</sup>-Ion ein O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''ZnO'''
| |
| * Kohlenstoff (Element, kein Bestandteil von HONClBrIF): '''C'''
| |
| * Zink (Element, kein Bestandteil von HONClBrIF): '''Zn'''
| |
| * Kohlenstoffdioxid (Molekularer Stoff, da aus zwei Nichtmetallen zusammengesetzt, Namensgebung s. Buch, S. 102): '''CO<sub>2</sub>'''
| |
| * ZnO + C --> Zn + CO<sub>2</sub>
| |
|
| |
| {{Lösung versteckt|
| |
| '''2 ZnO + C --> 2 Zn + CO<sub>2</sub>'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Zinkoxid''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 2fach positiv geladenen Zink-Kationen und 2fach negativ geladenen Oxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #007
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFF
| |
| |Hintergrund= #DFF
| |
| }}
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#007">'''Nr. f)''' Aluminiumhydroxid reagiert zu Aluminiumoxid und Wasser</span>
| |
| |Inhalt=
| |
|
| |
| {{Lösung versteckt|
| |
| 2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O
| |
| |Sofort gesamte Gleichung anzeigen|Lösung ausblenden}}
| |
| <br>
| |
| '''oder Schritt für Schritt:'''
| |
| <br>
| |
|
| |
| {{Lösung versteckt|
| |
| Aluminiumhydroxid --> Aluminiumoxid + Wasser
| |
|
| |
| {{Lösung versteckt|
| |
| * Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153):
| |
| ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup>
| |
| ** "Hydroxid" ist ein feststehender Begriff für das Molekül-Ion OH<sup>-</sup>.
| |
| ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro Al<sup>3+</sup>-Ion drei OH<sup>-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al(OH)<sub>3</sub>'''
| |
| * Aluminiumhydroxid (Ionenverbindung oder Salz, Namensgebung s. Buch, S. 152-153):
| |
| ** Aluminium steht in der 3. Hauptgruppe --> bildet in Salzen immer 3fach positiv geladenen Kationen: Al<sup>3+</sup>
| |
| ** Sauerstoff steht in der 6. Hauptgruppe --> bildet in Salzen immer 2fach negativ geladene Anionen: O<sup>2-</sup>.
| |
| ** Damit aus diesen beiden Ionen ein insgesamt ungeladenes Salz entstheht, müssen pro zwei Al<sup>3+</sup>-Ionen drei O<sup>2-</sup>-Ionen vorhanden sein. Daraus ergibt sich die Formel für das Salz: '''Al<sub>2</sub>O<sub>3</sub>'''
| |
| * Wasser (Tivialname, muss man auswendig wissen): '''H<sub>2</sub>O'''
| |
| * Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O
| |
|
| |
|
| |
| {{Lösung versteckt|
| |
| '''2 Al(OH)<sub>3</sub> --> Al<sub>2</sub>O<sub>3</sub> + 3 H<sub>2</sub>O'''
| |
| |Ausgleichen|Lösung ausblenden}}
| |
| |Chemische Formeln aufstellen|Lösung ausblenden}}
| |
|
| |
| |Edukte und Produkte festlegen|Lösung ausblenden}}
| |
|
| |
| Beschreibe den Aufbau des Stoffs '''Aluminiumhydroxid''' unter Verwendung von Fachbegriffen so genau wie möglich!
| |
| {{Lösung versteckt|
| |
| Es handelt sich um ein Salz (eine Ionenverbindung). Es besteht aus 3fach positiv geladenen Aluminium-Kationen und 2fach negativ geladenen Hydroxid-Anionen. Bei der chem. Formel handelt es sich um eine Verhältnisformel: Es liegen große Kristalle vor, die aus sehr vielen Ionen bestehen, die in einem starren Gitter im angegebenen Verhältnis vorliegen und sich alle gegenseitig anziehen.
| |
| |Lösung|Lösung ausblenden}}
| |
|
| |
| |Farbe= #007
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DFF
| |
| |Hintergrund= #DFF
| |
| }}
| |
|
| |
|
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#900">'''Termine'''</span> | | |Titel=<span style="color:#900">'''Termine'''</span> |
| |Inhalt= | | |Inhalt= |
| * '''2. Schulaufgabe''': ''noch nicht festgelegt'' <br> | | * '''2. Schulaufgabe''': Montag, 19.06.23 <br> |
| * '''2. kleiner angesagter Leistungsnachweis''': voraussichtlich am Di, 28.03.
| |
| |Farbe= #900 | | |Farbe= #900 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 258: |
Zeile 13: |
|
| |
|
| === aktuelle Aufgaben zum Üben === | | === aktuelle Aufgaben zum Üben === |
| | |
| {{Box-spezial | | {{Box-spezial |
| |Titel=<span style="color:#607">'''Rechnen mit molaren Größen '''</span> | | |Titel=<span style="color:#607">'''Rechnen mit molaren Größen '''</span> |
| Zeile 263: |
Zeile 19: |
| Allgemein müsst ihr mit folgenden Größen umgehen können: | | Allgemein müsst ihr mit folgenden Größen umgehen können: |
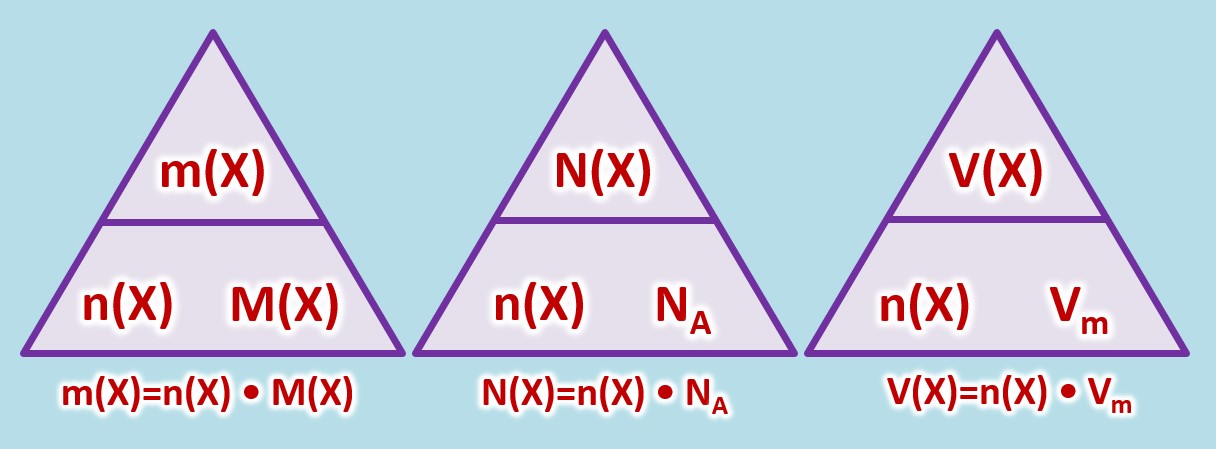
| * Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | | * Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) |
| | * Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit |
| | * Das Volumen eines (gasförmigen) Stoffes: <math>V(X)</math>, Einheit: <math>L</math> (Liter) |
| | * Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math> |
| * molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | | * molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden |
| * Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math>
| |
| * Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit
| |
| * Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | | * Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> |
| | * molares Volumen eines (gasförmigen) Stoffes bei Standardbedingungen (273°C und 1013hPa): <math>V_m = 22,4</math>, Einheit <math>\frac{L}{mol} </math> |
| <br> | | <br> |
| Es gelten die folgenden Zusammenhänge: | | Es gelten die folgenden Zusammenhänge: |
| [[Datei:C8NTG_ReMiMoGr_2ZH_3ecke.jpg]]<br> | | [[Datei:C8NTG_ReMiMoGr_3ZH_3ecke.jpg]]<br> |
| <br><br> | | <br><br> |
| |Farbe= #607 | | |Farbe= #607 |
| Zeile 281: |
Zeile 39: |
| |Inhalt= | | |Inhalt= |
| Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" | | Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" |
| |Farbe= #607
| |
| |Rahmen= 0
| |
| |Rahmenfarbe= #DCF
| |
| |Hintergrund= #DCF
| |
| }}
| |
|
| |
| {{Box-spezial
| |
| |Titel=<span style="color:#607">'''Wochenaufgabe 1 (20.-24.03.)'''</span>
| |
| |Inhalt=
| |
| * Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut?
| |
| * Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert?
| |
| : Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google!
| |
| {{Lösung versteckt|
| |
| Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt!
| |
| {{Lösung versteckt|
| |
| * '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol
| |
| * '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl")
| |
| * '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen
| |
| * Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>'''
| |
| |Ja, ich habe eine Lösung notiert|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| * Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid.
| |
| {{Lösung versteckt|
| |
| * Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht.
| |
| * Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup>
| |
| * Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>'''
| |
| * Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O
| |
| * Die chemische Gleichung lautet dann:
| |
| 4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O
| |
| |Lösung|Lösung ausblenden}}
| |
| * Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)?
| |
| {{Lösung versteckt|
| |
| Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen.
| |
| {{Lösung versteckt|
| |
| Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das?
| |
| {{Lösung versteckt|
| |
| '''gesucht:''' <math>m(K)= ? </math><br>
| |
| '''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br>
| |
| '''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br>
| |
| <br>
| |
| Einsetzen der Werte in die Formel:<br>
| |
| <math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math>
| |
| |Lösung 2|Lösung ausblenden}}
| |
| |Lösung|Lösung ausblenden}}
| |
| |Tipp|Lösung ausblenden}}
| |
|
| |
| |Farbe= #607 | | |Farbe= #607 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 606: |
Zeile 318: |
| |Tipp|Lösung ausblenden}} | | |Tipp|Lösung ausblenden}} |
|
| |
|
| | |Farbe= #080 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DFB |
| | |Hintergrund= #DFB |
| | }} |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#080">'''Wochenaufgabe 1 (20.-24.03.)'''</span> |
| | |Inhalt= |
| | * Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut? |
| | * Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert? |
| | : Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! |
| | {{Lösung versteckt| |
| | Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! |
| | {{Lösung versteckt| |
| | * '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol |
| | * '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") |
| | * '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen |
| | * Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>''' |
| | |Ja, ich habe eine Lösung notiert|Lösung ausblenden}} |
| | |Lösung|Lösung ausblenden}} |
| | * Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid. |
| | {{Lösung versteckt| |
| | * Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht. |
| | * Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup> |
| | * Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>''' |
| | * Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O |
| | * Die chemische Gleichung lautet dann: |
| | 4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O |
| | |Lösung|Lösung ausblenden}} |
| | * Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? |
| | {{Lösung versteckt| |
| | Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. |
| | {{Lösung versteckt| |
| | Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? |
| | {{Lösung versteckt| |
| | '''gesucht:''' <math>m(K)= ? </math><br> |
| | '''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> |
| | '''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> |
| | <br> |
| | Einsetzen der Werte in die Formel:<br> |
| | <math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math> |
| | |Lösung 2|Lösung ausblenden}} |
| | |Lösung|Lösung ausblenden}} |
| | |Tipp|Lösung ausblenden}} |
| | |
| | |Farbe= #080 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DFB |
| | |Hintergrund= #DFB |
| | }} |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#080">'''Abschlussaufgaben zum Thema Salze'''</span> |
| | |Inhalt= |
| | |
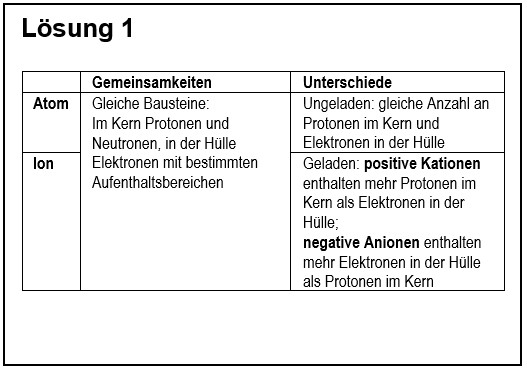
| | 1. Vergleiche in übersichtlicher Form ein '''Atom''' mit einem '''Ion'''! |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg1.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf! |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg2.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen: Verformbarkeit - große Bindungskräfte - Löslichkeit - elektrische Leitfähigkeit - Sprödigkeit - niedrige Siedetemperatur - Reaktionsträgheit. |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg3.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist. |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg4.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
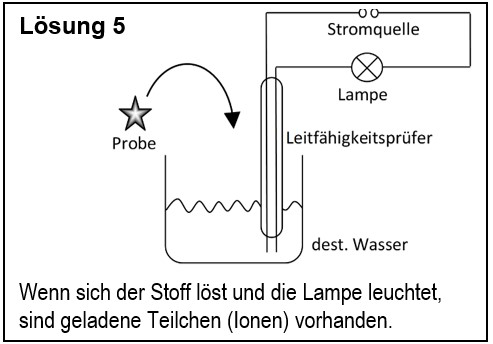
| | 5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht. |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg5.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg<sub>3</sub>N<sub>2</sub>, CaO, KI, BaCl<sub>2</sub> und Aluminiumfluorid |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg6.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li<sup>+</sup>, K, S<sup>2-</sup>, Na<sup>+</sup> |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg7.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| | 8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid. |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_AbschlA_Salze_Lsg8.jpg]] |
| | |Lösungsvorschlag|Lösung ausblenden}} |
| |Farbe= #080 | | |Farbe= #080 |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 630: |
Zeile 430: |
| * 1. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung.pdf| Hier klicken]] | | * 1. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung.pdf| Hier klicken]] |
| * 2. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung2.pdf| Hier klicken]] | | * 2. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung2.pdf| Hier klicken]] |
| '''Montag, 20.03. und 24.04. | | '''20.03. - 08.05.: Fällungsreaktionen''' |
| * Chemie-Übung: Fällungsreaktionen
| |
| * Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_ClBrI_V2.pdf| Hier klicken]] <span style="color:#F00">neue Version hochgeladen am 14.04., Fehler ausgebessert</span><br> | | * Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_ClBrI_V2.pdf| Hier klicken]] <span style="color:#F00">neue Version hochgeladen am 14.04., Fehler ausgebessert</span><br> |
| * Erklärung der Fällungsreaktion auf Teilchenebene als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_Teilchenebene.pdf| Hier klicken]] | | * Erklärung der Fällungsreaktion auf Teilchenebene als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_Teilchenebene.pdf| Hier klicken]] |
| * Unterscheidung von Silberchlorid-, Silberbromid und Silberiodid-Niederschlag als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung2_U_ClBrI.pdf| Hier klicken]] | | * Unterscheidung von Silberchlorid-, Silberbromid und Silberiodid-Niederschlag als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung2_U_ClBrI.pdf| Hier klicken]] |
| | * Fällung und Unterscheidung von Carbonat- und Sulfat-Ionen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_CarboSulf.pdf| Hier klicken]] |
| | '''15.05-22.05.: Ionenlotto''' |
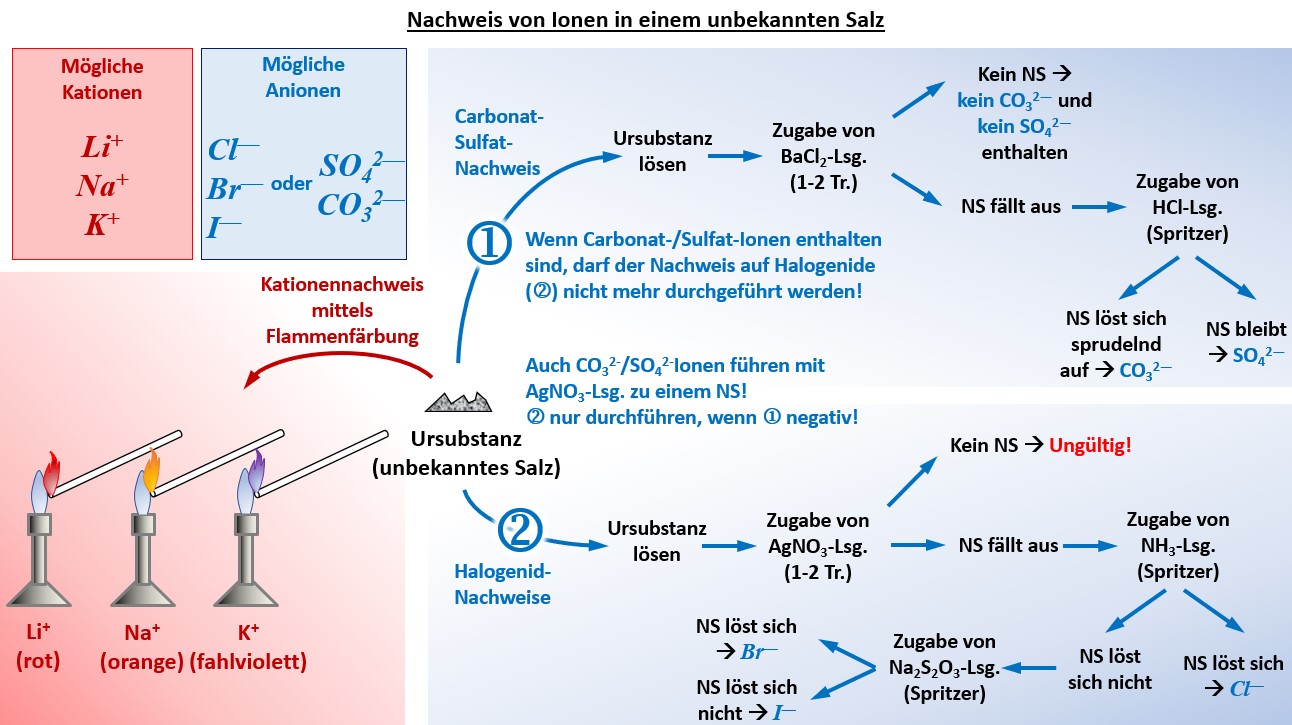
| | * Im Unterricht gestellte Aufgabe: "Identifiziere in der unbekannten Salzprobe die vorhanden Kationen und Anionen! Die Salzprobe enthält eines der folgenden Kationen: K<sup>+</sup>, Na<sup>+</sup>, Li<sup>+</sup> und eines der folgenden Anionen: Cl<sup>-</sup>, Br<sup>-</sup>, I<sup>-</sup>, CO<sub>3</sub><sup>2-</sup>, SO<sub>4</sub><sup>2-</sup>. Fertige ein sauberes Protokoll an, in dem vor allem die Durchführung und das Ergebnis dargestellt wird!" |
| | * Zwei zu dieser Aufgabe passende Muster-Protokoll als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Ionenlotto_ML.pdf| Hier klicken]] |
| | * Übersicht über die praktisch durchzuführenden Schritte: |
| | {{Lösung versteckt| |
| | [[Datei:G9_C8_Ü_011_NachweisGesamt_V2.jpg]]<br> |
| | |Grafische Darstellung einblenden|Lösung ausblenden}} |
| | <br> |
| | '''Montag, 03.07.''' |
| | * Eigenschaften von Alkanen (einfache Kohlenwasserstoffe) |
| | * Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_EigenschaftenAlkane.pdf| Hier klicken]] |
| |Farbe= #30F | | |Farbe= #30F |
| |Rahmen= 0 | | |Rahmen= 0 |
| Zeile 642: |
Zeile 453: |
|
| |
|
| ===Lernstoff für angekündigte Leistungsnachweise=== | | ===Lernstoff für angekündigte Leistungsnachweise=== |
| | {{Box-spezial |
| | |Titel= |
| | |Inhalt= Schulaufgabe am 19.06. |
| | |
| | Neben den Hefteinträgen und dem oben genannten Grundwissen, eignen sich folgende Seiten im Buch (Galvani - Chemie 8) zur Vorbereitung auf die Schulaufgabe: |
| | * S. 146 - 147: Aufbau von Salzen |
| | * S. 150 - 151: Verhältnisformeln |
| | * S. 152 - 153: Periodensystem der Atome und Ionen |
| | * S. 154 - 155: Eigenschaften von Salzen |
| | * S. 162 - 163 : Ionennachweise |
| | * S. 164: Flammenfärbung |
| | * S. 174 - 176: Metalle und ihre Eigenschaften |
| | * S. 120 - 121: Atommasse |
| | * S. 122 - 124: Stoffmenge, molare Masse und molares Volumen |
| | |
| | |Farbe= #30F |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DFF |
| | |Hintergrund= #DFF |
| | }} |
| | |
| | |
| {{Box-spezial | | {{Box-spezial |
| |Titel= | | |Titel= |