8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| (35 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
==Chemie== | ==Chemie== | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#900">'''Termine'''</span> | |Titel=<span style="color:#900">'''Termine'''</span> | ||
|Inhalt= | |Inhalt= | ||
* '''Schulaufgabe''': | * '''2. Schulaufgabe''': Montag, 19.06.23 <br> | ||
|Farbe= #900 | |Farbe= #900 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 11: | Zeile 11: | ||
}} | }} | ||
<br> | <br> | ||
=== aktuelle Aufgaben zum Üben === | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Rechnen mit molaren Größen '''</span> | |||
|Inhalt= | |||
Allgemein müsst ihr mit folgenden Größen umgehen können: | |||
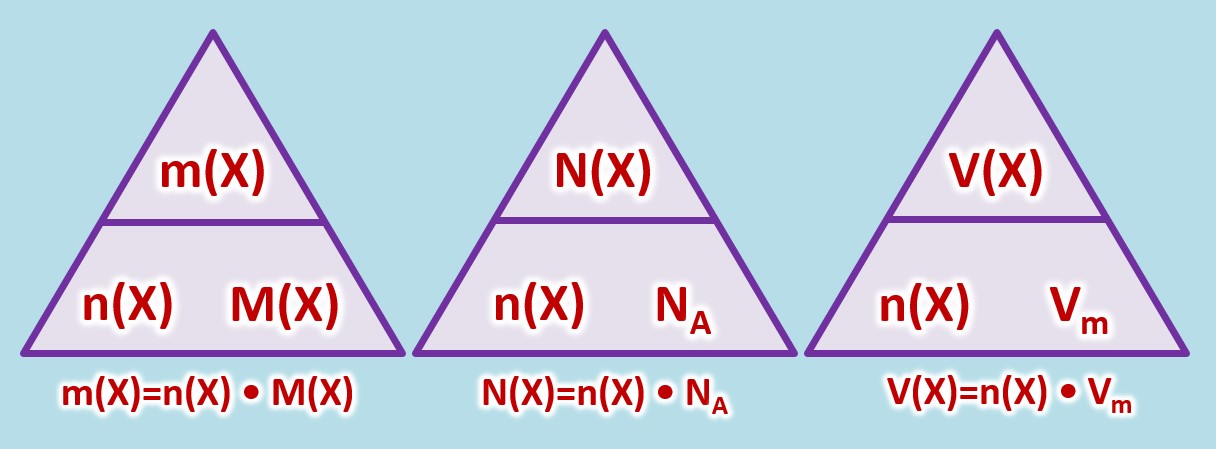
* Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | |||
* Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit | |||
* Das Volumen eines (gasförmigen) Stoffes: <math>V(X)</math>, Einheit: <math>L</math> (Liter) | |||
* Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math> | |||
* molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | |||
* Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | |||
* molares Volumen eines (gasförmigen) Stoffes bei Standardbedingungen (273°C und 1013hPa): <math>V_m = 22,4</math>, Einheit <math>\frac{L}{mol} </math> | |||
<br> | |||
Es gelten die folgenden Zusammenhänge: | |||
[[Datei:C8NTG_ReMiMoGr_3ZH_3ecke.jpg]]<br> | |||
<br><br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Ältere Aufgaben'''</span> | |||
|Inhalt= | |||
Ältere Aufgaben findet man weiter unten, im Block "Grundwissen" | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Online-Unterricht am 09.01.2023 === | === Online-Unterricht am 09.01.2023 === | ||
| Zeile 43: | Zeile 76: | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
'''Reaktion 3''': Eine pulverförmige Mischung aus Eisen und Schwefel wird als lange Spur auf eine feuerfeste Platte gestreut. Es genügt nun, diese Spur am einen Ende zu entzünden, um eine Reaktion zu starten, bei der die Verbindung Eisensulfid (FeS) entsteht. Das Gemisch glüht nach und nach vom einen Ende bis zum anderen komplett durch. | '''Reaktion 3''': Eine pulverförmige Mischung aus Eisen und Schwefel wird als lange Spur auf eine feuerfeste Platte gestreut. Es genügt nun, diese Spur am einen Ende zu entzünden, um eine Reaktion zu starten, bei der die Verbindung Eisensulfid (FeS<sub>2</sub>) entsteht. Das Gemisch glüht nach und nach vom einen Ende bis zum anderen komplett durch. | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Fe + S --> FeS | Fe + 2 S --> FeS<sub>2</sub> | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
| Zeile 181: | Zeile 214: | ||
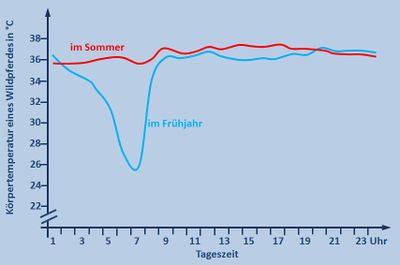
# ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} | # ''Im Unterricht könnte man dazu folgendes besprochen haben:'' Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.}} | ||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Fluor-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 9''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 10''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 9''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Ein Diamant besteht aus reinem Kohlenstoff. Üblicherweiße wird das Gewicht eines Diamanten in Karat angegeben. Es soll ein Diamant mit exakt einem Karat betrachtet werden. Das entspricht einer Masse von 0,2 Gramm. Berechne die Stoffmenge der Kohlenstoffatome in diesem Diamanten! | |||
{{Lösung versteckt| | |||
Hier ist die '''Stoffmenge '''gesucht, gegeben ist die '''Masse''' von Kohlenstoff. Die '''Molare Masse''' für Atome kann man direkt aus dem PSE ablesen, der Zahlenwert entspricht der "Massenzahl" (in der Regel oben links). | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>n(C)= ? </math><br> | |||
'''gegeben:''' <math>m(C)= 0,2g </math>, <math>M(C)= 12,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>n(x)=\frac{m(X)}{M(X)} </math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>n(C)=\frac{m(C)}{M(C)}=\frac{0,2g}{12\frac{g}{mol}}=0,017mol </math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 2 (27.02.-03.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Magnesium-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 12''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 12 oder 13''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 12''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Berechne die Masse einer Portion Wasser, deren Stoffmenge n(H<sub>2</sub>O) = 1,0mol beträgt! (Man könnte auch einfacher fragen: Wie viel Gramm wiegt 1 Mol Wasser?) | |||
{{Lösung versteckt| | |||
Hier ist die '''Masse'''gesucht, gegeben ist die '''Stoffmenge''' von Wasser. Die '''Molare Masse''' für Moleküle wie H<sub>2</sub>O kann durch Addition der am Aufbau beteiligten Atome direkt aus dem PSE abgeleitet werden. | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(H_{2}O)= ? </math><br> | |||
'''gegeben:''' <math>n(H_{2}O)= 1,0mol </math>, <math>M(H_{2}O)= 2 \cdot M(H) + M(O) = 18,0 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(H_{2}O) = M(H_{2}O) \cdot n(H_{2}O) = 18,0 \frac{g}{mol} \cdot 1,0mol = 18,0g</math> | |||
|Alles klar, zeig mir die Lösung|Lösung ausblenden}} | |||
|Tipps|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (06.03.-10.03)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Schwefel-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 16''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 16''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 16''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Das ist eine Verbindung mit der chemischen Formel '''MgO''' | |||
{{Lösung versteckt| | |||
2 Mg + O<sub>2</sub> --> 2 MgO | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 1 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Magnesiumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(Mg), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''zwei''' Magnesiumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Zwei Mol''' Magnesium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 2 Mol Magnesium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Magnesium entspricht das? | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(Mg)= ? </math><br> | |||
'''gegeben:''' <math>n(Mg)= 2,0mol </math>, <math>M(Mg)= 24,3 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(Mg) = M(Mg) \cdot n(Mg) = 24,3 \frac{g}{mol} \cdot 2,0mol = 48,6g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (20.-24.03.)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut? | |||
* Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
* Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>''' | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid. | |||
{{Lösung versteckt| | |||
* Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht. | |||
* Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup> | |||
* Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>''' | |||
* Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O | |||
* Die chemische Gleichung lautet dann: | |||
4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 8 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(K)= ? </math><br> | |||
'''gegeben:''' <math>n(K)= 8,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 8,0mol = 312,8g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Abschlussaufgaben zum Thema Salze'''</span> | |||
|Inhalt= | |||
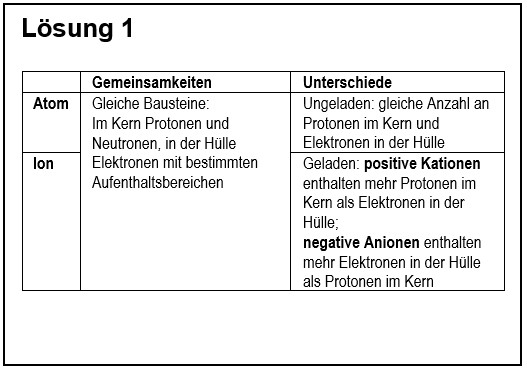
1. Vergleiche in übersichtlicher Form ein '''Atom''' mit einem '''Ion'''! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg1.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg2.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen: Verformbarkeit - große Bindungskräfte - Löslichkeit - elektrische Leitfähigkeit - Sprödigkeit - niedrige Siedetemperatur - Reaktionsträgheit. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg3.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg4.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
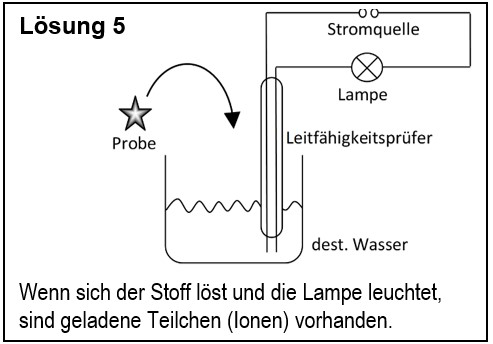
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg5.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg<sub>3</sub>N<sub>2</sub>, CaO, KI, BaCl<sub>2</sub> und Aluminiumfluorid | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg6.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li<sup>+</sup>, K, S<sup>2-</sup>, Na<sup>+</sup> | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg7.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg8.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 201: | Zeile 426: | ||
* Chemie-Übung: Wasserstoff oder Sauerstoff? | * Chemie-Übung: Wasserstoff oder Sauerstoff? | ||
* Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_H2oderO2.pdf| Hier klicken]] | * Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_H2oderO2.pdf| Hier klicken]] | ||
'''Montag, 27.02. und 06.03 | |||
* Chemie-Übung: Flammenfärbung | |||
* 1. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung.pdf| Hier klicken]] | |||
* 2. Übung: Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Flammenfärbung2.pdf| Hier klicken]] | |||
'''20.03. - 08.05.: Fällungsreaktionen''' | |||
* Anleitung + Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_ClBrI_V2.pdf| Hier klicken]] <span style="color:#F00">neue Version hochgeladen am 14.04., Fehler ausgebessert</span><br> | |||
* Erklärung der Fällungsreaktion auf Teilchenebene als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_Teilchenebene.pdf| Hier klicken]] | |||
* Unterscheidung von Silberchlorid-, Silberbromid und Silberiodid-Niederschlag als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung2_U_ClBrI.pdf| Hier klicken]] | |||
* Fällung und Unterscheidung von Carbonat- und Sulfat-Ionen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Fällung_CarboSulf.pdf| Hier klicken]] | |||
'''15.05-22.05.: Ionenlotto''' | |||
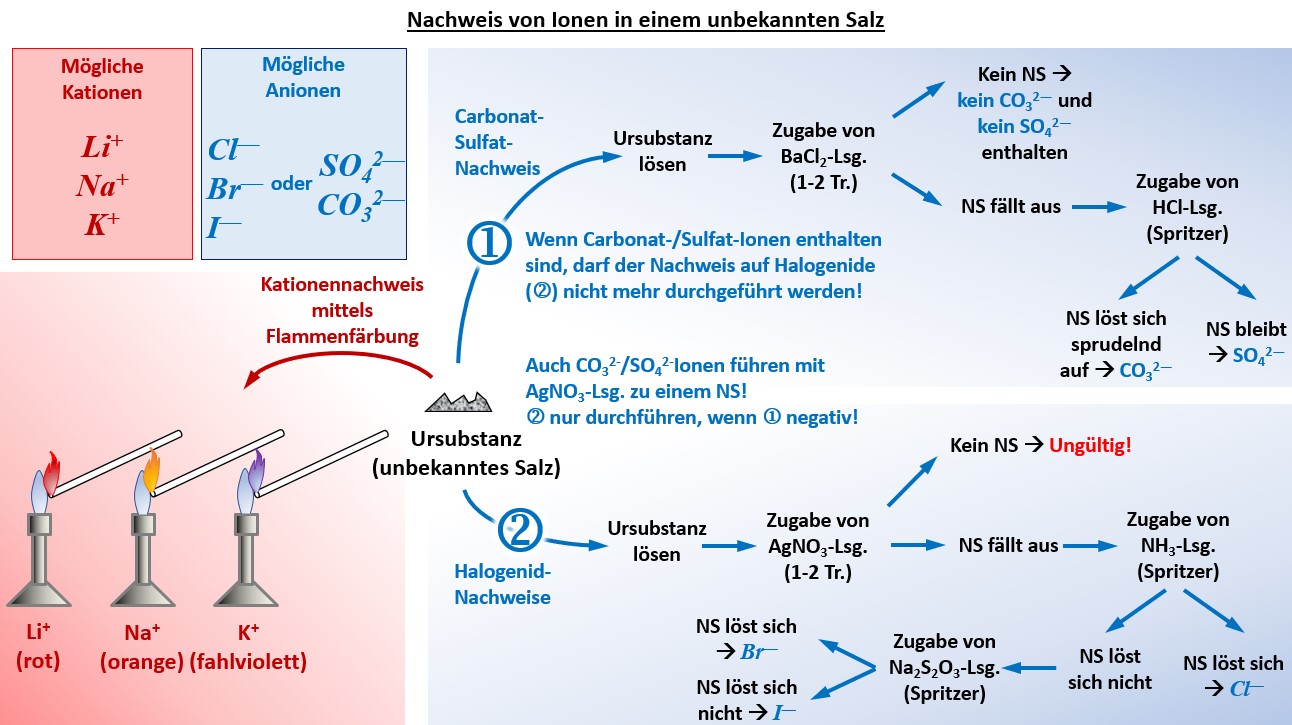
* Im Unterricht gestellte Aufgabe: "Identifiziere in der unbekannten Salzprobe die vorhanden Kationen und Anionen! Die Salzprobe enthält eines der folgenden Kationen: K<sup>+</sup>, Na<sup>+</sup>, Li<sup>+</sup> und eines der folgenden Anionen: Cl<sup>-</sup>, Br<sup>-</sup>, I<sup>-</sup>, CO<sub>3</sub><sup>2-</sup>, SO<sub>4</sub><sup>2-</sup>. Fertige ein sauberes Protokoll an, in dem vor allem die Durchführung und das Ergebnis dargestellt wird!" | |||
* Zwei zu dieser Aufgabe passende Muster-Protokoll als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_Ionenlotto_ML.pdf| Hier klicken]] | |||
* Übersicht über die praktisch durchzuführenden Schritte: | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_Ü_011_NachweisGesamt_V2.jpg]]<br> | |||
|Grafische Darstellung einblenden|Lösung ausblenden}} | |||
<br> | |||
'''Montag, 03.07.''' | |||
* Eigenschaften von Alkanen (einfache Kohlenwasserstoffe) | |||
* Versuchsprotokoll zum Herunterladen als .pdf-Datei: [[Spezial:FilePath/G9_C8_VProt_EigenschaftenAlkane.pdf| Hier klicken]] | |||
|Farbe= #30F | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
===Lernstoff für angekündigte Leistungsnachweise=== | |||
{{Box-spezial | |||
|Titel= | |||
|Inhalt= Schulaufgabe am 19.06. | |||
Neben den Hefteinträgen und dem oben genannten Grundwissen, eignen sich folgende Seiten im Buch (Galvani - Chemie 8) zur Vorbereitung auf die Schulaufgabe: | |||
* S. 146 - 147: Aufbau von Salzen | |||
* S. 150 - 151: Verhältnisformeln | |||
* S. 152 - 153: Periodensystem der Atome und Ionen | |||
* S. 154 - 155: Eigenschaften von Salzen | |||
* S. 162 - 163 : Ionennachweise | |||
* S. 164: Flammenfärbung | |||
* S. 174 - 176: Metalle und ihre Eigenschaften | |||
* S. 120 - 121: Atommasse | |||
* S. 122 - 124: Stoffmenge, molare Masse und molares Volumen | |||
|Farbe= #30F | |Farbe= #30F | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 207: | Zeile 474: | ||
}} | }} | ||
{{Box-spezial | {{Box-spezial | ||
|Titel= | |Titel= | ||
Aktuelle Version vom 3. Juli 2023, 13:23 Uhr
Chemie
aktuelle Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen
Versuchsprotokolle
Lernstoff für angekündigte Leistungsnachweise