8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 13: | Zeile 13: | ||
=== aktuelle Aufgaben zum Üben === | === aktuelle Aufgaben zum Üben === | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 61: | Zeile 19: | ||
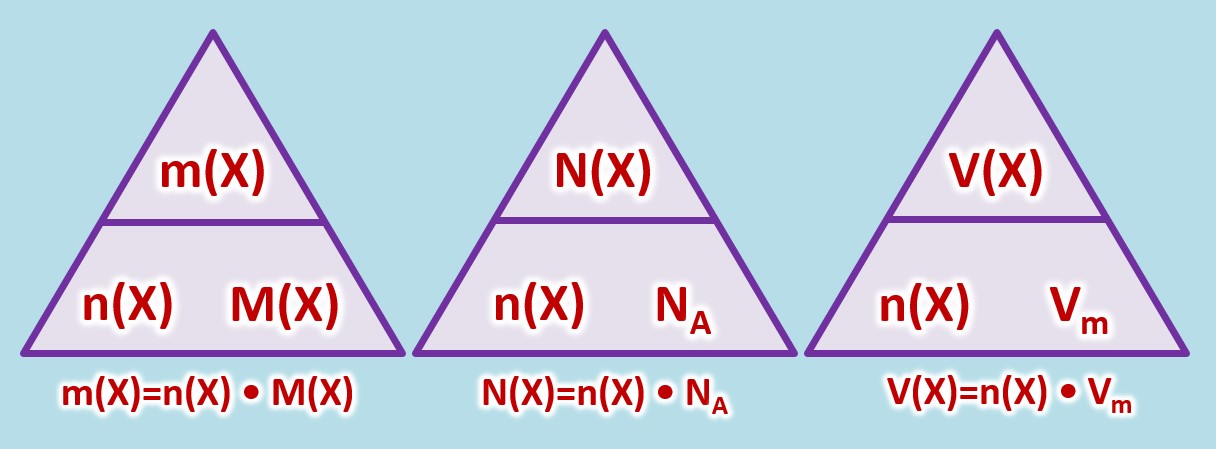
Allgemein müsst ihr mit folgenden Größen umgehen können: | Allgemein müsst ihr mit folgenden Größen umgehen können: | ||
* Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | * Masse eines Stoffes: <math>m(X)</math>, Einheit: <math>g</math> (Gramm) | ||
* Die tatsächlich Anzahl von Teilchen eines Stoffes: <math>N(X)</math>, keine Einheit | |||
* Das Volumen eines (gasförmigen) Stoffes: <math>V(X)</math>, Einheit: <math>L</math> (Liter) | |||
* Stoffmenge eines Stoffes: <math>n(X)</math>, Einheit: <math>mol (Mol)</math> | |||
* molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | * molare Masse eines Stoffes: <math>M(X)</math>, Einheit <math>\frac{g}{mol} </math>, kann für Atome aus dem PSE abgeleitet werden | ||
* Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | * Die Avogadrokonstante <math>N_A = 6,022 \cdot 10^{23} \frac{1}{mol}</math> | ||
* molares Volumen eines (gasförmigen) Stoffes bei Standardbedingungen (273°C und 1013hPa): <math>V_m = 22,4</math>, Einheit <math>\frac{L}{mol} </math> | |||
<br> | <br> | ||
Es gelten die folgenden Zusammenhänge: | Es gelten die folgenden Zusammenhänge: | ||
[[Datei: | [[Datei:C8NTG_ReMiMoGr_3ZH_3ecke.jpg]]<br> | ||
<br><br> | <br><br> | ||
|Farbe= #607 | |Farbe= #607 | ||
| Zeile 404: | Zeile 364: | ||
|Tipp|Lösung ausblenden}} | |Tipp|Lösung ausblenden}} | ||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Abschlussaufgaben zum Thema Salze'''</span> | |||
|Inhalt= | |||
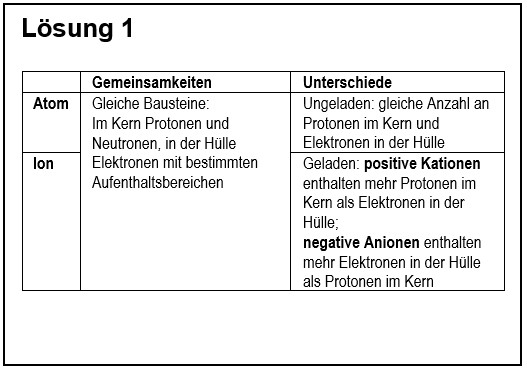
1. Vergleiche in übersichtlicher Form ein '''Atom''' mit einem '''Ion'''! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg1.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
2. Beschreibe mit Hilfe einer chemischen Gleichung die Bildung von Cäsiumchlorid aus den Elementen1 Stelle vorher die Gleichungen zur Bildung der Ionen aus den Elementen auf! | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg2.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
3. Wähle aus den folgenden Eigenschaften diejenigen aus, die sich mit dem Ionengitter von Salzen erklären lassen: Verformbarkeit - große Bindungskräfte - Löslichkeit - elektrische Leitfähigkeit - Sprödigkeit - niedrige Siedetemperatur - Reaktionsträgheit. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg3.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
4. Beziehe zu folgender Aussage begründet Stellung: Beim Schmelzen von Kaliumbromid müssen Ionen entstanden sein, weil die Schmelze elektrisch leitfähig ist. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg4.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
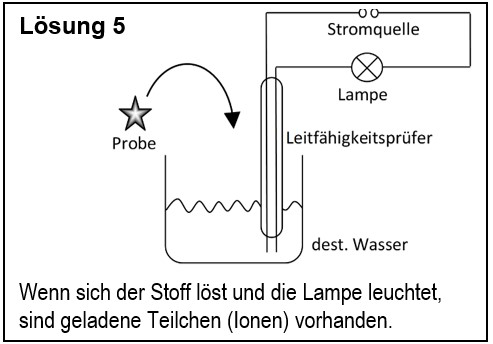
5. Entwirf einen Versuch, mit dem man zeigen kann, dass ein unbekannter Feststoff aus Ionen besteht. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg5.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
6. Formuliere (mit Ionengleichungen) die Bildung von folgenden Salzen: Mg<sub>3</sub>N<sub>2</sub>, CaO, KI, BaCl<sub>2</sub> und Aluminiumfluorid | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg6.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
7. Sortiere folgende Teilchen nach abnehmender Teilchengröße: Li<sup>+</sup>, K, S<sup>2-</sup>, Na<sup>+</sup> | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg7.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
8. Ermittle das Zahlenverhältnis der Ionen in folgenden Salzen: Kaliumsulfid, Aluminiumoxid, Natriumbromid, Calciumoxid. | |||
{{Lösung versteckt| | |||
[[Datei:G9_C8_AbschlA_Salze_Lsg8.jpg]] | |||
|Lösungsvorschlag|Lösung ausblenden}} | |||
|Farbe= #080 | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
Version vom 13. Mai 2023, 15:33 Uhr
Chemie
aktuelle Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen