8a 2022 23: Unterschied zwischen den Versionen
Aus RMG-Wiki
Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 43: | Zeile 43: | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Wochenaufgabe 1 ( | |Titel=<span style="color:#607">'''Wochenaufgabe 1 (20.-24.03.)'''</span> | ||
|Inhalt= | |Inhalt= | ||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein | * Aus wie vielen Protonen, Neutronen und Elektronen ist ein Kalium-Atom aufgebaut? | ||
* Welche Ionen bildet Kalium, wenn es mit Nichtmetallen zu einem Salz reagiert? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | : Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
* '''Protonen: | * '''Protonen: 19''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | ||
* '''Neutronen: | * '''Neutronen: 20''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | ||
* '''Elektronen: | * '''Elektronen: 19''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | ||
* Kalium bildet in Salzen '''einfach positiv geladene Kationen, K<sup>+</sup>''' | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
* Stelle die chemische Gleichung auf: | * Stelle die chemische Gleichung auf: Kalium reagiert mit Sauerstoff zu Kaliumoxid. | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
2 | * Man muss erkennen, dass Kaliumoxid '''ein Salz''' ist, das aus positiv geladenen Kationen und negativ geladenen Anionen besteht. | ||
* Die Kaliumionen sind (wie in der Aufgabe oben bereits erwähnt) einfach positiv geladen: K<sup>+</sup> | |||
* Sauerstoff steht in der 6. Hauptgruppe und bildet demzufolge immer '''zweifach negativ geladene Anionen O<sup>2-</sup>''' | |||
* Wenn aus diesen beiden Ionen ein Salz gebildet werden soll, das insgesamt ungeladen ist, dann braucht man zwei K<sup>+</sup>-Ionen pro einem O<sup>2-</sup>-Ion. Daraus folgt die Summenformel für Kaliumoxid: K<sub>2</sub>O | |||
* Die chemische Gleichung lautet dann: | |||
4 K + O<sub>2</sub> --> 2 K<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt | * Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 2 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Kaliumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n( | Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(K), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''vier''' Kaliumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Vier Mol''' Kalium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Es müssen | Es müssen 4 Mol Kalium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Kalium entspricht das? | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
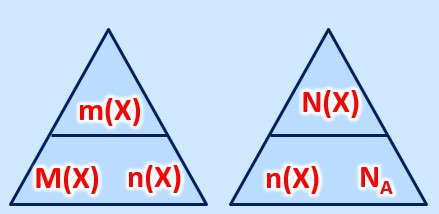
'''gesucht:''' <math>m( | '''gesucht:''' <math>m(K)= ? </math><br> | ||
'''gegeben:''' <math>n( | '''gegeben:''' <math>n(K)= 4,0mol </math>, <math>M(K)= 39,1 \frac{g}{mol} </math> <br> | ||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | '''Formel:''' <math>m(x)= M(X) \cdot n(X)</math><br> | ||
<br> | <br> | ||
Einsetzen der Werte in die Formel:<br> | Einsetzen der Werte in die Formel:<br> | ||
<math>m( | <math>m(K) = M(K) \cdot n(K) = 39,1 \frac{g}{mol} \cdot 4,0mol = 156,4g</math> | ||
|Lösung 2|Lösung ausblenden}} | |Lösung 2|Lösung ausblenden}} | ||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
| Zeile 82: | Zeile 89: | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Wochenaufgabe 2 ( | |Titel=<span style="color:#607">'''Wochenaufgabe 2 (20.-24.03.)'''</span> | ||
|Inhalt= | |Inhalt= | ||
Diese Woche keine | Diese Woche keine zweite Wochenaufgabe. Stellt einfach sicher, dass ihr '''alle''' chemischen Gleichungen auf dem Arbeitsblatt gelöst habt! | ||
|Farbe= #607 | |Farbe= #607 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
| Zeile 330: | Zeile 337: | ||
}} | }} | ||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wochenaufgabe 1 (06.03.-10.03)'''</span> | |||
|Inhalt= | |||
* Aus wie vielen Protonen, Neutronen und Elektronen ist ein Schwefel-Atom aufgebaut? | |||
: Verwendet euer PSE! - Natürlich könntet ihr die Lösung auch googeln, aber in der Schulaufgabe oder in einem Test steht euch nur das PSE zur Verfügung, nicht Google! | |||
{{Lösung versteckt| | |||
Nicht schummeln: Wirklich erst auf Lösung klicken, wenn ihr eine Lösung aufgeschrieben habt! | |||
{{Lösung versteckt| | |||
* '''Protonen: 16''' (erkennbar an der "Kernladungszahl" oder auch "Ordnungszahl", steht in der Regel unten links beim Elementsymbol | |||
* '''Neutronen: 16''' (erkennbar an der "Massenzahl", die in der Regel oben links beim Elementsymbol steht, abzüglich der "Kernladungszahl") | |||
* '''Elektronen: 16''' (bei ungeladenen Atomen muss die Anzahl der Elektronen genau so groß sein, wie die Anzahl der Protonen | |||
|Ja, ich habe eine Lösung notiert|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
* Stelle die chemische Gleichung auf: Magnesium reagiert mit Sauerstoff zu Magnesiumoxid. Das ist eine Verbindung mit der chemischen Formel '''MgO''' | |||
{{Lösung versteckt| | |||
2 Mg + O<sub>2</sub> --> 2 MgO | |||
|Lösung|Lösung ausblenden}} | |||
* Wenn man die Reaktion in einem abgeschlossenen Gefäß durchführt, in das man vorher exakt 1 Mol Sauerstoffmoleküle (O<sub>2</sub>) eingesperrt wurden, welche Stoffmenge an Magnesiumatomen muss man dazu geben, damit die Reaktion vollständig abläuft (also alle Sauerstoffmoleküle verbraucht werden)? | |||
{{Lösung versteckt| | |||
Das hat eigentlich nicht viel mit "chemischem Rechnen" zu tun: Gesucht wird hier die Stoffmenge n(Mg), Einheit "mol". Aus der chemischen Gleichung geht hervor, dass vom Verhältnis her immer '''zwei''' Magnesiumteilchen mit '''einem''' Sauerstoffmolekül reagieren. Da "Mol" nichts anderes ist, als die Bezeichnung für eine bestimmte Anzahl an Teilchen, bedeutet die Gleichung aber auch gleichzeitig: '''Zwei Mol''' Magnesium reagieren mit '''einem Mol''' Sauerstoffmoleküle. Jetzt sollte man aber auf die Lösung kommen. | |||
{{Lösung versteckt| | |||
Es müssen 2 Mol Magnesium dazu gegeben werden, damit alle Sauerstoff-Moleküle reagieren. - Zusatzfrage: Wie viel Gramm sind das? Oder anders: Welcher Masse an Magnesium entspricht das? | |||
{{Lösung versteckt| | |||
'''gesucht:''' <math>m(Mg)= ? </math><br> | |||
'''gegeben:''' <math>n(Mg)= 2,0mol </math>, <math>M(Mg)= 24,3 \frac{g}{mol} </math> <br> | |||
'''Formel:''' <math>m(x)=M(X) \cdot n(X)</math><br> | |||
<br> | |||
Einsetzen der Werte in die Formel:<br> | |||
<math>m(Mg) = M(Mg) \cdot n(Mg) = 24,3 \frac{g}{mol} \cdot 2,0mol = 48,6g</math> | |||
|Lösung 2|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
===Versuchsprotokolle=== | ===Versuchsprotokolle=== | ||
{{Box-spezial | {{Box-spezial | ||
| Zeile 346: | Zeile 392: | ||
|Farbe= #30F | |Farbe= #30F | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
Version vom 21. März 2023, 15:39 Uhr
Chemie
aktuelle Aufgaben zum Üben
Online-Unterricht am 09.01.2023
Grundwissen