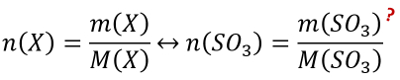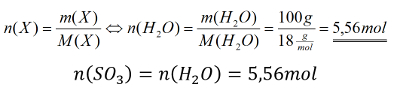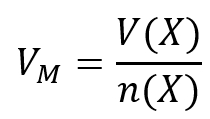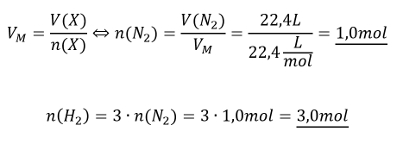Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(Enzympraktikum angelegt) Markierung: Quelltext-Bearbeitung 2017 |
||
| (57 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
==Enzympraktikum== | |||
=== Molekulare Grundlagen === | |||
{{Box-spezial | |||
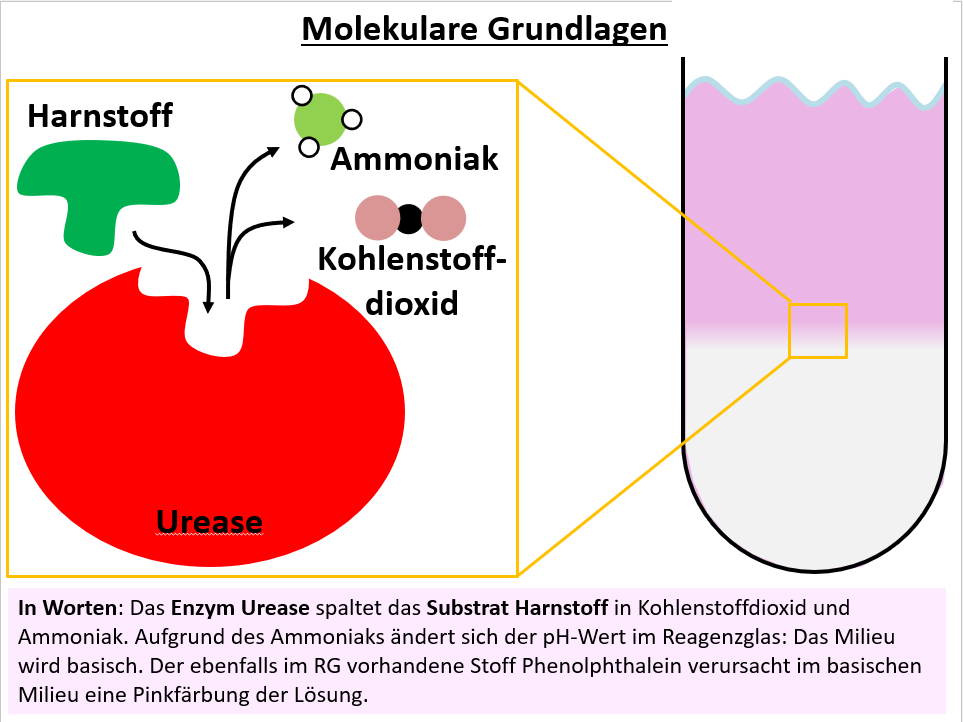
|Titel=<span style="color:#007">'''Versuche mit Urease'''</span> | |||
|Inhalt= | |||
[[Datei:Q11_B_Enzympr_MolekGrndl_Urease.jpg]] | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
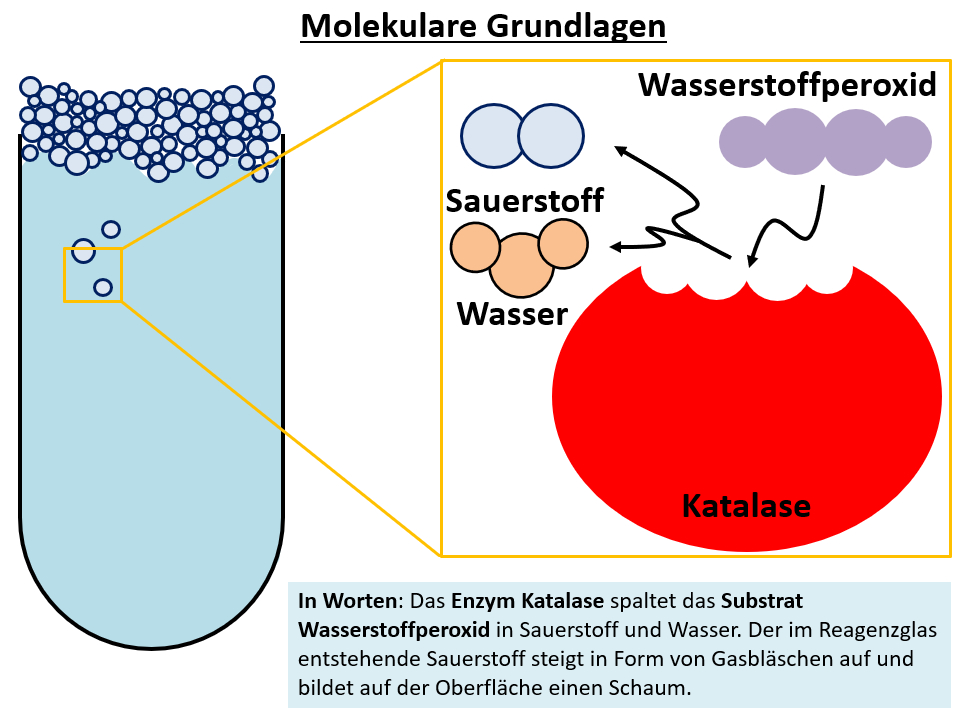
|Titel=<span style="color:#007">'''Versuche mit Katalase'''</span> | |||
|Inhalt= | |||
[[Datei:Q11_B_Enzympr_MolekGrndl_Katalase.jpg]] | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
=== Versuche im Unterricht === | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Substratspezifität der Urease'''</span> | |||
|Inhalt= | |||
[[Datei:Q11_B_Enzympr_VBeschr_Urease.jpg]] | |||
[[Datei:Q11_B_Enzympr_Erg_Urease.jpg]] | |||
{{Lösung versteckt| | |||
Ihr solltet erklären können, warum in RG2 eine Pinkfärbung auftritt, in RG3 nicht. Warum der Kontrallansatz (RG1) eine leichte Pinkfärbung aufweist ist nicht ganz einfach zu erklären, aber ein paar begründete Hypothesen kann man schon aufstellen. Die milchige Trübung in RG3 spielt hier keine Rolle, sie hängt mit dem Lösungsmittel des Phenolphthaleins zusammen. | |||
|Hinweise|Verbergen}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} <br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''pH-Abhängigkeit der Katalase'''</span> | |||
|Inhalt= | |||
[[Datei:Q11_B_Enzympr_VBeschr_Katalase.jpg]] | |||
[[Datei:Q11_B_Enzympr_Erg_Katalase.jpg]] | |||
{{Lösung versteckt| | |||
Wenn ihr die Seiten im Buch und die Hefteinträge gelesen habt, solltet ihr hier keine Probleme bei der Erklärung haben. | |||
|Hinweise|Verbergen}} | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
=== Weitere Versuche === | |||
Nicht alle Versuche des Enzym-Praktikums konnten im Unterricht durchgeführt werden. Das würde den zeitlichen Rahmen sprengen. Das folgende Skript enthält jedoch weitere Versuchsanleitungen und Fotos der Ergebnisse aus vergangenen Jahren. | |||
* Ladet das Skript herunter (bitte nicht ausdrucken, wer es unbedingt physisch haben möchte: Ich werde am Mittwoch einige Exemplare mitbringen) | |||
* Beschreibt zunächst für alle Ergebnisse die Beobachtung (mündlich, nicht schriftlich) | |||
* Versucht dann, die Eregbniss mit eurem Wissen über die Funktionsweise von Enzymen zu erklären (mündlich, nicht schriftlich) | |||
* Eine Verbesserung erfolgt im Unterrich am 05.10. | |||
Hier das Skript zum Download: [[Spezial:FilePath/Q11_B_Enzympr_VBeschr_alle.pdf| pdf-Datei]] | |||
=== Corona-Sonderregeln === | |||
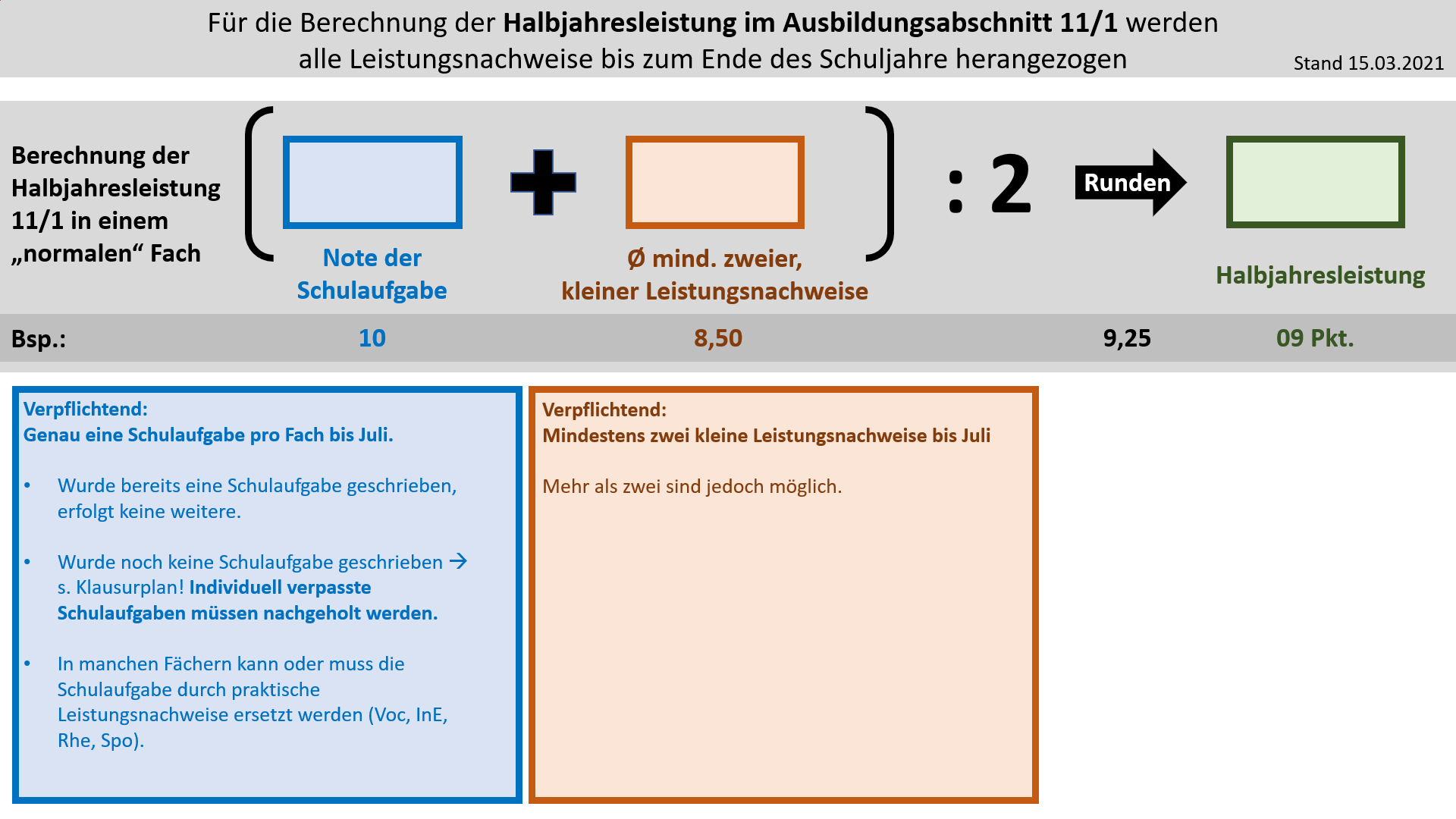
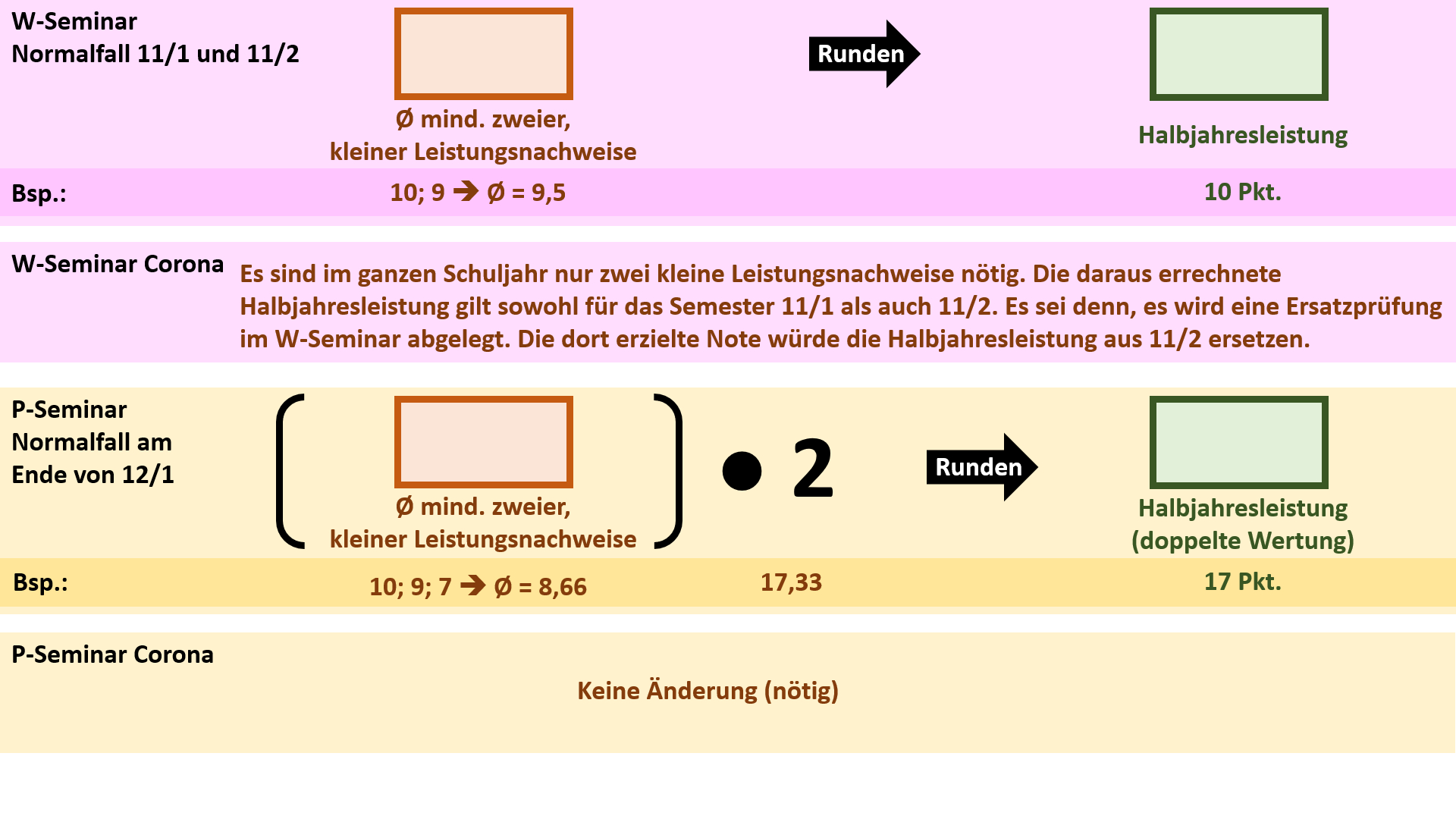
'''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/1''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_HJL111.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
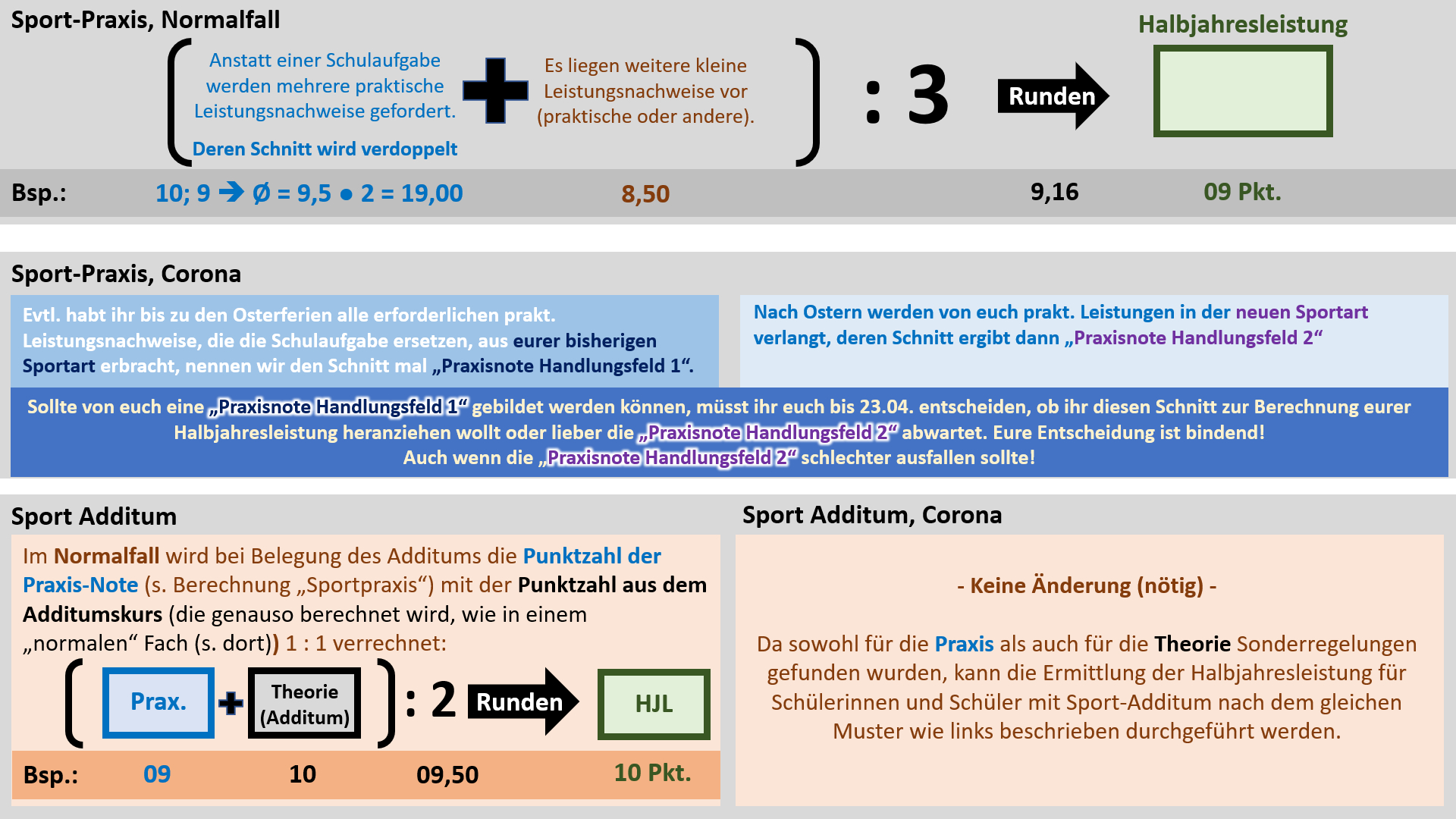
'''Regelungen für Sport''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_Sport.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
'''Regelungen für die Seminare''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_Seminare.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
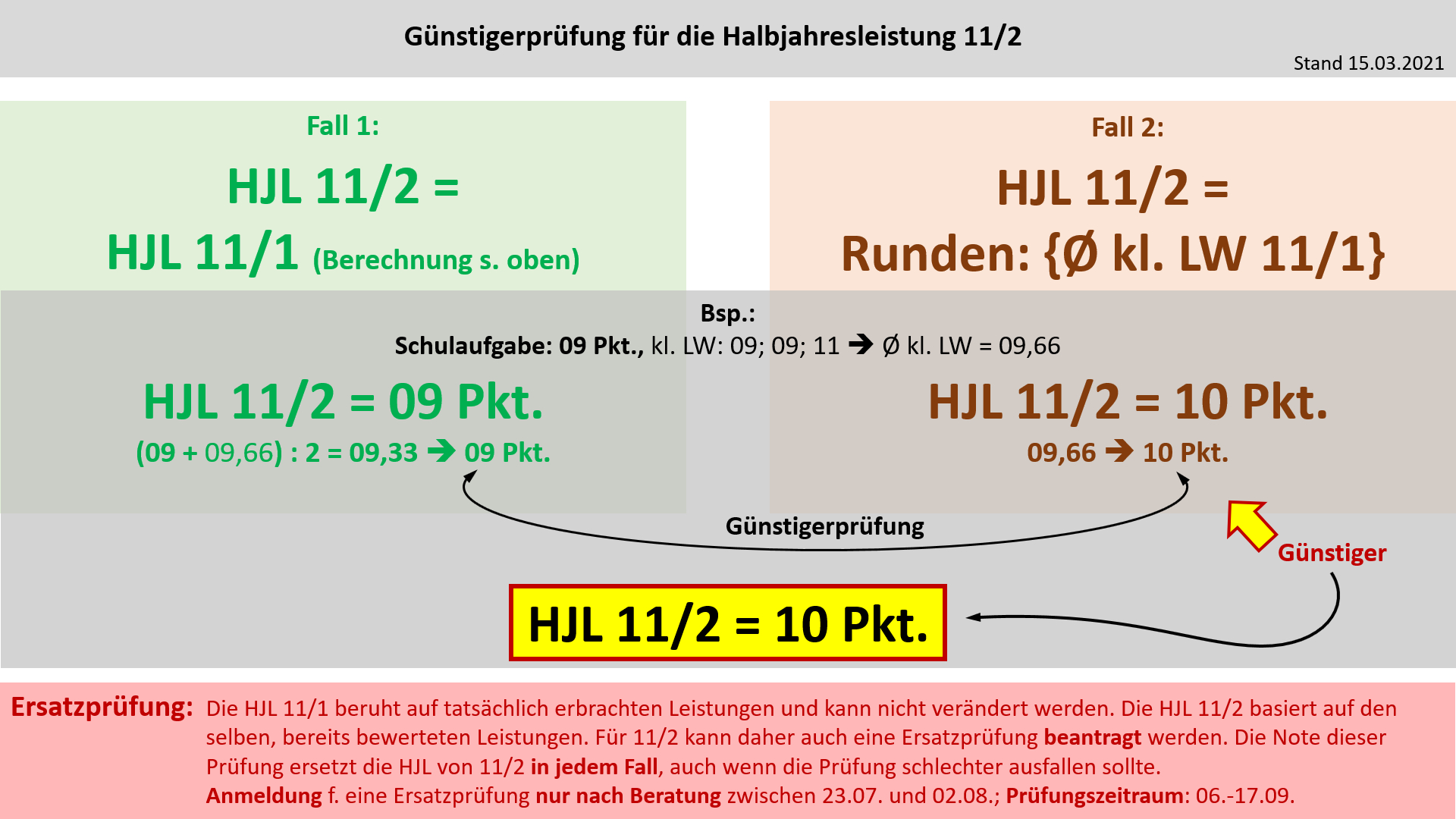
'''Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/2''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_HJL112.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
'''Zeitplan''' | |||
{{Lösung versteckt| | |||
[[Datei:Cor_ab1503_Zeitplan.jpg]] | |||
|Anzeigen|Verbergen}} | |||
<br> | |||
== Distanz-Unterricht, Montag 08.03: Q11-Corona-Recap == | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Wiederholung aller bisherigen Einheiten'''</span> | |||
|Inhalt= | |||
Die folgende Einheit stellt eine Wiederholung einiger Einheiten dar, die in den letzten Wochen während des Home-Schoolings besprochen wurden. Bitte prüft, ob ihr die folgenden Fragen beantworten könnt. Natürlich liegen manche Inhalte schon etwas länger zurück, daher dürft ihr gerne auf dieser Seite scrollen, um zu einer Lösung zu gelangen.<br> | |||
Ihr erhaltet am Montag, 08.03. den klassischen "Start-in-den-Tag-Arbeitsauftrag" über den Schulmanager. Ich hätte gerne von ALLEN ein Feedback, welche Fragen für euch nicht lösbar waren und welche nicht. Das Feedback soll als Antwort auf den Arbeitsauftrag im Schulmanager erfolgen (entweder ein Foto von euren handschriftlichen Aufzeichnungen oder ein Textdokument hochladen). Ihr habt Zeit prinzipiell Zeit bis Mittwoch, 23:59 Uhr, empfehle aber dringend das Feedback sofort nach der Unterrichtsdoppelstunde (also 09:30 Uhr) abzugeben. Das Feedback stellt für mich eine wichtige Grundlage für das weitere Vorgehen im Unterricht dar. <br> | |||
Bitte beachtet jedoch folgendes: | |||
* Solltet ihr mir rückmelden, dass ihr keine einzige Frage beantworten konntet, bedeutet das nicht, dass ich im Unterricht alles wiederholen werde. Definitiv nicht. | |||
* Wenn ihr während des Home-Schoolings keine Arbeitsaufträge hier im Wiki erledigt habt, dann brauche ich auch kein Feedback zu den Fragen von euch. Antwortet auf den '''Arbeitsauftrag im Schulmanager''' einfach mit "Keine Teilnahme". | |||
* Ich gehe davon aus, dass viele von euch alle Fragen (evtl. mit ein bisschen Recherche) beantworten können. In dem Fall antwortet auf den '''Arbeitsauftrag im Schulmanager''' einfach mit "Alles o.k." (o.ä.) | |||
<br> | |||
Los geht´s: | |||
<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Stammbaumanalyse + Heterozygoten-Test, pränatale Diagnosemöglichkeiten'''</span> | |||
|Inhalt= | |||
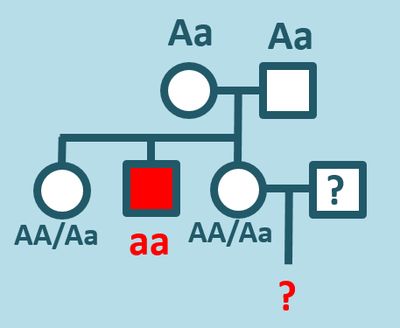
* Bei der '''Mukoviszidose''' handelt es sich um eine autosomal-rezessiv vererbte Krankheit. Eine phänotypisch gesunde Frau möchte wissen, wie hoch die Wahrscheinlichkeit dafür ist, dass sie ein Kind zur Welt bringt, das an Mukoviszidose leidet. Der Grund ihrer Besorgnis ist ihr Bruder, der ebenfalls an dieser Krankheit leidet. Ihre Schwester und ihre Eltern sind jedoch phänotypisch gesund. | |||
** Geben Sie - soweit das möglich ist - alle möglichen Genotypen aller genannten Personen! | |||
** Welche Aussagen über die Wahrscheinlichkeit eines kranken Kindes kann man treffen? | |||
* Was ist ganz allgemein ein "Heterozygoten-Test"? (Kein konkretes Beispiel). | |||
* Beschreibe kurz zwei pränatale Diagnosemöglichkeiten! | |||
{{Lösung versteckt| | |||
* [[Datei:Recap_Corona20_1_A1_ML.jpg|400px]] | |||
** Über die Wahrscheinlichkeit eines kranken Kindes kann man hier sehr wenig konkretes sagen. Allgemein gilt: Wenn die fragende Frau den Genotyp AA besitzt, wird ein Kind nie an Mukoviszidose leiden. Wenn die Frau den Genotyp Aa besitzt, kommt es auf den Genotyp des Mannes an. Ein möglicher Mann wird im vorliegenden Szenario überhaupt nicht erwähnt, vielleicht weil die Frau auch noch gar keinen hat. Da Erbkrankheiten in der Regel selten sind, ist die Wahrscheinlichkeit, dass ein Mensch aus einer Familie mit Mukoviszidose auf einen Menschen trifft, der ebenfalls aus einer Familie mit Mukoviszidose stammt eher gering (keine genauen Werte). <br> | |||
** Möglich Fälle: Wenn der Mann den Genotyp AA aufweist, ist die Wahrscheinlichkeit für ein krankes Kind gleich 0. Wenn er den Genotyp Aa aufweist (und die Frau auch), dann ist die Wahrscheinlichkeit für ein krankes Kind 25%. Sollte der Mann den Genotyp aa besitzen (früher erreichten Mukoviszidose-Patienten nicht das fortpflanzungsfähige Alter, durch Fortschritte in der medizinischen Betreuung sind heute jedoch bereits 50% der Menschen mit Mukoviszidose älter als 18 Jahr), dann beträgt die Wahrscheinlichkeit für ein krankes Kind 50% (immer vorausgesetzt die Frau besitzt den Genotyp Aa). | |||
* '''Heterozygotentest:''' Ein Test mit dem man bei phänotypisch gesunden Menschen überprüfen kann, ob bezüglich einer rezessiven Erbkrankheit ein heterozygoter Genotyp vorliegt (Aa). | |||
* '''Fruchtwasseruntersuchung''': Entnahme von Fruchtwasser über die Bauchdecke der schwangeren Frau mit einer Spritze. Untersuchung der darin enthaltenen kindlichen Zellen. <br> '''Ultraschall-Untersuchung''': Durch "Beschallung" des Bauchraums der schwangeren Frau und Auffangen des Echos können Bilder vom Fötus erstellt werden. Fehlentwicklungen können so frühzeitig erkannt werden. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Numerische Chromosomen-Aberrationen'''</span> | |||
|Inhalt= | |||
* Nenne eine häufig vorkommende, lebensfähige autosomale, numerische Chromosomenaberration! | |||
* Nenne eine häufig vorkommende, lebensfähige gonosomale, numerische Chromosomenaberration! | |||
* Beschreibe möglichst detailliert das Phänomen "Non-Disjunction"! | |||
{{Lösung versteckt| | |||
* z.B. Trisomie 21 (Down-Syndrom), auch noch möglich: Trisomie 13 (Pätau-Syndrom) oder Trisomie 18 (Edward-Syndrom) | |||
* z.B. Turner-Syndrom (45, X0), auch möglich: Klinefelter- (47, XXY), Triplo-X- (47,XXX), Diplo-Y-Syndrom (47, XYY) | |||
* In der ersten oder zweiten meiotischen Teilung kommt es zu einer "Nicht-Trennung" von Chromosomen: Im einen Fall (bei der ersten meiotischen Teilung) werden die homologen Chromosomen nicht voneinander getrennt, im zweiten Fall (bei der zweiten meiotischen Teilung) werden die Chromatiden nicht voneinander getrennt. Es entstehen Tochterzellen, deren Chromosomenzahlen von der Norm abweichen. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''DNS als Träger der Erbinformation, Bau der DNS'''</span> | |||
|Inhalt= | |||
* Nenne die Grundbausteine der DNS! | |||
* Erkläre in Bezug auf die DNS die Begriffe "komplementär und antiparallel"! | |||
* Wie lautet die Sequenz des komplementären Strangs zu 5´-TCTGAG-3´ | |||
{{Lösung versteckt| | |||
* Als "Grundbausteine" der DNS werden gerne "die Nukleotide" genannt. Das ist die Einheit aus einem Zucker (Ribose), einem Phosphat-Rest und einer von vier möglichen Basen (Adenin, Thymin, Cytosin, Guanin). | |||
* '''komplementär''': Es gibt nur zwei Paarungen von Basen, die aufgrund des räumlichen Baus in einem intakten DNS-Strang gegenüberliegen können: Adenin und Thymin bzw. Guanin und Cytosin. Allgemein bedeutet "komplementär": Nicht identisch, aber sich ergänzend. <br> '''antiparallel''': Betrachtet man das Zucker-Phosphat-Gerüsts eines DNS-Einzelstrangs, dann liegen aufgrund des Baus zwei verschiedene Enden vor. Man bezeichnet das eine Ende als 3´-Ende, das andere als 5´-Ende. Insofern kann man beim Ablesen des DNS-Einzelstrangs ganz klar eine Richtung festlegen, z.B. von '''3´ nach 5´''' (ähnlich wie beim echten Lesen eines Buchs: Im Deutschen liest man die Buchstaben von '''links nach rechts''', im Hebräischen von '''rechts nach links'''). Wenn man die einmal festgelegte Richtung des einen DNS-Einzelstranges betrachtet und mit der Richtung des gegenüberliegenden DNS-Einzelstrangs vergleicht, stellt man fest, dass dieser genau entgegengesetzt gerichtet ist. Das bezeichnet man als antiparallel. | |||
* 3´-AGACTC-5´ | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Die Replikation'''</span> | |||
|Inhalt= | |||
* Warum muss die DNS überhaupt repliziert werden? | |||
* Bei der Replikation spielen die Enzyme "Helicase", "DNS-Polymerase", "Primase" und "Ligase" eine wichtige Rolle. Beschreibe von jedem Enzym kurz die Aufgabe! | |||
* Betrachtet den ''leading-strand'': Eines der oben genannten Enzyme ist hier nicht nötig. Welches? | |||
* Warum gibt es Okazaki-Fragmente? (Achtung: Die Frage lautet nicht: Was sind Okazaki-Fragmente? Aber das sollte man natürlich trotzdem wissen.) | |||
{{Lösung versteckt| | |||
* Nach einer Zellteilung liegt nur noch die Hälfte des diploiden Chromosomensatzes vor. Durch die Replikation wird die ursprüngliche Menge Erbgut wieder hergestellt. | |||
* Helicase: Entdrillt die DNS; DNS-Polymerase: Setzt entsprechend der Vorlage des Einzelstranges die richtigen komplementären Nukleotide zum gegenüberliegenden Strang zusammen; Primase: Nach dem Öffnen der DNS erzeugt dieses Enzym an einem bestimmten Punkt der DNS ein kurzes Stück komplementäre RNS. Dieses kurze Stück Doppelstrang (Primer) ist der Startpunkt für die DNS-Polymerase; Ligase: Sie verknüpft Okazaki-Fragmente am Zucker-Phosphat-Gerüst miteinander | |||
* Die Ligase. Auf dem dem leading-strand kommen keine Okazaki-Fragmente vor, die verknüpft werden müssten. | |||
* Die DNS-Polymerase kann einen DNS-Einzelstrang nur in eine Richtung ablaufen: Von 3´nach 5´. Im Falle des leading-strands kann sie der Helicase daher einfach hinterher laufen. Auf dem lagging-strand muss die Polymerase immer erst warten, bis ein Stück Doppelstrang entdrillt und dann ein Primer gesetzt wurde. Ab da kann sie dann von der Helicase weg arbeiten bis zum vorangegangenen Primer. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#C00">'''Feedback'''</span> | |||
|Inhalt= | |||
<span style="color:#C00">Jetzt bitte das Feedback über den Schulmanager abgeben. Danke! - Videokonferenz am Donnerstag.</span> | |||
<br> | |||
|Farbe= #C00 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #FCA | |||
|Hintergrund= #FCA | |||
}} | |||
== Distanzunterricht, Montag 01.03. == | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Einstieg/Wiederholung'''</span> | |||
|Inhalt= | |||
Zur Erinnerung: Das langfristige Ziel dieser Einheit ist es, zu klären, wie ein Stück DNS die Ausprägung eines Merkmals (also z.B. eure Haarfarbe) beeinflussen kann.<br> | |||
In der letzten Einheit habt ihr den Aufbau der DNS kennengelernt. Bevor wir uns anschauen, wie dieser Aufbau nun ein sichtbares Merkmal beeinflussen kann, zunächst ein Zwischenschritt: <br> | |||
<br> | |||
Euer aktueller Körper, in dem ihr steckt, besteht aus ca. 100 000 000 000 000 Zellen. Entstanden seid ihr aber alle zunächst aus einer einzigen befruchteten Eizelle. Das Erbgut in dieser befruchteten Eizelle musste sehr oft vervielfältigt werden, damit alle Zellen eures heutigen Körpers exakt das gleiche Erbgut enthalten und eine Einheit bilden. Ihr kennt den Prozess schon, der hierbei eine entscheidende Rolle spielt: '''Die Mitose'''. <br> | |||
Sucht das Arbeitsblatt zum Thema '''Mitose''' heraus (auch im Buch wäre eine Abbildung)! Analysiert die einzelnen Schritte noch einmal und formuliert dann '''einen Satz''', der die relativ simple Frage beantwortet: | |||
<br> | |||
* Was passiert in der Meiose (weniger auf den Mechanismus eingehen, sondern auf das Ergebnis)? | |||
{{Lösung versteckt| | |||
Die Meiose ist ein Abschnitt während der Zellteilung, bei der das Erbgut eines Zellkerns in zwei gleich große Portionen aufgeteilt wird, die jeweils in den beiden entstehenden Tochterzellen landen. <br> | |||
An dem oben stehenden Satz erkennt man, dass folgende Aspekte berücksichtigt wurden (überprüft, ob euch das klar ist!): | |||
* Die Meiose ist nur ein Abschnitt der Zellteilung | |||
* Bei der Meiose wird das Erbgut im Zellkern halbiert | |||
* Die Tochterzellen enthalten nach der Meiose zunächst nur die Hälfte des ursprünglichen Erbguts. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Vorüberlegung 1'''</span> | |||
|Inhalt= | |||
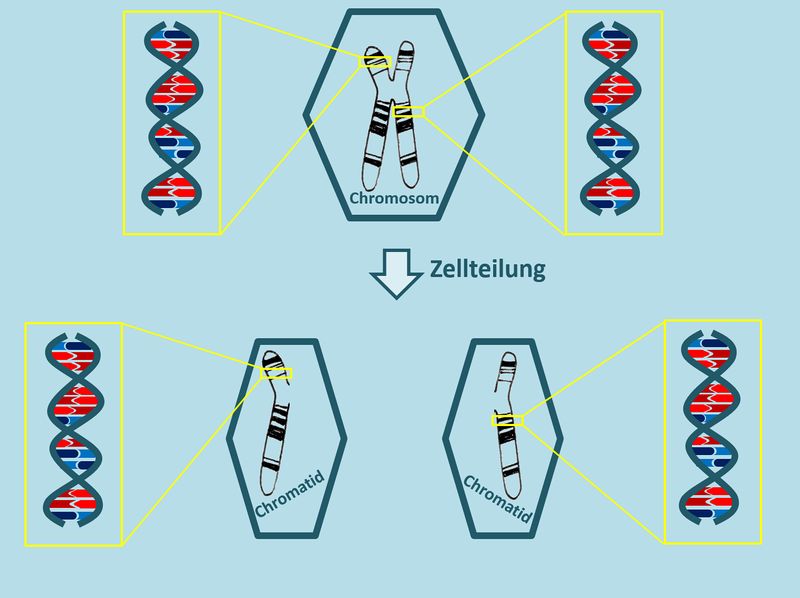
Die Tochterzellen einer Zelle, die sich soeben geteilt hat, besitzen also nur die Hälfte des "normalen" Erbguts. Die folgende Abbildung verdeutlicht die Situation noch einmal an einem Chromosom. Macht euch anhand dieser Abbildung noch einmal klar: Aus wie vielen DNS-Fäden besteht das Erbgut eines Menschen? <u>Ohne</u> '''numerische Chromosomenaberration'''! (was war das noch mal?) <br> | |||
[[Datei:Repli_Vgl_Chromo_DNS.jpg|800px]] | |||
{{Lösung versteckt| | |||
* Numerische Chromosomenaberration: Abweichung von der "normalen Anzahl" an Chromosomen. Bsp.: Trisomie-21, Turner-Syndrom, Klinefelter-Syndrom | |||
* Normalerweise: '''23 Chromosomenpaare''' entspricht '''46 einzelnen Chromosomen''' entspricht '''92 Chromatiden'''. Ein Chromatid entspricht einem DNS-Faden, also besteht das Erbgut eines Menschen normalerweise aus '''92 DNS-Fäden'''. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Vorüberlegung 2'''</span> | |||
|Inhalt= | |||
Damit sich eine Tochterzelle erneut teilen kann, muss das "halbe Erbgut" zunächst wieder verdoppelt werden. Dieser Prozess nennt sich '''Replikation'''. Die Forscher, die maßgeblich an der Entschlüsselung dieses Prozesses mitgewirkt haben, waren Matthew Meselson und das Ehepaar Mary und Frank Stahl (müssten alle noch leben). Das Meselson-Stahl-Experiment soll hier nachempfunden werden.<br> | |||
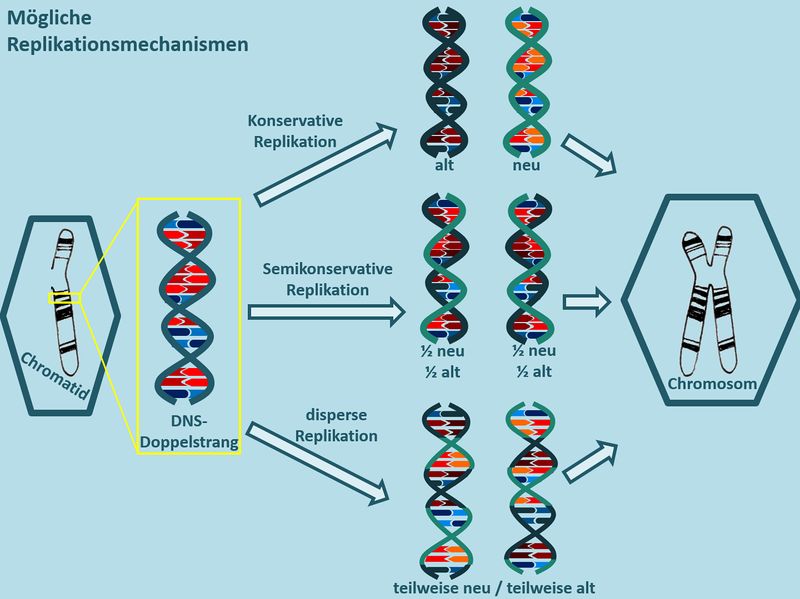
Rein theoretisch gibt es drei verschiedene Möglichkeiten wie ein DNS-Faden repliziert (verdoppelt) werden kann: | |||
* '''konservativ''': Könnte man mit einem Kopierer vergleichen. Es gibt ein Orginal, das unverändert bleibt und ein Duplikat, das aus neuen Bausteinen zusammengebastelt wird. | |||
* '''semikonservativ''': Bei der DNS sind die beiden Einzelsträng komplementär. Das bedeutet, wenn ich den einen Einzelstrang kenne, kann ich den fehlenden einfach erzeugen. Das ermöglich eine semikonservative Replikation: Die doppelsträngige DNS wird in ihre zwei Einzelstränge getrennt, und der komplementäre wird jeweils neu ergänzt. | |||
* '''dispers''': Das könnte man wohl am ehesten mit... "irgendwie" oder "durcheinander" übersetzen. Gemeint ist: Das Original wird zerstückelt und mit neuen Bausteinen zu zwei Abbildungen des Originals wieder zusammengesetzt. Dafür gibt es in unserer Lebensumwelt kein vernünftiges Beispiel. | |||
Die folgenden Abbildungen zeigen einen grafischen Überblick über diese drei Varianten: <br> | |||
[[Datei:Repli_Mechanismen_denkbareVarianten.jpg|800px]]<br> | |||
<br> | |||
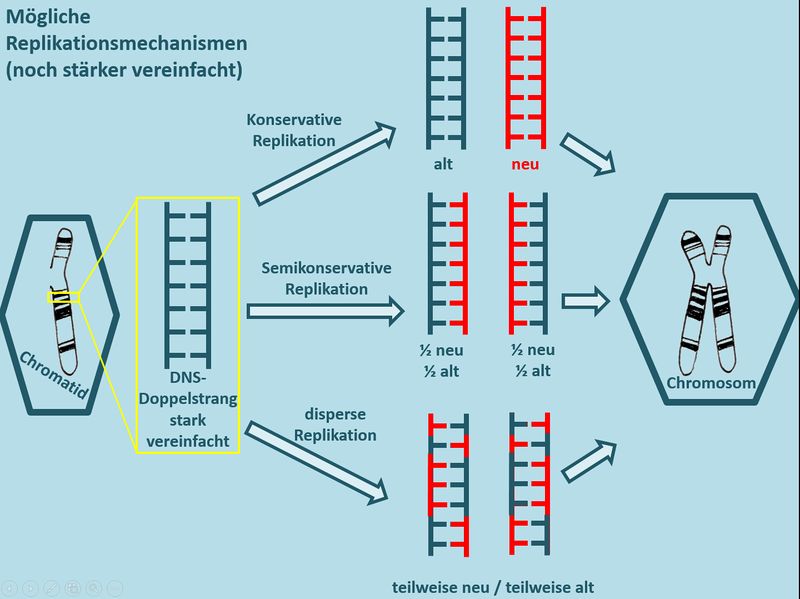
[[Datei:Repli_Mechanismen_denkbareVarianten_einfach.jpg|800px]]<br> | |||
<br> | |||
Das Problem an dieser Darstellung: Auf den Bildern könnt ihr aufgrund von Farben sehr schön sehen, welcher Teil der DNS alt ist und welcher neu. In der Realität geht das nicht! Erstens gibt es überhaupt kein Mikroskop, mit dem man einen DNS-Strang überhaupt sehen könnte und selbst wenn, wüsste man nicht, was an einem DNS-Strang alt und was neu ist... <br> | |||
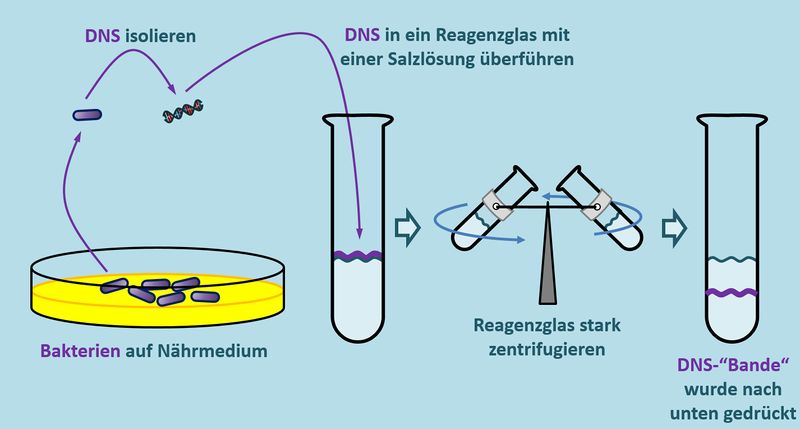
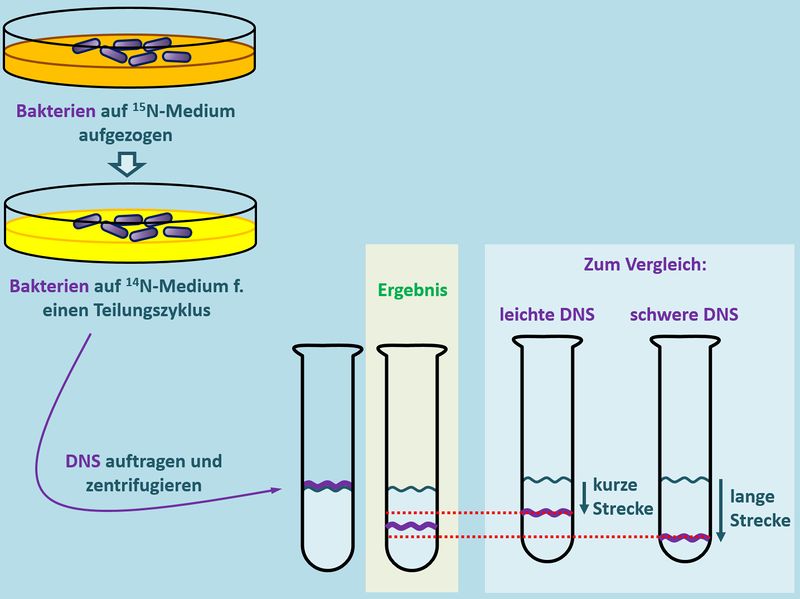
Wir haben schon oft über solche Phänomene gesprochen: Man braucht ein Experiment, mit dem man etwas sichtbar machen kann, was eigentlich nicht sichtbar ist. Und genau hier kommt das Experiment von Meselson und Stahl ins Spiel. Sie machten sich folgenden Effekt zu Nutze: Isoliert man DNS aus Bakterien, kann man sie in einem Reagenzglas auf eine Salz-Lösung auftragen und den Ansatz stark zentrifugieren. Je nachdem, wie "schwer" (das ist nicht ganz korrekt, aber ich bleibe mal bei diesem Begriff) die DNS ist, wird sie beim Zentrifugieren durch die Zentrifugalkraft im Reagenzglas weiter nach unten gedrückt (oder gezogen, wie ihr wollt).<br> | |||
[[Datei:Repli_MeselsonStahl_VDesign.jpg|800px]]<br> | |||
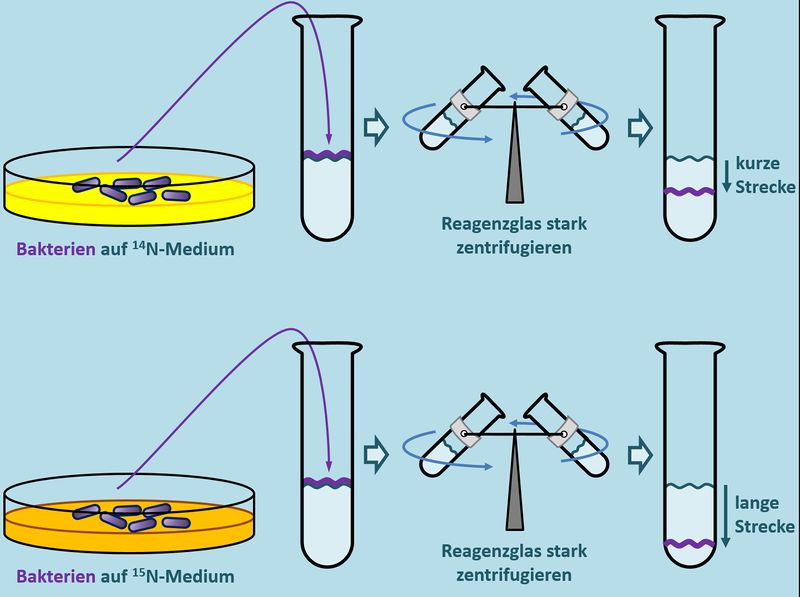
Wenn man das Experiment mehrfach wiederholt, kommt logischerweise immer das gleiche Ergebnis heraus: Die isolierte DNS wandert immer die gleiche Strecke im Reagenzglas nach unten. Meselson und Stahl haben nun aber einen Weg gefunden, die DNS in den Bakterien zu manipulieren. Sie konnten sie '''schwerer''' machen als normal: Sie ließen die Bakterien auf einem Medium wachsen und sich vermehren, welches '''schwere Stickstoff-Atome''' enthielt (man symbolisiert schweren Stickstoff mit <sup>15</sup>N). Auch die DNS enthält Stickstoff-Atome. Normalerweise leichten Stickstoff (<sup>14</sup>N), weil nur der in der Natur in großen Mengen vorkommt. Nachdem den Bakterien im Versuch aber nur '''schwerer Sticktstoff''' <sup>15</sup>N zur Verfügung stand, mussten sie diesen zum Aufbau ihrer DNS heranziehen. Lässt man die Bakterien lange genug in diesem <sup>15</sup>N-Medium wachsen, enthalten sie nach einiger Zeit nur noch '''"schwere DNS"'''. Zentrifugiert man nun die DNS von diesen Bakterien, stellt man tatsächlich fest, dass diese DNS etwas weiter nach unten gedrückt/gezogen wird als die '''leichte DNS''' der ursprünglichen Bakterien.<br> | |||
[[Datei:Repli_MeselsonStahl_U_N14_N15.jpg|800px]]<br> | |||
<br> | |||
Was bringt das jetzt?<br> | |||
<br> | |||
Noch gar nichts! Man kann erstmal nur unterscheiden, ob die DNS schwer oder leicht ist. Aber der Versuch war noch nicht zu Ende. Meselson und Stahl überführten nun Bakterien, die ihr Leben lang auf Medium mit schwerem Stickstoff <sup>15</sup>N gewachsen waren, auf ein neues Medium, das nur leichten Stickstoff <sup>14</sup>N enthielt. Dort durften die Bakterien genau so lange bleiben, bis sie sich '''einmal geteilt''' hatten, das Erbgut also genau '''einmal verdoppelt''' worden war.<br> Anschließend wurde die DNS wieder isoliert und zentrifugiert.<br> | |||
<br> | |||
Welches Ergebnis sollte man erhalten, bei: | |||
* einer '''konservativen''', | |||
* einer '''semikonservativen''' und | |||
* einer '''dispersen''' | |||
Replikation? | |||
{{Lösung versteckt| | |||
* '''konservativ''': Es sollte eine Bande mit schwerer und eine Bande mit leichter DNS auftauchen. Nachdem beim konservativen Mechanismus die alte (schwere) DNS erhalten bleiben würde und eine neue (leichte) DNS erzeugt werden würde, müsste man diese beiden Banden finden. | |||
* '''semikonservativ''': Es sollte nur eine Bande auftauchen; und zwar zwischen der Stelle, an der normalerweise die schwere DNS auftauchen würde und der Stelle, an der normalerweise die leichte DNS auftauchen würde. Beim semikonservativen Mechanismus wird die alte (schwere) DNS in der Mitte geteilt und jeweils eine Hälfte durch neue Bausteine ergänzt. Das bedeutet, '''alle''' DNS-Stränge sind gleich (halb schwer, halb leicht, also: mittelschwer). | |||
* '''dispers''': Nachdem hier alle möglichen Varianten denkbar sind, sollten viele verschiedene DNS-Varianten auftauchen. Es sollte also keine klare Bande entstehen, sondern eher ein verschwommener Fleck | |||
Das tatsächliche Ergebnis seht ihr hier:<br> | |||
[[Datei:Repli_MeselsonStahl_VErgebnis.jpg|800px]]<br> | |||
Welcher Replikationsmechanismus liegt also vor? | |||
{{Lösung versteckt| | |||
Der semikonservative | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Wie funktioniert´s?'''</span> | |||
|Inhalt= | |||
Schaut das Video, welches zeigt, wie die Replikation auf molekularer Ebene abläuft! Beantwortet während des Videos bzw. danach folgende Fragen: <br> | |||
* Was macht die Helicase? | |||
* Wie heißt das Enzym, das aus RNA-Stückchen einen kleinen Primer formt? | |||
* Warum kann der "leading-strand" (Vorwärts-Strang) in einem Stück ergänzt werden, der "lagging-strand" (Rückwärts-Strang) nicht? | |||
* Was ist ein Okazaki-Fragment? | |||
* Was macht die Ligase? | |||
{{#ev:youtube |TNKWgcFPHqw}}<br> | |||
{{Lösung versteckt| | |||
* Sie entdrillt die DNS-Doppelhelix und trennt die beiden Einzelstränge voneinander. | |||
* Primase | |||
* Weil die Polymerase nur in eine Richtung arbeiten kann (am neu entstehenden Strang die Nukleotide von 5´ nach 3´ verknüpfen), auf dem Vorwärtsstrang kann die Polymerase daher der Helicase "hinterher" laufen, auf dem Rückwärtsstrang muss gewartet werden, bis ein neuer Primer erstellt wurde, erst dann kann die Polymerase "von der der Helicase weg" arbeiten. | |||
* Die noch nicht miteinander verknüpften doppelsträngigen Abschnitte auf dem Rückwärtsstrang | |||
* Sie schließt die Lücke im Zucker-Phosphat-Gerüst der neu synthetisierten Einzelstränge. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Lesen: Buch, S. 63 - 65 (ohne den blauen Zettelkasten)<br> | |||
Aufgaben: | |||
* Beschreibe das sichtbare Ergebnis, wenn man die Bakterien im Versuch von Meselson und Stahl nicht einen Teilungszyklus lang, sondern zwei Teilungszyklen lang auf Medium mit leichtem Stickstoff wachsen lässt! | |||
* Untermauere Deine Beschreibung durch das Anfertigen einiger aussagekräftiger Skizzen! | |||
|Farbe= #060 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
== Distanzunterricht, Montag 15.02. == | |||
'''Zu bearbeiten: Am besten heute.'''<br> | |||
'''Zur Bearbeitung benötig ihr das Schulbuch, einen Zettel, Stift, eine Internetverbindung, um Videos zu schauen. Und Ruhe!'''<br> | |||
'''Die Bearbeitungszeit sollte unter 90 Minuten liegen.'''<br> | |||
'''Die <span style="color:#060">optionalen Inhalte</span> sind nicht in die Bearbeitungszeit mit einberechnet.'''<br> | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Abweichungen vom normalen Chromosomensatz'''</span> | |||
|Inhalt= | |||
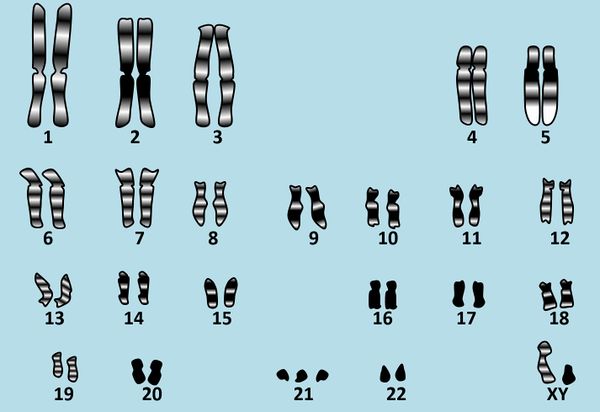
Die meisten von den bisher im Unterricht aufgetretenen Erbkrankheiten haben ihre Ursache in einem defekten Gen, also einem kleinen Abschnitt DNA in einem Chromosom. In dieser Einheit soll es um eine Gruppe von Erbkrankheiten gehen, bei denen eine andere Ursache eine Rolle spielt. Betrachtet dazu das folgende Karyogramm eines Menschen: <br> | |||
[[Datei:GenomMut_KaryogrammT21.jpg|600px]]<br> | |||
* Beschreibt dieses Karyogramm! | |||
{{Lösung versteckt| | |||
Es handelt sich um das Karyogramm eines Mannes, da bei den Gonosomen ein X- und ein Y-Chromosom vorliegen. Zusätzlich ist das 21. Chromosom dreimal vorhanden. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Bevor wir uns mit den Konsequenz dieser Abweichung beschäftigen zunächst ein Blick auf die Ursachen: Wie kommt es dazu, dass hier eine '''Trisomie 21''' vorliegt (''tri'' = drei, ''soma'' = das Körperchen; gemeint ist also: '''das dreifache Vorliegen des 21.''' Körperchens/'''Chromosoms'''). <br> | |||
Das folgende Video ist auf englisch. Das macht aber nichts. Wenn ihr gut in Englisch seid, könnt ihr versuchen den gesprochenen Text zu verstehen. Wenn nicht, konzentriert euch auf die Animationen und die geschriebenen Fachbegriffe. Und ignoriert bitte die Kommentare...<br> | |||
Schaut bitte lediglich bis zum Zeitindex '''3:41 min'''! Der restliche Teil des Videos kann später freiwillig angeschaut werden:<br> | |||
{{#ev:youtube |ze_6VWwLtOE|800}} | |||
<br> | |||
'''Zusammenfassung:''' Ursachen für eine Trisomie 21 sind also '''Nondisjunction-Ereignisse''', in der Regel gekennzeichnet durch das Symbol '''N!'''. | |||
* Beschreibe mit Worten, was das bedeutet! | |||
{{Lösung versteckt| | |||
Nondisjunction bedeutet "Nicht-Trennung". Es handelt sich um einen Vorgang, der in der Meiose, also bei der Bildung von Geschlechtszellen, auftreten kann. Bei einem '''N!''' in der '''ersten meiotischen Teilung''' werden die '''homologen Chromosomen''' nicht voneinander getrennt, bei einem '''N!''' in der '''zweiten meiotischen Teilung''' werden '''die Chromatiden''' nicht voneinander getrennt. In beiden Fällen kommt es zu Geschlechtszellen (Eizellen, Spermien), die von einem Chromosom ein Chromatid zu viel oder zu wenig haben. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
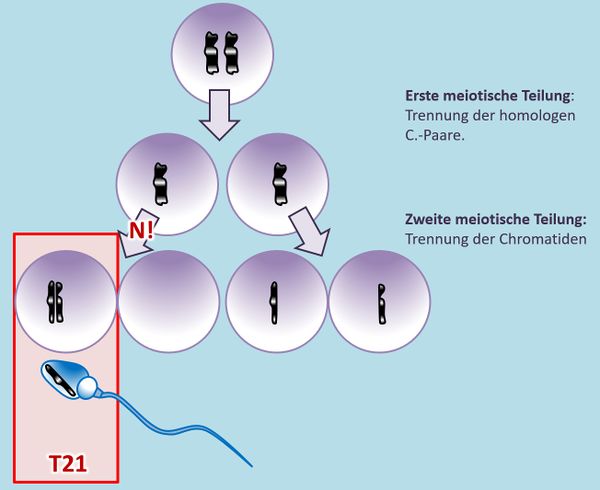
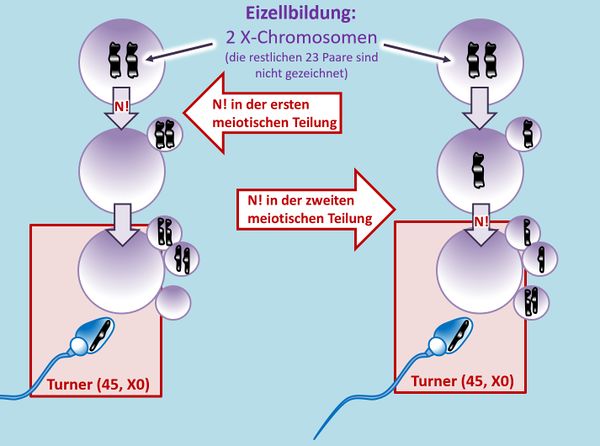
Ihr sollt dieses Phänomen selbst noch einmal zeichnen. Betrachtet eine hypothetische Urkeimzelle mit nur einem Chromosomenpaar. Zeichne die Schritte, die durch ein '''N!''' in der zweiten meiotischen Teilung zu einer Eizelle führen, die nach der Befruchtung mit einem "normalen" Spermium in einer Trisomie mündet.<br> | |||
{{Lösung versteckt| | |||
[[Datei:GenomMut_N_in_2meiost_T21.jpg|600px]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Im Film wurde auch bereits auf die '''Monosomien''' eingegangen. Im oben gezeichneten Beispiel würde eine Monosomie entstehen, wenn die zweite Eizelle von links durch ein "normales" Spermium befruchtet werden würde. '''Monosomien''' (also Zustände, bei denen von einem Chromosom nur '''eine Kopie''' in der Zelle vorliegt) sind immer tödlich. Eine befruchtete Eizelle mit einer derartigen Ausstattung an Chromosomen entwickelt sich nicht oder kaum zu einem Fötus bzw. Embryo heran. Eine Ausnahme existiert, auf die wird später eingegangen: Menschen mit 44 normalen Autosomen aber nur einem X-Chromosom. Man könnte von einer "Monosomie 23" sprechen (tut man aber nicht). <br> | |||
In eurem Buch auf der Seite 92 sind die Auswirkungen einer Trisomie 21, auch bekannt unter dem Namen Down-Syndrom, aufgeführt. Lest diese Seite!<br> | |||
<br> | |||
Schließt jetzt das Buch und beantwortet folgende Fragen: <br> | |||
* Woher hat das Down-Syndrom seinen Namen? | |||
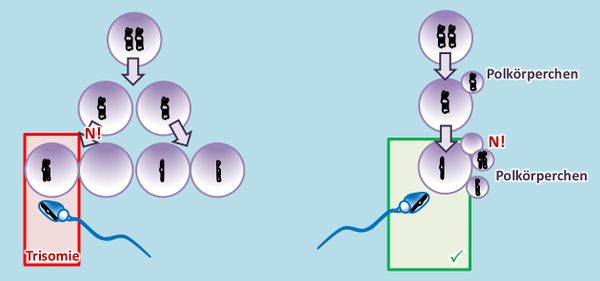
* Was ist ein Polkörperchen und was hat das mit Trisomien zu tun? (Was ein Polkörperchen ist, steht nicht hier im Text, wurde aber früher bereits besprochen.) | |||
* Was für ein Faktor beeinflusst die Häufigkeit des Auftretens von '''N!''' ? | |||
{{Lösung versteckt| | |||
* Der Name stammt von dem Arzt, der die Symptome als erstes dokumentiert hat: ''John Langdon Down''. | |||
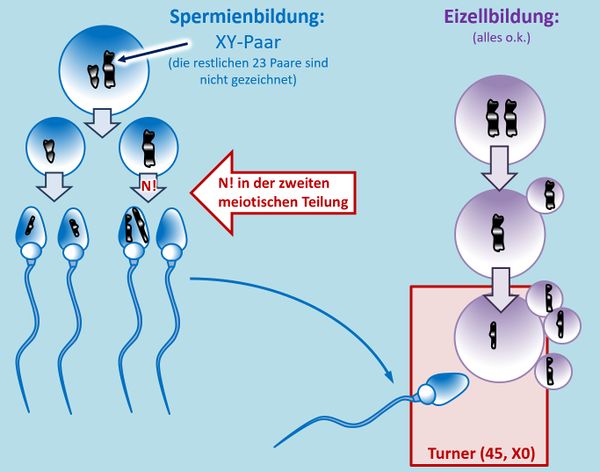
* Bei der Bildung von Eizellen in der Meiose entwickelt sich immer nur eine Tochterzelle zur Eizelle weiter, die restlichen bleiben als deutlich kleineres Polkörperchen an der großen Eizelle kleben. Im Film bzw. auch in der oberen Abbildung ist dieser Prozess nicht dargestellt. Dort sieht es so aus, als würden aus einer Urkeimzelle vier gleichwertige Zellen entstehen. Das ist aber Absicht. Es ging in diesen Darstellungen einfach darum, die prinzipiellen Möglichkeiten aufzuzeigen. Zum Zusammenhang mit Trisomien: Wenn ein '''N!''' stattfindet, kann es sein, dass die fehlerhafte Zelle sich zufällig zu einem Polkörperchen entwickelt. Dann hat das keine Auswirkungen auf das Kind. <br> | |||
[[Datei:GenomMut_N_in_2meiost_Polkörper.jpg|600px]]<br> | |||
<br> | |||
* Je älter eine Frau, umso größer ist die Wahrscheinlichkeit für ein '''N!'''. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Früher war es üblich bei der Besprechung des Down-Syndroms alle möglichen Symptome aufzuzählen. Dadurch entstand der Eindruck, Menschen mit Trisomie 21 sind immer hochgradig behindert. Das trifft jedoch nicht zu. In vielen Fällen sind nur wenige der möglichen Symptome, teilweise auch nur sehr schwach ausgeprägt. Vor allem wenn die Trisomie 21 früh entdeckt wird, z.B. durch pränatale Diagnostik, können frühkindliche Fördermaßnahmen dazu führen, dass sich Kinder mit Trisomie 21 nahezu normal entwickeln.<br> | |||
* Wiederholung: Beschreibe eine pränatale Diagnose-Möglichkeit, um Trisomie 21 festzustellen! | |||
{{Lösung versteckt| | |||
z.B. Amniozentese (Fruchtwasseruntersuchung): Entnahme von Fruchtwasser durch die Bauchdecke der schwangeren Frau. Das Fruchtwasser enthält immer auch kindliche, abgestoßene (oder andere) Zellen. Aus diesen kann ein Karyogramm angefertigt werden. Eine Trisomie wäre dann erkennbar | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (freiwillig)'''</span> | |||
|Inhalt= | |||
Es gibt eine ganze Reihe von Dokumenten (Filme etc.), die zeigen, dass Menschen mit Down-Syndrom eben nicht "weniger intelligente Behinderte" sein müssen. Die folgende Seite gehört zur regelmäßig erscheinenden Zeitschrift "Ohrenkuss", die ausschließlich von Menschen mit Down-Syndrom produziert wird. Wer will, kann darin stöbern: | |||
* Link zur Seite des Magazins "Ohrenkuss": [https://ohrenkuss.de/ohrenblog/page-1.html Hier klicken] <br> | |||
<br> | |||
In den Bildern dieser Unterrichtseinheit wird immer die "freie Trisomie" dargestellt. Das bedeutet: Alle drei Chromosomen sind frei beweglich. Es gibt aber auch Formen, die entstehen, weil Chromosomen miteinander verkleben. In der Fachsprache nennt man das eine Translokation. Wer will kann jetzt den Film vom Anfang weiter schauen, indem das Zustandekommen der Translokationstrisomie 21 erklärt wird. | |||
|Farbe= #060 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''andere Trisomien'''</span> | |||
|Inhalt= | |||
'''N!''' kommen tatsächlich sehr häufig vor. In den meisten Fällen entwickeln sich aus befruchteten Eizellen, die Trisomien enthalten aber keine Embryonen oder Föten. Warum ein zusätzliches Chromosom in den meisten Fällen letal (tödlich) ist, kann an dieser Stelle nicht geklärt werden, auch weil noch nicht alle Prozesse vollständig verstanden sind. Letztlich liegt es wohl an einem Ungleichgewicht von Enzymen, die entstehen. <br> | |||
Nachdem das Chromosom 21 klein ist, könnte dies erklären, warum eine Trisomie 21 nicht tödlich ist. Die entstehenden Ungleichgewichte im Zellhaushalt scheinen für den Organismus verkraftbar. Zwei weitere Trisomien, die deutlich seltener auftreten und mit massiven Störungen der Entwicklung einhergehen sind die Trisomie 18 (Edwards-Syndrom) und die Trisomie 13 (Pätau-Syndrom). Bei der Trisomie 18 liegt die Todesrate innerhalb der ersten sechs Tage nach der Geburt z.B. bei 50%. | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (freiwillig)'''</span> | |||
|Inhalt= | |||
Wenn ihr Schwierigkeiten mit dieser Art von Themen habt (Behinderungen, Tod, Ausgrenzung), empfehle ich euch diesen Punkt wirklich zu überspringen oder jemanden dazu zu holen. Im Unterricht kann man hier bestimmte Ängste, Vorurteile etc. abfangen, im Moment müsst ihr aber alleine klarkommen. <br> | |||
Verschafft euch auf den folgenden WIKIPEDIA-Seiten einen Überblick über die Symptome, Lebenserwartung und Behandlungsmöglichkeiten bei: | |||
* Trisomie 18 (Edwards-Syndrom) [https://de.wikipedia.org/wiki/Edwards-Syndrom Hier klicken] | |||
* Trisomie 13 (Pätau-Syndrom) [https://de.wikipedia.org/wiki/Pätau-Syndrom Hier klicken] | |||
|Farbe= #060 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#007">'''Gonosomale Abweichungen'''</span> | |||
|Inhalt= | |||
Die bisher besprochenen '''numerischen Chromosomenabberationen''' (zahlenmäßige Abweichung von der Chromosomen-Anzahl) betrafen ausschließlich die Autosomen. Es können aber auch die Gonosomen betroffen sein. Man unterscheidet folgende Typen: <br> | |||
[[Datei:GenomMut_gonosAbberat_Übersicht.jpg|600px]]<br> | |||
<br> | |||
Lest im Buch die S. 99 und bearbeitet die Aufgaben 1 - 4! | |||
{{Lösung versteckt| | |||
[[Datei:GenomMut_HA1_ML_Teil1.jpg|600px]]<br> | |||
[[Datei:GenomMut_HA1_ML_Teil2.jpg|600px]] | |||
|Lösung für Aufgabe 1|Lösung ausblenden}}<br> | |||
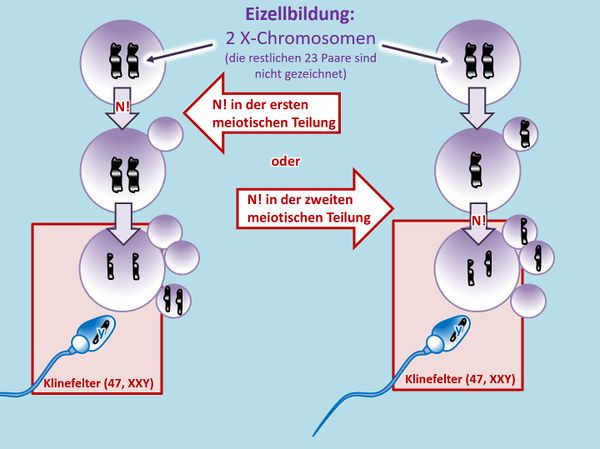
{{Lösung versteckt| | |||
[[Datei:GenomMut_HA2_ML.jpg|600px]] | |||
|Lösung für Aufgabe 2|Lösung ausblenden}}<br> | |||
{{Lösung versteckt| | |||
[[Datei:GenomMut_HA3_ML.jpg|600px]]<br> | |||
Nachdem in der Aufgabe die Rede davon ist, dass die beiden X-Chromosomen genetisch völlig identisch sind, kommt hier eigentlich nur die rechte Variante in Frage! Bei der linken Variante wären die beiden X-Chromosomen genetisch unterschiedlich. (Das eine Chromatid in der Eizelle stammt von dem Chromosom, welches die Frau von ihrem Vater hat; das andere Chromatid stammt von dem Chromosom, welches die Frau von ihrer Mutter hat.) | |||
|Lösung für Aufgabe 3|Lösung ausblenden}}<br> | |||
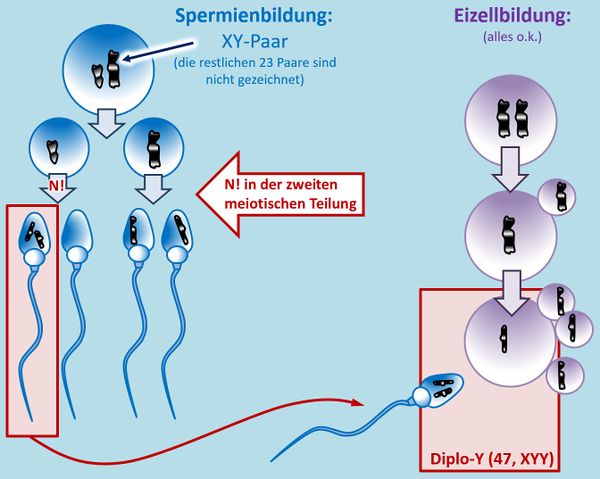
{{Lösung versteckt| | |||
Vermutlich habt ihr keine Lösung gefunden und trotzdem auf den Anzeigen-Butten geklickt...<br> | |||
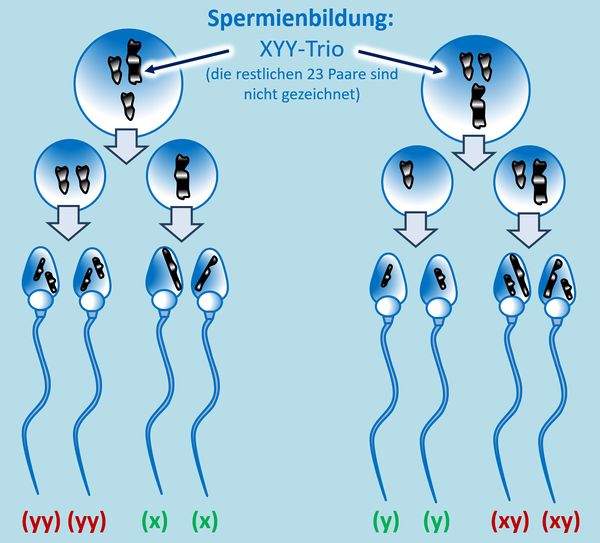
Hm. Aber gut, was solltet ihr auch sonst machen? O.k., hier ein Tipp: Bei einer ungeraden Anzahl an Chromosomen in der Zelle taucht in der 1. meiotischen Teilung ein Problem auf: Normalerweise ordnen sich hier die homologen Paare nebeneinander an, so dass jeweils ein ganzes Chromosom vom Spindelfaserapparat zum einen oder anderen Zellpol gezogen wird. Bei einer ungeraden Anzahl bleibt aber ein Chromosom übrig. Dieses wird wahlweise entweder zum einen oder anderen Zellpol gezogen. In diesem speziellen Fall muss man auch noch folgende Fälle unterscheiden: Bei einem normalen Mann ordnen sich in der 1. meiotischen Teilung das X- und das Y-Chromosom nebeneinander an und werden dann getrennt. Liegen allerdings wie hier zwei Y-Chromosome (und ein X-Chromosom) vor, könnte es auch sein, dass sich in der 1. meiotischen Teilung die beiden Y-Chromosome in der Äquatorialebene nebeneinander anordnen und das X-Chromosom keinen Partner hat.<br> | |||
Probiert es jetzt erneut! | |||
|Lösung für Aufgabe 4|Lösung ausblenden}}<br> | |||
{{Lösung versteckt| | |||
[[Datei:GenomMut_HA4_ML.jpg|600px]] | |||
|Zusatzlösung|Lösung ausblenden}}<br> | |||
|Farbe= #007 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFF | |||
|Hintergrund= #DFF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Fertig für heute!'''</span> | |||
|Inhalt= | |||
Bereitet euch auf die Videokonferenz am Donnerstag vor, indem ihr kurz vorher diese Seite noch einmal überfliegt und den Hefteintrag herunter ladet. | |||
|Farbe= #060 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
=== Distanzunterricht Montag, 08.02.=== | |||
'''Zu bearbeiten: Am besten heute. Ihr könnt gerne zusammen an dieser Einheit arbeiten, indem ihr euch über ein Kommunikations-Tool eurer Wahl Kontakt aufnehmt.'''<br> | |||
'''Zur Bearbeitung benötig ihr das '''Schulbuch''', einen Zettel und einen Stift.'''<br> | |||
'''Die Bearbeitungszeit wird 90 Minuten sicher nicht überschreiten.'''<br> | |||
'''Die <span style="color:#070">optionalen Inhalte</span> sind jedoch nicht in die Bearbeitungszeit mit eingerechnet.'''<br> | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Stammbaumanalysen'''</span> | |||
|Inhalt= | |||
Wie in der letzten Unterrichts-Stunde angedeutet hat das Analysieren von Stammbäumen eine ganz praktische Bedeutung: Man kann damit z.B. die Wahrscheinlichkeit ableiten, mit der ein Kind geboren wird, das Träger einer Erbkrankheit ist. <br> | |||
* Lest zunächst auf S. 109 in der linken Spalte die Absätze 1, 2 und 4 | |||
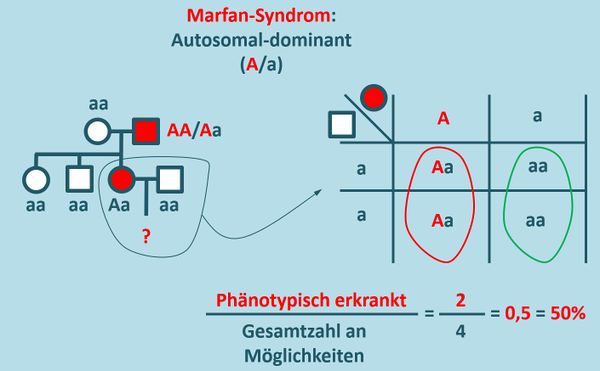
* Zeichnet unter Angabe aller möglichen Genotypen einen Stammbaum für eine Familie, in der ein autosomal-dominant vererbtes Merkmal (z.B. das Marfan-Syndrom) vorkommen soll: Ein gesunder '''Mann''' heiratet eine '''Frau''', die das Marfan-Syndrom zeigt. Die beiden Geschwister der Frau (ein Bruder, eine Schwester) sind phänotypisch unauffällig, ebenso wie die Mutter. Der Vater litt allerdings auch am Marfan-Syndrom. | |||
* Berechnen Sie die Wahrscheinlichkeit dafür, dass ein Kind des '''eingangs genannten Paares''' das Marfan-Syndrom aufweisen wird. | |||
{{Lösung versteckt| | |||
[[Datei:Stammbaum_Marfan_ML.jpg|600px]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (= freiwillig)'''</span> | |||
|Inhalt= | |||
* Es gibt einen berühmten Fall von einer Frau, die das Marfan-Syndrom zeigt. Wer will, kann '''Lizzie Velásquez''' recherchieren. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Stammbaumanalysen 2'''</span> | |||
|Inhalt= | |||
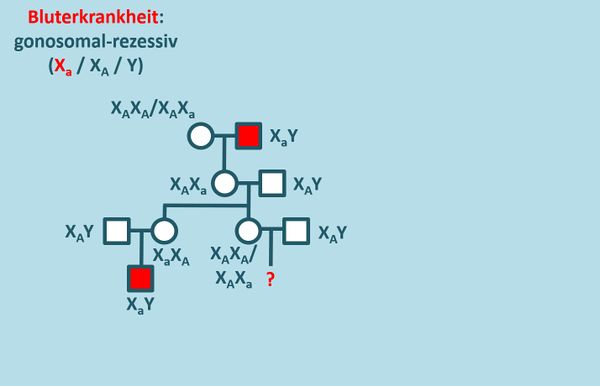
Die '''Aufgabe 1''' auf der S. 110 beschäftigt sich mit einer Familie, in der die Bluterkrankheit vorkommt. Diese wird gonosomal-rezessiv vererbt. Löst die Aufgabe mit folgender Änderung: ''... Ermitteln Sie über einen Stammbaum der Familie das Risiko, mit dem '''ein Kind''' dieser Frau ebenfalls bluterkrank sein wird.'' | |||
* Zeichnet zunächst den Stammbaum unter Angabe aller möglichen Genotypen! | |||
{{Lösung versteckt| | |||
[[Datei:Stammbaum_Bluter_ML1.jpg|600px]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
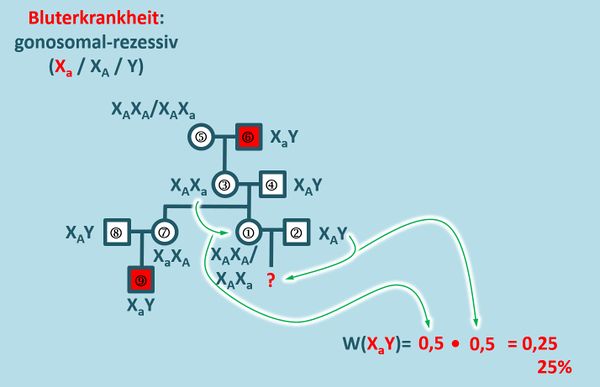
* Berechnet jetzt die Wahrscheinlichkeit für ein Kind, das an der Bluterkrankheit leidet | |||
{{Lösung versteckt| | |||
[[Datei:Stammbaum_Bluter_ML2.jpg|600px]]<br> | |||
Die Gesamtwahrscheinlichkeit ergibt sich aus der Multiplikation der Einzelwahrscheinlichkeiten. Fälle, die zu 100% eintreten, brauchen nicht berücksichtigt werden (weil sie in der Multiplikation als Faktor 1 auftreten würden und das Ergebnis nicht verändern). | |||
* Betrachten wir zunächst die Mutter 1: <br> | |||
Sie könnte die den Genotyp X<sub>A</sub>X<sub>a</sub> oder X<sub>A</sub>X<sub>A</sub> besitzen. Dies hängt von ihrer Mutter (3) ab. Von ihrem Vater (4) erhält sie in jedem Fall X<sub>A</sub>. X<sub>a</sub> kann der Vater nicht besitzen, sonst wäre er krank. <br> | |||
Das die Mutter (3) tatsächlich Konduktorin ist (Genotyp X<sub>A</sub>X<sub>a</sub>) ist aufgrund ihrer Eltern (5) und (6) sicher.<br> | |||
Mit welcher Wahrscheinlichkeit trägt die Frau (1) nun den Genotyp X<sub>A</sub>X<sub>a</sub>?<br> | |||
Es gibt prinzipiell zwei Möglichkeiten: Entweder sie erhält von ihrer Mutter (3) X<sub>A</sub> oder X<sub>a</sub>. In einem von zwei Fällen also. Das entspricht einer Wahrscheinlichkeit von 50% (oder 0,5). | |||
* Betrachten wir nun den Vater (2): <br> | |||
Nachdem er gesund ist, muss er den Genotyp X<sub>A</sub>Y besitzen. Wenn er das Chromosom X<sub>A</sub> an sein Kind weitergibt, wird es eine Tochter, die gesund ist. Gibt er das Y-Chromosom weiter, wird es ein Junge. Ob dieser krank ist oder nicht, hängt vom X-Chromosom der Mutter ab.<br> | |||
Mit welcher Wahrscheinlichkeit gibt der Mann (2) nun ein Y-Chromosom weiter? <br> | |||
Es gibt prinzipiell zwei Möglichkeiten: Entweder X<sub>A</sub> oder Y. In einem von zwei Fällen also. Das entspricht einer Wahrscheinlichkeit von 50% (oder 0,5). | |||
* Beide Wahrscheinlichkeiten miteinander multipliziert ergibt eine Wahrscheinlichkeit von 25%, mit der ein krankes Kind (ein Junge) auf die Welt kommt. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Der Heterozygoten-Test'''</span> | |||
|Inhalt= | |||
Das letzte Beispiel zeigt auch, dass es bei rezessiv vererbten Merkmalen einen entscheidenden Unterschied macht, ob eine phänotypisch gesunde Person '''heterozygot''' ist, also den Genotyp '''Aa''' bzw. '''X<sub>A</sub>X<sub>a</sub>''' besitzt oder '''homozygot''' ist, also den Genotyp '''AA''' bzw. '''X<sub>A</sub>X<sub>A</sub>''' besitzt. Lange Zeit gab es keine Möglichkeit (außer in bestimmten Fällen über Stammbaum-Betrachtungen) zu testen, ob eine Person heterozygot ist. Inzwischen gibt es für einige Krankheiten gentechnische Nachweis-Methoden. <br> | |||
Ein schon etwas älterer "Heterozygoten-Test" nutzt eher die Prozesse im Stoffwechsel von Menschen aus. | |||
* Lest auf S. 108 den Text über Phenylketonurie (PKU) (1. Absatz link + 2. und 3. Absatz rechts) und auf der S. 109 den Abs. 5 (rechte Spalte) | |||
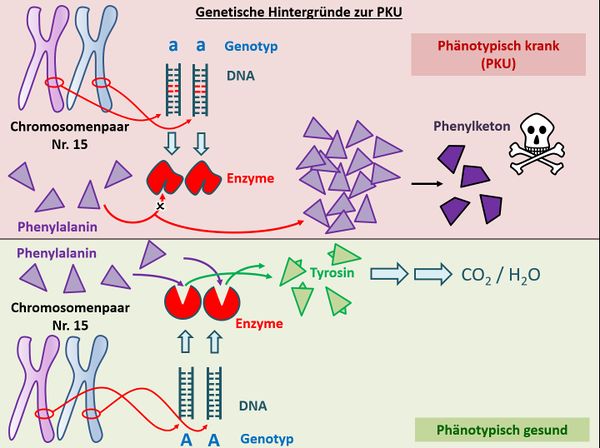
* Betrachtet anschließend das folgende Bild und beschreibt es mit eurem soeben erworbenen Fachwissen. Sprecht dabei laut! Am besten ihr holt euch jemanden dazu, der gerade Zeit hat, z.B. eure Eltern, die sich bestimmt wahnsinnig freuen werden! Wenn ihr das nicht möchtet, dann erzählt es wenigstens einem Gegenstand auf eurem Schreibtisch, laut!<br> | |||
[[Datei:PKU_VglGesundKrank_Schema.jpg|600px]] | |||
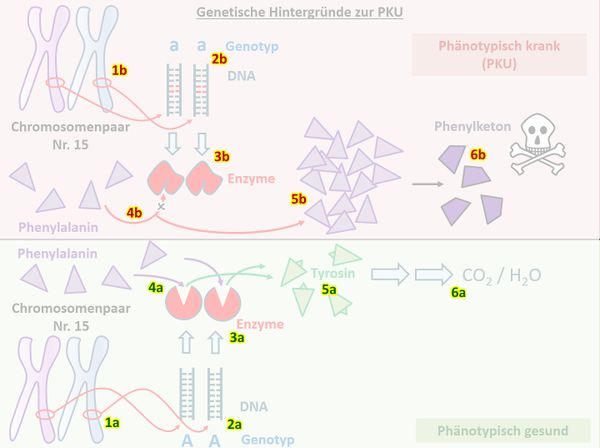
{{Lösung versteckt| | |||
[[Datei:PKU_VglGesundKrank_Schema_ML.jpg|600px]]<br> | |||
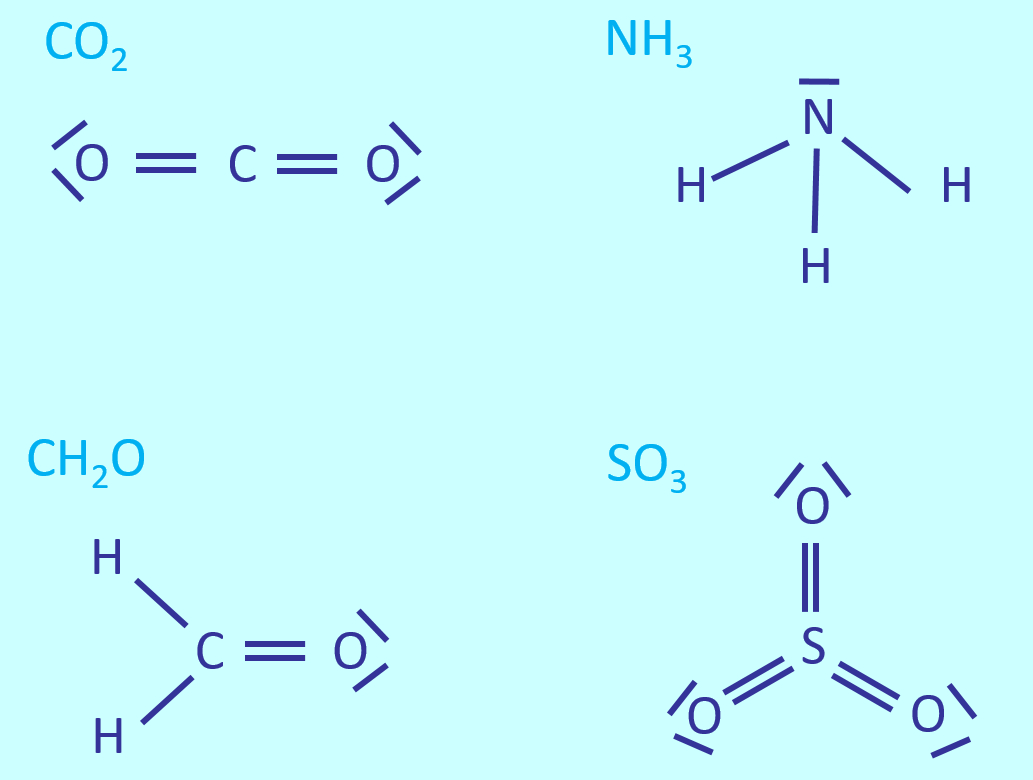
Z.B.: Menschen besitzen von jedem Chromosom ein homologes Paar. Auf diesen Chromosomen gibt es Orte, die z.B. für die sichtbare Ausprägung eines Merkmals mitverantwortlich sind. Diese Orte nennt man auch Gene (1a/1b). Die Gene bestehen aus DNA, die aber nicht immer gleich ist. Häufig gibt es verschiedene Varianten von DNA-Abschnitten, die in einem Gen sitzen (2a/2b). Diese Varianten heißen Allele. Im Normalfall sorgt ein Allel auf dem Chromosom Nr. 15 (das konnten ihr nicht wissen) für die Bildung des Enzyms Phenylalaninhydroxylase (3a), welches in der Lage ist, mit der Nahrung aufgenommenes Phenylalanin in Tyrosin umzuwandeln (4a). Dieses wird von anderen Enzymen, die hier nicht relevant sind, in CO<sub>2</sub> und H<sub>2</sub>O zerlegt (5a, 6a). <br> | |||
Bei Menschen mit Phenylketonurie befindet sich auf dem entsprechenden Gen ein Allel, welches nicht zur Bildung des korrekten Enzyms führt (2b/3b). Mit der Nahrung aufgenommenes Phenylalanin kann nicht weiterverarbeitet werden (4b) und reichert sich im Körper an (5b). In einer Nebenreaktion entsteht Phenylketon (6b) was sich äußerst toxisch auf die Entwicklung von Nervenzellen auswirkt. <br> | |||
Wird die Krankheit nicht erkannt, entwickeln Kinder mit PKU schwerste Behinderungen. Diese Fehlentwicklung lässt sich einfach vermeiden, indem man eine strenge Diät einhält, bei der kein Phenylalanin in der Nahrung vorkommt. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (= freiwillig)'''</span> | |||
|Inhalt= | |||
* Recherchiert Lebensmittel, die viel bzw. kaum Phenylalanin enthalten! | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Der Heterozygoten-Test'''</span> | |||
|Inhalt= | |||
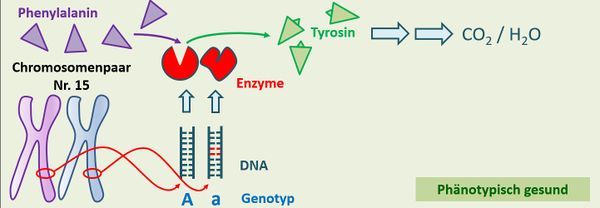
* Im Buchtext wurde bereits der Genotyp '''Aa''' angesprochen. Zeichnet diesen Fall nach dem gleichen Schema wie auf der Folie oben! | |||
{{Lösung versteckt| | |||
[[Datei:PKU_Heterozygot_Schema_ML.jpg|600px]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
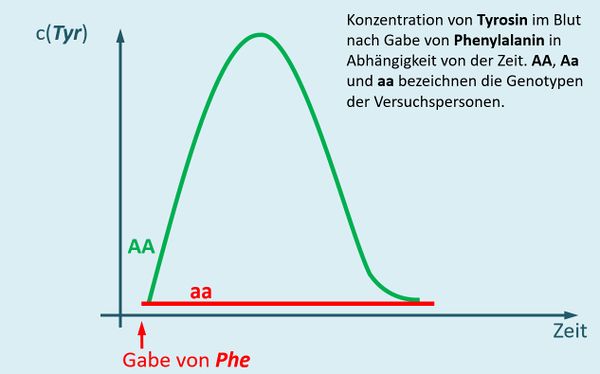
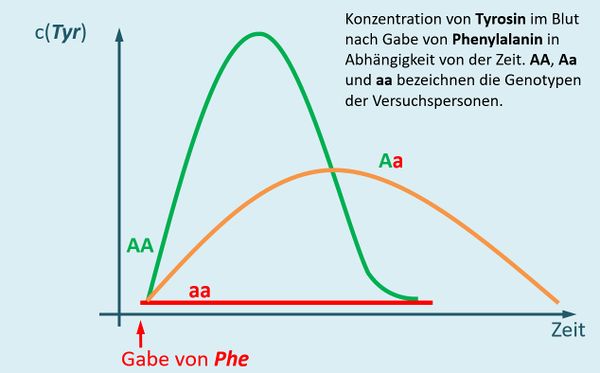
Der Heterozygoten-Test auf Phenylketonurie wird bei nahezu allen Neugeborenen durchgeführt und kann nach folgendem Muster erfolgen (heutzutage macht man das allerdings anders): Man spritzt einer Person Phenylalanin und misst im Anschluss regelmäßig den Tyrosin-Gehalt im Blut. | |||
* Zeichne ein Diagramm, das die Tyrosin-Konzentration im Blut nach der Gabe von Phenylalanin in Abhängigkeit von der Zeit zeigt. Einmal für den Fall, dass die betroffene Person den Genotyp AA besitzt und mit einer zweiten Kurve den Genotyp aa. | |||
{{Lösung versteckt| | |||
[[Datei:PKU_HeterozygotentestAAaa_ML.jpg|600px]]<br> | |||
Bei Personen mit dem Genotyp AA werden zwei funktionstüchtige Enzyme gebildet, die Phenylalanin zu Tyrosin umwandeln. Das bedeutet, dass nach der Gabe von Phenylalanin der Tyrosin-Gehalt stark ansteigen muss. Tyrosin wird jedoch weiterverarbeitet, insofern fällt nach einiger Zeit der Tyrosin-Spiegel wieder. <br> | |||
Bei Personen mit dem Genotyp aa werden zwei funktionslose Enzyme gebildet. Phenylalanin wird nicht weiterverarbeitet, es taucht kein zusätzliches Tyrosin im Blut auf. | |||
|Lösung|Lösung ausblenden}}<br> | |||
* Zeichne in das Diagramm nun den Verlauf ein, der sich ergeben sollte, wenn die betrachtete Person heterozygot (Genotyp '''Aa''') ist. | |||
{{Lösung versteckt| | |||
[[Datei:PKU_HeterozygotentestAa_ML.jpg|600px]]<br> | |||
Personen mit dem Genotyp Aa bilden teilweise intakte, teilweise defekte Enzyme. Die intakten können Phenylalanin abbauen. Aber eben nicht so schnell im Vergleich zur Situation bei Menschen mit dem Genotyp AA, die doppelt so viele intakte Enzyme herstellen. Die Kurve steigt daher nicht so schnell, hält aber länger an. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<span style="color:#B0F">'''Ende der ersten Stunde. Kurze Pause :)''' - Die zweite Hälfte wird kürzer. </span><br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Pränatale Diagnose'''</span> | |||
|Inhalt= | |||
Auch wenn eine Frau bereits schwanger ist, können Diagnosen über das ungeborene Kind gestellt werden. Die dazu zur Verfügung stehenden Methoden nennt man '''pränatale Diagnosemöglichkeiten''' ('''prä''' = vor, '''natal''' = Geburt; also '''vorgeburtliche''' Diagnosen). Im Buch sind die Verfahren nur sehr grob dargestellt (S. 110, untere Tabelle). Zur Bearbeitung von Aufgaben in der Klausur bzw. Abitur genügt es jedoch, wenn ihr die Inhalte dieser Tabelle wiedergeben könnt. | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (= freiwillig)'''</span> | |||
|Inhalt= | |||
* Eine detailliertere Übersicht über Pränatale Diagnostik bietet z.B. diese Seite: [https://www.familienplanung.de/schwangerschaft/praenataldiagnostik/ Familienplanung.de] | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Nicht immer gilt: Ein Gen - ein Merkmal'''</span> | |||
|Inhalt= | |||
Zu Beginn der Vererbungslehre haben wir einfach Fälle betrachtet. Zum Beispiel bei Erbsen: Die Farbe der Samen wurde von einem Gen bestimmt. Je nachdem welche Allelkombination vorlag, waren die Früchte gelb oder grün. Ähnlich war es bei den Farben der Blüten oder der Oberflächenbeschaffenheit der Samen (rund oder runzelig). Dieser Zusammenhang gilt jedoch nicht streng. Folgende Effekte treten auf: | |||
* '''Polyphänie''': Ein Gen sorgt nicht nur für die Ausprägung eines Merkmals am Körper, sondern es werden gleich ganz viele Merkmale beeinflusst. Bsp.: Das Marfan-Syndrom. Ein einziges defekten Allel sorgt hier für eine ganze Reihe von Veränderungen: Herzfehler, Augenfehler, Verlängerung der Gliedmaßen etc. | |||
* '''Polygenie''': Ein Merkmal wird von vielen Genen beeinflusst. Bsp.: Die Hautfarbe. Es gibt nicht ein Gen, welches die Hautfarbe bestimmt, sondern viele. Damit kann man sehr gut erklären, warum Menschen nicht einfach weiß, schwarz oder braun sind, sondern sehr viele Zwischenstufen denkbar sind. | |||
* '''Modifikation:''' Ein Merkmal wird nicht (nur) von den Genen bestimmt, sondern ein Umweltfaktor sorgt für die Veränderung des Merkmals. Bsp.: Auch hier könnte man die Hautfarbe anführen. Jeder weiß, dass die Haut dunkler wird, wenn man sie der Sonne aussetzt. Der Umweltfaktor '''"Sonne"''' sorgt hier also für eine Veränderung des Merkmals '''"Hautfarbe"'''. | |||
* Lest S. 100 und bearbeitet die Aufgabe 2 und Aufgabe 4! | |||
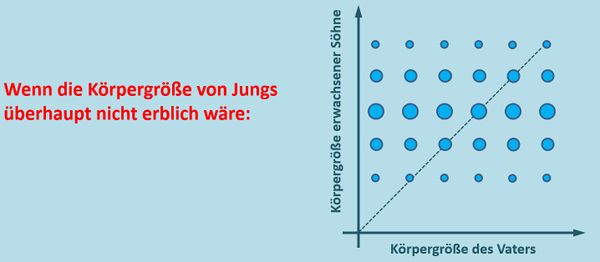
{{Lösung versteckt| | |||
* Aufgabe 2: Wenn die Körpergröße keinerlei genetischen Anteil hätte, dann dürften sich die Verteilungsmuster bei Männern verschiedener Größen nicht unterscheiden. Egal wie groß ein Mann ist, es müsste immer das selbe Verteilungsmuster bezüglich der Körpergröße seiner Söhne herauskommen. Die Abbildung zeigt nur eine Möglichkeit. Andere wären denkbar:<br> | |||
[[Datei:Polyphänie_genie_Modifik_ML1.jpg|600px]] | |||
* Aufgabe 4: Im Schnitt sind die Söhne immer etwas größer als ihre Väter: Es befinden sich mehr und größere Punkte '''über''' der Mittelgeraden (heißt das Ding so? - Also die rote Linie in der Abbildung im Buch?). Wenn sich dieser Trend fortsetzt, werden Männer (im Schnitt) immer größere Söhne zeugen und langfristig werden Männer damit selbst immer größer. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#060">'''Optional (= freiwillig)'''</span> | |||
|Inhalt= | |||
* Zur Vererbung der Hautfarbe: Recherchiert die '''Zwillinge Leo und Ryan'''. | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFC | |||
|Hintergrund= #DFC | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Hausaufgabe'''</span> | |||
|Inhalt= | |||
Beendet jetzt die Arbeit in Biologie und macht erst etwas anderes, geht... spielen?! Lest zu einem späteren Zeitpunkt die S. 100, 108-109 und bearbeitet die unten stehenden Aufgaben. Der Hefteintrag wurde bereits hochgeladen.<br> | |||
<br> | |||
Wie schon erwähnt, werden heutzutage oft genetische Tests herangezogen werden, um Aussagen über mögliche Veranlagungen zu machen. Die Tests sind in den letzten Jahren immer billiger und genauer geworden. | |||
* Lest auf der S. 109 den Abs. 3 über Chorea Huntington! | |||
* Fasst die (eher ethischen) Probleme solcher Tests in diesem speziellen Fall zusammen! | |||
{{Lösung versteckt| | |||
z.B.: Mit einem positiven Test auf Chorea-Huntington könnte ein Konflikt entstehen: Eine Person, die sich ein Kind wünscht muss dann mit der Tatsache leben, dass eine 50%ige Wahrscheinlichkeit besteht, dass das Kind ebenfalls an dieser schweren, unheilbaren Krankheit erkranken wird. | |||
|Lösung|Lösung ausblenden}}<br> | |||
Rosafarbene Hortensien (das sind Pflanzen. Wenn ihr die nicht kennt: [https://de.wikipedia.org/wiki/Hortensien Hier klicken]) können mit einem einfachen Trick "umgefärbt" werden. | |||
* Recherchiert eine Methode, rosafarbene Hortensien blau zu färben! | |||
* Was hat das mit der letzten Unterrichtseinheit zu tun? | |||
{{Lösung versteckt| | |||
Die '''Blaufärbung''' wird (bei bestimmten Sorten) sowohl durch den pH-Wert des Bodens, als auch durch Aluminiumsalze im Boden verursacht. Das betrachtete Merkmal (Blütenfarbe) wird hier also nicht (nur) von Genen bestimmt sondern von einem Umweltfaktor. Insofern handelt es sich hier eine '''Modifikation'''. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Dienstag, 26.01.=== | |||
Verbessert gegenseitig eure Hausaufgabe: | |||
* Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern. | |||
* Besorgt euch einen Rotstift! | |||
* Macht ein Foto von eurer Hausaufgabe (Aufgabe 10 und Aufgabe 12 auf dem AB) und schickt sie an eure Korrekturpartnerin bzw. eurem Korrekturpartner! | |||
* Druckt dann die Lösungen, die ihr jetzt erhalten habt aus (wenn ihr euch selbst korrigiert ist das natürlich nicht nötig) | |||
* Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint einfügen und dann mit dem Mauszeiger etwas hineinmalen. | |||
* Geht zunächst auf dieser Seite Schritt für Schritt die Musterlösung durch und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler! | |||
* Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon) | |||
* Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt. | |||
* Ihr erhaltet um 13:50 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück! | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Verbesserung der Hausaufgabe'''</span> | |||
|Inhalt= | |||
'''Aufgabe 10:''' Berechne die Stoffmenge an Schwefeltrioxid, die man benötigt, um mit 100g Wasser vollständig zur Schwefelsäure zu reagieren.<br> | |||
<br>'''Tipp 1:''' Es geht hier um die Stoffmenge und eine Masse ist gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S1.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 2:''' Direkt lässt sich die Stoffmenge von Schwefeltrioxid mit dieser Gleichung nicht berechnen. Das geht nur, wenn alle anderen Größen der Gleichung bekannt wären, aber die Masse von Schwefeltrioxid ist unbekannt. Über die chemische Gleichung kann man die Stoffmenge von Schwefeltrioxid jedoch mit der Stoffmenge des Wassers in Beziehung setzen: Wie verhält sich die Stoffmenge (also die Anzahl der Teilchen) von Schwefeltrioxid zu der Stoffmenge (also der Anzahl der Teilchen) von Wasser? | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S2.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 3:''' Die Stoffmenge des Schwefeltrioxids lässt sich also durch die Stoffmenge des Wassers ausdrücken. Und die kann berechnet werden! Denn von Wasser hat man die Masse gegeben. Berechne zunächst die Stoffmenge des Wassers und schließe dann die Aufgabe ab! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A10_S3.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
'''Aufgabe 12:''' Im Labor soll Ammoniak aus den Elementen hergestellte werden (also aus H<sub>2</sub> und N<sub>2</sub>). Es gibt noch exakt 22,4L Stickstoff. Welche Stoffmenge an Wasserstoff benötigt man, um den gesamten Stickstoff zu Ammoniak umzusetzen.<br> | |||
<br>'''Tipp 1:''' Es geht hier um die Stoffmenge. Darüber hinaus ist ein Volumen gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S1.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 2:''' Direkt lässt sich die Stoffmenge von Wasserstoff mit dieser Gleichung nicht berechnen, es fehlt das Volumen, V(H<sub>2</sub>). Aber wie immer kann über die chemische Gleichung die Stoffmengen der beteiligten Stoffe in Beziehung zueinander setzen. Stelle die chemische Gleichung auf und drücke dann die Stoffmenge des benötigten Wasserstoffs in der Stoffmenge des Stickstoffs aus! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S2.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br>'''Tipp 3:''' Jetzt kann die Stoffmenge des Stickstoffs ausgerechnet werden und daraus die Stoffmenge des benötigten Wasserstoffs! | |||
{{Lösung versteckt| | |||
[[Datei:C9NTG_chemRechnen_A12_S3.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Dienstag, 26.01.=== | |||
Die folgende Einheit soll auf das chemische Reaktionsverhalten von Alkoholen hinführen. Dazu ist eine Wiederholung von Unterrichtsstoff aus dem letzten Schuljahr nötig: Die '''Redoxreaktionen'''. Das folgende Video wiederholt alles, was für die folgenden Stunden wichtig ist. Es ist sehr ausführlich und schreitet langsam voran. Wahrscheinlich werden sich einige von euch langweilen. Aber auch diejenigen unter euch, die letztes Jahr unter Umständen große Probleme beim Aufstellen von Redoxgleichungen hatten: Das Video erklärt wirklich jeden einzelnen Schritt, den man machen muss. Das Video dauert fast 30min. Danach sollt ihr selbst weitere Aufgaben lösen. Dazu benötigt ihr ein Arbeitsblatt, welches ihr am besten schon vor dem Anschauen des Videos ausdruckt oder in einem separaten Fenster öffnet | |||
* Hier gibt es das Arbeitsblatt: [[Spezial:FilePath/Ü_8_Redox_AB_WHmit MLf1.pdf| pdf-Datei]] | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Redoxreaktionen: Wiederholung'''</span> | |||
|Inhalt= | |||
{{#ev:youtube|NYtXRS1S8i4}}<br> | |||
<br> | |||
Nachdem ihr das Video geschaut habt, geht zur nächsten Aufgabe auf dem Arbeitsblatt über: <br> | |||
Die Reaktion von Permanganat (MnO<sub>4</sub><sup>-</sup>) in basischer Sulfit-Lsg. zum grünen Manganat MnO<sub>4</sub><sup>2-</sup>. Im Video war häufiger zwar die Rede von gründen Mn<sup>6+</sup>-Ionen, es ist jedoch fachwissenschaftlich besser von MnO<sub>4</sub><sup>2-</sup> zu sprechen. Am Verfahren ändert sich dadurch nicht, nur das Ergebnis sieht anders aus.<br> | |||
Ich empfehle übrigens, dass ihr diese Aufgaben am besten mit einem Partner besprecht! - Ruft euch über ein Medium eurer Wahl zu einer '''kleinen''' Gruppen (2 - 4 Personen) zusammen und löst die folgende Aufgabe zusammen! Die letzte Aufgabe könnt ihr dann zur Überprüfung eurer Fähigkeiten alleine rechnen. | |||
<br> | |||
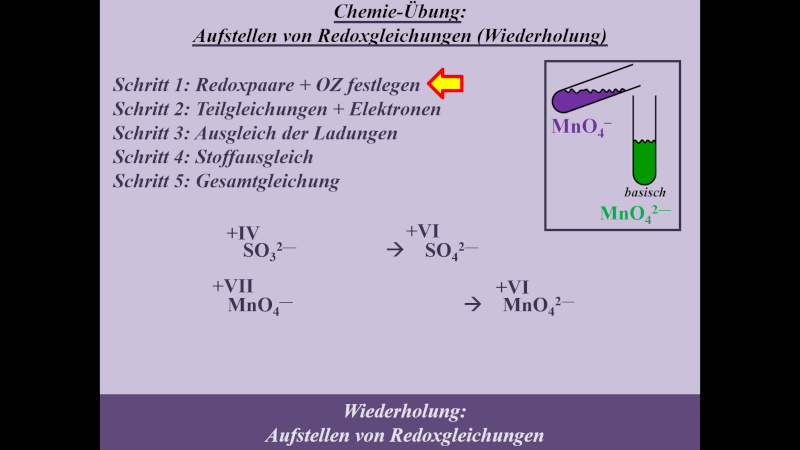
* Schritt 1: '''Redoxpaare und Oxidationszahlen festlegen''' | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_basisch_S1_ML.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
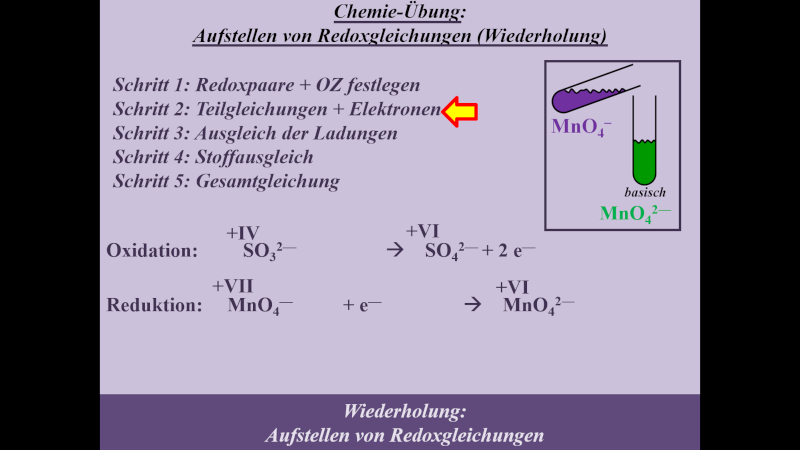
* Schritt 2: '''geflossene Elektronen festlegen''' | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_basisch_S2_ML.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
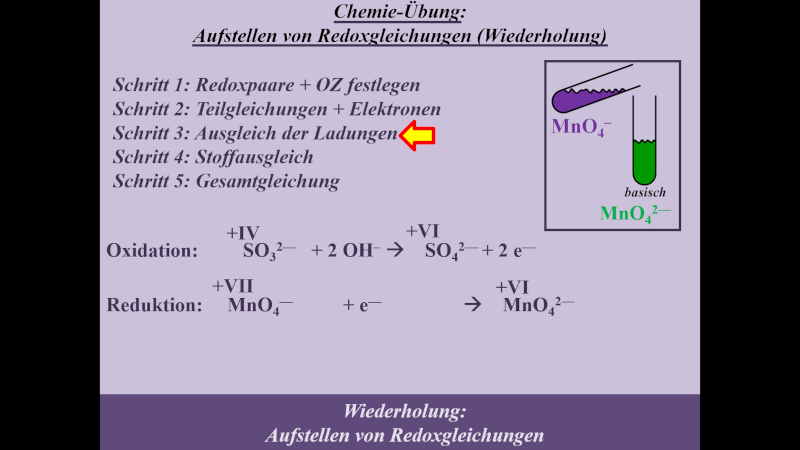
* Schritt 3: '''Ladungsausgleich''' | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_basisch_S3_ML.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
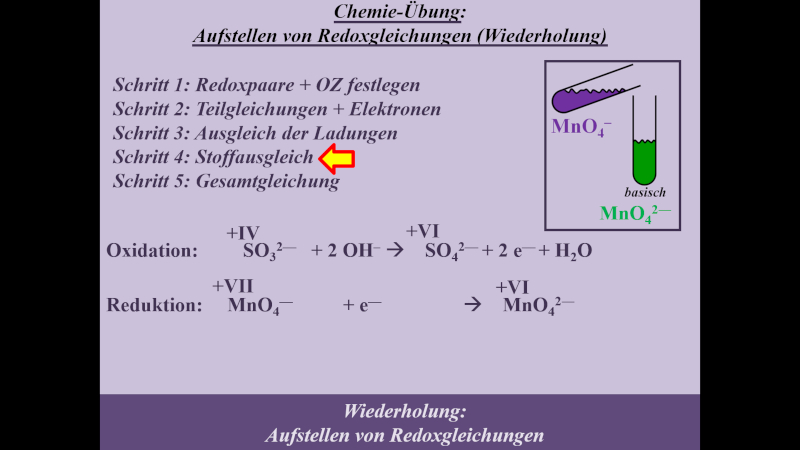
* Schritt 4: '''Stoffausgleich mit H<sub>2</sub>O''' | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_basisch_S4_ML.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
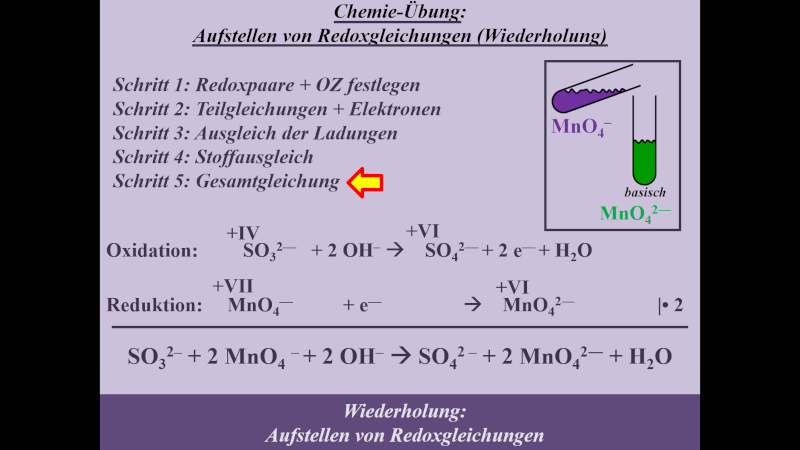
* Schritt 5: '''Gesamtgleichung aufstellen''' | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_basisch_S5_ML.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
In der nächsten Aufgabe geht es um die Bildung von braunem MnO<sub>2</sub> in basischer Sulfit-Lsg. Wenn das Medium weder sauer noch basisch ist, dürft ihr euch entscheiden, mit welchen Ionen ihr den Stoffausgleich durchführt: entweder mit OH<sup>-</sup>- oder mit H<sub>3</sub>O<sup>+</sup>-Ionen.<br> | |||
Stellt zunächst die Redoxgleichung auf, indem ihr die H<sub>3</sub>O<sup>+</sup>-Ionen zum Ausgleichen verwendet!<br> | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_neutralH3O_gesamtML.jpg]] | |||
|Gesamtlösung|Lösung ausblenden}}<br> | |||
<br> | |||
Letzte Aufgabe: Betrachtet noch einmal die Bildung von braunem MnO<sub>2</sub> in basischer Sulfit-Lsg. Verwendet diesmal aber zum Ausgleichen die OH<sup>-</sup>-Ionen!<br | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:MnO4_SO3_neutralOH_gesamtML.jpg]] | |||
|Gesamtlösung|Lösung ausblenden}}<br> | |||
<br> | |||
In eurem Schulbuch beginnt das Thema sofort mit Redoxreaktionen bei Alkoholen. Mir war es aber wichtig, dass ihr zunächst die Grundlagen anhand von anorganischen Molekülen wieder auffrischt. Eine Hausaufgabe im Buch gibt es daher nicht, ihr solltet aber tatsächlich die Aufgaben auf dem AB beherrschen! | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF'''Fett''' | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Donnerstag 20.01. Chemie === | |||
Mit der folgenden Einheit möchte ich in ein neues Stoffgebiet einsteigen. Schaut das folgende Video (17min.). Dort wird zunächst ein Versuch vorgestellt und die Beobachtung dann erklärt. Am Ende wird euch eine Aufgabe gestellt. Diese Aufgabe erledigt ihr bitte sofort im Anschluss an das Video. Dazu braucht ihr entweder ein Periodensystem oder ihr recherchiert die nötigen Infos direkt im Netz. Eure Lösung schickt ihr bitte in Form eines Fotos als Antwort auf den Arbeitsauftrag, den ich euch morgen um 08:10 Uhr über den Schulmanager anzeigen lasse.<br> | |||
Am Freitag machen wird eine Videokonferenz über MS Teams, um eure Ergebnisse sowohl in Bio als auch Chemie zu besprechen. Viel Erfolg! <br> | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Die polare Atombindung'''</span> | |||
|Inhalt= | |||
{{#ev:youtube|aCRfPCyilQo}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Mittwoch, 19.01. === | |||
Ihr habt gestern sehr gut mitgearbeitet, daher heute eine etwas weniger anspruchsvolle Stunde. Mit dem folgenden Link gelangt ihr auf eine Seite von ''BR alpha'' (Ein TV-Sender, der zum Bayerischen Rundfunk gehört): <br> | |||
<br> | |||
[https://www.br.de/alphalernen/faecher/chemie/gaerung-alkohol-brauerei-100.html Trinkalkohol]<br> | |||
<br> | |||
Diese Seite besitzt '''sieben Unterkapitel''', die ihr dort auf der rechten Seite der Homepage anklicken könnt:<br> | |||
1. Alkoholische Gärung in der Brauerei<br> | |||
2. Die alkoholische Gärung im Labor<br> | |||
3. Was macht Ethanol zu einem Alkohol<br> | |||
usw.<br> | |||
Zu jedem Kapitel gibt es einen kurzen Film (insgesamt ca. 35 Minuten) und darunter ein Quiz. Ich vertraue darauf, dass ich ihr euch heute alleine mit dieser Seite 45 Minuten beschäftigen könnt. Wer noch eine etwas anspruchsvollere Aufgabe braucht, bearbeitet bitte die folgende Aufgabe (Kontrolle in der nächsten Stunde am Di, 26.01.): [[Spezial:FilePath/Alkholoe_AufgabenBennungSdp1.pdf| pdf-Datei]] | |||
<br> | |||
=== Distanzunterricht Montag, 18.01. === | |||
Hallo 10d! <br> | |||
In der letzten Woche kam es vor allem in der 1. Stunde zu Problemen bei manchen Videokonferenzen. Höchstwahrscheinlich ist der Server überlastet, an dem Problem wird gearbeitet. Solange verzichte ich auf die Videokonferenz in der 1. Stunde, ich kann mit euch ja auch in der zweiten Stunde sprechen. Der Zeitplan für heute sieht also so aus: | |||
* Um 07:50 Uhr solltet ihr einen Arbeitsauftrag über den Schulmanager erhalten haben, auf den ihr bis spätestens 08:15 Uhr antwortet. Das dient zunächst als Anwesenheitskontrolle. Erhalte ich keine Rückmeldung von euch, melde ich euch im Sekretariat als fehlend (was vermutlich dazu führt, dass eure Eltern informiert werden). | |||
* Ihr arbeitet bis 09:00 Uhr alleine an diesem Arbeitsauftrag<br> | |||
* Dann starte ich eine BBB-Konferenz und wir besprechen, was ihr hier geschafft habt. | |||
Für diesen Arbeitsauftrag benötigt ihr euer Buch und einen Zettel mit Stift. | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung von letzter Stunde'''</span> | |||
|Inhalt= | |||
In der letzten Stunde habt ihr die Stoffklasse der Alkohole kennengelernt. Überlegt noch einmal, welches Strukturmerkmal bei allen Stoffen dieser Klasse gleich ist! | |||
{{Lösung versteckt| | |||
Alkohole besitzen eine Hydroxygruppe: -OH | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Diese funktionelle Gruppe im Molekül hat Auswirkungen auf die physikalischen Eigenschaften. Vergleicht die beiden Stoffe Propan-1-ol und Butan hinsichtlich ihrer Siedepunkte und begründet die Unterschiede so genau wie möglich! - Ihr müsst die Lösung zu dieser Aufgabe nicht ausführlich hinschreiben, aber notiert Stichpunkte, die ihr in einer Schulaufgaben-Situation genauer ausführen würdet. Eine solche Aufgabe könnte in einer schriftlichen Arbeit - je nachdem in welchem Zusammenhang sie gestellt wird - 10 BE oder mehr wert sein. | |||
{{Lösung versteckt| | |||
* Propan-1-ol hat den deutlich höheren Sdp. | |||
* Um einen Stoff zum Sieden zu bringen, müssen die Teilchen (hier: Moleküle) eines Stoffes voneinander getrennt werden | |||
* Je höher die Siedetemp. desto mehr Energie muss man anscheinend aufwenden, um die Moleküle voneinander zu trennen. Umso größer müssen offensichtlich die '''Zwischenmolekularen Anziehungskräfte''' sein. | |||
* Beim Butan wirken als Zwischenmolekularen Kräfte nur die schwachen '''Van-der-Waals-Kräfte''': Aufgrund von Fluktuationen in der Elektronenhülle kommt es zu '''spontanen Dipolen''' (mit geringen Partialladungen), die im Nachbarmolekül '''induzierte Dipole''' erzeugen. Die Stärke der Van-der-Waals-Kräfte hängt von der Größe bzw. der Masse des Moleküls ab. | |||
* Beim Propan-1-ol wirken zwei weitere (starke bis sehr starke) Zwischenmolekulare Anziehungskräfte. Zum einen stellt die Hydroxy-Gruppe aufgrund der großen '''Elektronegativitätsdifferenz''' zwischen den C- und O- bzw. den H- und O-Atomen einen '''permanenten Dipol''' mit relativ starken '''Partialladungen '''dar. Hier ziehen sich die Moleküle stark an. | |||
* Zum anderen ist das Molekül in der Lage '''Wasserstoffbrückenbindungen''' auszubilden: Sehr starke Anziehungskräfte zwischen Wasserstoffatomen, die an ein stark elektronegatives Element gebunden sind (hier der Fall: Das H-Atom der Hydroxygruppe) und den freien Elektronenpaaren von stark elektronegativen Element der 2. Periode (hier der Fall: Das O-Atom der Hydroxy-Gruppe) | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Ihr könnt hier einen Hefteintrag zu der letzten Einheit herunterladen, den ihr entweder abschreibt oder ausdruckt und in euer Heft klebt: [[Spezial:FilePath/18_Alkohole1_Sdp_Lslchkt.pdf| pdf-Datei]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Neu: Benennung von Alkoholen'''</span> | |||
|Inhalt= | |||
Die Benennung von Alkoholen ist relativ simpel. Lest daher zunächst die S. 81 in eurem Buch und bearbeitet dann die Aufgaben 1 - 3! (Den kleinen Absatz links unten "Abgrenzung zwischen Stellung und Wertigkeit" lasst ihr bitte weg.)<br> | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:2Methylhexan14diol.jpg]] | |||
|Lösung 1a|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:23Dimethylbut2en1ol.jpg]] | |||
|Lösung 1b|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:4IsomereButanol.jpg]] | |||
|Lösung 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
3-Methylpentan-2,3,4-triol | |||
|Lösung 3|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
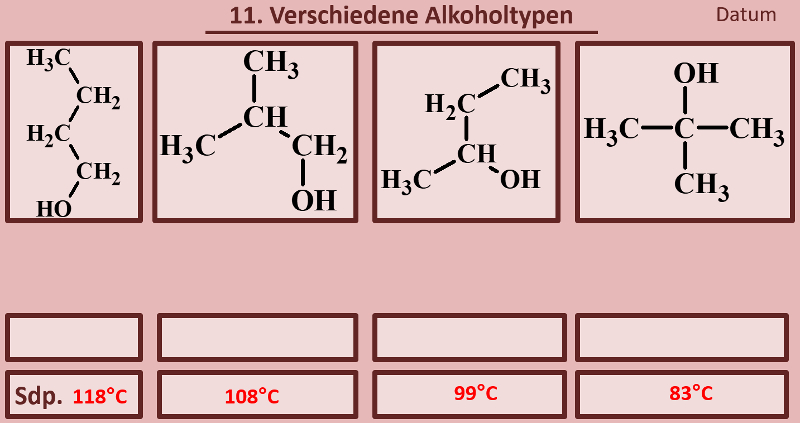
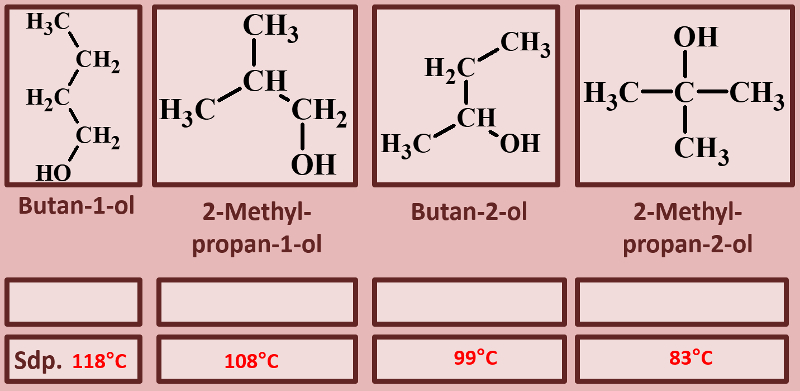
|Titel=<span style="color:#607">'''Es gibt verschiedene Alkohol-Typen'''</span> | |||
|Inhalt= | |||
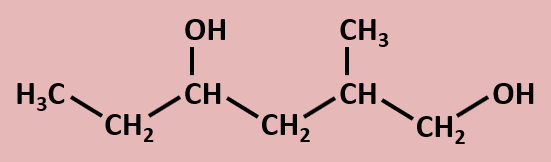
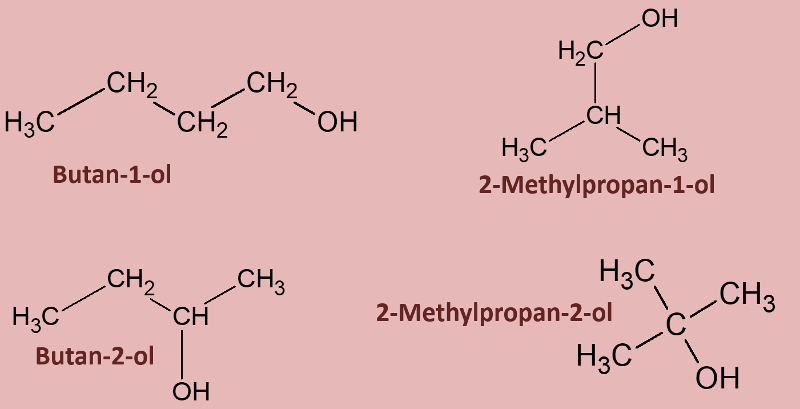
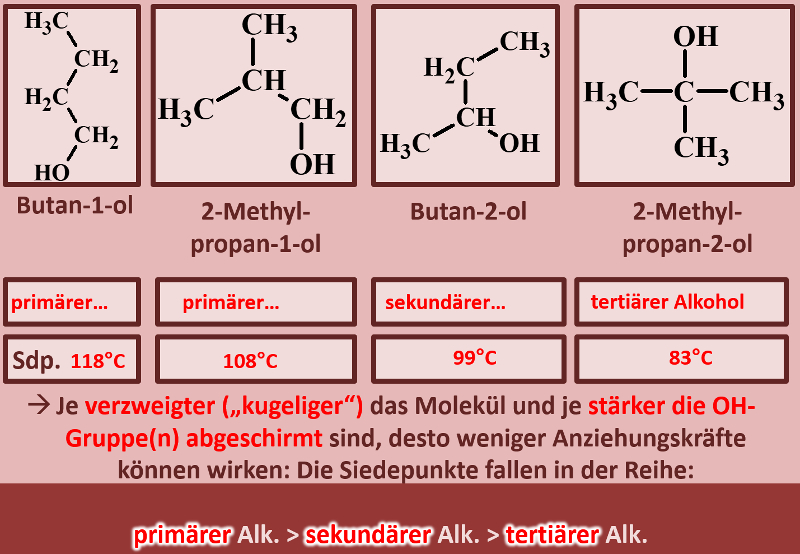
Betrachtet die folgenden Alkohole und deren Siedepunkte. Benennt zunächst die Alkohole! Stellt dann eine Hypothese auf, welche die unterschiedlichen Siedepunkte erklären könnte! Die Masse aller vier Alkohole ist gleich, außerdem sind es Konstitutionsisomere (gleiche Bausteine nur anders zusammengesetzt), daher ist es (bei eurem aktuellen Wissensstand) evtl. verwunderlich, warum sich die Siedepunkte überhaupt unterscheiden.<br> | |||
[[Datei:divAlkTypen_primsekter.jpg]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:divAlkTypen_primsekter_ML_Benennung.jpg]] | |||
|Benennung überprüfen|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Warum Butan-1-ol den höchsten Siedepunkt im Vergleich zu den anderen hat solltet ihr bereits erklären können, wenn nicht, lest jetzt im Buch auf der Seite 36 den Abschnitt "Unterscheide beruhen auf Gemeinsamkeiten". | |||
{{Lösung versteckt| | |||
Butan-1-ol ist ein langgestrecktes Molekül. Dadurch entstehen große Kontaktflächen zwischen den Molekülen und das vergrößert die Van-der-Waals-Kräfte. Die anderen Alkohole sind verzweigt und damit "kugeliger", die Oberfläche wird also kleiner und die Van-der-Waals-Kräfte schwächer. Das führt zu geringeren Anziehungskräften zwischen den Molekülen und damit zu geringeren Siedepunkten. | |||
|Hab´s gelesen, weiß Bescheid|Lösung ausblenden}}<br> | |||
|Tipp 1 anzeigen|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Damit die Stelle des Moleküls, an denen ein permanenter Dipol vorliegt (also die OH-Gruppe) gut mit anderen OH-Gruppen wechselwirken kann, sollte sie möglichst "frei in der Gegend herum baumeln" oder "von allen Seiten zugänglich sein". Vergleicht unter diesem Gesichtspunkt die Situation bei den vier Molekülen! | |||
{{Lösung versteckt| | |||
Bei den verzweigten Alkoholen wird die OH-Gruppe teilweise von angrenzenden Methylgruppen abgeschirmt. Andere Moleküle können sich ihr also nicht so gut nähern. Daher funktioniert auch die Anziehung nicht so gut und die Siedepunkte fallen. | |||
|Ahhh! Verstehe|Lösung ausblenden}}<br> | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
Noch ein Punkt: Je nachdem mit wie vielen C-Atomen das C-Atom, an dem die OH-Gruppe hängt, verbunden ist, spricht man von primären, sekundären oder tertiären Alkoholen. Ordne diese Begriffe den vier abgebildeten Molekülen zu und formuliere eine Aussage, in der ein Zusammenhang dieser Begriffe mit dem Siedepunkt hergestellt wird! | |||
{{Lösung versteckt| | |||
[[Datei:divAlkTypen_primsekter_ML_Ben_u_Rest.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
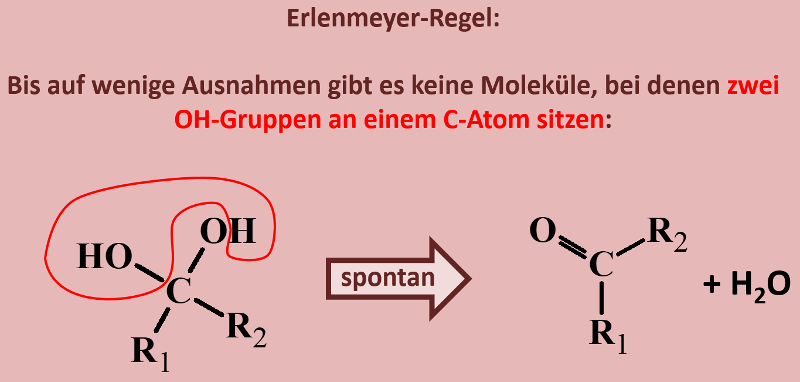
|Titel=<span style="color:#607">'''Die Erlenmeyer-Regel'''</span> | |||
|Inhalt= | |||
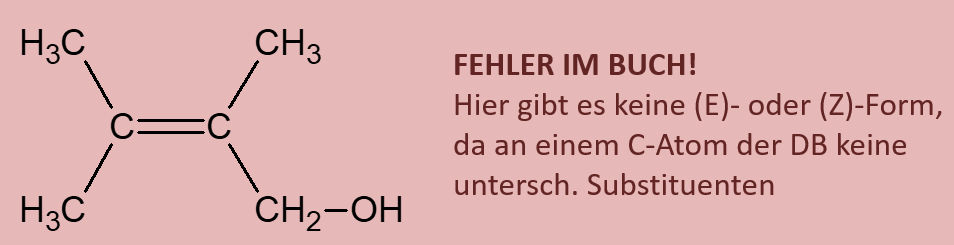
Ihr habt beim Einüben der Benennung von Alkoholen bereits gesehen, dass es Moleküle gibt, die mehr als eine Hydroxy-Gruppe enthalten. Was jedoch so gut wie nie vorkommt, sind Moleküle, bei denen zwei Hydroxygruppen an einem C-Atom hängen. Das folgende Bild stellt beispielhaft dar, was mit solchen Molekülen spontan passieren würde. Beschreibe das Bild mit eigenen Worten! (Und zwar wirklich, nicht nur in Gedanken. Sprich es laut aus!)<br> | |||
[[Datei:ErlenmeyerRegel.jpg]]<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich einen schönen, deutschen Satz auf dem Papier stehen? | |||
{{Lösung versteckt| | |||
Unter Abspaltung von Wasser reagiert das Molekül zu einer Verbindung, die anstelle von zwei Hydroxy-Gruppen nun eine Doppelbindung zu einem O-Atom aufweist. | |||
|Ja, selbstvertändlich!|Lösung ausblenden}}<br> | |||
|Lösung anzeigen|Lösung ausblenden}}<br> | |||
<br> | |||
Dieses Phänomen ist unter dem Namen Erlenmeyer-Regel bekannt. Ihr kennt den Namen sicher von dem Glasgefäß "Erlenmeyerkolben".<br> | |||
[[Datei:E._Erlenmeyer_ca_1863.jpg|400px]]<br> | |||
<br> | |||
'''Freiwillig''': Lest den Wikipedia-Eintrag über Emil Erlenmeyer: [[https://de.wikipedia.org/wiki/Emil_Erlenmeyer| Hier klicken]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Verwendungsmöglichkeiten von Alkoholen'''</span> | |||
|Inhalt= | |||
Aufgrund der polaren Hydroxygruppe eignen sich Alkohole für viele Dinge, für die Alkane nicht brauchbar sind. Lest im Buch die S. 78 - 79 und notiert euch zu jeder fett gedruckten Überschrift einen Satz, der die dort beschriebenen Inhalte zusammenfasst. Solltet ihr das vor 09:00 Uhr geschafft haben, habt ihr kurz Pause. Um 09:00 Uhr wählt euch bitte in die Videokonferenz ein über den Link, den ich euch im Schulmanager geschickt habe. | |||
<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Hefteintrag und Hausaufgabe'''</span> | |||
|Inhalt= | |||
* Der zu dieser Einheit passende Hefteintrag kann hier heruntergeladen werden: [[Spezial:FilePath/18_Alkohole1_Sdp_Lslchkt.pdf| pdf-Datei]]. Bitte abschreiben oder ausdrucken und ins Heft kleben. | |||
* Lest bis morgen im Buch zur Wiederholung die S. 80, 82 und neu: S. 84 | |||
<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Montag, 18.01. === | |||
Hallo 9a! <br> | |||
In der heutigen Einheit sollt ihr eine weitere Einteilungsmöglichkeit von chemischen Reaktionen kennenlernen und im Anschluss die neuen Begriff anhand einiger Beispiele einüben. Am Freitag würde ich gerne eine Videokonferenz mit euch durchführen, um die letzten drei Einheiten mit euch live zu besprechen.<br> | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Drei Grundtypen chemischer Reaktionen'''</span> | |||
|Inhalt= | |||
Im folgenden Video (3:28min) werden drei Grundtypen chemischer Reaktionen theoretisch vorgestellt. Prägt euch die Begriffe ein, im Anschluss sollt ihr sie anwenden! <br> | |||
{{#ev:youtube|WSVnJPBwpek}}<br> | |||
<br> | |||
'''Aufgaben:''' Stellt für die folgenden Reaktionen die chemische Gleichung auf. Gebt an, ob es sich um eine Synthese, Analyse oder Umsetzung handelt und entscheidet, ob es eine exotherme oder endotherme Reaktion ist!<br> | |||
<br> | |||
* Eisenpulver und Schwefelpulver wird vermischt. Man taucht einen glühenden Nagel kurz in das Gemisch und es beginnt eine starke Reaktion. Nach und nach glüht das gesamte Gemisch auf. Am Ende liegt der Stoff Pyrit (FeS<sub>2</sub>) vor. | |||
{{Lösung versteckt| | |||
* '''Chemische Gleichung''': Fe + 2 S --> FeS<sub>2</sub> | |||
* '''Grundtyp''': Synthese. Begründung: Aus '''mehreren Edukten''' wird '''ein Produkt''' | |||
* '''Energiebeteiligung''': Exotherm. Begründung: Man muss nur am Anfang kurz den glühenden Eisennagel ins Gemisch tauchen. Danach läuft die Reaktion von alleine ab und setzt die ganze Zeit Energie frei. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
* Quecksilberoxid (HgO) wird in einem Reagenzglas mit dem Bunsenbrenner stark erhitzt. Solange sich das RG in der BB-Flamme befindet, strömt Sauerstoff aus dem RG und es bilden sich am Rand kleine Quecksilbertröpfchen | |||
{{Lösung versteckt| | |||
* '''Chemische Gleichung''': 2 HgO --> 2 Hg + O<sub>2</sub><br> | |||
* '''Grundtyp''': Analyse. Begründung: Aus '''einem Edukt''' werden '''mehrere Produkte''' | |||
* '''Energiebeteiligung''': Endotherm. Begründung: Nur solange man Energie zuführt, also sich das RG in der BB-Flamme befindet, läuft die Reaktion ab. Man muss also permanent Energie zuführen. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
* In einem RG befinden sich Wasser und ein Stück Magnesium-Band. Am oberen Ende ist das RG mit einem Stopfen verschlossen, in dem ein dünnes Glasrohr steckt. Das Wasser im RG wird vorsichtig erhitzt, so dass es verdampft und alle anderen Gase aus dem RG verbrennt. Es liegt also ein Stück Magensiumband in gasförmigem Wasser vor. Entzünden man das Magnesiumband dann an einer Stelle, reagiert es mit dem Wasser. Sobald die Reaktion gestartet ist, reagiert das gesamte Magnesiumband nach und nach auf der gesamten Länge unter Freisetzung großer Mengen von Licht und Wärme. Nach der Reaktion bleibt der der Stoff Magnesiumoxid (MgO) im RG übrig und während der Reaktion kann man zeigen, dass aus dem dünnen Glasrohr im Stopfen Wasserstoff entweicht. | |||
{{Lösung versteckt| | |||
* '''Chemische Gleichung''': Mg + H<sub>2</sub>O --> MgO + H<sub>2</sub><br> | |||
* '''Grundtyp''': Umsetzung. Begründung: Aus '''mehreren Edukten''' werden '''mehrere Produkte''' | |||
* '''Energiebeteiligung''': Exotherm. Begründung: Man muss die Reaktion nur einmal kurz starten. Danach läuft die Reaktion von alleine ab und setzt die ganze Zeit Energie frei. | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Nachdem nicht klar ist, wann jemals wieder normaler Unterricht stattfindet, hier ein paar Videos, in denen ihr die chemischen Reaktionen dieser Einheit sehen könnt: <br> | |||
Ein relativ ausführliches Video zur Synthese von Eisensulfid (Pyrit):<br> | |||
{{#ev:youtube|8c01I9Pq0is}}<br> | |||
<br> | |||
Die Thermolyse von Quecksilberoxid:<br> | |||
{{#ev:youtube|8jnLKkagFjw}}<br> | |||
<br> | |||
Die Umsetzung von Magnesium in Wasserdampf (mit lustiger Musik... YEAH!): | |||
{{#ev:youtube|IQ8Tx0gWM1E|||||start=0&end=115}}<br> | |||
<br> | |||
'''Hausaufgabe (könnt ihr auch sofort erledigen):'''<br> | |||
* Ladet den Hefteintrag herunter. Schreibt ihn bitte entweder ab oder druckt ihn aus und klebt ihn in euer Heft: [[Spezial:FilePath/C9SG_012_SynAnaUms_Hefteintrag.pdf| pdf-Datei]] | |||
* Lest im Buch, S. 34 | |||
* Sucht das Arbeitsblatt heraus, auf dem wir das Aufstellen chemischer Gleichungen geübt haben. Falls ihr es nicht findet, kann es hier noch einmal heruntergeladen werden: [[Spezial:FilePath/C9SG_010_Ausgleichen_AB.pdf| pdf-Datei]]. Entscheidet, ob es sich bei den Reaktionen 1, 3, 5 und 7 auf der Vorderseite (links) und den Reaktionen 3, 8 und 10 auf der Rückseite (rechts) um eine Synthese, Analyse oder Umsetzung handelt. Falls die Beschreibung es zulässt, könnt ihr auch angeben, ob es eine exo- oder endotherme Reaktion ist und wenn ihr die chemische Gleichung noch nicht aufgestellt habt, dann holt das bitte nach!<br> | |||
<br> | |||
Wir hören uns am Freitag, Link zur Konferenz kommt über den Schulmanager!<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Montag, 18.01. === | |||
In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten Einheiten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:<br> | |||
<br> | |||
''"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."''<br> | |||
<br> | |||
Bis dahin müssen jedoch noch einige Dinge geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an. Ihr benötigt für diese Einheit einen Stift, Zettel und euer Buch!<br> | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung: Die Bestimmung der absoluten Atommasse'''</span> | |||
|Inhalt= | |||
Ihr solltet in der letzten Einheit bemerkt haben, dass die "frühen Chemiker" sehr daran interessiert waren, die Masse von einzelnen Atomen zu bestimmen. Diese Atommasse spielt eine wichtige Rolle bei der Berechnung von Mengeneinheiten, um chemische Reaktionen vollständig durchführen zu können. Nachdem es keine Waage gab, mit der man so kleine Massen bestimmen konnte, behalf man sich mit einer willkürlichen Größe: Die '''atomare Masseneinheit''' '''''u''''' wurde eingeführt. Man wusste zwar nicht, wie viel Gramm ein Teilchen wog, welches 1'''''u''''' schwer war, aber man konnte bestimmen wie viel '''''u''''' z.B. ein Sauerstoffatom und wie viel '''''u''''' ein Wasserstoffatom wog. So konnte man die Atome von unterschiedlichen Elementen vergleichen.<br> | |||
Mit Hilfe von Massenspektrometern gelang es irgendwann, für die '''atomare Masseneinheit''' '''''u''''' einen Wert in Gramm zu bestimmen, es gilt:<br> | |||
<br> | |||
1u = 1,66 x 10<sup>-24</sup>g <br> | |||
<br> | |||
Damit lassen sich nun schon ein paar einfache Aufgaben rechnen. Um zu unterscheiden, ob man von der '''Masse''' eines Teilchens in '''''g''''' oder der '''atomaren Masseneinheit''' in '''''u''''' spricht, gibt es die zwei Variablen '''m(X)''' für die "normale" '''Masse '''und '''m<sub>a</sub>(X)''' für die '''atomare Masseneinheit'''. X steht dabei für die Teilchen, das man betrachtet. Die folgenden Ausdrücke bedeuten dann folgendes:<br> | |||
<br> | |||
m(O-Atom) = 2,658 x 10<sup>-23</sup>g. | |||
{{Lösung versteckt| | |||
Die Masse eines Sauerstoffatoms beträgt zwei Komma sechs fünf acht mal zehn hoch minus dreiundzwanzig Gramm. | |||
|spricht man|Lösung ausblenden}}<br> | |||
<br> | |||
m<sub>a</sub>(C-Atom) = 12,0u | |||
{{Lösung versteckt| | |||
Die Masse eines Kohlenstoffatoms beträgt zwölf Komma Null u. | |||
|spricht man|Lösung ausblenden}}<br> | |||
<br> | |||
'''Test''':<br> | |||
Schreibe als mathematische Gleichung: Misst man die Masse eines Bor-Atoms in atomaren Masseneinheiten, so erhält man 10,811u. | |||
{{Lösung versteckt| | |||
[[Datei:ma_Bor.jpg]]<br> | |||
|Lösung|Lösung ausblenden}}<br> | |||
Schreibe als mathematische Gleichung: Die Masse eines Sauerstoff-Moleküls (!) beträgt 5,313 x 10<sup>-23</sup> Gramm | |||
{{Lösung versteckt| | |||
[[Datei:m_O2.jpg]]<br> | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Mit Hilfe des oben beschriebenen Zusammenhangs zwischen der '''Masse in ''g''''' und der '''atomaren Masseneinheit in ''u''''' lassen sich die beiden Größen auch leicht ineinander umwandeln: <br> | |||
<br> | |||
[[Datei:Umrechnung_ma_m.jpg]]<br> | |||
<br> | |||
Berechne die Masse eines Sauerstoffmoleküls in '''''u'''''! (Die Masse in Gramm ist oben bereits angegeben) | |||
{{Lösung versteckt| | |||
[[Datei:ma_Ber_O2.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Nachdem ein unbekannter Stoff X im Massenspektrometer untersucht wurde, konnte die Masse eines Teilchens dieses Stoffes auf 4,79 x 10<sup>-22</sup>g bestimmt werden. Rechne diesen Wert in atomare Masseneinheiten um! | |||
{{Lösung versteckt| | |||
[[Datei:ma_Ber_StoffX.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Man sollte meinen, nachdem man jetzt die atomare Masseneinheit auch in Gramm bestimmen kann, ist die Angabe in '''''u''''' doch nicht mehr nötig. Es war doch nur eine Hilfsgröße, solange man das Gewicht von Atomen noch nicht direkt bestimmen konnte. Die Einheit hat sich aber gehalten, denn sie ist (unter anderem) in folgendem Punkt ganz praktisch: Sie lässt sich einfacher schreiben! Nehmt an, ihr habt ein Molekül "XYZ", für das gilt: m<sub>a</sub>(XYZ) = 212,3u und m(XYZ) = 3,5 x 10<sup>-24</sup>g. <br> | |||
Versucht beide Angaben in einem Word-Dokument zu schreiben! Das geht mit der atomaren Masseneinheit sehr leicht, mit der "normalen" Masse tut man sich deutlich schwerer. Dieses "Zehn hoch irgendwas" ist einfach umständlich.<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
<br><br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Molekül- und Formelmassen'''</span> | |||
|Inhalt= | |||
Wenn ihr eure Hausaufgabe gemacht habt und das Buch auf den Seiten 34 - 35 gelesen habt, dann wisst ihr schon, dass man die Masse von Molekülen oder die Formelmasse von Salzen, gemessen in der atomaren Masseneinheit '''''u''''', ganz einfach bestimmen kann, indem man die Masseneinheiten der einzelnen Atome, die am Aufbau des Moleküls oder der Formelmasse beteiligt sind, zusammenzählt. Bsp.: Möchte man die Masse eines Schwefelsäure-Moleküls (H<sub>2</sub>SO<sub>4</sub>) wissen (in '''''u'''''), dann addiert man einfach die Masseneinheiten der am Aufbau beteiligten Atome, also: 2 x m<sub>a</sub>(H) + m<sub>a</sub>(S) + 4 x m<sub>a</sub>(O). <br> | |||
[[Datei:ma_H2SO4_Berechnung.jpg]]<br> | |||
<br> | |||
Das leuchtet vermutlich den meisten ein, aber die große Frage ist doch: Woher weiß man die Werte für die einzelnen Atome? - Sie stehen im Periodensystem! Nehmt das Periodensystem im Buch auf der letzten Seite zur Hand. Ihr erkennt im oberen weißen Feld "Erklärungen", dass die Zahl links oberhalb des Elementsymbols die Atommasse in '''''u''''' angibt.<br> | |||
Berechnet nun mit Hilfe des PSEs die Molekülmassen (in '''''u''''') von: <br> | |||
* Adrenalin (ein Hormon, welches euer Körper in stressigen Situationen ausschüttet), chem. Formel: C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub> | |||
* Koffein (ein Stoff in Kaffee oder Cola, der anregend wirkt), chem. Formel: C<sub>8</sub>H<sub>10</sub>N<sub>4</sub>O<sub>2</sub> | |||
* Indigo (ein Stoff zum Färben von Jeans), chem. Formel: C<sub>16</sub>H<sub>10</sub>N<sub>2</sub>O<sub>2</sub> | |||
{{Lösung versteckt| | |||
Adrenalin C<sub>9</sub>H<sub>13</sub>NO<sub>3</sub>: <br> | |||
[[Datei:ma_Ber_Adrenalin.jpg]]<br> | |||
Solltet ihr das nicht richtig haben, dann überprüft genau, wo der Fehler lag und rechnet die anderen beiden Stoffe noch einmal nach! | |||
{{Lösung versteckt| | |||
Koffein C<sub>8</sub>H<sub>10</sub>N<sub>4</sub>O<sub>2</sub>: <br> | |||
Indigo C<sub>16</sub>H<sub>10</sub>N<sub>2</sub>O<sub>2</sub>: <br> | |||
[[Datei:ma_Ber_KoffeinIndigo.jpg]]<br> | |||
|Hab ich|Lösung ausblenden}} | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Das Mol'''</span> | |||
|Inhalt= | |||
Mit dem nun verfügbaren Atomgewicht könnte man theoretisch schon arbeiten. Betrachten wir noch einmal das Beispiel aus der letzten Einheit. Es ging um die chemische Reaktion: Eisen reagiert mit Schwefel zu Pyrit: <br> | |||
<br> | |||
Fe + 2 S --> FeS<sub>2</sub><br> | |||
<br> | |||
Diese chemische Gleichung sagt aus, dass man doppelt so viele Schwefel-Atome wie Eisenatome braucht, damit alles miteinander reagiert und nichts übrig bleibt. Angenommen ihr habt einen Teelöffel voll Eisenpulver und wollte exakt die Menge Schwefel dazugeben, die nötig ist, um alles vollständig in Pyrit umzuwandeln. Dann könnte man jetzt die Portion Eisen wiegen, mit Hilfe der Atommasse von Eisen ausrechnen, wie viele Atome das sind. Diese Anzahl verdoppeln und dann ausrechnen, welche Masse diese Anzahl an Schwefelatomen hat. Diese Menge könnte man dann abwiegen. Das folgende Bild veranschaulicht den Rechenweg: <br> | |||
[[Datei:FeS2BerechnungohneMol.jpg]]<br> | |||
Das wirkt noch etwas umständlich... <br> | |||
Bei dieser Berechnung tauchen nämlich wieder sehr große, unhandliche Zahlen auf: Die Anzahl der Teilchen. Diese wird in der Chemie mit einem N(X) gekennzeichnet. Also z.B. kann man den Satz: "In meinem Zimmer liegen 3208 Legosteine auf dem Boden mathematisch so formulieren: <br> | |||
<br> | |||
N(Legosteine) = 3208<br> | |||
<br> | |||
Weil Atome so klein sind, befinden sich in den 6,0g Eisen einfach unglaublich viele Atome: Die Anzahl beträgt N(Fe) = 6,47 x 10<sup>22</sup>. Eine Zahl mit dreiundzwanzig Stellen (!), in Worten also ungefähr 600 Trilliarden Atome...<br> | |||
Daher hat man sich etwas einfacheres ausgedacht: Man betrachtet einfach eine sehr große Menge an Teilchen und gibt dieser Anzahl einen bestimmten Namen. Das ist nicht so ungewöhnlich, wie es vielleicht im ersten Moment klingt. Ihr kennt z.B. sicher den Ausdruck "ein Dutzend" für die Anzahl 12. (Wo jetzt genau der Sinn darin liegt zu sagen, "Ich hole beim Bauern ein Dutzend Eier" anstatt "Ich hole beim Bauern zwölf Eier", kann ich euch auch nicht genau sagen. Aber das Phänomen gibt es eben. Fragt mal eure Oma ob sie den Begriff "Schock" noch kennt, für eine Anzahl an z.B. Eiern).<br> | |||
In der Chemie hat man nun den Begriff '''"Mol"''' eingeführt. Das ist die Bezeichnung für eine bestimmte Anzahl an Teilchen, nämlich 6,022 x 10<sup>23</sup>. Man nennt diesen Wert auch Avogadro-Konstante N<sub>A</sub> = 6,022 x 10<sup>23</sup> '''''1/mol'''''<br> | |||
<br> | |||
'''Freiwilliger Test:'''<br> | |||
* Besorgt euch eine Stoppuhr oder ruft die Funktion auf eurem Handy auf! | |||
* Stoppt die Zeit, die ihr benötigt, um zehn mal "Sechs Komma null zwei zwei mal zehn hoch dreiundzwanzig" zu sagen! | |||
* Stoppt die Zeit, die ihr benötigt, um zehn mal "Ein Mol" zu sagen! | |||
Ergebnis? - Seht ihr, die Einheit "Mol" ist eben praktisch. | |||
<br> | |||
Warum jetzt ausgerechnet 6,022 x 10<sup>23</sup>? - Das ist genialer Schachzug der Chemiker gewesen. Diese Zahl wurde deshalb gewählt, weil dann die im PSE angegebene atomare Masseneinheit genau übereinstimmt mit der Masse in '''''g''''', die ein Mol dieser Teilchen wiegt. <br> | |||
Nochmal langsam, zum mitschreiben: Die Zahl, die oben links bei den Elementsymbolen im PSE steht, gibt also nicht nur die Masse eines Atoms dieses Elements in '''''u''''' an, sondern gleichzeitig entspricht dieser Wert der Masse in '''''g''''' von einem Mol dieser Atome. - Wahnsinn! Diese Chemiker..., das sind vielleicht Teufelskerle!<br> | |||
Und jetzt wieder ernst: Diese Größe, also die Masse, die ein Mol eines Stoffes in '''''g''''' wiegt, nennt man '''Molare Masse M(X)'''. Ein Beispiel: "Die molare Masse von Wasser, also diejenige Masse in Gramm, die ein Mol Wassermoleküle wiegen, beträgt 18'''''g/mol'''''." oder in Form einer mathematischen Gleichung: M(H<sub>2</sub>O) = 18'''''g/mol'''''.<br> | |||
Die Variable, um eine Anzahl in Mol zu messen, nennt man '''"Stoffmenge"''', sie wird mit einem kleinen '''n(X)''' gekennzeichnet, die Einheit Mol wird abgekürzt mit '''''mol'''''. Wenn man also sagen möchte: "Ich habe heute 2 Mol Erdbeeren gepflückt, dann kann man das so formulieren: <br> | |||
n(Erdbeeren) = 2mol (Dieser Wert ist völlig unrealistisch. So viele Erdbeeren gibt es auf der ganzen Welt nicht)<br> | |||
<br> | |||
'''Test''':<br> | |||
Wie spricht man die folgende Gleichung aus: n(Sterne im Universum) = 0,1mol (Dieser Wert stimmt ungefähr)? Wie viele Sterne sind das? | |||
{{Lösung versteckt| | |||
* Die Anzahl der Sterne im Universum beträgt Null Komma Ein Mol. | |||
* Das sind 6,022 x 10<sup>22</sup> oder auch 0,602 x 10<sup>23</sup> | |||
|Lösung|Lösung ausblenden}}<br> | |||
Schreibe als mathematische Gleichung: In der Sahara gibt es ungefähr Null Komma eins Mol Sandkörner. | |||
{{Lösung versteckt| | |||
[[Datei:nSand_gleich_01mol.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
'''Einfache Aufgaben'''<br> | |||
* Es liegen 14,007'''''g''''' Stickstoffatome vor. Wie viel Mol sind das? | |||
* Wie viel Gramm wiegen 2 Mol Kohlenstoffatome? | |||
* Im Jahr 2018 wurden grob geschätzt 4 x 10<sup>11</sup> Äpfel auf der ganzen Welt geerntet. Wie viel Mol sind das? | |||
{{Lösung versteckt| | |||
* Der Wert der angegebenen Masse in g entspricht genau dem Wert, der im PSE links über dem Element steht, also ist das genau die Masse eines Mols Stickstoffatome | |||
* Die Zahl links oberhalb des Kohlenstoffs im PSE lautet 12,000. Das ist die Masse in g, die ein Mol wiegen würde. Zwei Mol müssen dann das doppelte wiegen, also 24,0g. | |||
* Als Hilfe: Das ist eine ähnliche Frage, wie man wissen will: "Wie viele Dutzend sind 7 Eier?". Man muss die tatsächliche Anzahl durch diejenige Anzahl teilen, die in einem Dutzende stecken, also 7 geteilt durch 12. Bei dem Beispiel mit den Äpfeln: 4 x 10<sup>11</sup> geteilt durch 6,022 x 10<sup>23</sup>. Ergibt 6,67 x 10<sup>-13</sup>mol. | |||
|Lösung|Lösung ausblenden}}<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Systematische Zusammenfassung'''</span> | |||
|Inhalt= | |||
Die einfachen Berechnungen in den oberen Kästen waren mehr so... "freestyle". Viele von euch werden die Aufgaben relativ problemlos lösen können. Manche brauchen aber vielleicht etwas mehr Struktur. Diesen Personen empfehle ich das Buch (S. 35 - 38), die Hefteinträge (s. u.) und ganz knapp zusammengefasst die folgende Übersicht, die die bisher besprochenen Größen und ein paar Gleichungen zum Umrechnen enthält: <br> | |||
[[Datei:Übersicht_Größen1.jpg]]<br> | |||
<br> | |||
'''Hausaufgabe''': | |||
Auch wenn ihr zu der Gruppe gehört, die glaubt, bereits alles verstanden zu haben, lest ihr bitte als Hausaufgabe im Buch die folgenden Absätze und die Hefteinträge. Die Datei mit den Hefteinträgen haltet ihr bitte morgen Nachmittag bereit (z.B. geöffnet in einem Fenster auf dem PC, an dem ihr arbeitet). Wir machen eine Videokonferenz, besprechen noch einmal alles und lösen dann die in der pdf-Datei enthaltenen Aufgaben! | |||
* Die Teilchenzahl (S. 36) | |||
* Die Stoffmenge (S. 36-37) | |||
* Teilchenzahl und Stoffmenge (S. 37) | |||
* Teilchenzahl und Masse (S. 37) | |||
* Molare Masse und molares Volumen (S. 38) | |||
* Die molare Masse (S. 38) | |||
* '''Hefteinträge''' zu dieser und letzter Stunde (Punkt 4 wurde noch nicht besprochen): [[Spezial:FilePath/C9_Quanti1_Hefteintrag_inkl_Aufg.pdf| pdf-Datei]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Donnerstag, 14.01. Chemie=== | |||
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:<br> | |||
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.<br> | |||
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten. | |||
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag! | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholungsaufgaben zu den verschiedenen Bindungstypen'''</span> | |||
|Inhalt= | |||
'''Aufgaben:'''<br> | |||
* '''Salze 1''' | |||
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen | |||
{{Lösung versteckt| | |||
* Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff. | |||
* Leite daraus ab, welche Ionen diese Stoffe bilden werden | |||
{{Lösung versteckt| | |||
Na --> Na<sup>+</sup> + e<sup>-</sup> <br> | |||
O + 2e<sup>-</sup> --> O<sup>2-</sup> <br> | |||
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt) | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 1|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden? | |||
* Wie formuliert man das als chemische Formel? | |||
{{Lösung versteckt| | |||
2 Na<sup>+</sup> und 1 O<sup>2-</sup> Teilchen ergeben insgesamt die chemische Formel Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört! | |||
* Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte! | |||
{{Lösung versteckt| | |||
4 Na + O<sup>2-</sup> --> 2Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 3|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Salze 2''' | |||
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere! | |||
{{Lösung versteckt| | |||
Eine gute Begründung enthält folgende Aspekte: | |||
* Man erklärt zunächst, was "Sieden überhaupt bedeutet"! | |||
{{Lösung versteckt| | |||
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden. | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt! | |||
{{Lösung versteckt| | |||
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
* Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen! | |||
{{Lösung versteckt| | |||
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.<br> | |||
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst. | |||
|Teillösung 3|Lösung ausblenden}}<br> | |||
|Lösungsschema|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Moleküle''' | |||
Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
* '''Metalle ''' | |||
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind! | |||
{{Lösung versteckt| | |||
* Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben. | |||
{{Lösung versteckt| | |||
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:<br> | |||
[[Datei:Metallgitter_animiert_1.gif]] | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her! | |||
{{Lösung versteckt| | |||
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}} | |||
Fertig für heute. Wenn ihr Schwierigkeiten bei diesen Aufgaben hattet, findet ihr Überblicksseiten zu den Stoffklassen in eurem Buch Galvani - Chemie S1 auf den S. 102-103, 120-121 und 132,133 | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Freitag, 15.01. Chemie=== | |||
Bitte bearbeitet die folgende Einheit am besten in der eigentlichen Unterrichtszeit von 08:45 - 09:30 Uhr. Ihr benötigt das Arbeitsblatt, welches ihr vor den Ferien erhalten habt und auf dem die Vorderseite bereits ausgefüllt ist. Solltet ihr das AB nicht mehr finden, könnt ihr es hier noch einmal herunterladen:<br> | |||
[[Spezial:FilePath/C9SG_ExoEndo_AB.pdf| pdf-Datei]] | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Energiebeteiligung bei chemischen Reaktionen'''</span> | |||
|Inhalt= | |||
Schaut bitte zunächst das folgende Video. Es enthält eine Zusammenfassung der letzten Einheit und erklärt einen neuen Aspekt. Während des Videos solltet ihr auch das AB auf der Rückseite ausfüllen. Nach dem Video bearbeitet bitte die Aufgaben darunter. Lasst euch die Lösung erst anzeigen, wenn ihr tatsächlich eine gefunden habt! | |||
<br> | |||
{{#ev:youtube|tGU3tXrnq5k}} | |||
<br> | |||
'''Aufgaben:'''<br> | |||
Startet man ein Auto, so wird durch das Umdrehen des Schlüssels etwas Energie aus der Batterie in einen elektrischen Funken im Motor umgewandelt, der vergastes Benzin entzünden. Dabei reagiert das Benzin mit Sauerstoff. Wenn der Motor läuft, könnte man die Batterie auch entfernen.<br> | |||
* Erkläre, ob es sich bei der Verbrennung von Benzin im Motor eines Autos um einen exothermen oder endothermen Vorgang handelt! | |||
* Zeichne ein Energie-Reaktionsverlaufs-Diagramm, in dem die wichtigen Begriffe aus dem Text der Grafik richtig zugeordnet sind! | |||
<br> | |||
{{Lösung versteckt| | |||
Es muss sich um eine exotherme Reaktion handeln. Sie muss nur einmal kurz durch Zufuhr von Aktivierungsenergie gestartet werden. Danach wird ständig Energie (in Form von Wärme oder auch Bewegungsenergie) frei. | |||
|Erklärung|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ExoEndo_ExoDiagramm_BenzMotor_ML.jpg]] | |||
|Grafik|Lösung ausblenden}}<br> | |||
<br> | |||
Pflanzen können mit Hilfe von Sonnenlicht aus Kohlenstoffdioxid und Wasser die Stoffe Glukose und Sauerstoff herstellen. Bei manchen Unterwasserpflanzen kann man den entstehenden Sauerstoff sehr schön sehen, da er in Form von Gasbläschen aufsteigt. Das funktioniert allerdings nur solange, wie die Unterwasserpflanze mit Licht bestrahlt wird. Verdunkelt man die Pflanze entstehen auch keine Gasblasen mehr.<br> | |||
* Erkläre, ob es sich bei der Verbrennung von Benzin im Motor eines Autos um einen exothermen oder endothermen Vorgang handelt! | |||
* Zeichne ein Energie-Reaktionsverlaufs-Diagramm, in dem die wichtigen Begriffe aus dem Text der Grafik richtig zugeordnet sind! | |||
<br> | |||
{{Lösung versteckt| | |||
Es muss sich um eine endotherme Reaktion handeln. Nur solange die Pflanze von Licht (Energie) getroffen wird, entstehen die Produkte (zu sehen am aufsteigenden Sauerstoff) | |||
|Erklärung|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
[[Datei:ExoEndo_ExoDiagramm_FotoSyn_ML.jpg]] | |||
|Grafik|Lösung ausblenden}}<br> | |||
<br> | |||
Als Hausaufgabe lest ihr bitte die Seiten 136 - 137 im Buch und bearbeitet die Aufgabe 3 auf der Seite 137: Findet sowohl drei weitere Beispiele für exotherme als auch drei Beispiele für endotherme Reaktionen! Ihr erhaltet um 10:30 Uhr einen Arbeitsauftrag im Schulmanager. Dort gebt ihr bitte eure Vorschläge ab! | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Donnerstag, 14.01. Chemie=== | |||
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:<br> | |||
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.<br> | |||
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten. | |||
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag! | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholungsaufgaben zu den verschiedenen Bindungstypen'''</span> | |||
|Inhalt= | |||
'''Aufgaben:'''<br> | |||
* '''Salze 1''' | |||
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen | |||
{{Lösung versteckt| | |||
* Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff. | |||
* Leite daraus ab, welche Ionen diese Stoffe bilden werden | |||
{{Lösung versteckt| | |||
Na --> Na<sup>+</sup> + e<sup>-</sup> <br> | |||
O + 2e<sup>-</sup> --> O<sup>2-</sup> <br> | |||
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt) | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 1|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden? | |||
* Wie formuliert man das als chemische Formel? | |||
{{Lösung versteckt| | |||
2 Na<sup>+</sup> und 1 O<sup>2-</sup> Teilchen ergeben insgesamt die chemische Formel Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört! | |||
* Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte! | |||
{{Lösung versteckt| | |||
4 Na + O<sup>2-</sup> --> 2Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 3|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Salze 2''' | |||
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere! | |||
{{Lösung versteckt| | |||
Eine gute Begründung enthält folgende Aspekte: | |||
* Man erklärt zunächst, was "Sieden überhaupt bedeutet"! | |||
{{Lösung versteckt| | |||
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden. | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt! | |||
{{Lösung versteckt| | |||
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
* Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen! | |||
{{Lösung versteckt| | |||
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.<br> | |||
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst. | |||
|Teillösung 3|Lösung ausblenden}}<br> | |||
|Lösungsschema|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Moleküle''' | |||
Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
* '''Metalle ''' | |||
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind! | |||
{{Lösung versteckt| | |||
* Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben. | |||
{{Lösung versteckt| | |||
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:<br> | |||
[[Datei:Metallgitter_animiert_1.gif]] | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her! | |||
{{Lösung versteckt| | |||
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}} | |||
Fertig für heute. Wenn ihr Schwierigkeiten bei diesen Aufgaben hattet, findet ihr Überblicksseiten zu den Stoffklassen in eurem Buch Galvani - Chemie S1 auf den S. 102-103, 120-121 und 132,133 | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Donnerstag, 14.01. Bio === | === Distanzunterricht Donnerstag, 14.01. Bio === | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Ökologie'''</span> | ||
|Inhalt= | |Inhalt= | ||
In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.<br> | In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.<br> | ||
| Zeile 14: | Zeile 1.415: | ||
<br> | <br> | ||
'''Aufgaben:'''<br> | '''Aufgaben:'''<br> | ||
Klickt zunächst auf folgenden Link. Ihr gelangt zu einer Seite, die "Eco-Spheres" verkauft. Ein angeblich ursprünglich von der NASA entwickeltes "Ökosystem" für den Schreibtisch. Lest die Produktinformationen und kehrt dann wieder hierher zurück!<br> | |||
[https://www.ecosphere-europe.com/product-page/kleine-kugel-10cm Zur Eco-Sphere]<br> | |||
<br> | |||
'''Aufgaben: '''<br> | |||
* Wende die soeben gelernten Fachgriffe an und ordnen ihnen die richtigen Objekte aus der Eco-Sphere zu! | |||
* Was an der Eco-Sphere ist Biotop, was Biozönose? | |||
* Welche Organismen sind Produzenten, Konsumenten und Reduzenten? | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
* '''Biotop''': Glasgefäß, Steinchen, Muschel-'''Schalen''' (Das Gefäß enthält keine lebenden Muscheln) Gorgonie, Wasser; '''Biozönose''': grüne Faden- und braune Flächen-Algen, Garnelen, Mikroorganismen | |||
* '''Produzenten''': grüne Faden- und braune Flächen-Algen, '''Konsumenten''': Garnelen, '''Reduzenten''': Mikroorganismen | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
* | |||
Es gibt drei Begriff, die eher aus der Physik stammen und die Wechselwirkung von Systemen mit ihrer Umgebung beschreiben: <br> | |||
* Offene Systeme | |||
Offen bedeutet, dass SOWOHL Energie mit der Umgebung ausgetauscht werden, ALS AUCH Stoffe | |||
* Geschlossene Systeme | |||
Bei geschlossenen System kann zwar Energie mit der Umgebung ausgetauscht werden, allerdings keine Stoffe | |||
* Isolierte Systeme | |||
Isolierte System stehen in überhaupt keinem Austausch mit der Umgebung. | |||
<br> | |||
<br> | |||
Ökosysteme sind in der Regel offene Systeme. Betrachten wir einen See: Ein im See lebender Frosch könnte den See durchaus verlassen und in den angrenzenden Wald hüpfen und dort Kot absetzen. Damit wären Stoffe aus dem See in die Umgebung gelangt. Umgekehrt könnte auch ein Ente von weit her angeflogen können und Fischeier, die an ihrem Gefieder hingen im See hinterlassen. Damit wären Stoffe in den See aus der Umgebung eingetragen worden. <br> | |||
Auch ein Energieaustausch ist möglich: Wenn die Sonne scheint, können die Sonnen strahlen in den See eindringen und ihn aufheizen. Nachts kann diese Wärme z.B. an die Atmosphäre wieder abgegeben werden. <br> | |||
Beurteile begründet, ob die Eco-Sphere tatsächlich ein Öko-System in diesem Sinne ist. | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Ein Energieaustausch ist zwar möglich. Das Glasgefäß lässt ja z.B. Lichtstrahlen ein- und austreten; ein Stoffaustausch ist jedoch mit der Umgebung nicht möglich. Daher ist dieses System geschlossen und unterscheidet sich in diesem Punkt von offenen Ökosystemen in der Natur | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
<br> | |||
<br> | |||
'''Freiwillig:'''<br> | |||
Vor einigen Jahren versuchte man mit einer Art Gewächshaus die Erde nachzuahmen, um zu testen, ob man in einem geschlossenen System (z.B. auf dem Mars) als Mensch länger überleben könnte. Das Projekt hieß "Biosphäre 2". Wer möchte, kann einen 7min. Film dazu schauen: | |||
{{#ev:youtube|qO7NkNJOhAk}}<br> | |||
<br> | |||
'''Hausaufgabe:'''<br> | |||
Lest im Buch S. 62 - 63 | |||
|Farbe= # | <br> | ||
|Farbe= #080 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
<br> | <br> | ||
Aktuelle Version vom 1. Oktober 2022, 07:10 Uhr
Enzympraktikum
Molekulare Grundlagen
Versuche im Unterricht
Weitere Versuche
Nicht alle Versuche des Enzym-Praktikums konnten im Unterricht durchgeführt werden. Das würde den zeitlichen Rahmen sprengen. Das folgende Skript enthält jedoch weitere Versuchsanleitungen und Fotos der Ergebnisse aus vergangenen Jahren.
- Ladet das Skript herunter (bitte nicht ausdrucken, wer es unbedingt physisch haben möchte: Ich werde am Mittwoch einige Exemplare mitbringen)
- Beschreibt zunächst für alle Ergebnisse die Beobachtung (mündlich, nicht schriftlich)
- Versucht dann, die Eregbniss mit eurem Wissen über die Funktionsweise von Enzymen zu erklären (mündlich, nicht schriftlich)
- Eine Verbesserung erfolgt im Unterrich am 05.10.
Hier das Skript zum Download: pdf-Datei
Corona-Sonderregeln
Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/1
Regelungen für Sport
Regelungen für die Seminare
Bildung der Halbjahresleistung (HJL) für den Ausbildungsabschnitt 11/2
Zeitplan
Distanz-Unterricht, Montag 08.03: Q11-Corona-Recap
Distanzunterricht, Montag 01.03.
Distanzunterricht, Montag 15.02.
Zu bearbeiten: Am besten heute.
Zur Bearbeitung benötig ihr das Schulbuch, einen Zettel, Stift, eine Internetverbindung, um Videos zu schauen. Und Ruhe!
Die Bearbeitungszeit sollte unter 90 Minuten liegen.
Die optionalen Inhalte sind nicht in die Bearbeitungszeit mit einberechnet.
Distanzunterricht Montag, 08.02.
Zu bearbeiten: Am besten heute. Ihr könnt gerne zusammen an dieser Einheit arbeiten, indem ihr euch über ein Kommunikations-Tool eurer Wahl Kontakt aufnehmt.
Zur Bearbeitung benötig ihr das Schulbuch, einen Zettel und einen Stift.
Die Bearbeitungszeit wird 90 Minuten sicher nicht überschreiten.
Die optionalen Inhalte sind jedoch nicht in die Bearbeitungszeit mit eingerechnet.
Ende der ersten Stunde. Kurze Pause :) - Die zweite Hälfte wird kürzer.
Distanzunterricht Dienstag, 26.01.
Verbessert gegenseitig eure Hausaufgabe:
- Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
- Besorgt euch einen Rotstift!
- Macht ein Foto von eurer Hausaufgabe (Aufgabe 10 und Aufgabe 12 auf dem AB) und schickt sie an eure Korrekturpartnerin bzw. eurem Korrekturpartner!
- Druckt dann die Lösungen, die ihr jetzt erhalten habt aus (wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
- Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
- Geht zunächst auf dieser Seite Schritt für Schritt die Musterlösung durch und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler!
- Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon)
- Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
- Ihr erhaltet um 13:50 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück!
Distanzunterricht Dienstag, 26.01.
Die folgende Einheit soll auf das chemische Reaktionsverhalten von Alkoholen hinführen. Dazu ist eine Wiederholung von Unterrichtsstoff aus dem letzten Schuljahr nötig: Die Redoxreaktionen. Das folgende Video wiederholt alles, was für die folgenden Stunden wichtig ist. Es ist sehr ausführlich und schreitet langsam voran. Wahrscheinlich werden sich einige von euch langweilen. Aber auch diejenigen unter euch, die letztes Jahr unter Umständen große Probleme beim Aufstellen von Redoxgleichungen hatten: Das Video erklärt wirklich jeden einzelnen Schritt, den man machen muss. Das Video dauert fast 30min. Danach sollt ihr selbst weitere Aufgaben lösen. Dazu benötigt ihr ein Arbeitsblatt, welches ihr am besten schon vor dem Anschauen des Videos ausdruckt oder in einem separaten Fenster öffnet
- Hier gibt es das Arbeitsblatt: pdf-Datei
Distanzunterricht Donnerstag 20.01. Chemie
Mit der folgenden Einheit möchte ich in ein neues Stoffgebiet einsteigen. Schaut das folgende Video (17min.). Dort wird zunächst ein Versuch vorgestellt und die Beobachtung dann erklärt. Am Ende wird euch eine Aufgabe gestellt. Diese Aufgabe erledigt ihr bitte sofort im Anschluss an das Video. Dazu braucht ihr entweder ein Periodensystem oder ihr recherchiert die nötigen Infos direkt im Netz. Eure Lösung schickt ihr bitte in Form eines Fotos als Antwort auf den Arbeitsauftrag, den ich euch morgen um 08:10 Uhr über den Schulmanager anzeigen lasse.
Am Freitag machen wird eine Videokonferenz über MS Teams, um eure Ergebnisse sowohl in Bio als auch Chemie zu besprechen. Viel Erfolg!
Distanzunterricht Mittwoch, 19.01.
Ihr habt gestern sehr gut mitgearbeitet, daher heute eine etwas weniger anspruchsvolle Stunde. Mit dem folgenden Link gelangt ihr auf eine Seite von BR alpha (Ein TV-Sender, der zum Bayerischen Rundfunk gehört):
Trinkalkohol
Diese Seite besitzt sieben Unterkapitel, die ihr dort auf der rechten Seite der Homepage anklicken könnt:
1. Alkoholische Gärung in der Brauerei
2. Die alkoholische Gärung im Labor
3. Was macht Ethanol zu einem Alkohol
usw.
Zu jedem Kapitel gibt es einen kurzen Film (insgesamt ca. 35 Minuten) und darunter ein Quiz. Ich vertraue darauf, dass ich ihr euch heute alleine mit dieser Seite 45 Minuten beschäftigen könnt. Wer noch eine etwas anspruchsvollere Aufgabe braucht, bearbeitet bitte die folgende Aufgabe (Kontrolle in der nächsten Stunde am Di, 26.01.): pdf-Datei
Distanzunterricht Montag, 18.01.
Hallo 10d!
In der letzten Woche kam es vor allem in der 1. Stunde zu Problemen bei manchen Videokonferenzen. Höchstwahrscheinlich ist der Server überlastet, an dem Problem wird gearbeitet. Solange verzichte ich auf die Videokonferenz in der 1. Stunde, ich kann mit euch ja auch in der zweiten Stunde sprechen. Der Zeitplan für heute sieht also so aus:
- Um 07:50 Uhr solltet ihr einen Arbeitsauftrag über den Schulmanager erhalten haben, auf den ihr bis spätestens 08:15 Uhr antwortet. Das dient zunächst als Anwesenheitskontrolle. Erhalte ich keine Rückmeldung von euch, melde ich euch im Sekretariat als fehlend (was vermutlich dazu führt, dass eure Eltern informiert werden).
- Ihr arbeitet bis 09:00 Uhr alleine an diesem Arbeitsauftrag
- Dann starte ich eine BBB-Konferenz und wir besprechen, was ihr hier geschafft habt.
Für diesen Arbeitsauftrag benötigt ihr euer Buch und einen Zettel mit Stift.
Distanzunterricht Montag, 18.01.
Hallo 9a!
In der heutigen Einheit sollt ihr eine weitere Einteilungsmöglichkeit von chemischen Reaktionen kennenlernen und im Anschluss die neuen Begriff anhand einiger Beispiele einüben. Am Freitag würde ich gerne eine Videokonferenz mit euch durchführen, um die letzten drei Einheiten mit euch live zu besprechen.
Distanzunterricht Montag, 18.01.
In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten Einheiten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:
"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."
Bis dahin müssen jedoch noch einige Dinge geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an. Ihr benötigt für diese Einheit einen Stift, Zettel und euer Buch!
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Freitag, 15.01. Chemie
Bitte bearbeitet die folgende Einheit am besten in der eigentlichen Unterrichtszeit von 08:45 - 09:30 Uhr. Ihr benötigt das Arbeitsblatt, welches ihr vor den Ferien erhalten habt und auf dem die Vorderseite bereits ausgefüllt ist. Solltet ihr das AB nicht mehr finden, könnt ihr es hier noch einmal herunterladen:
pdf-Datei
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Donnerstag, 14.01. Bio