10e 2020 21/Bio Chemie: Unterschied zwischen den Versionen
(AA f. Fr. 19.12) Markierung: Quelltext-Bearbeitung 2017 |
(AA f Do, 14.01) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
=== Distanzunterricht Donnerstag, 14.01. Chemie=== | |||
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:<br> | |||
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.<br> | |||
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten. | |||
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag! | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholungsaufgaben zu den verschiedenen Bindungstypen'''</span> | |||
|Inhalt= | |||
'''Aufgaben:'''<br> | |||
* '''Salze 1''' | |||
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen | |||
{{Lösung versteckt| | |||
* Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff. | |||
* Leite daraus ab, welche Ionen diese Stoffe bilden werden | |||
{{Lösung versteckt| | |||
Na --> Na<sup>+</sup> + e<sup>-</sup> <br> | |||
O + 2e<sup>-</sup> --> O<sup>2-</sup> <br> | |||
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt) | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 1|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden? | |||
* Wie formuliert man das als chemische Formel? | |||
{{Lösung versteckt| | |||
2 Na<sup>+</sup> und 1 O<sup>2-</sup> Teilchen ergeben insgesamt die chemische Formel Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört! | |||
* Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte! | |||
{{Lösung versteckt| | |||
4 Na + O<sup>2-</sup> --> 2Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 3|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Salze 2''' | |||
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere! | |||
{{Lösung versteckt| | |||
Eine gute Begründung enthält folgende Aspekte: | |||
* Man erklärt zunächst, was "Sieden überhaupt bedeutet"! | |||
{{Lösung versteckt| | |||
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden. | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt! | |||
{{Lösung versteckt| | |||
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
* Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen! | |||
{{Lösung versteckt| | |||
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.<br> | |||
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst. | |||
|Teillösung 3|Lösung ausblenden}}<br> | |||
|Lösungsschema|Lösung ausblenden}}<br> | |||
<br> | |||
* '''Moleküle''' | |||
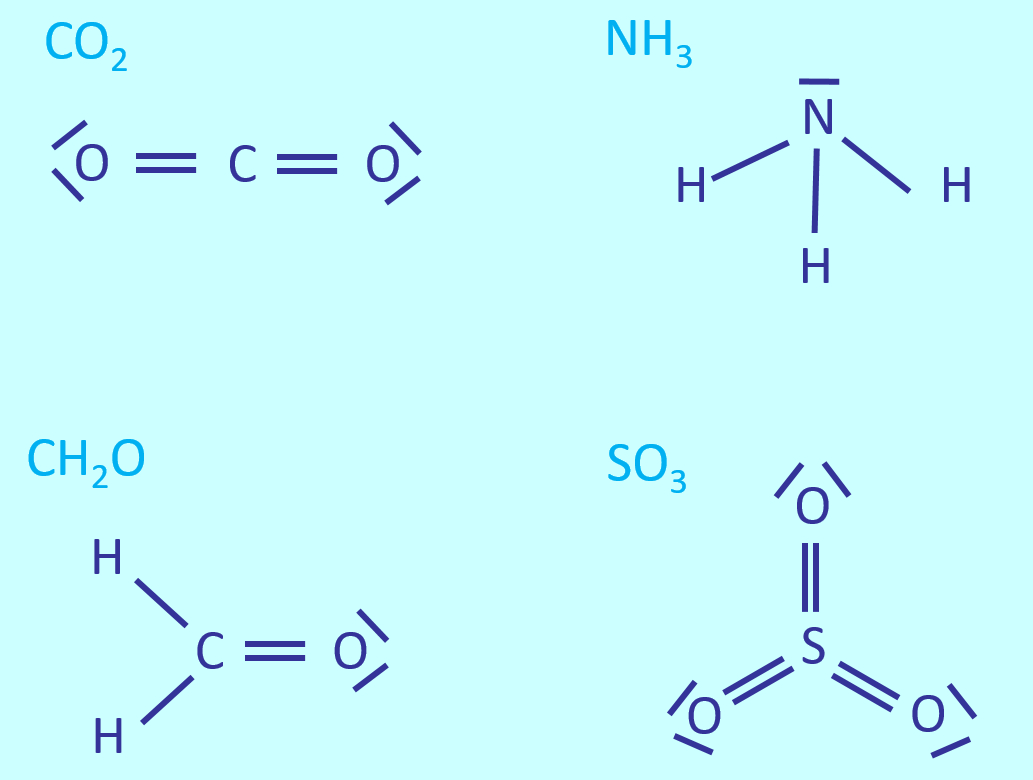
Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
* '''Metalle ''' | |||
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind! | |||
{{Lösung versteckt| | |||
* Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben. | |||
{{Lösung versteckt| | |||
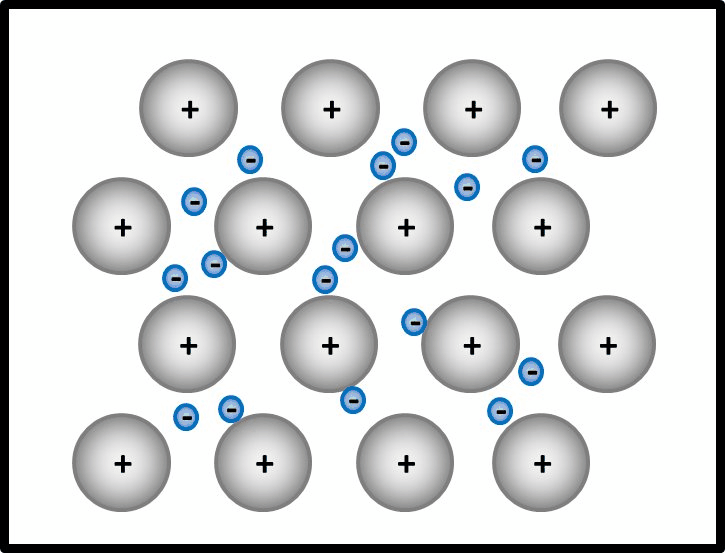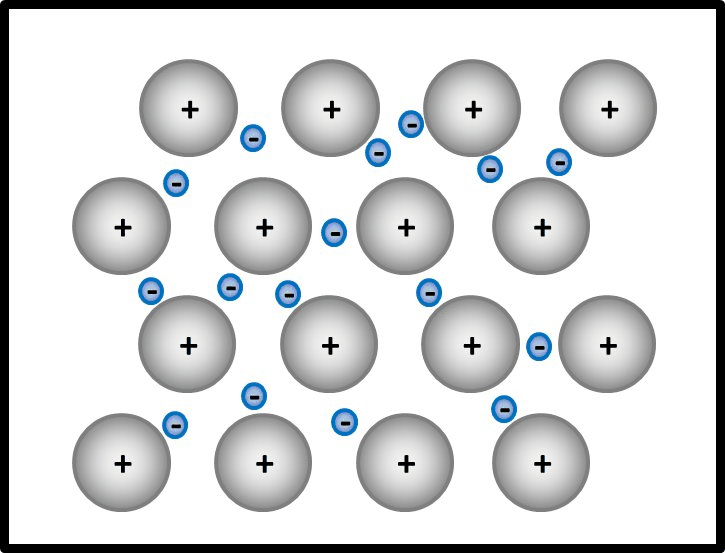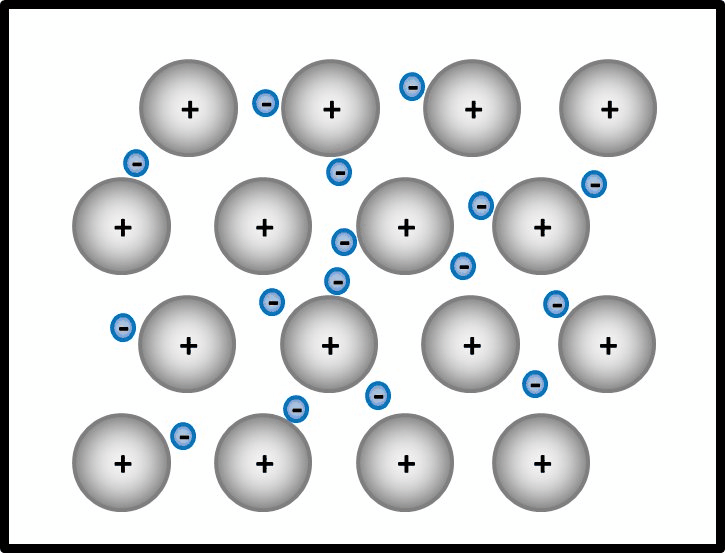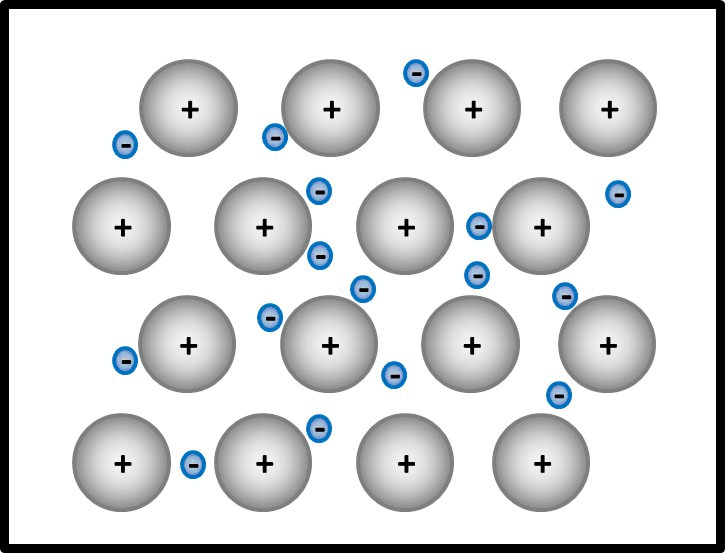
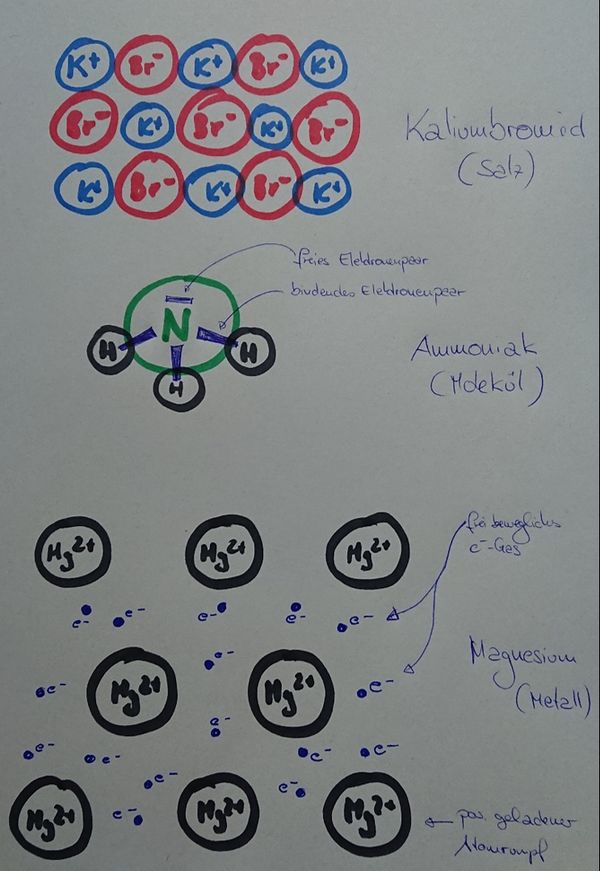
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:<br> | |||
[[Datei:Metallgitter_animiert_1.gif]] | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her! | |||
{{Lösung versteckt| | |||
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}} | |||
Fertig für heute. Wenn ihr Schwierigkeiten bei diesen Aufgaben hattet, findet ihr Überblicksseiten zu den Stoffklassen in eurem Buch Galvani - Chemie S1 auf den S. 102-103, 120-121 und 132,133 | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht Donnerstag, 14.01. Bio === | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Ökologie'''</span> | |||
|Inhalt= | |||
In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.<br> | |||
Das Wort ist euch sicher geläufig, die genaue Bedeutung wahrscheinlich nicht unbedingt. Ihr seht unten zwei Videos, die sich mit Grundbegriffen der Ökologie beschäftigen. Die Videos besitzen eine hohe Informationsdichte und sind unter Umständen etwas schnell. Trotzdem sind sie ganz gut gelungen und bieten vielleicht etwas Abwechslung. Es werde euch hier Ausschnitte abgespielt. Auf yt direkt könnt ihr die Videos aber auch ganz anschauen. <br> | |||
Schaut beide Videos und bearbeitet anschließend die Aufgaben darunter! | |||
<br> | |||
{{#ev:youtube|oaPVSX3MLCk||center|||start=0&end=155}} | |||
<br> | |||
<br> | |||
{{#ev:youtube|_Yb3up2Iacs||center|||start=0&end=199}} | |||
<br> | |||
'''Aufgaben:'''<br> | |||
Klickt zunächst auf folgenden Link. Ihr gelangt zu einer Seite, die "Eco-Spheres" verkauft. Ein angeblich ursprünglich von der NASA entwickeltes "Ökosystem" für den Schreibtisch. Lest die Produktinformationen und kehrt dann wieder hierher zurück!<br> | |||
[https://www.ecosphere-europe.com/product-page/kleine-kugel-10cm Zur Eco-Sphere]<br> | |||
<br> | |||
'''Aufgaben: '''<br> | |||
* Wende die soeben gelernten Fachgriffe an und ordnen ihnen die richtigen Objekte aus der Eco-Sphere zu! | |||
* Was an der Eco-Sphere ist Biotop, was Biozönose? | |||
* Welche Organismen sind Produzenten, Konsumenten und Reduzenten? | |||
{{Lösung versteckt| | |||
* '''Biotop''': Glasgefäß, Steinchen, Muschel-'''Schalen''' (Das Gefäß enthält keine lebenden Muscheln) Gorgonie, Wasser; '''Biozönose''': grüne Faden- und braune Flächen-Algen, Garnelen, Mikroorganismen | |||
* '''Produzenten''': grüne Faden- und braune Flächen-Algen, '''Konsumenten''': Garnelen, '''Reduzenten''': Mikroorganismen | |||
|Lösung|Lösung ausblenden}} | |||
Es gibt drei Begriff, die eher aus der Physik stammen und die Wechselwirkung von Systemen mit ihrer Umgebung beschreiben: <br> | |||
* Offene Systeme | |||
Offen bedeutet, dass SOWOHL Energie mit der Umgebung ausgetauscht werden, ALS AUCH Stoffe | |||
* Geschlossene Systeme | |||
Bei geschlossenen System kann zwar Energie mit der Umgebung ausgetauscht werden, allerdings keine Stoffe | |||
* Isolierte Systeme | |||
Isolierte System stehen in überhaupt keinem Austausch mit der Umgebung. | |||
<br> | |||
<br> | |||
Ökosysteme sind in der Regel offene Systeme. Betrachten wir einen See: Ein im See lebender Frosch könnte den See durchaus verlassen und in den angrenzenden Wald hüpfen und dort Kot absetzen. Damit wären Stoffe aus dem See in die Umgebung gelangt. Umgekehrt könnte auch ein Ente von weit her angeflogen können und Fischeier, die an ihrem Gefieder hingen im See hinterlassen. Damit wären Stoffe in den See aus der Umgebung eingetragen worden. <br> | |||
Auch ein Energieaustausch ist möglich: Wenn die Sonne scheint, können die Sonnen strahlen in den See eindringen und ihn aufheizen. Nachts kann diese Wärme z.B. an die Atmosphäre wieder abgegeben werden. <br> | |||
Beurteile begründet, ob die Eco-Sphere tatsächlich ein Öko-System in diesem Sinne ist. | |||
{{Lösung versteckt| | |||
Ein Energieaustausch ist zwar möglich. Das Glasgefäß lässt ja z.B. Lichtstrahlen ein- und austreten; ein Stoffaustausch ist jedoch mit der Umgebung nicht möglich. Daher ist dieses System geschlossen und unterscheidet sich in diesem Punkt von offenen Ökosystemen in der Natur | |||
|Lösung|Lösung ausblenden}} | |||
<br> | |||
<br> | |||
'''Freiwillig:'''<br> | |||
Vor einigen Jahren versuchte man mit einer Art Gewächshaus die Erde nachzuahmen, um zu testen, ob man in einem geschlossenen System (z.B. auf dem Mars) als Mensch länger überleben könnte. Das Projekt hieß "Biosphäre 2". Wer möchte, kann einen 7min. Film dazu schauen: | |||
{{#ev:youtube|qO7NkNJOhAk}}<br> | |||
<br> | |||
'''Hausaufgabe:'''<br> | |||
Lest im Buch S. 62 - 63 | |||
<br> | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
<br> | |||
== Distanzlernen für Freitag, 18.12. == | == Distanzlernen für Freitag, 18.12. == | ||
Version vom 14. Januar 2021, 06:06 Uhr
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Donnerstag, 14.01. Bio
Distanzlernen für Freitag, 18.12.
Distanzlernen für Donnerstag, 17.12 (Chemie)
Die folgenden Boxen enthalten ein paar Wiederholungseinheiten zu bereits behandelten Themen in Chemie. Ihr braucht zur Bearbeitung einen Stift, einen Zettel und evtl. euer Buch. Und Ruhe. Ich hoffe, die Aufgaben reichen aus, um euch eine angemessene Zeit zu beschäftigen. Klickt bitte erst auf "Lösung", wenn ihr wirklich eine gefunden habt!
Distanzlernen für Donnerstag, 17.12 (Bio)
Termine
Grundlagen in Chemie
Einheit: Atombau
Einheit: Aufbau des PSE
Einheit: Bindungsarten
Wie man Grafiken interpretiert
Das Interpretieren von Grafiken (auch Tabellen oder Karikaturen) ist eine oft verlangte Fähigkeit von Oberstufen-Schülern. Ich empfehle folgendes Vorgehen:
- Man beginnt mit einer Beschreibung
- Was zeigt die Grafik? (y-Achse und x-Achse in Beziehung setzen, z.B. mit der Formulierung: "Die Grafik zeigt das was auf der y-Achse steht in Abhängigkeit von dem was auf der x-Achse steht.)
- Welche Zusammenhänge sind zu sehen? Man verzichtet zunächst auf Erklärungen/Begründungen, bleibt zunächst noch bei einer reinen Beschreibung (Schöne Formulierungen: "Je ...größer/kleiner/höher/niedriger/usw. desto ..."
- Erst zum Schluss versucht man die Zusammenhänge zu erklären. Je nach behandeltem Stoff im Unterricht kann diese Erklärung recht umfangreiches Wissen verlangen. Gelegentlich sind hier auch Hypothesen über eine mögliche Begründung verlangt, die noch nicht besprochen wurden.
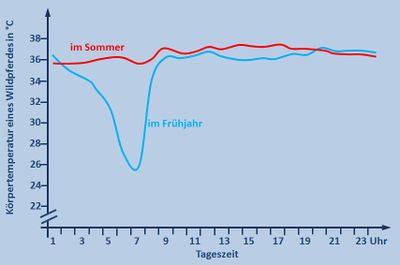
Abb. selbst erstellt, Originalgrafik: Kuntz, Regina; Der versteckte Winterschlaf der Wildpferde; Spektrum der Wissenschaft; August 2008; S. 46 - 53, 2008
Versucht zunächst selbst diese Grafiken zu interpretieren. - Lasst euch dann die Lösung anzeigen.
- Die Grafik zeigt die Körpertemperatur eines Wildpferdes in Abhängigkeit von der Uhrzeit einmal im Sommer und einmal im Winter.
- Im Sommer bleibt die Körpertemperatur den ganzen Tag konstant bei 36°C. Im Frühjahr sinkt die Körpertemperatur nachts und in den frühen Morgenstunden um 10°C auf 26°C ab. Ab 08:00 Uhr steigt sie wieder auf 36°C und bleibt dann konstant.
- Im Unterricht könnte man dazu folgendes besprochen haben: Die Sommerkurve ist völlig normal. Pferde zählen zu den gleichwarmen Tieren und halten ihre Körpertemperatur konstant. Überraschend ist das starke Absinken der Körpertemperatur in der Nacht in kalten Frühjahrsnächten. Wahrscheinlich hat das Pferd aber einen Vorteil von dieser Absenkung, denn es muss weniger Wärme erzeugen, um den Körper über die Umgebung aufzuheizen. Dadurch spart es z.B. Fettreserven und Nahrung.