Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
(AA 10e C Do 1401) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 1: | Zeile 1: | ||
=== Distanzunterricht Donnerstag, 14.01. Chemie=== | |||
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:<br> | |||
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.<br> | |||
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten. | |||
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag! | |||
{{Box-spezial | |||
|Titel=<span style="color:#080">'''Wiederholungsaufgaben zu den verschiedenen Bindungstypen'''</span> | |||
|Inhalt= | |||
'''Aufgaben:'''<br> | |||
* Salze 1 | |||
Formuliere die chemische Gleichung zur Bildung von Natriumoxid aus den Elementen | |||
{{Lösung versteckt| | |||
* Bestimme die Anzahl an Valenzelektronen von Natrium und Sauerstoff. | |||
* Leite daraus ab, welche Ionen diese Stoffe bilden werden | |||
{{Lösung versteckt| | |||
Na --> Na<sup>+</sup> + e<sup>-</sup> <br> | |||
O + 2e<sup>-</sup> --> O<sup>2-</sup> <br> | |||
(Eine chemische Gleichung ist hier nicht unbedingt nötig, es genügt, wenn ihr die richtigen Ionen ableiten könnt) | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 1|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Aus den Ionen muss sich ein Salz bilden, das insgesamt neutral ist. In welchem Verhältnis müssen sich die Ionen dazu zusammen finden? | |||
* Wie formuliert man das als chemische Formel? | |||
{{Lösung versteckt| | |||
2 Na<sup>+</sup> und 1 O<sup>2-</sup> Teilchen ergeben insgesamt die chemische Formel Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
* Nun kann man beginnen die chemische Gleichung aufzustellen. Dabei ist darauf zu achten, dass Sauerstoff zur HONClBrIF-Gruppe gehört! | |||
* Alle Edukte links, Reaktionspfeil, Produkt rechts und ausgleichen bitte! | |||
{{Lösung versteckt| | |||
4 Na + O<sup>2-</sup> --> 2Na<sub>2</sub>O | |||
|Lösung|Lösung ausblenden}} | |||
|Tipp 3|Lösung ausblenden}}<br> | |||
<br> | |||
* Salze 2 | |||
Begründe, warum Salze in der Regel einen sehr hohen Siedepunkt haben, Moleküle eher niedrigere! | |||
{{Lösung versteckt| | |||
Eine gute Begründung enthält folgende Aspekte: | |||
* Man erklärt zunächst, was "Sieden überhaupt bedeutet"! | |||
{{Lösung versteckt| | |||
Beim "Sieden" müssen die Teilchen, aus denen sich ein Stoff zusammensetzt voneinander getrennt werden. | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Dann kann man darauf eingehen, warum die Siedetemperatur ganz generell unterschiedlich sein kann, wovon sie also allgemein abhängt! | |||
{{Lösung versteckt| | |||
Es kommt auf die Kräfte an, welche die Teilchen zusammenhält. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
* Jetzt kann man konkret werden und auf die hier vorliegenden Unterschiede dieser Kräfte eingehen! | |||
{{Lösung versteckt| | |||
Salze bestehen aus Ionen, die alle geladen sind. Unterschiedlich geladene Teilchen ziehen sich (stark) an, daher haben Metalle im Vergleich zu Molekülen hohe Siedepunkte. Moleküle sind in der Regel nämlich neutral. Sie ziehen Nachbarmoleküle kaum an. Daher lassen sie sich leicht (schon bei geringen Temperaturen) voneinander trennen und der Stoff siedet.<br> | |||
Warum sich Moleküle doch etwas gegenseitig anziehen und manche Moleküle daher schon höhere Siedepunkte besitzen können, besprechen wir demnächst. | |||
|Teillösung 3|Lösung ausblenden}}<br> | |||
|Lösungsschema|Lösung ausblenden}}<br> | |||
<br> | |||
* Moleküle | |||
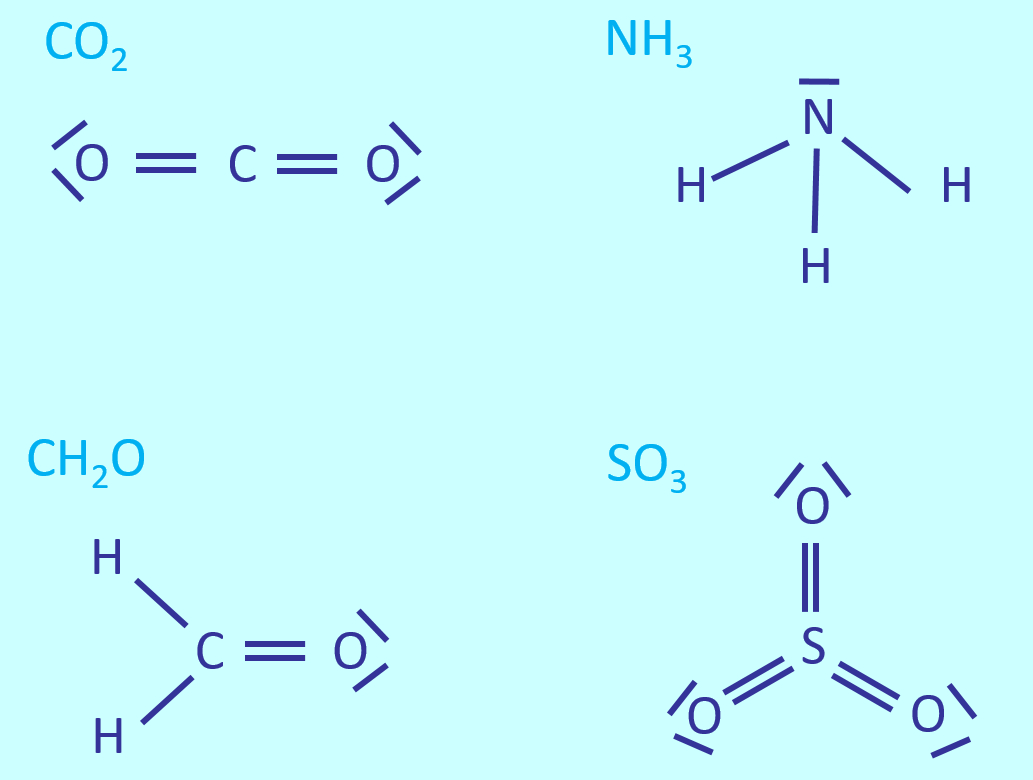
Zeichnet die Valenzstrichformeln für: CO<sub>2</sub>, NH<sub>3</sub>, CH<sub>2</sub>O, SO<sub>3</sub> | |||
{{Lösung versteckt| | |||
[[Datei:A6_WH_Lsg1_Valenzstrichformeln.jpg]] | |||
|Lösung|Lösung ausblenden}} | |||
* Metalle | |||
Begründe, warum Metalle in der Regel sehr gute elektrische Leiter sind! | |||
{{Lösung versteckt| | |||
* Es bietet sich an, hier zunächst den Aufbau von Metallen zu beschreiben. | |||
{{Lösung versteckt| | |||
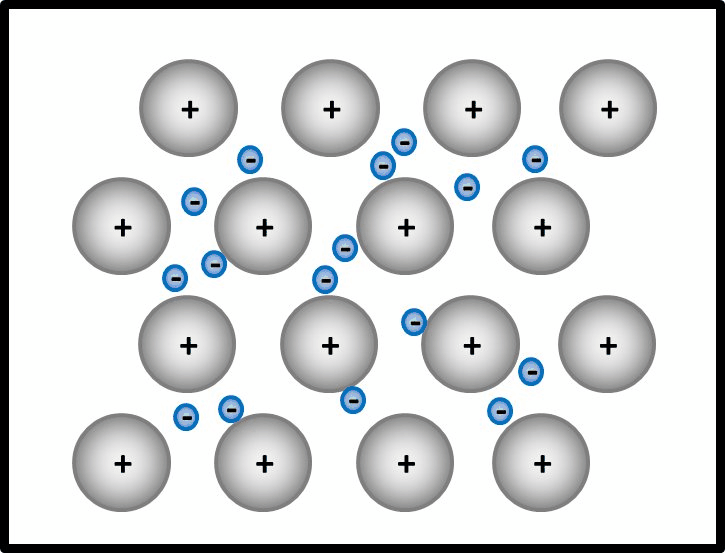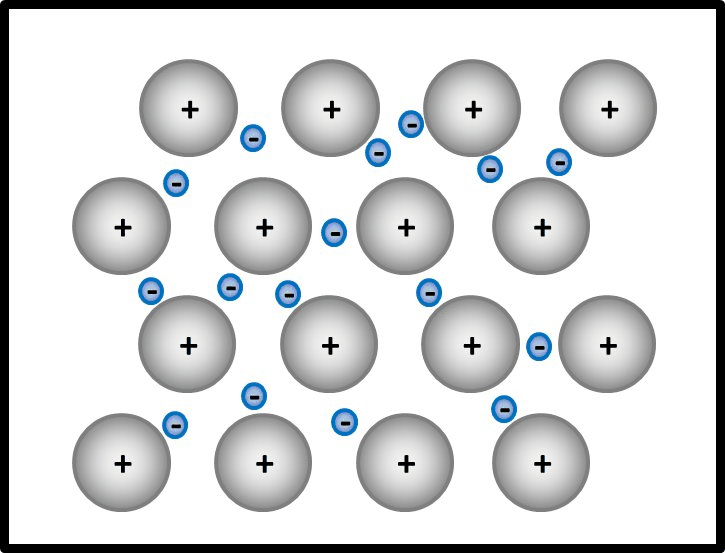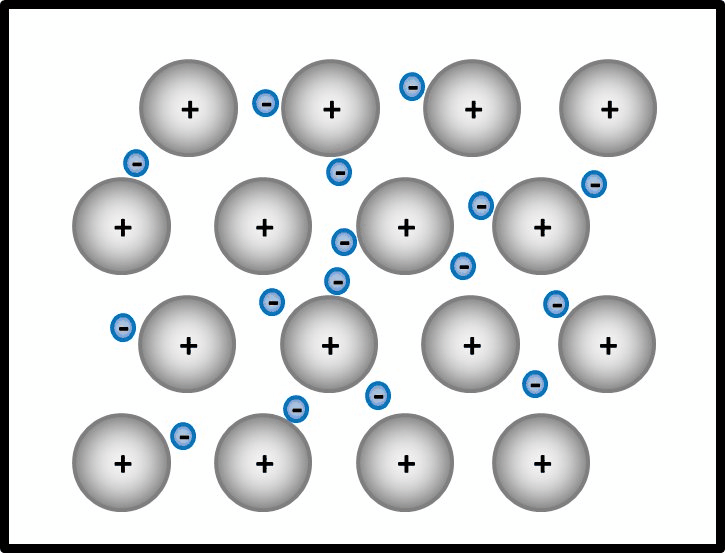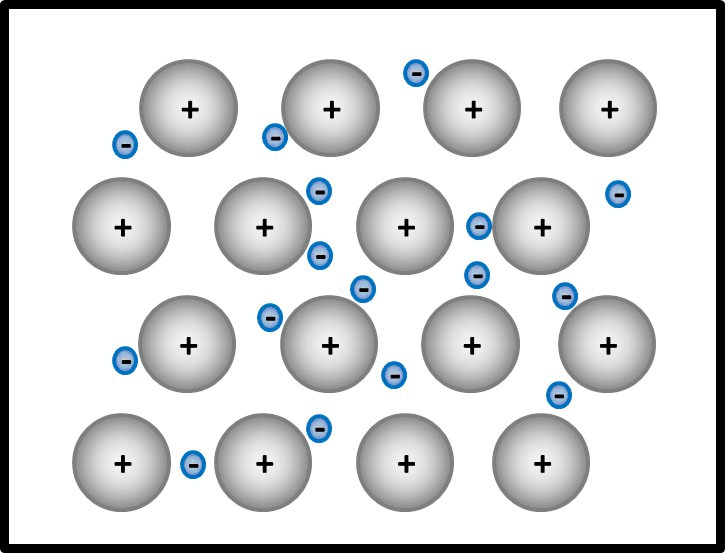
Man kann das natürlich auch mit Worten beschreiben, dann sollten auf jeden Fall die Begriffe "positiv geladenene Atomrümpfe" und "frei bewegliches Elektronengas" auftauchen. Eine Skizze sieht so aus:<br> | |||
[[Datei:Metallgitter_animiert_1.gif]] | |||
|Teillösung 1|Lösung ausblenden}}<br> | |||
* Jetzt stellt man den Zusammenhang mit der elektrischen Leitfähigkeit her! | |||
{{Lösung versteckt| | |||
Elektrisch leitend ist ein Stoff dann, wenn geladene Teilchen durch ihn fließen können. Hier sind frei bewegliche, negativ geladene Elektronen vorhanden. Damit sind alle Bedingungen erfüllt. | |||
|Teillösung 2|Lösung ausblenden}}<br> | |||
|Lösung|Lösung ausblenden}} | |||
|Farbe= #080 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DFB | |||
|Hintergrund= #DFB | |||
}} | |||
=== Distanzunterricht Donnerstag, 14.01. Bio === | === Distanzunterricht Donnerstag, 14.01. Bio === | ||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#080">'''Ökologie'''</span> | ||
|Inhalt= | |Inhalt= | ||
In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.<br> | In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.<br> | ||
| Zeile 47: | Zeile 133: | ||
{{#ev:youtube|qO7NkNJOhAk}} | {{#ev:youtube|qO7NkNJOhAk}} | ||
|Farbe= # | |Farbe= #080 | ||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DFB | ||
|Hintergrund= # | |Hintergrund= #DFB | ||
}} | }} | ||
<br> | <br> | ||
Version vom 13. Januar 2021, 12:05 Uhr
Distanzunterricht Donnerstag, 14.01. Chemie
Um 08:15 Uhr findet die BBB-Konferenz statt, um die Anwesenheit zu kontrollieren. Bis dahin macht ihr ab 08:00 Uhr bitte folgendes:
Scrollt auf dieser Seite nach unten bis zum Abschnitt "Distanzlernen für Donnerstag, 17.12.". Wiederholt die dort gestellte Aufgabe im ersten lilafarbenen Block "Bindungsarten". Das sollte in 15min. zu schaffen sein. Startet dann bitte pünktlich die BBB-Konferenz.
Nach der Anwesenheitskontrolle bearbeitet ihr bitte die folgenden Aufgaben alleine. Sollte BBB stabil laufen, können wir das gerne in Form von Gruppenarbeiten mit anschließender Besprechung durchführen. Sollte die Verbindung schlecht sein oder abbrechen, könnt ihr die Aufgaben hier auch alleine bearbeiten.
Wechselt um 08:45 Uhr auf jeden Fall zum Biologie-Auftrag!
Distanzunterricht Donnerstag, 14.01. Bio