Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 8: | Zeile 8: | ||
Schaut beide Videos und bearbeitet anschließend die Aufgaben darunter! | Schaut beide Videos und bearbeitet anschließend die Aufgaben darunter! | ||
<br> | <br> | ||
{{#ev:youtube| | {{#ev:youtube|oaPVSX3MLCk||center|||start=0&end=155}} | ||
<br> | <br> | ||
<br> | <br> | ||
Version vom 13. Januar 2021, 09:36 Uhr
Distanzunterricht Donnerstag, 14.01. Bio
In den letzten Stunden vor den Weihnachtsferien ging es um Prozesse, die sich auf molekularer Ebene abspielen. Ihr habt gesehen, wie in den Mitochondrien energiereiches ATP aus Zucker und Sauerstoff hergestellt wird. Das Thema war im Prinzip abgeschlossen und wir machen einen großen Sprung zur Ökologie.
Das Wort ist euch sicher geläufig, die genaue Bedeutung wahrscheinlich nicht unbedingt. Ihr seht unten zwei Videos, die sich mit Grundbegriffen der Ökologie beschäftigen. Die Videos besitzen eine hohe Informationsdichte und sind unter Umständen etwas schnell. Trotzdem sind sie ganz gut gelungen und bieten vielleicht etwas Abwechslung. Es werde euch hier Ausschnitte abgespielt. Auf yt direkt könnt ihr die Videos aber auch ganz anschauen.
Schaut beide Videos und bearbeitet anschließend die Aufgaben darunter!
Aufgaben:
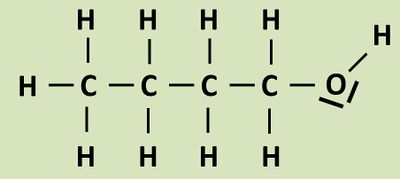
- Zeichne die Valenzstrichformel von Butan-1-ol!
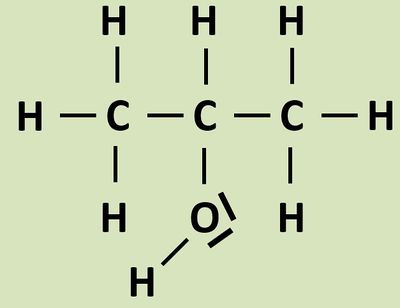
- Benennen das folgende Molekül!
Propan-2-ol
- Nenne alle bei Ethanol-Molekülen auftretenden "zwischenmolekularen Kräfte" und ordne sie nach ihrer Stärke! (Das ist eine Wiederholungsaufgabe. Die geforderten Inhalte sind nur teilweise im Video oder im Buch enthalten)
Die stärksten "zwischenmolekularen Kräfte" wären hier: Wasserstoffbrückenbindungen.
- Sie können sich ausbilden zwischen Wasserstoffen, die an ein stark elektronegatives Element gebunden sind (ist hier der Fall: Das H-Atom der Hydroxgruppe) und freien Elektronenpaaren eines stark elektronegativen Elements der 2. Periode (ist hier der Fall: Das O-Atom der Hdroxgruppe hat freie Elektronenpaare und ist stark elektronegativ)
Die zweitstärksten "zwischenmolekularen Kräfte" wären hier: Die Kräfte zwischen den permanenten Dipolen.
Dann gibt eine Kraft, die aufritt, wenn ein permanenter Dipol in benachbarten Molekülen einen Dipol induziert.
Die schwächsten Kräfte sind die van-der-Waals-Kraft im engeren Sinne: Durch Fluktuationen in der Elektronenhülle entstehen spontane Dipole, die im Nachbarmolekül ebenfalls kleine Dipole induzieren können.
Lasst euch das, was wir gestern (Montag) besprochen haben noch einmal kurz durch den Kopf gehen. Ihr könnt dazu auf dieser Seite etwas nach unten scrollen und die Fragen überfliegen, die im letzten Arbeitsauftrag behandelt wurden.
Wie würdet ihr in höchstens drei Sätzen zusammenfassen, was ihr aus dieser letzten Einheit mitgenommen habt?
Möglich wäre z.B.:
- Ein Schokokuchen ist schon was leckeres...
- Auf "Vogelhäuschen selber bauen" hätte ich ja gar keinen Bock. Da kauf ich lieber eins.
- Eine Tonne Äpfel auf einem Anhänger??? Auf den Anhänger von meinem Onkel passen 16 Tonnen!
O.k., das könnten zwar auch Dinge gewesen sein, die euch durch den Kopf gegangen sind, aber jetzt mal in Bezug auf Chemie!
Möglich wäre z.B.:
- In chemischen Gleichungen spielt die Anzahl von Teilchen (Atomen, Molekülen, Salzeinheiten) eine Rolle
- Leider kann man solche Teilchen aber nicht abzählen
- Man müsste die Masse von diesen Teilchen wissen, damit man etwas damit anfangen kann
Ihr sollt heute einen kleinen Versuch durchführen, mit dem man die Masse von kleinen Teilchen ziemlich genau bestimmen kann, auch wenn man sie nicht direkt wiegt. Mit einzelnen Atomen oder Molekülen könnt ihr natürlich nicht arbeiten, daher nehmen wir andere "kleine Teilchen". Ihr benötigt also:
- Entweder Reiskörner oder trockene Erbsen oder trockene Linsen oder sonst irgendetwas kleines (Reißnägel, Büroklammern etc.)
- Eine Küchenwaage
- Geduld
Die Objekte, die ihr euch aussucht, sollten so klein (und leicht) sein, dass eine Küchenwaage "nichts" anzeigt, wenn man eins dieser Objekte darauf legt. Zählt jetzt so viele Teilchen ab (z.B. 100, evtl. aber auch 1000), dass eure Küchenwaage einen "vernünftigen Wert" anzeigt, ich würde empfehlen so um die 10 Gramm.
Ihr könnt auch umgekehrt vorgehen: Wiegt exakt 10,0g ab und bestimmt dann die in dieser Menge enthaltene Anzahl an Objekten.
Berechnet aus diesen beiden Werten (Anzahl und Gewicht) das Gewicht eines Teilchens. Recherchiert dann im Internet ob ihr einen Wert findet, der euer Ergebnis bestätigt (oder auch widerlegt). Wenn ihr Pflanzenteile genommen habt, dann werdet ihr wahrscheinlich sehr schnell auf Wikipedia fündig. Als Suchtipp kann ich euch auch den Begriff "Tausendkornmasse" empfehlen.
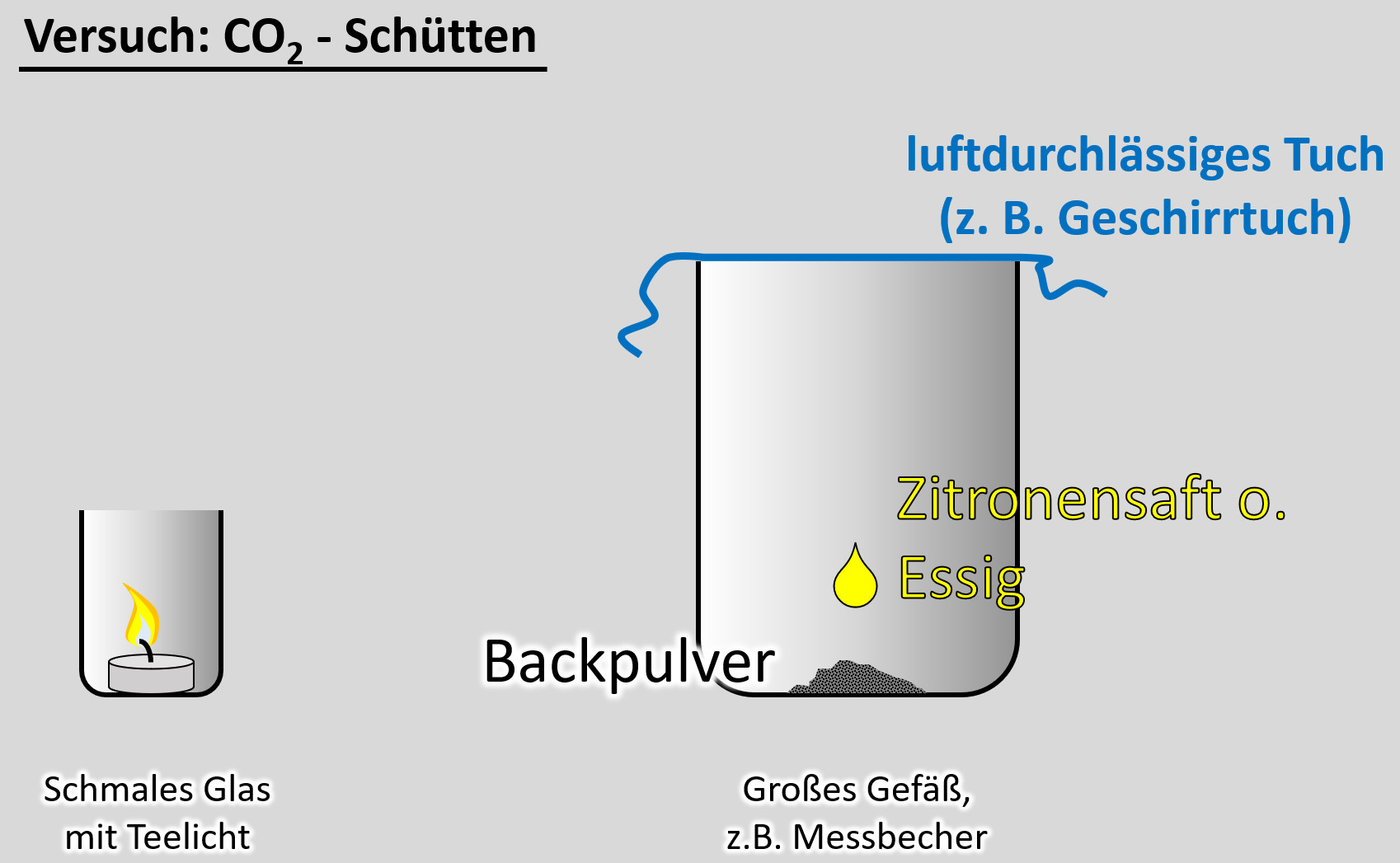
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmale Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.