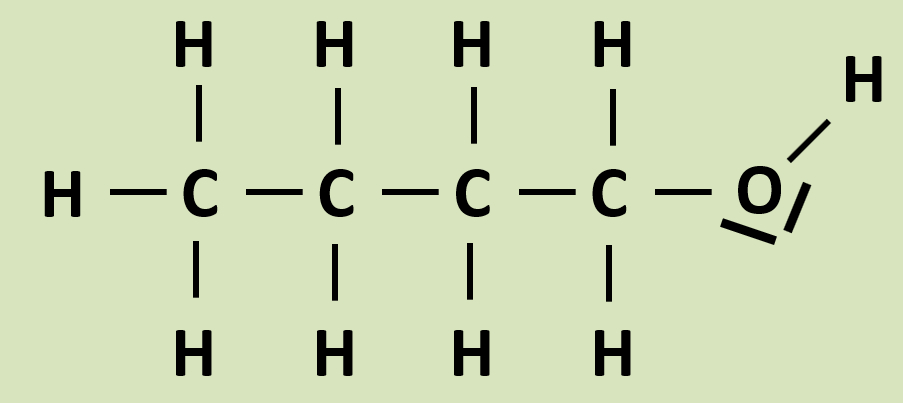Benutzer:Thomas Lux/Test Oberstufe: Unterschied zwischen den Versionen
Aus RMG-Wiki
(AA C10d f. Mi 13.01.) Markierung: Quelltext-Bearbeitung 2017 |
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 10: | Zeile 10: | ||
* Zeichne die Valenzstrichformel von Butan-1-ol! | * Zeichne die Valenzstrichformel von Butan-1-ol! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
[[Datei:Butan1ol_Valenzstrich_grHG.jpg]]<br> | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
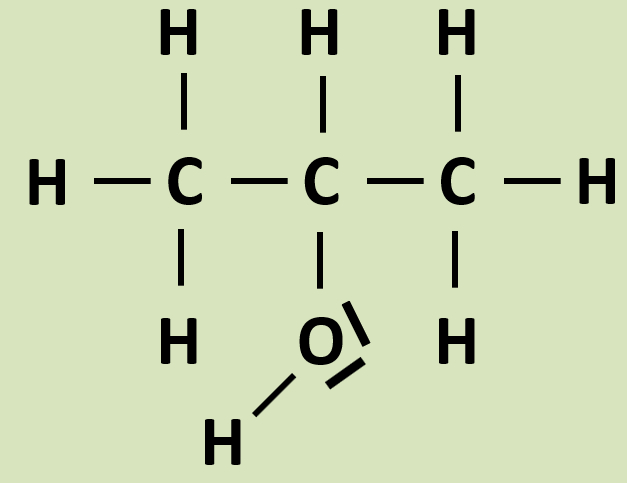
* Benennen das folgende Molekül! | * Benennen das folgende Molekül! | ||
[[Datei:Propan2ol_Valenzstrich_grHG.jpg]]<br> | |||
{{Lösung versteckt| | {{Lösung versteckt| | ||
Möglich wäre z.B.: | Möglich wäre z.B.: | ||
| Zeile 18: | Zeile 19: | ||
* Nenne alle bei Ethanol-Molekülen auftretenden "zwischenmolekularen Kräfte" und ordne sie nach ihrer Stärke! | * Nenne alle bei Ethanol-Molekülen auftretenden "zwischenmolekularen Kräfte" und ordne sie nach ihrer Stärke! | ||
{{Lösung versteckt| | {{Lösung versteckt| | ||
*Die stärksten "zwischenmolekularen Kräfte" wären hier: Wasserstoffbrückenbindungen. | |||
Sie können sich ausbilden zwischen Wasserstoffen, die an ein stark elektronegatives Element gebunden sind (ist hier der Fall: Das H-Atom der Hydroxgruppe) und freien Elektronenpaaren eines stark elektronegativen Elements der 2. Periode (ist hier der Fall: Das O-Atom der Hdroxgruppe hat freie Elektronenpaare und ist stark elektronegativ) | |||
* Die zweitstärksten "zwischenmolekularen Kräfte" wären hier: Die Kräfte zwischen den permanenten Dipolen. | |||
* Dann gibt eine Kraft, die aufritt, wenn ein permanenter Dipol in benachbarten Molekülen einen Dipol induziert. | |||
* Die schwächsten Kräfte sind die van-der-Waals-Kraft im engeren Sinne: Durch Fluktuationen in der Elektronenhülle entstehen spontane Dipole, die im Nachbarmolekül ebenfalls kleine Dipole induzieren können. | |||
|Lösung|Lösung ausblenden}} | |Lösung|Lösung ausblenden}} | ||
Version vom 12. Januar 2021, 15:15 Uhr
Distanzunterricht Mittwoch, 13.01.