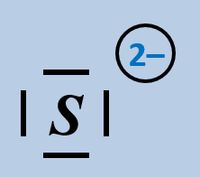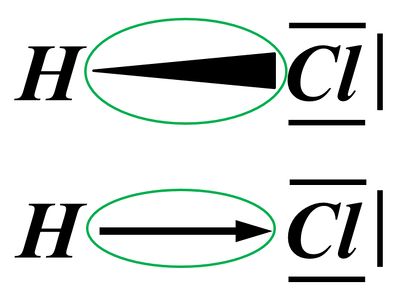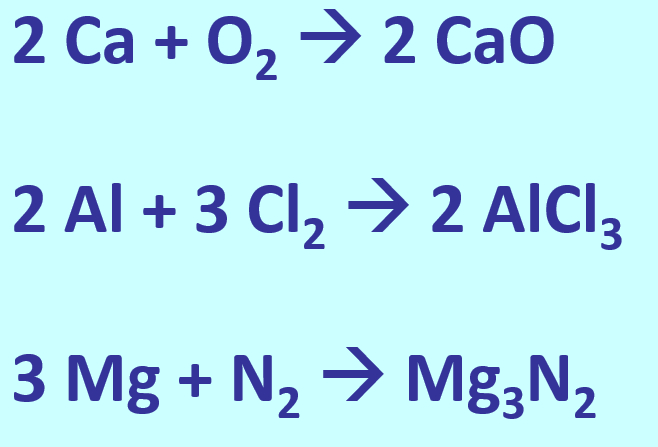|
|
| Zeile 2: |
Zeile 2: |
| <br> | | <br> |
| <br> | | <br> |
| | |
| | == Arbeitsauftrag Chemie für den 04.05. == |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#080">Verbesserung der Hausaufgabe</span> |
| | |Inhalt= |
| | '''Pflicht''': Sucht bei euch zu Hause drei völlig verschiedene '''Lebensmittel''', die '''sauer '''sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen"). <br> |
| | '''Freiwillig:''' Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist! |
| | * z.B.: Essig - Essigsäure (CH<sub>3</sub>-COOH) |
| | * z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C<sub>6</sub>H<sub>8</sub>O<sub>7</sub>) |
| | * z.B.: Joghurt (allgemein Sauermilchprodukte) - Milchsäure (C<sub>3</sub>H<sub>6</sub>O<sub>3</sub>) |
| | * z.B.: Limo (allgemein sprudelnde Getränke) - Kohlensäure (H<sub>2</sub>CO<sub>3</sub>) |
| | |Farbe= #080 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DFB |
| | |Hintergrund= #DFB |
| | }} |
| | <br> |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#607">'''Die "Gegenspieler" der Säuren'''</span> |
| | |Inhalt= |
| | In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer '''polaren Atombindung''' zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die '''heterolytisch ein Proton abspalten''' können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).<br> |
| | [[Datei:SäBa2_Heterolyse_divDarstellungen.jpg|600px]]<br> |
| | <br> |
| | <br> |
| | Moleküle, bei denen eine derartige Reaktion möglich ist, nennt man '''Säuren'''. Typische '''Eigenschaften '''von Säuren sind z.B. der '''"saure Geschmack"''' oder '''"greifen unedle Metalle an"'''. Diese Eigenschaften sind auf das abspaltbare Proton zurückzuführen.<br> |
| | Sicher können sich diejenigen, die Chemie schon länger in der Schule hatten erinnern, dass es zu Säuren einen '''"Gegenspieler"''' gibt. Wie heißen diese Gegenspieler? |
| | {{Lösung versteckt| |
| | Basen oder Laugen (als Lauge bezeichnet man in der Regel eine wässrige Lösung einer Base) |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | Diese Gegenspieler sind in der Lage, die saure Wirkung von Säuren zu neutralisieren, also aufzuheben. Dazu gleich ein Versuch. Vorher noch etwas Theorie: Wenn die saure Wirkung einer Säure darauf beruht, dass die Säure-Teilchen ein Proton abgeben, welche Fähigkeit muss dann ein solches Gegenspieler-Teilchen besitzen, wenn es diese Wirkung aufzuheben vermag? |
| | {{Lösung versteckt| |
| | Es muss in der Lage sein, ein Proton aufzunehmen |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | |
| | |Farbe= #607 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DCF |
| | |Hintergrund= #DCF |
| | }} |
| | <br> |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#607">'''Beispiel'''</span> |
| | |Inhalt= |
| | Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH<sub>3</sub> (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:<br> |
| | [[Datei:SäBa2_NH3_AufnahmeProton.jpg|600px]]<br> |
| | <br> |
| | |
| | {{Lösung versteckt| |
| | Das Ammoniak-Molekül NH<sub>3</sub> stellt sein freies Elektronen-Paar für eine Atombindung mit einem Proton zur Verfügung |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | Was ist der Unterschied zwischen dieser neu gebildeten Atombindung im Vergleich zu einer "normalen" Atombindung, wie ihr sie früher kennengelernt habt? |
| | <br> |
| | {{Lösung versteckt| |
| | Bei der Bildung einer Atombindung sind wir in den vorangegangenen Einheiten davon ausgegangen, dass jeder Partner ein Elektron zur Verfügung stellt. Hier stammen aber beide Elektronen der Atombindung nur vom Stickstoff-Atom. Das Proton hat kein Elektron zur Bindung beigetragen. |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | |
| | |Farbe= #607 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DCF |
| | |Hintergrund= #DCF |
| | }} |
| | <br> |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#607">'''Versuch'''</span> |
| | |Inhalt= |
| | Ein freiwilliger Versuch. '''Ihr benötigt dazu:''' |
| | * Zitrone(nsaft) |
| | * Bullrichsalz (Tabletten oder Pulver), falls nicht verfügbar ist auch Backpulver möglich. |
| | * 2 kleine Gläschen (z.B. Schnapsgläser) |
| | <br> |
| | |
| | '''Durchführung''': |
| | * Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Pulver oder einen halben Teelöffel Backpulver. |
| | * Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um. |
| | * Probiert von jeder Lösung einen Teelöffel voll (Ihr könnt das noch einmal wiederholen, dann aber bitte keine größeren Mengen mehr von der Backpulver-Lsg. schlucken. Backpulver kann im Magen zur Bildung großer Mengen Gas führen. |
| | <br> |
| | |
| | Beschreibt das '''Ergebnis''' in Form eurer Geschmacks-Empfindung |
| | |
| | {{Lösung versteckt| |
| | Die Lösung mit Bullrich-Salz / Backpulver sollte deutlich weniger sauer schmecken. Es kommt aber ein bisschen auf die Zitrone an. Die muss sehr sauer sein, damit der Versuch gut klappt. <br> |
| | Nur kurz zur Erklärung: Bullrichsalz enthält Natriumhydrogencarbonat. In Wasser gelöst entstehen Hydrogencarbonat-Ionen. Diese sind in der Lage Protonen aufzunehmen. Sie fungieren also als Base.<br> |
| | Die sauere Wirkung von Zitronensaft beruht auf der Zitronensäure, die ein (bzw. auch mehrere) Proton(en) abgeben kann. Nachdem diese jedoch von den Hydrogencarbonat-Ionen "abgefangen" werden, entsteht auf der Zunge kein sauerer Eindruck. |
| | |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | |
| | |Farbe= #607 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DCF |
| | |Hintergrund= #DCF |
| | }} |
| | <br> |
| | |
| | {{Box-spezial |
| | |Titel=<span style="color:#080">Hausaufgabe</span> |
| | |Inhalt= |
| | Formuliert die Aufnahme '''eines Protons''' auf Teilchen-Ebene von folgenden Basen: |
| | * Hydrogencarbonat-Ion |
| | * Sulfid-Ion |
| | [[Datei:SäBa2_HCO3minus_VSF.jpg|200px]] [[Datei:SäBa2_S2minus_VSF.jpg|200px]]<br> |
| | Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt! |
| | {{Lösung versteckt| |
| | Hast Du wirklich die Lösung schon gezeichnet? |
| | |
| | {{Lösung versteckt| |
| | [[Datei:SäBa2_HA_ML.jpg|600px]]<br> |
| | Beim Hydrogencarbonat-Ion könnte es sein, dass ihr ein anderes freies Elektronenpaar für die Bindung zum Proton verwendet habt. Das ist aber falsch! Das Proton wird immer über eines der drei freie Elektronenpaare gebunden, die am Sauerstoff mit der negativen Ladung sitzen (im Bild blau markiert). Schon allein aufgrund der elektrischen Ladung dort, wird das positiv geladene Proton dort hin gezogen.<br> |
| | Beim Sulfid-Ion ist egal, welches Elektronenpaar verwendet wird, das Ergebnis ist faktisch immer das selbe. |
| | |Ja!|Lösung ausblenden}} |
| | |
| | |Lösung|Lösung ausblenden}} |
| | <br> |
| | |Farbe= #080 |
| | |Rahmen= 0 |
| | |Rahmenfarbe= #DFB |
| | |Hintergrund= #DFB |
| | }} |
| | <br> |
| | |
|
| |
|
| == Arbeitsauftrag 27.04. == | | == Arbeitsauftrag 27.04. == |
Diejenigen unter euch, die in der Oberstufe Chemie belegt haben, sollten diese Aufgaben wirklich bearbeiten. Bitte meldet mir Unklarheiten auch möglichst zeitnah zurück. Für diejenigen, die kein Chemie belegt haben, können die Aufgaben trotzdem ganz nützlich sein. Vor allem in der ersten Hälfte der elften Klasse in Biologie wird oft auf die chemischen Grundlagen bestimmter Stoffwechselreaktionen zurückgegriffen.
Arbeitsauftrag Chemie für den 04.05.
Verbesserung der Hausaufgabe
Pflicht: Sucht bei euch zu Hause drei völlig verschiedene Lebensmittel, die sauer sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen").
Freiwillig: Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist!
- z.B.: Essig - Essigsäure (CH3-COOH)
- z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C6H8O7)
- z.B.: Joghurt (allgemein Sauermilchprodukte) - Milchsäure (C3H6O3)
- z.B.: Limo (allgemein sprudelnde Getränke) - Kohlensäure (H2CO3)
Die "Gegenspieler" der Säuren
In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer polaren Atombindung zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die heterolytisch ein Proton abspalten können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).
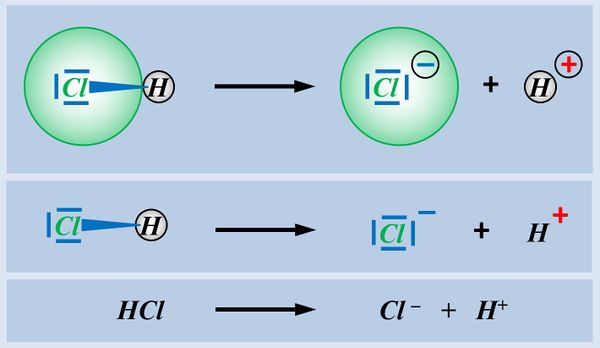
Moleküle, bei denen eine derartige Reaktion möglich ist, nennt man Säuren. Typische Eigenschaften von Säuren sind z.B. der "saure Geschmack" oder "greifen unedle Metalle an". Diese Eigenschaften sind auf das abspaltbare Proton zurückzuführen.
Sicher können sich diejenigen, die Chemie schon länger in der Schule hatten erinnern, dass es zu Säuren einen "Gegenspieler" gibt. Wie heißen diese Gegenspieler?
Basen oder Laugen (als Lauge bezeichnet man in der Regel eine wässrige Lösung einer Base)
Diese Gegenspieler sind in der Lage, die saure Wirkung von Säuren zu neutralisieren, also aufzuheben. Dazu gleich ein Versuch. Vorher noch etwas Theorie: Wenn die saure Wirkung einer Säure darauf beruht, dass die Säure-Teilchen ein Proton abgeben, welche Fähigkeit muss dann ein solches Gegenspieler-Teilchen besitzen, wenn es diese Wirkung aufzuheben vermag?
Es muss in der Lage sein, ein Proton aufzunehmen
Beispiel
Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH3 (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:
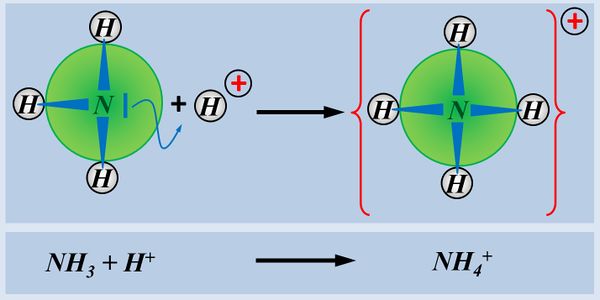
Das Ammoniak-Molekül NH3 stellt sein freies Elektronen-Paar für eine Atombindung mit einem Proton zur Verfügung
Was ist der Unterschied zwischen dieser neu gebildeten Atombindung im Vergleich zu einer "normalen" Atombindung, wie ihr sie früher kennengelernt habt?
Bei der Bildung einer Atombindung sind wir in den vorangegangenen Einheiten davon ausgegangen, dass jeder Partner ein Elektron zur Verfügung stellt. Hier stammen aber beide Elektronen der Atombindung nur vom Stickstoff-Atom. Das Proton hat kein Elektron zur Bindung beigetragen.
Versuch
Ein freiwilliger Versuch. Ihr benötigt dazu:
- Zitrone(nsaft)
- Bullrichsalz (Tabletten oder Pulver), falls nicht verfügbar ist auch Backpulver möglich.
- 2 kleine Gläschen (z.B. Schnapsgläser)
Durchführung:
- Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Pulver oder einen halben Teelöffel Backpulver.
- Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um.
- Probiert von jeder Lösung einen Teelöffel voll (Ihr könnt das noch einmal wiederholen, dann aber bitte keine größeren Mengen mehr von der Backpulver-Lsg. schlucken. Backpulver kann im Magen zur Bildung großer Mengen Gas führen.
Beschreibt das Ergebnis in Form eurer Geschmacks-Empfindung
Die Lösung mit Bullrich-Salz / Backpulver sollte deutlich weniger sauer schmecken. Es kommt aber ein bisschen auf die Zitrone an. Die muss sehr sauer sein, damit der Versuch gut klappt.
Nur kurz zur Erklärung: Bullrichsalz enthält Natriumhydrogencarbonat. In Wasser gelöst entstehen Hydrogencarbonat-Ionen. Diese sind in der Lage Protonen aufzunehmen. Sie fungieren also als Base.
Die sauere Wirkung von Zitronensaft beruht auf der Zitronensäure, die ein (bzw. auch mehrere) Proton(en) abgeben kann. Nachdem diese jedoch von den Hydrogencarbonat-Ionen "abgefangen" werden, entsteht auf der Zunge kein sauerer Eindruck.
Hausaufgabe
Formuliert die Aufnahme eines Protons auf Teilchen-Ebene von folgenden Basen:
- Hydrogencarbonat-Ion
- Sulfid-Ion
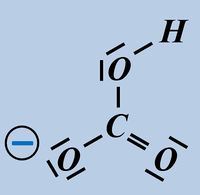
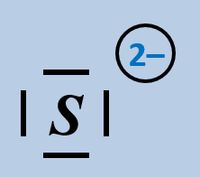
Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt!
Hast Du wirklich die Lösung schon gezeichnet?
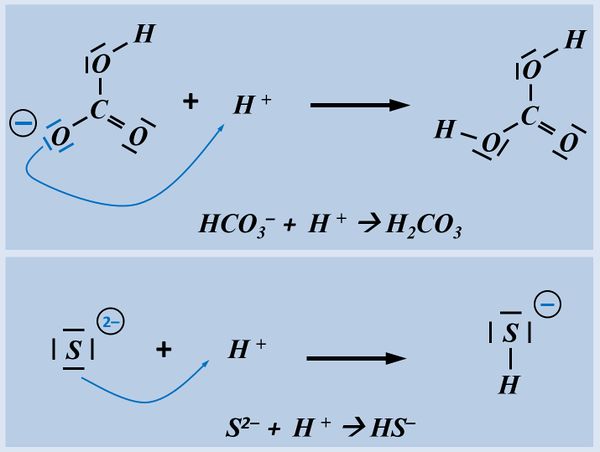
Beim Hydrogencarbonat-Ion könnte es sein, dass ihr ein anderes freies Elektronenpaar für die Bindung zum Proton verwendet habt. Das ist aber falsch! Das Proton wird immer über eines der drei freie Elektronenpaare gebunden, die am Sauerstoff mit der negativen Ladung sitzen (im Bild blau markiert). Schon allein aufgrund der elektrischen Ladung dort, wird das positiv geladene Proton dort hin gezogen.
Beim Sulfid-Ion ist egal, welches Elektronenpaar verwendet wird, das Ergebnis ist faktisch immer das selbe.
Arbeitsauftrag 27.04.
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.
Säure-Base-Reaktionen
Normalerweise würde ich das Kapitel "Säure-Base-Reaktion" sehr ausführlich behandeln. Ich beschränke mich während des Home-Schoolings auf absolute Grundlagen.
Einstieg/Wiederholung
Versucht im folgenden Bild möglichst genau zu beschreiben, was die eingekringelten Symbole bedeuten sollen. (In beiden Fällen wird das gleiche symbolisiert, es sind nur unterschiedliche Varianten.) In eurer Beschreibung sollte der Begriff "Elektronegativität (EN)" vorkommen.
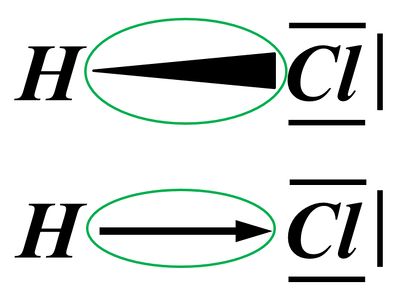
Am besten macht ihr das wirklich schriftlich, damit ihr eure Lösung mit der hier angegebenen nachträglich gut überprüfen könnt!
Die eingekreisten Symbole stehen für eine "polare Atombindung".
Beide Begriffe, polar und Atombindung, sollte man nun erklären.
Eine Atombindung entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt.
Polar sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an.
Trennung einer polaren Atombindung
Grundsätzlich bildet sich ein Molekül aus zwei Atomen ja deswegen, weil der durch die Atombindung erreichte Zustand energetisch günstiger ist, als wenn die beiden Atome alleine bleiben würden. Wir haben das schon einmal anhand eines Energie-Abstands-Diagramms für die Bildung von H2 aus 2 H dargestellt. Skizziert dieses Diagramm zur Erinnerung noch einmal:
- Was muss an den Achsen stehen?
- Wie ist der Verlauf?
- Welche Werte könnte man aus diesem Diagramm ablesen, wenn auf den Achsen welche angegeben wären?
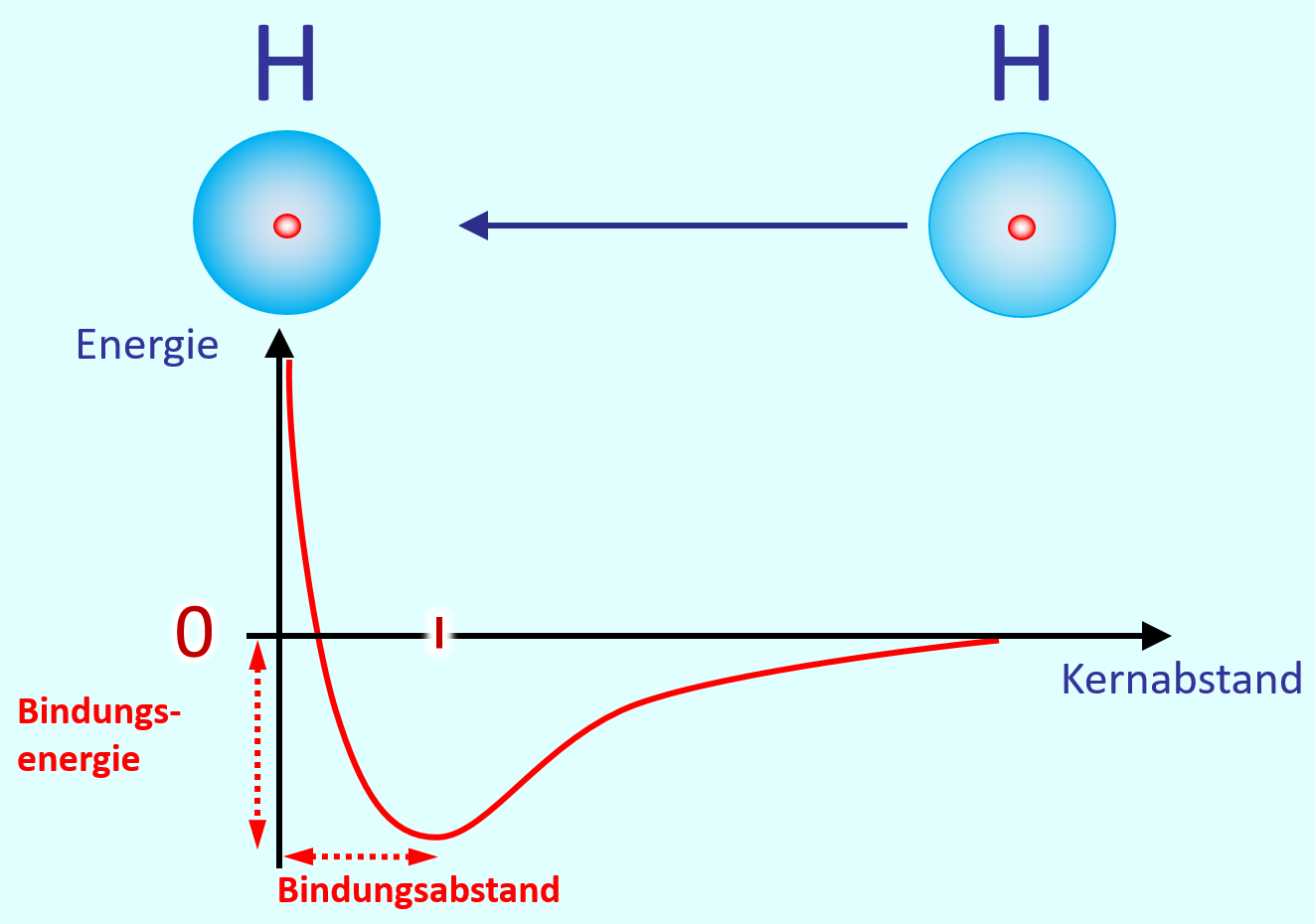
Zwei Wasserstoff-Atome würden sich bei Raumtemperatur daher nicht spontan voneinander trennen. Die Atombindung ist zu stark. Bei polaren Atombindungen gibt es Situationen, in denen das anders ausschaut. Vor allem, wenn der eine Bindungspartner Wasserstoff ist. Bleiben wir bei dem oben dargestellten Molekül "Hydrogenchlorid" (HCl). Hier lassen sich die beiden Partner sehr leicht voneinander trennen. Warum?
Bevor diese Frage beantwortet wird vorher wieder etwas zum Auffrischen:
- Wie viele Elektronen besitzt ein einzelnes Chlor-Atom insgesamt?
- Wie viele davon sind Valenzelektronen?
- Was muss passieren, damit dieses Chlor-Atom Edelgaskonfiguration erreicht?
- Wie viele Elektronen besitzt ein einzelnes Wasserstoff-Atom insgesamt?
- Wie viele davon sind Valenzelektronen?
- Was muss passieren, damit Wasserstoff-Atom Edelgaskonfiguration erreicht?
- Wirklich? Keine zweite Möglichkeit?
- Ein Chlor-Atom besitzt insgesamt 17 Elektronen
- Sieben davon sitzen auf der äußersten Schale, sind also Valenzelektronen
- Chlor muss ein Elektron aufnehmen
- Ein Wasserstoff-Atom besitzt ein Elektron
- ...sehr witzig...
- Es muss eins aufnehmen, um die Edelgas-Konfiguration von Helium zu erreichen (Zwei Elektronen auf der innersten Schale, die damit voll besetzt ist und einen sehr energiearmen Zustand darstellt)
- Das haben wir noch nicht besprochen: Wasserstoff könnte das eine Elektron auch abgeben. Dann hat es überhaupt keins mehr. Vom Wasserstoffatom bliebe dann nur das eine Proton im Kern übrig. Das ist zwar keine klassische Edelgaskonfiguration, aber dennoch auch ein sehr energiearmer Zustand.
Die folgende Aussage ist "anthropomorph". Das bedeutet, man tut so, als wären die betrachteten Teilchen Lebewesen/Menschen mit Gefühlen und Bedürfnissen. Das ist natürlich nicht so! Solche Aussagen sind aber oft sehr leicht verständlich für Schülerinnen und Schüler. Ich werde die Aussage erst später fachwissenschaftlich umformulieren:
O.k., schauen wir uns die Situation mal an: Wir haben zwei Atome, ein Wasserstoff-Atom und ein Chlor-Atom. Beide teilen sich ein Elektronenpaar und bilden daher ein Molekül. Das Chlor-Atom ist unglaublich scharf auf das Elektronenpaar. Wenn es beide Elektronen haben könnte, hätte es Edelgaskonfiguration. Das Wasserstoff-Atom könnte mit beiden Elektronen zwar auch etwas anfangen, ist aber auch glücklich, wenn es überhaupt kein Elektron mehr hat.
WAS WIRD WOHL PASSIEREN?
Wer keine Ahnung hat, was das soll, vielleicht noch ein anderes Beispiel: Ihr habt ein kleines Geschwister. Das hat zum Geburtstag ein Playmobil-Pferd geschenkt bekommen. Ihr habt den passenden Playmobil-Cowboy dazu, den ihr irgendwie ganz witzig findet. Euer kleines Geschwister kommt permanent zu euch ins Zimmer und will mit euch und eurem Playmobil-Cowboy spielen. Eine Zeit lang macht euch das auch Spaß und ihr macht mit. Aber plötzlich klingelt euer Handy und euer... bester Freund/beste Freundin ist dran. WAS MACHT IHR? - Vermutlich: Ihr schenkt euren Playmobil-Cowboy eurem Geschwister und schickt ihn aus dem Zimmer. Übertragt das jetzt auf die Atome!
Das bindende Elektronenpaar (Playmobil-Pferd + Playmobil-Cowboy) wird komplett auf das Chlor-Atom (euer Geschwister) übertragen. Es entsteht ein positiv geladenes Wasserstoff-Teilchen (vorher: ein positiv geladenes Proton im Kern, ein negatives Elektron in der Hülle; jetzt; nur noch ein Proton) und ein negativ geladenes Chlor-Teilchen (vorher: 17 Protonen im Kern, 17 Elektronen in der Hülle; jetzt: 17 Protonen im Kern, 18 Elektronen in der Hülle.
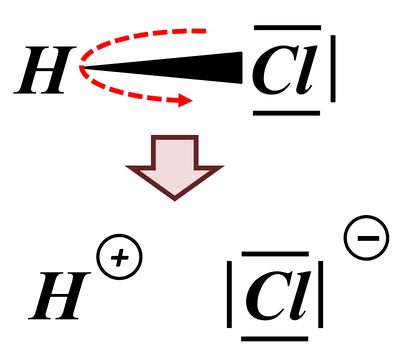
Man spricht in so einem Fall von einer heterolytischen Bindungstrennung. "Bindungstrennung" bedeutet, dass eine Bindung getrennt wird (ziemlich logisch...) und "hetero"(lytisch) bedeutet, dass die Bindung (bzw. besser: das bindende Elektronenpaar) "ungleichmäßig" aufgeteilt wird. Es gibt auch die "homolytische Bindungstrennung", bei der wird die Bindung so aufgeteilt, dass jeder Partner ein Elektron des bindenden Paares bekommt. Das ist hier aber nicht so: Das Wasserstoff-Atom bekommt gar kein, das Chlor-Atom beide. Deswegen: heterolytische Bindungstrennung.
Die Abspaltung eines Wasserstoffteilchens nach diesem Muster ist etwas, was viele Moleküle können (wenn ein passender Reaktionspartner zur Verfügung steht). Man zählt solche Moleküle zur Gruppe der "Säuren". Wenn z.B. etwas "sauer" schmeckt, dann sicher deswegen, weil eine Säure enthalten ist, also ein Molekül, das durch heterolytische Bindungstrennung ein Proton (das was vom Wasserstoffteilchen nach der Abspaltung übrig bleibt) abgespalten hat.
Man kann diese Abspaltung als chemische Gleichung formulieren:
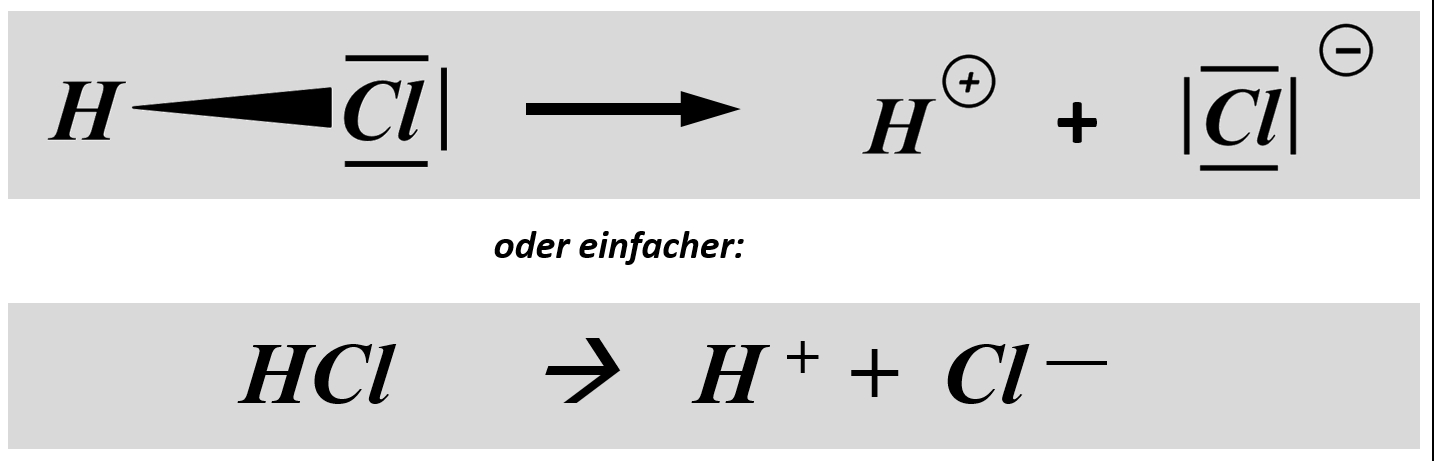
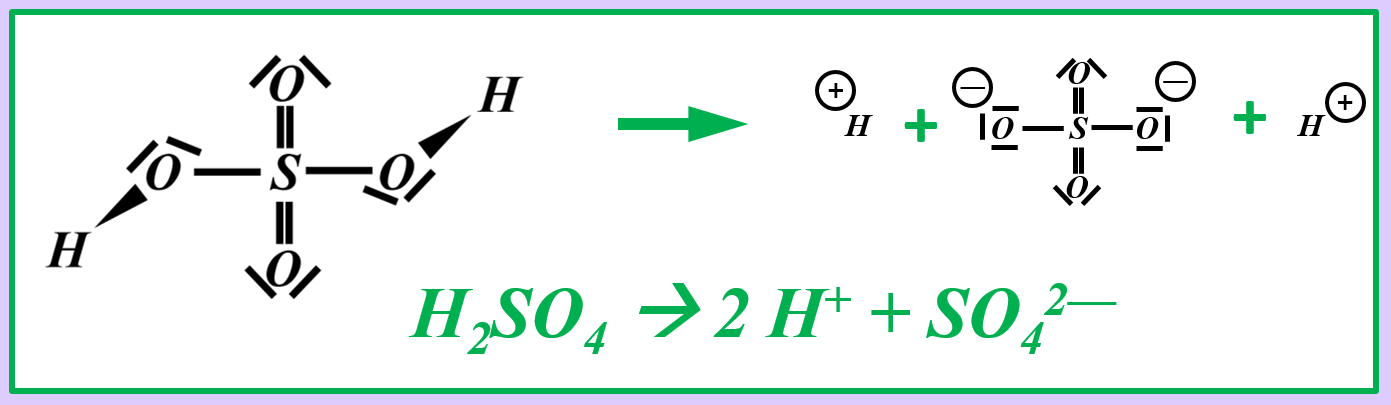
Stellt nach dem gleichen Muster die chemischen Gleichungen (beide Varianten: mit und ohne Valenzstrichformel) für die heterolytische Bindungstrennung für folgende Säure-Moleküle auf:
- Hydrogenfluorid (HF)
- Iodsäure (HIO3)
- Schwefelsäure (H2SO4)
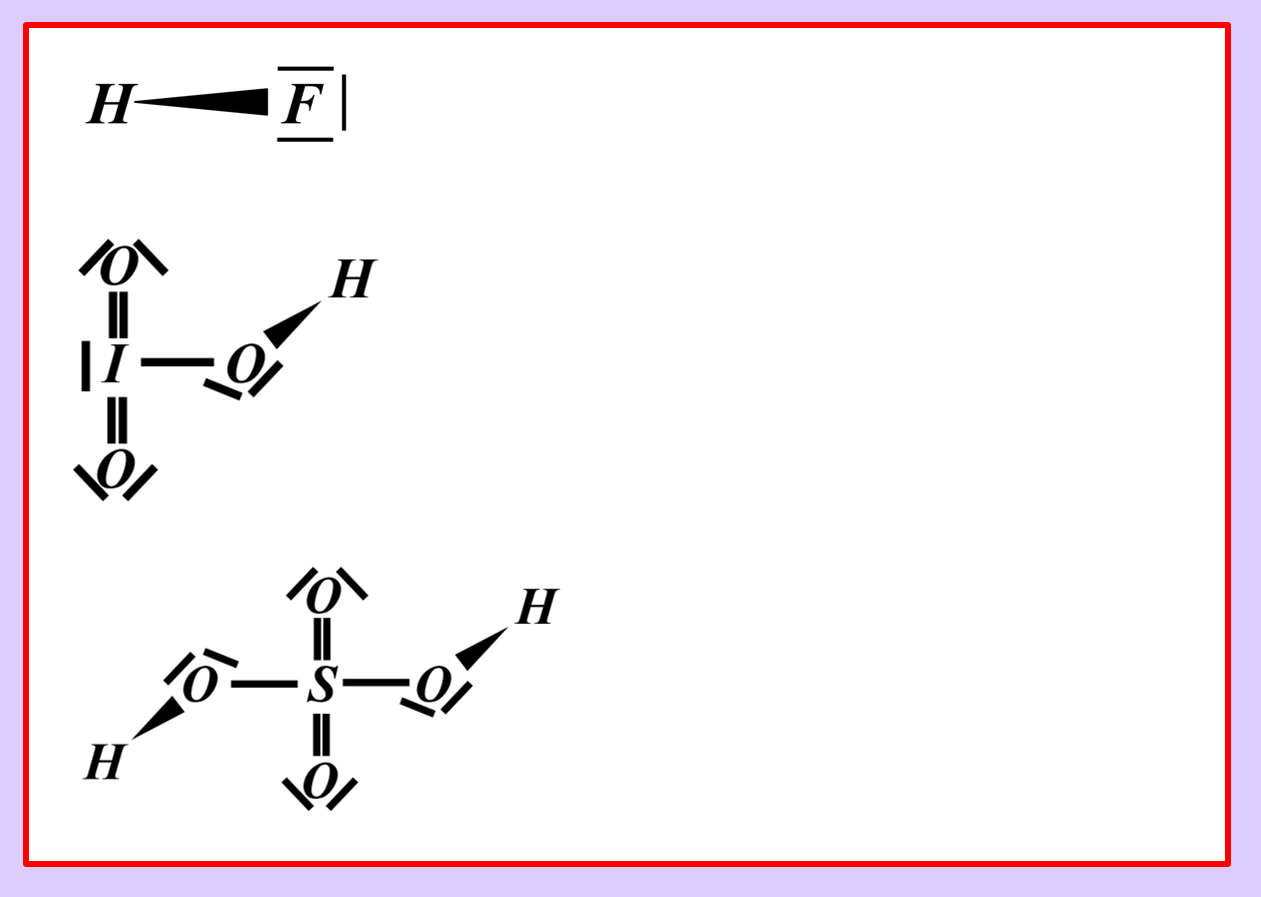
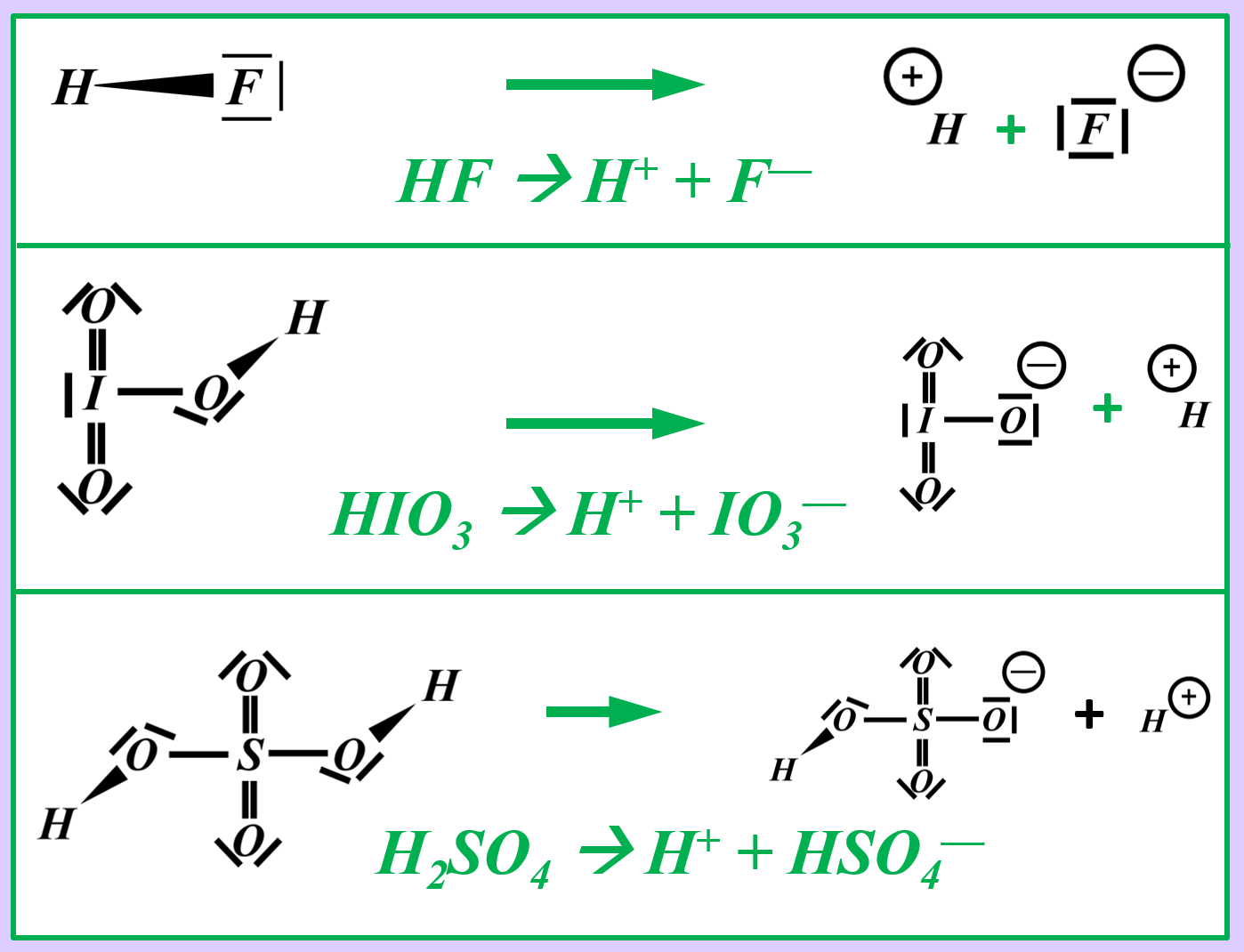
Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
Hausaufgabe
Das Buch geht hier anders vor, deswegen keine Seiten im Buch lesen. Eher etwas praktisches als Hausaufgabe:
Pflicht: Sucht bei euch zu Hause drei völlig verschiedene Lebensmittel, die sauer sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen").
Freiwillig: Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist!
Arbeitsauftrag 20.04.
Wiederholung
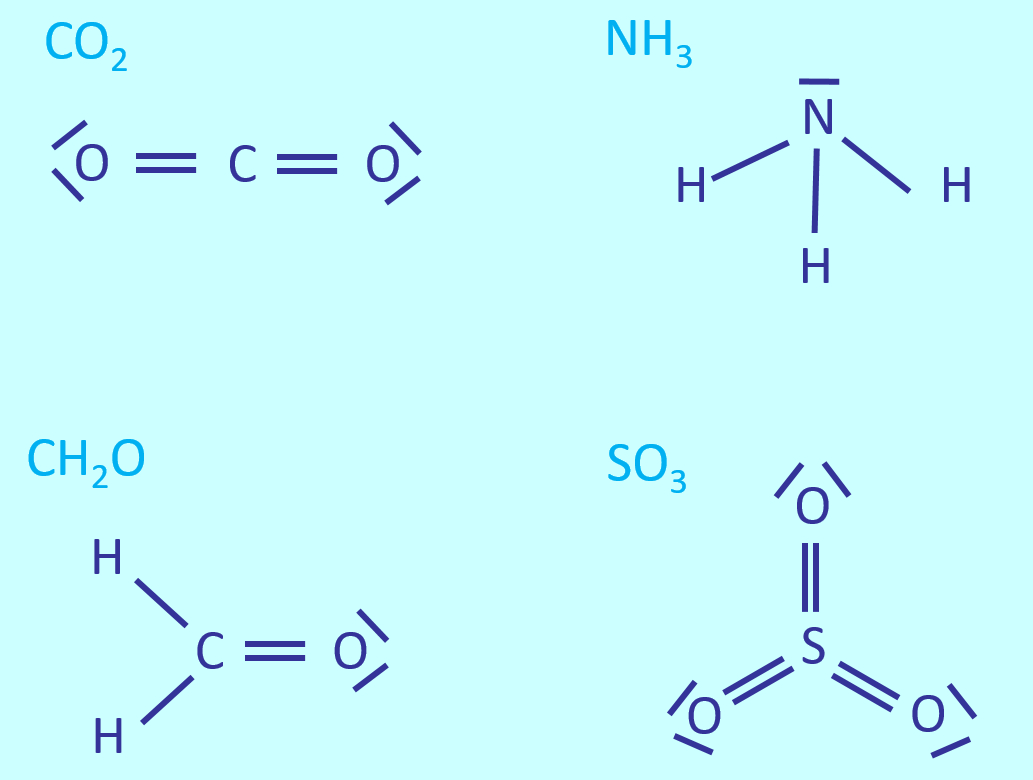
Ein paar einfache Aufgaben, um euch nach zwei Wochen Ferien langsam wieder auf Betriebs-Temperatur zu bringen:
- Zeichnet die Valenzstrichformeln für: CO2, NH3, CH2O, SO3
- Stellt die Bildung der folgenden Salze aus den Element in Form von chemischen Gleichung dar: Calciumoxid, Aluminiumchlorid, Magnesiumnitrid
Das war es schon für heute
Falls ihr Schwierigkeiten mit den Aufgaben hattet, meldet euch bitte bei mir.