10d 2020 21/Chemie
Inhaltsverzeichnis
Lernen zu Hause
Distanzunterricht Dienstag, 20.04.
In der heutigen Einheit soll es um einen typischen Reaktionstyp gehen, an dem Carbonsäuren beteiligt sind. Ihr braucht dazu später das Schulbuch und das unten verfügbare Arbeitsblatt (das nicht zwangsläufig ausgedruckt werden muss).
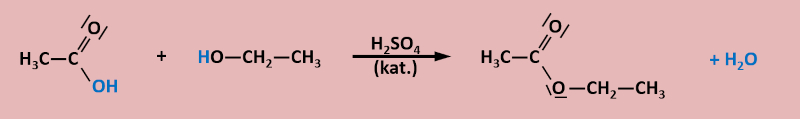
Erhitzt man in einem Rundkolben, auf dem ein Rückflusskühler sitzt (ihr könnt euch die Apparatur später im Buch auf S. 123 anschauen), Essigsäure (systematischer Name: Ethansäure) mit Ethanol, so ist nach einigen Minuten im Reaktionsgefäß deutlich der Geruch von "Klebstoff" wahrnehmbar. Dieser Geruch ist auf den entstanden Stoff "Essigsäureethylester" zurückzuführen.
Einige Ergänzungen:
- Als Katalysator für diese Reaktion sind zusätzlich einige Tropfen Schwefelsäure erforderlich. Für die weiteren Betrachtungen sollen diese jedoch keine Rolle spielen.
- Alle Schülerinnen und Schüler identifizieren den Geruch sofort als "Uhu" oder eben "Klebstoff". Die von Kindern häufig in der Schule verwendeten Klebestifte enthalten aber schon seit vielen Jahren keinen Essigsäureethylester mehr.
Zur eigentlichen Aufgabe: Das folgende Bild zeigt die beiden Ausgangsstoffe und das Endprodukt. Versucht möglichst genau stichpunktartig zu beschreiben, was bei dieser Reaktion passiert ist! Zur Erleichterung sind die Kohlenstoffatome der Säure rot und die C-Atome des Alkohols blau markiert.
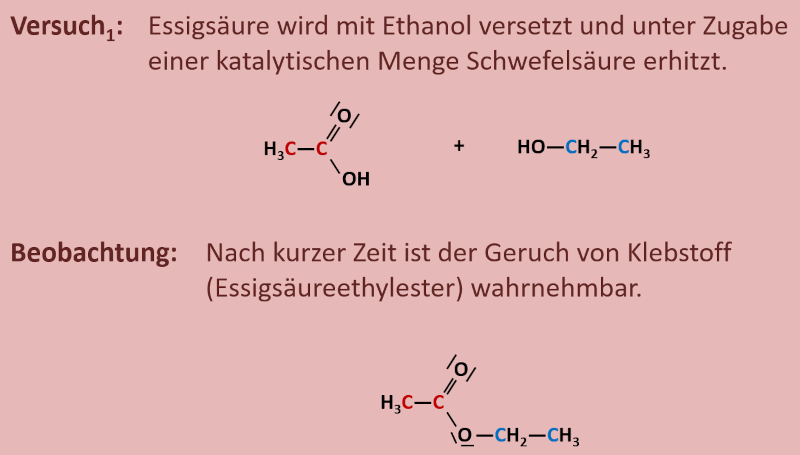
Die beiden Moleküle werden unter Wasserabspaltung miteinander verknüpft.
Stellt jetzt die chemische Gesamtgleichung für die Reaktion auf!
Betrachte die an dieser Reaktion beteiligten Stoffe nun aus physikalischer Sicht: Der Siedepunkt der Essigsäure (Ethansäure) liegt bei 118°C, der von Ethanol bei 78°C. Begründe, welchen ungefähren Siedepunkt beim Essigsäureethylester erwartest!
Folgende Gedanken sollten in Deine Überlegung eingeflossen sein:
- Sowohl die Säure als auch der Alkohol haben (gemessen an ihrer Größe, bzw. ihrem molaren Gewicht) hohe Siedepunkte, da bei ihnen starke zwischenmolekulare Kräfte wirken. Dazu zählen Wechselwirkungen zwischen permanenten Dipolen, aber vor allem die Fähigkeit Wasserstoffbrücken ausbilden zu können.
- Im Ester können keine Wasserstoffbrücken mehr ausgebildet werden. Es fehlen H-Atome, die an ein stark elektronegatives Element (z.B. Sauerstoff) gebunden sind. Damit sollten die Siedepunkte deutlich niedriger liegen als vergleichbar schwere Moleküle, die H-Brücken ausbilden können.
- Der Ester ist größer und schwerer als die Säure und der Alkohol. Das wird den Siedepunkt etwas erhöhen. Denn je größer ein Moleküle, desto leichter lassen sich Dipole induzieren und die van-der-Waals-Kräfte nehmen zu.
Letztlich liegt der Siedepunkt von Essigsäureethylester bei 77°C.
Lest nun die S. 123 im Buch. Beantwortet anschließend folgende Fragen:
- Warum erhitzt man den Reaktionsansatz überhaupt (Grund im Buch nicht enthalten, das ist Grundwissen)
- Selbst wenn man den Ansatz nur so leicht erwärmen würde, dass die Ausgangsstoffe noch nicht sieden, braucht man trotzdem einen Rückflusskühler. Warum?
- Was bedeutet bei chemischen Reaktionen der Begriff "Kondensation"?
- Je höher die Temperatur, desto schneller laufen chemische Reaktion ab
- Der Siedepunkt des Produkts liegt niedriger als die Siedepunkte der Edukte. Ohne Rückflusskühler würde das Produkt das Reaktionsgefäß verlassen und wäre verloren. In der Regel führt man eine chemische Reaktion ja aber durch, weil man das Produkt haben möchte.
- Bei einer Kondensation werden zwei Moleküle unter Abspaltung einer kleinen Gruppe (hier: Wasser) miteinander verknüpft.
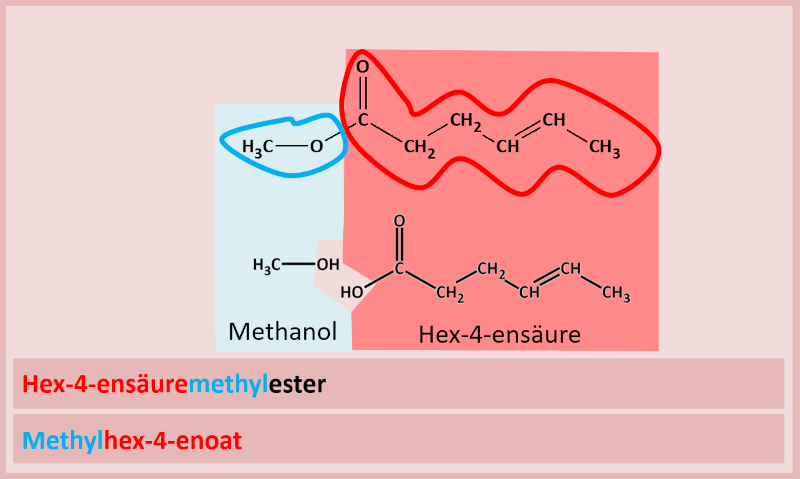
Es gibt verschiedene Möglichkeiten Ester zu benennen.
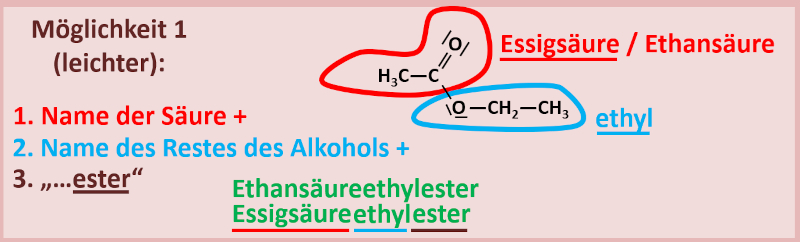
1. Variante
Man nennt zuerst den Namen der Säure (entweder den Trivialnamen oder den systematischen Namen), hängt dann den Namen des Alkyl-Restes vom Alkohol an (man tut also so, als wäre der Alkohol eine Seitengruppe eines größeren Moleküls) und lässt den Namen auf -ester enden. Bsp.:
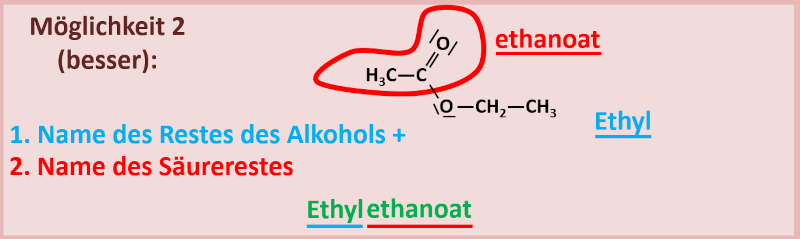
2. Variante
Man nennt zuerst den Alkohol-Rest und dann den Namen des Säure-Restes. Bei einem Säure-Rest wird die sonst übliche Endung ...-säure ersetzt durch ...-oat. Also z.B. Ethansäure wird zu Ethanoat. Das funktioniert allerdings nur mit den systematischen Namen. Mit Trivialnamen geht das nicht, der Rest der Ameisensäure heißt also nicht Ameisenoat. Die Ameisensäure heißt systematisch Methansäure, ihr Rest würde Methanoat heißen. Tatsächlich würde es aber auch für die Säurereste Trivialnamen geben. Bei der Ameisensäure wäre das z.B. "Formiat"...
Haltet euch am besten an die systematischen Namen. Die sind eindeutig! Bsp.:
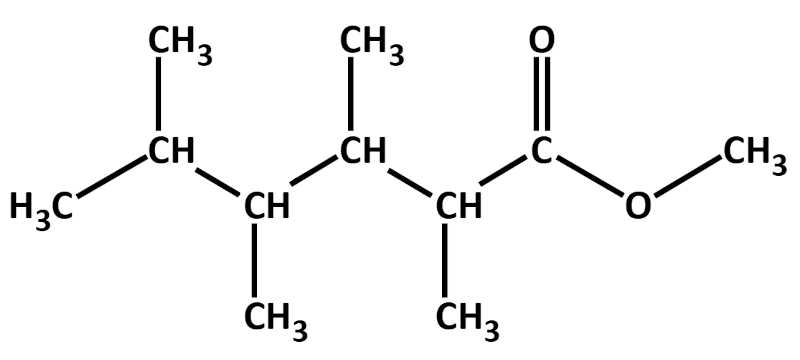
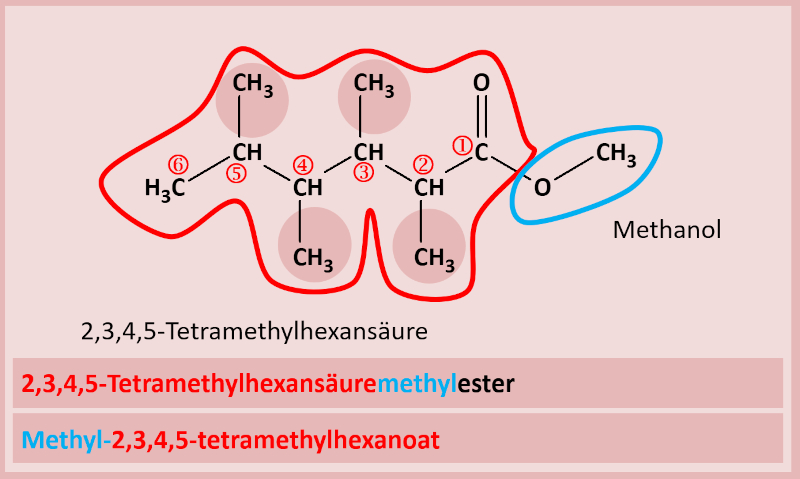
Hier zwei weitere Beispiele mit Lösung:
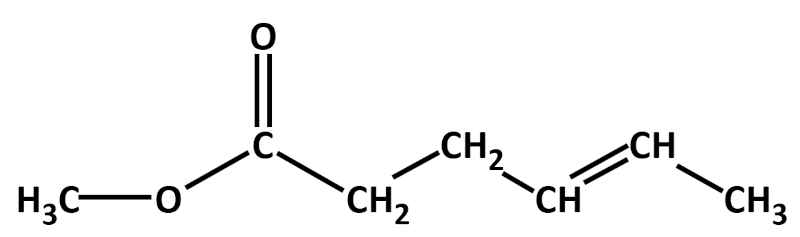
Bearbeitet nun nach diesem Muster das folgende Arbeitsblatt!
- Arbeitsblatt als pdf-Datei: Hier klicken
- Lösungsvorschlag als pdf-Datei: Hier klicken
Wer schnell gearbeitet hat und noch Zeit übrig ist, kann den Mechanismus der Esterbildung auf S. 126 genauer unter die Lupe nehmen.
- Formuliert den Mechanismus für die säurekatalysierte Bildung von Essigsäurepropylester!
Distanzunterricht Dienstag, 13.04.
Hallo 10d!
Also wieder Distanzunterricht... Na ja,... Was will man machen.
Um euch wieder auf Betriebstemperatur zu bringen: Vor den Ferien haben wir zum einen über das Erstellen guter PowerPoint-Präsentationen gesprochen. Behaltet das im Hinterkopf! Ihr werdet alle in diesem Schuljahr noch ein Referat halten. Zur Not auch von zu Hause aus per Videokonferenz.
Zum anderen haben wir begonnen über Carbonsäuren zu sprechen. Dazu habt ihr ein Übungsblatt bekommen. Auf der einen Seite war eine Wiederholungseinheit zu anorganischen Säuren aus der 9. Jahrgangsstufe. Diese Seite haben wir im Unterricht bereits verbessert. Die zweite Seite enthielt weitere Arbeitsaufträge, die wir noch nicht besprochen haben. Hier zunächst noch einmal das Arbeitsblatt, falls es euch nicht mehr zur Verfügung steht, die Vorderseite enthält schon eine Musterlösung:
Bearbeitet die zweite Seite des Arbeitsblattes erneut! Wenn ihr das vor den Ferien tatsächlich bereits erledigt habt, dann versucht diesmal ohne erneutes Lesen der Buchseiten sofort die Aufgaben zu lösen.
- Buch, S. 114 - 115 lesen
- Aufgabe 2 auf S. 114 lösen
- Buch, S. 118 - 119 lesen
- Interpretiere Abb. 1 auf S. 119
- Interpretiere Abb. 3 auf S. 119
- Bearbeite Aufgabe 1 auf S. 119
1. Sofern ihr es noch nicht getan habt, widmet euch der "freiwilligen Aufgabe" auf dem Arbeitsblatt:
Woher hat Pimelinketon seinen Namen?
- Verwendet auf keinen Fall mehr als 15 Minuten für diese Aufgabe! Ich werde euch die Auflösung am Mittwoch sagen.
2. Ein PPP-Effekt: Ich habe versucht euch klar zu machen, dass man bei Referaten in der PowerPoint-Präsentation möglichst viele Aspekte anschaulich visualisieren sollte. Text sollte so weit es geht, vermieden werden. In den letzten Jahren bin ich mit den zehnten Klassen immer eine Stunde pro Woche in den Computerraum gegangen, um dort das Erstellen anschaulicher Präsentationen zu üben. Im folgenden Video (3:55min) ist ein Problem beschrieben, auf das ein Schüler in diesen Stunden gestoßen ist und lange keine Lösung gefunden hat. Vielleicht bekommt ihr es ja hin?
- Auch hier: Verwendet auf keinen Fall mehr als 15 Minuten für diese Aufgabe! Ich werde euch eine Lösung am Mittwoch zeigen.
Distanzunterricht Dezember bis März
- s. Archiv: Hier klicken
Versuchsprotokolle
Versuchsprotokoll vom 23.09.: Eigenschaften von Alkanen
- Hier zum Herunterladen
Lösungen für Aufgaben
Termine
Schulaufgabe: Mittwoch, 13.01.2021
- Lernstoff: Neben den Hefteinträgen eignen sich folgende Seiten im Buch (Galvani Chemie 3) zur Vorbereitung auf die Schulaufgabe:
- S. 20 - 21 Die Chemie der Kohlenstoffverbindungen
- S. 22 - 23 Kohlenstoff als Bindungspartner
- S. 32 - 33 Die homologe Reihe der Alkane
- S. 36 - 37 Die Familie der Alkane genauer betrachtet
- S. 40 - 41 Wie aus Erdöl andere Produkte entstehen
- S. 42 - 43 Vom Erdöl zum Benzin
- S. 48 Die homologe Reihe der Alkene
- S. 50 - 51 Die homologe Reihe der Alkine
- S. 58 - 59 Die Verbrennung von Kohlenwasserstoffen
- S. 63 - 64 Die radikalische Substitution (NICHT DER MECHANISMUS AUF S. 65)
- S. 66 Die elektrophile Addition (NICHT DER MECHANISMUS AUF S. 67)
- Die Benennung von organischen Molekülen müsst ihr beherrschen! Folgende Seiten im Buch helfen:
- S. 34 - 35 Alkane
- S. 49 ungesättigte Kohlenwasserstoffe
- S. 62 Halogenkohlenwasserstoffe