10d 2020 21/Chemie: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
(AA f. 19.01. hierher verschoben) Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 1: | Zeile 1: | ||
== | ==Lernen zu Hause== | ||
=== Distanzunterricht Montag, 18.01. === | |||
Hallo 10d! <br> | |||
In der letzten Woche kam es vor allem in der 1. Stunde zu Problemen bei manchen Videokonferenzen. Höchstwahrscheinlich ist der Server überlastet, an dem Problem wird gearbeitet. Solange verzichte ich auf die Videokonferenz in der 1. Stunde, ich kann mit euch ja auch in der zweiten Stunde sprechen. Der Zeitplan für heute sieht also so aus: | |||
* Um 07:50 Uhr solltet ihr einen Arbeitsauftrag über den Schulmanager erhalten haben, auf den ihr bis spätestens 08:15 Uhr antwortet. Das dient zunächst als Anwesenheitskontrolle. Erhalte ich keine Rückmeldung von euch, melde ich euch im Sekretariat als fehlend (was vermutlich dazu führt, dass eure Eltern informiert werden). | |||
* Ihr arbeitet bis 09:00 Uhr alleine an diesem Arbeitsauftrag<br> | |||
* Dann starte ich eine BBB-Konferenz und wir besprechen, was ihr hier geschafft habt. | |||
Für diesen Arbeitsauftrag benötigt ihr euer '''Buch '''und einen '''Zettel mit Stift'''. | |||
<br> | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Wiederholung von letzter Stunde'''</span> | |||
|Inhalt= | |||
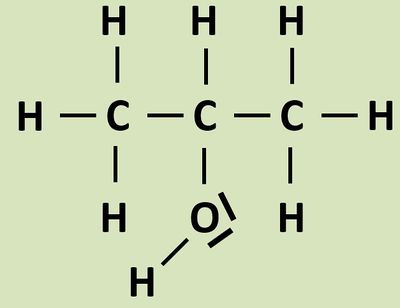
In der letzten Stunde habt ihr die Stoffklasse der Alkohole kennengelernt. Überlegt noch einmal, welches Strukturmerkmal bei allen Stoffen dieser Klasse gleich ist! | |||
{{Lösung versteckt| | |||
Alkohole besitzen eine Hydroxygruppe: -OH | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
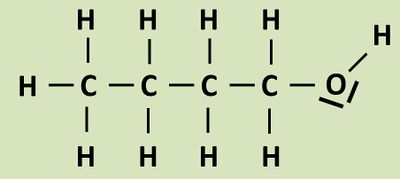
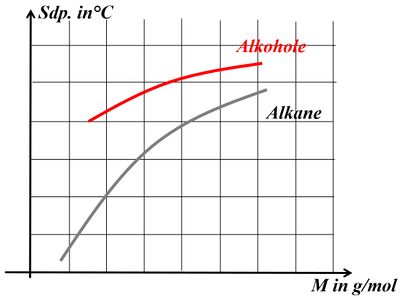
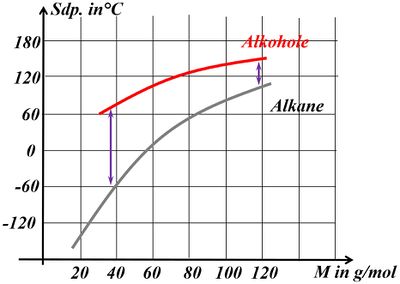
Diese funktionelle Gruppe im Molekül hat Auswirkungen auf die physikalischen Eigenschaften. Vergleicht die beiden Stoffe Propan-1-ol und Butan hinsichtlich ihrer Siedepunkte und begründet die Unterschiede so genau wie möglich! - Ihr müsst die Lösung zu dieser Aufgabe nicht ausführlich hinschreiben, aber notiert Stichpunkte, die ihr in einer Schulaufgaben-Situation genauer ausführen würdet. Eine solche Aufgabe könnte in einer schriftlichen Arbeit - je nachdem in welchem Zusammenhang sie gestellt wird - 10 BE oder mehr wert sein. | |||
{{Lösung versteckt| | |||
* Propan-1-ol hat den deutlich höheren Sdp. | |||
* Um einen Stoff zum Sieden zu bringen, müssen die Teilchen (hier: Moleküle) eines Stoffes voneinander getrennt werden | |||
* Je höher die Siedetemp. desto mehr Energie muss man anscheinend aufwenden, um die Moleküle voneinander zu trennen. Umso größer müssen offensichtlich die '''Zwischenmolekularen Anziehungskräfte''' sein. | |||
* Beim Butan wirken als Zwischenmolekularen Kräfte nur die schwachen '''Van-der-Waals-Kräfte''': Aufgrund von Fluktuationen in der Elektronenhülle kommt es zu '''spontanen Dipolen''' (mit geringen Partialladungen), die im Nachbarmolekül '''induzierte Dipole''' erzeugen. Die Stärke der Van-der-Waals-Kräfte hängt von der Größe bzw. der Masse des Moleküls ab. | |||
* Beim Propan-1-ol wirken zwei weitere (starke bis sehr starke) Zwischenmolekulare Anziehungskräfte. Zum einen stellt die Hydroxy-Gruppe aufgrund der großen '''Elektronegativitätsdifferenz''' zwischen den C- und O- bzw. den H- und O-Atomen einen '''permanenten Dipol''' mit relativ starken '''Partialladungen '''dar. Hier ziehen sich die Moleküle stark an. | |||
* Zum anderen ist das Molekül in der Lage '''Wasserstoffbrückenbindungen''' auszubilden: Sehr starke Anziehungskräfte zwischen Wasserstoffatomen, die an ein stark elektronegatives Element gebunden sind (hier der Fall: Das H-Atom der Hydroxygruppe) und den freien Elektronenpaaren von stark elektronegativen Element der 2. Periode (hier der Fall: Das O-Atom der Hydroxy-Gruppe) | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
Ihr könnt hier einen Hefteintrag zu der letzten Einheit herunterladen, den ihr entweder abschreibt oder ausdruckt und in euer Heft klebt: [[Spezial:FilePath/18_Alkohole1_Sdp_Lslchkt.pdf| pdf-Datei]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Neu: Benennung von Alkoholen'''</span> | |||
|Inhalt= | |||
Die Benennung von Alkoholen ist relativ simpel. Lest daher zunächst die S. 81 in eurem Buch und bearbeitet dann die Aufgaben 1 - 3! (Den kleinen Absatz links unten "Abgrenzung zwischen Stellung und Wertigkeit" lasst ihr bitte weg.)<br> | |||
<br> | |||
{{Lösung versteckt| | |||
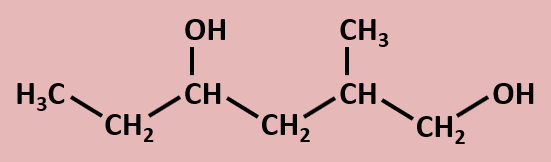
[[Datei:2Methylhexan14diol.jpg]] | |||
|Lösung 1a|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
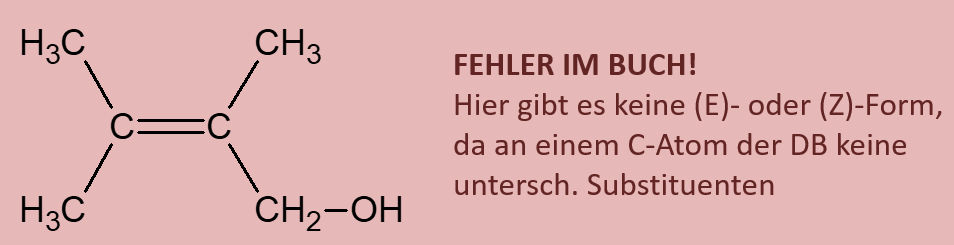
[[Datei:23Dimethylbut2en1ol.jpg]] | |||
|Lösung 1b|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
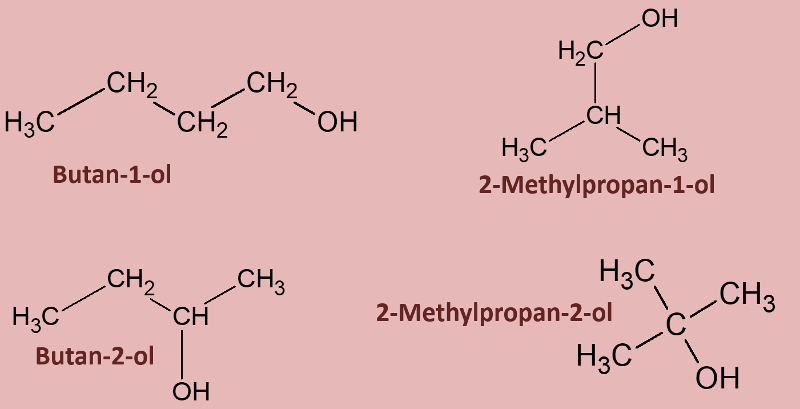
[[Datei:4IsomereButanol.jpg]] | |||
|Lösung 2|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
3-Methylpentan-2,3,4-triol | |||
|Lösung 3|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | {{Box-spezial | ||
|Titel=<span style="color:# | |Titel=<span style="color:#607">'''Es gibt verschiedene Alkohol-Typen'''</span> | ||
|Inhalt= | |Inhalt= | ||
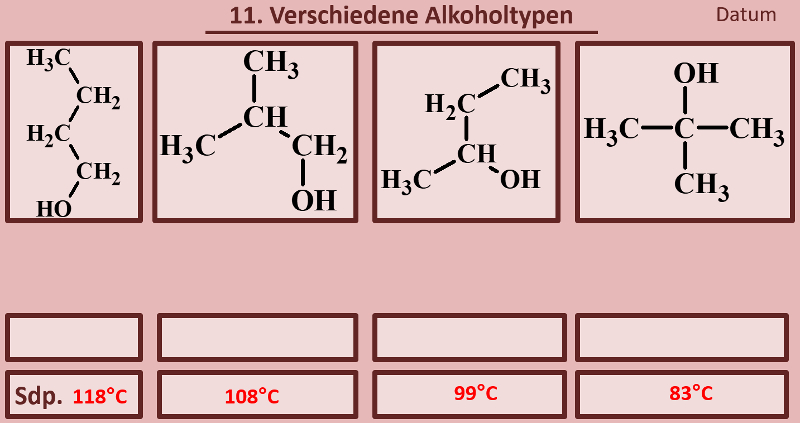
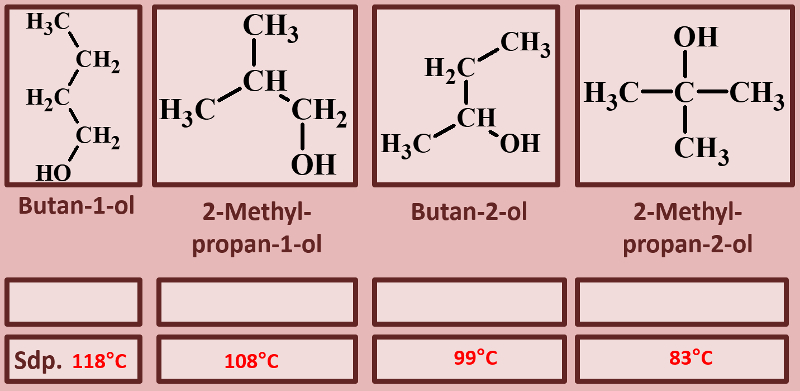
Betrachtet die folgenden Alkohole und deren Siedepunkte. Benennt zunächst die Alkohole! Stellt dann eine Hypothese auf, welche die unterschiedlichen Siedepunkte erklären könnte! Die Masse aller vier Alkohole ist gleich, außerdem sind es Konstitutionsisomere (gleiche Bausteine nur anders zusammengesetzt), daher ist es (bei eurem aktuellen Wissensstand) evtl. verwunderlich, warum sich die Siedepunkte überhaupt unterscheiden.<br> | |||
[[Datei:divAlkTypen_primsekter.jpg]]<br> | |||
{{Lösung versteckt| | |||
[[Datei:divAlkTypen_primsekter_ML_Benennung.jpg]] | |||
|Benennung überprüfen|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Warum Butan-1-ol den höchsten Siedepunkt im Vergleich zu den anderen hat solltet ihr bereits erklären können, wenn nicht, lest jetzt im Buch auf der Seite 36 den Abschnitt "Unterscheide beruhen auf Gemeinsamkeiten". | |||
{{Lösung versteckt| | |||
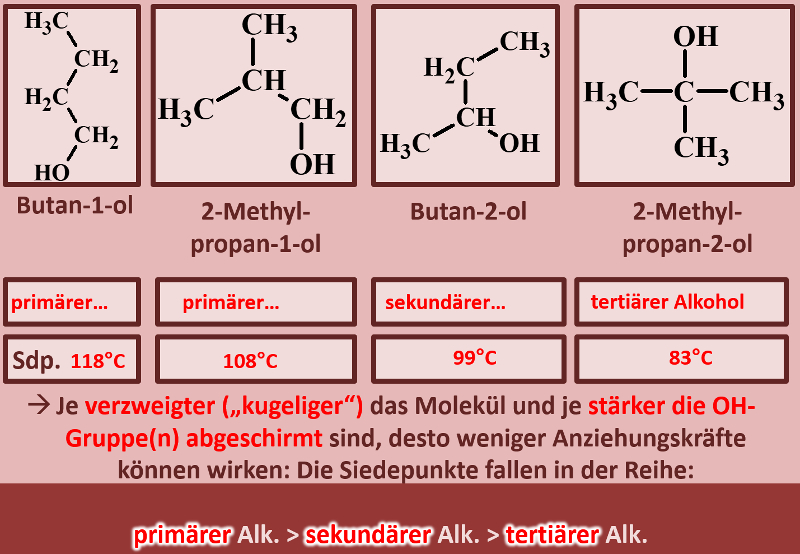
Butan-1-ol ist ein langgestrecktes Molekül. Dadurch entstehen große Kontaktflächen zwischen den Molekülen und das vergrößert die Van-der-Waals-Kräfte. Die anderen Alkohole sind verzweigt und damit "kugeliger", die Oberfläche wird also kleiner und die Van-der-Waals-Kräfte schwächer. Das führt zu geringeren Anziehungskräften zwischen den Molekülen und damit zu geringeren Siedepunkten. | |||
|Hab´s gelesen, weiß Bescheid|Lösung ausblenden}}<br> | |||
|Tipp 1 anzeigen|Lösung ausblenden}}<br> | |||
<br> | |||
{{Lösung versteckt| | |||
Damit die Stelle des Moleküls, an denen ein permanenter Dipol vorliegt (also die OH-Gruppe) gut mit anderen OH-Gruppen wechselwirken kann, sollte sie möglichst "frei in der Gegend herum baumeln" oder "von allen Seiten zugänglich sein". Vergleicht unter diesem Gesichtspunkt die Situation bei den vier Molekülen! | |||
{{Lösung versteckt| | |||
Bei den verzweigten Alkoholen wird die OH-Gruppe teilweise von angrenzenden Methylgruppen abgeschirmt. Andere Moleküle können sich ihr also nicht so gut nähern. Daher funktioniert auch die Anziehung nicht so gut und die Siedepunkte fallen. | |||
|Ahhh! Verstehe|Lösung ausblenden}}<br> | |||
|Tipp 2|Lösung ausblenden}}<br> | |||
<br> | |||
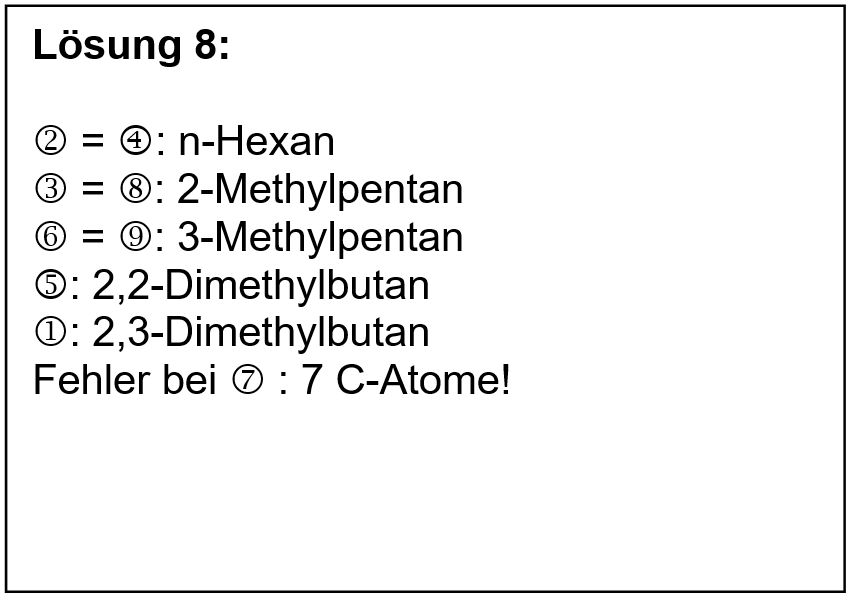
Noch ein Punkt: Je nachdem mit wie vielen C-Atomen das C-Atom, an dem die OH-Gruppe hängt, verbunden ist, spricht man von primären, sekundären oder tertiären Alkoholen. Ordne diese Begriffe den vier abgebildeten Molekülen zu und formuliere eine Aussage, in der ein Zusammenhang dieser Begriffe mit dem Siedepunkt hergestellt wird! | |||
{{Lösung versteckt| | |||
[[Datei:divAlkTypen_primsekter_ML_Ben_u_Rest.jpg]] | |||
|Lösung|Lösung ausblenden}}<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Die Erlenmeyer-Regel'''</span> | |||
|Inhalt= | |||
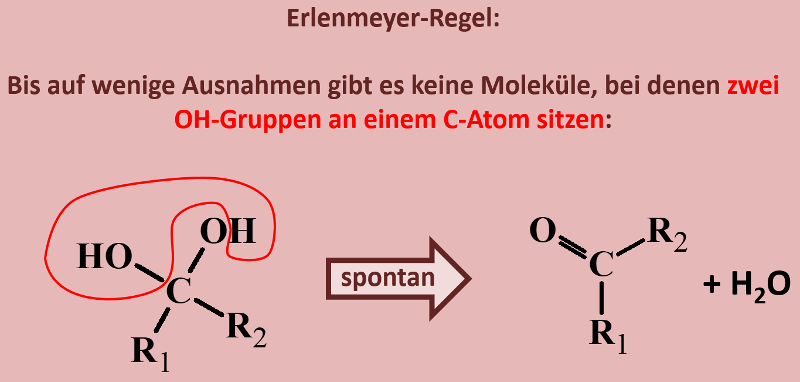
Ihr habt beim Einüben der Benennung von Alkoholen bereits gesehen, dass es Moleküle gibt, die mehr als eine Hydroxy-Gruppe enthalten. Was jedoch so gut wie nie vorkommt, sind Moleküle, bei denen zwei Hydroxygruppen an einem C-Atom hängen. Das folgende Bild stellt beispielhaft dar, was mit solchen Molekülen spontan passieren würde. Beschreibe das Bild mit eigenen Worten! (Und zwar wirklich, nicht nur in Gedanken. Sprich es laut aus!)<br> | |||
[[Datei:ErlenmeyerRegel.jpg]]<br> | |||
{{Lösung versteckt| | |||
Hast Du wirklich einen schönen, deutschen Satz auf dem Papier stehen? | |||
{{Lösung versteckt| | |||
Unter Abspaltung von Wasser reagiert das Molekül zu einer Verbindung, die anstelle von zwei Hydroxy-Gruppen nun eine Doppelbindung zu einem O-Atom aufweist. | |||
|Ja, selbstvertändlich!|Lösung ausblenden}}<br> | |||
|Lösung anzeigen|Lösung ausblenden}}<br> | |||
<br> | |||
Dieses Phänomen ist unter dem Namen Erlenmeyer-Regel bekannt. Ihr kennt den Namen sicher von dem Glasgefäß "Erlenmeyerkolben".<br> | |||
[[Datei:E._Erlenmeyer_ca_1863.jpg|400px]]<br> | |||
<br> | |||
'''Freiwillig''': Lest den Wikipedia-Eintrag über Emil Erlenmeyer: [[https://de.wikipedia.org/wiki/Emil_Erlenmeyer| Hier klicken]] | |||
|Farbe= #607 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
|Farbe= # | {{Box-spezial | ||
|Titel=<span style="color:#607">'''Verwendungsmöglichkeiten von Alkoholen'''</span> | |||
|Inhalt= | |||
Aufgrund der polaren Hydroxygruppe eignen sich Alkohole für viele Dinge, für die Alkane nicht brauchbar sind. Lest im Buch die S. 78 - 79 und notiert euch zu jeder fett gedruckten Überschrift einen Satz, der die dort beschriebenen Inhalte zusammenfasst. Solltet ihr das vor 09:00 Uhr geschafft haben, habt ihr kurz Pause. Um 09:00 Uhr wählt euch bitte in die Videokonferenz ein über den Link, den ich euch im Schulmanager geschickt habe. | |||
<br> | |||
<br> | |||
|Farbe= #607 | |||
|Rahmen= 0 | |Rahmen= 0 | ||
|Rahmenfarbe= # | |Rahmenfarbe= #DCF | ||
|Hintergrund= # | |Hintergrund= #DCF | ||
}} | }} | ||
{{Box-spezial | |||
|Titel=<span style="color:#607">'''Hefteintrag und Hausaufgabe'''</span> | |||
|Inhalt= | |||
* Der zu dieser Einheit passende Hefteintrag kann hier heruntergeladen werden: [[Spezial:FilePath/18_Alkohole1_Sdp_Lslchkt.pdf| pdf-Datei]]. Bitte abschreiben oder ausdrucken und ins Heft kleben. | |||
* Lest bis morgen im Buch zur Wiederholung die S. 80, 82 und neu: S. 84 | |||
<br> | |||
<br> | <br> | ||
== | |Farbe= #607 | ||
|Rahmen= 0 | |||
|Rahmenfarbe= #DCF | |||
|Hintergrund= #DCF | |||
}} | |||
=== Distanzunterricht am Mittwoch, 13.01. === | === Distanzunterricht am Mittwoch, 13.01. === | ||
| Zeile 364: | Zeile 478: | ||
|Hintergrund= #DFF | |Hintergrund= #DFF | ||
}}<br> | }}<br> | ||
==Termine== | |||
{{Box-spezial | |||
|Titel=<span style="color:#900">'''Termine'''</span> | |||
|Inhalt= | |||
'''Schulaufgabe''': <s>Mittwoch, 13.01.2021</s> | |||
* Lernstoff: Neben den Hefteinträgen eignen sich folgende Seiten im Buch (Galvani Chemie 3) zur Vorbereitung auf die Schulaufgabe: | |||
** S. 20 - 21 Die Chemie der Kohlenstoffverbindungen | |||
** S. 22 - 23 Kohlenstoff als Bindungspartner | |||
** S. 32 - 33 Die homologe Reihe der Alkane | |||
** S. 36 - 37 Die Familie der Alkane genauer betrachtet | |||
** S. 40 - 41 Wie aus Erdöl andere Produkte entstehen | |||
** S. 42 - 43 Vom Erdöl zum Benzin | |||
** S. 48 Die homologe Reihe der Alkene | |||
** S. 50 - 51 Die homologe Reihe der Alkine | |||
** S. 58 - 59 Die Verbrennung von Kohlenwasserstoffen | |||
** S. 63 - 64 Die radikalische Substitution (NICHT DER MECHANISMUS AUF S. 65) | |||
** S. 66 Die elektrophile Addition (NICHT DER MECHANISMUS AUF S. 67) | |||
** '''Die Benennung''' von organischen Molekülen müsst ihr beherrschen! Folgende Seiten im Buch helfen: | |||
** S. 34 - 35 Alkane | |||
** S. 49 ungesättigte Kohlenwasserstoffe | |||
** S. 62 Halogenkohlenwasserstoffe | |||
Ich habe mich entschieden die "Kunststoff" wegzulassen. Die eine Gruppe hatte dazu eine Stunde mehr als die andere, das fände ich irgendwie nicht fair. | |||
|Farbe= #900 | |||
|Rahmen= 0 | |||
|Rahmenfarbe= #FCA | |||
|Hintergrund= #FCA | |||
}} | |||
<br> | |||
Version vom 18. Januar 2021, 07:38 Uhr
Lernen zu Hause
Distanzunterricht Montag, 18.01.
Hallo 10d!
In der letzten Woche kam es vor allem in der 1. Stunde zu Problemen bei manchen Videokonferenzen. Höchstwahrscheinlich ist der Server überlastet, an dem Problem wird gearbeitet. Solange verzichte ich auf die Videokonferenz in der 1. Stunde, ich kann mit euch ja auch in der zweiten Stunde sprechen. Der Zeitplan für heute sieht also so aus:
- Um 07:50 Uhr solltet ihr einen Arbeitsauftrag über den Schulmanager erhalten haben, auf den ihr bis spätestens 08:15 Uhr antwortet. Das dient zunächst als Anwesenheitskontrolle. Erhalte ich keine Rückmeldung von euch, melde ich euch im Sekretariat als fehlend (was vermutlich dazu führt, dass eure Eltern informiert werden).
- Ihr arbeitet bis 09:00 Uhr alleine an diesem Arbeitsauftrag
- Dann starte ich eine BBB-Konferenz und wir besprechen, was ihr hier geschafft habt.
Für diesen Arbeitsauftrag benötigt ihr euer Buch und einen Zettel mit Stift.
Distanzunterricht am Mittwoch, 13.01.
Distanzunterricht am Dienstag 12.01.
Arbeitsauftrag wurde über Schulmanager verschickt. Nach einer Einführungsphase sollt ihr in Gruppen an euren Ergebnissen zur Recherche von Haushaltsgegenständen aus Kunststoff und ihren Alternativen arbeiten. Das entsprechende Arbeitsblatt wurde ebenfalls über den Schulmanager verschickt. Falls ihr aus technischen Gründen nicht an der Videokonferenz teilnehmen könnt, bearbeitet das Arbeitsblatt alleine, ihr könnt es hier noch einmal herunterladen:
pdf-Datei
Distanz-Lernen am Mittwoch 16.12. (ALLE)
Arbeitsauftrag für Donnerstag, 10.12. (nur Gruppe B)
Arbeitsauftrag für Mittwoch, 09.12. (nur Gruppe A)
Arbeitsauftrag für Donnerstag, 03.12. (nur Gruppe A)
Arbeitsauftrag für Mittwoch, 02.12. (nur Gruppe B)
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Quarantäne-Einheit 1: Aufgaben
Für diese Einheit benötigt ihr: Euer Schulbuch, Zettel und Stift, eine Internetverbindung und Ruhe. Die Bearbeitungsdauer sollte 30 Minuten nicht wesentlich übersteigen.
Versuchsprotokolle
Lösungen für Aufgaben
Termine