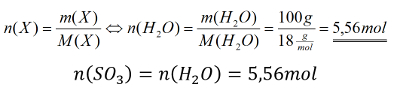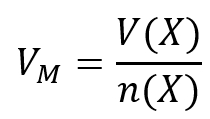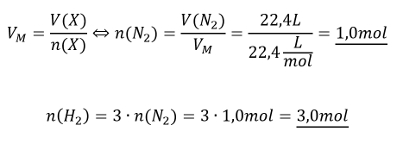Benutzer:Thomas Lux/Test Q11-Struktur
Distanzunterricht Montag, 01.02.
Ihr benötigt das Arbeitsblatt mit den Aufgaben (doppelseitig, links: Aufgaben 1 - 9, rechts: Aufgaben 10 - 17). Versucht heute die Aufgaben 7 - 9 (lins) zu lösen. Diese sind eher mittel - schwer. Gebt trotzdem nicht gleich auf, sondern geht systematisch vor, wie wir es in den letzten Einheiten immer geübt haben:
- Überlegt zunächst welche Größe gesucht ist!
- Überlegt euch dann, welche Größen gegeben sind! (Achtet darauf, dass Konstanten, wie z.B. NA immer gegeben sind oder sich die molare Masse M(X) bzw. die Masse von Teilchen in u ma(X) sich jederzeit aus dem Periodensystem "ablesen" lassen)
- Wenn ihr eine passende Gleichung gefunden habt, in der die verfügbaren bzw. gesuchten Größen vorhanden sind, formt sie entsprechend eurer gesuchten Größe um!
- Oft hat man in den Aufgabenstellungen zwar Größen gegeben, die zum Lösen einer passenden Gleichung nötig sind, aber sie stammen nicht vom selben Stoff. Beispiel: Man möchte die Masse eines benötigten Stoffes ausrechnen, dazu benötigt man z.B. seine Molare Masse M(X) und die Stoffmenge n(X). In der Aufgabe ist aber vielleicht nur die Stoffmenge des Reaktionspartners oder seine verfügbare Masse gegen. - Die Lösung besteht oft darin, sich über die chemische Gleichung das Verhältnis der Stoffmengen abzuleiten, also z.B. n(Stoff A) = 4x n(Stoff B).
Aufgabe 7:
Ammoniak wird mit einem speziellen Gerät untersucht. Die Analyse ergibt ein Massenverhältnis von Stickstoff : Wasserstoff = 4,66 : 1. Berechne daraus das Atomzahlenverhältnis und leite die chemische Formel von Ammoniak ab!
Hinweis: Diese Aufgabenstellung wirkt vielleicht etwas seltsam. Denn die chemische Formel von Ammoniak solltet ihr ja schon wissen: NH3. Trotzdem ist sie in gewisser Weise realistisch. Denn genau so wird auch heute noch in der Chemie gearbeitet, wenn man eine unbekannte Substanz entdeckt (z.B. aus neu entdeckten Pflanzen, Tieren oder Pilzen), um sie als Medikament o.ä. einzusetzen: Man bestimmt das Massenverhältnis aller enthaltenen Elemente und daraus kann man die chemische Gleichung des unbekannten Stoffs ableiten.
Außerdem gibt es hier zwei Wege, um zum Ziel zu kommen. Hier zunächst mal die erste Variante, später noch eine zweite.
Bitte klickt erst auf "Lösung", wenn ihr den Tipp wirklich selbst versucht habt, umzusetzen.
Tipp 1: Hier wird das Atomzahlen- Verhältnis verlangt. Zunächst mal: Ein "Verhältnis" kennt ihr vielleicht von Fußball-Tabellen, wenn es ums Tor-Verhältnis geht (aktuell am 30.01.2021 liebt bei Bayern ein Torverhältnis von 53:25 vor) . Oder vielleicht auch von manchen "Rezepten": Beim Reiskochen nimmt man z.B. (bei bestimmten Sorten) 1 Teil Reis und 1,5 Teile Wasser, das entspricht dem Verhältnis 1:1,5. In den Naturwissenschaften schreibt man Verhältnisse aber nicht mit Doppelpunkt (was eigentlich für "pro" steht), sondern mit einem Bruchstrich!
O.k., wir brauchen also einen Bruchstrich, auf dem im Zähler eine Anzahl von Atomen und im Nenner eine Anzahl von Atomen steht. Suche nach der Größe, mit der man in der Chemie eine Anzahl (ohne Einheit) ausdrückt und formuliere dann den "Bruchstrich"!
Überlegt euch auch schon mal Gleichungen, die helfen könnten und gegebene Größen!
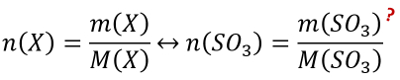
Den Bruchstrich solltet ihr mit dem Tipp aufgestellt haben können! Nochmal in Worten: Man sucht das Verhältnis der Anzahl von den Stickstoffatomen zur Anzahl der Wasserstoffatome.
Gegeben sind:
- Die Molare Masse M(X) - kann man aus dem PSE ableiten
- Das Massenverhältnis von Stickstoff zu Wasserstoff
- Eine Gleichung in der N(X) vorkommt. - Die braucht man auf jeden Fall, denn das muss man ja ausrechnen!
- Die zweite Gleichung habt ihr vielleicht noch nicht für nötig erachtet, aber wenn ihr die erste Gleichung anschaut seht ihr, dass diese nur die Stoffmenge n(X) und eine Konstante NA enthält. Die Konstante ist nicht das Problem. Aber n(X)! Das hat man nicht gegeben. Daher muss man nach einer Gleichung suchen, mit der man n(X) ausrechnen kann, mit Größen, die man hat. Die zweite Gleichung erfüllt diese Bedingungen.
Tipp 2: Sowohl im Zähler als auch im Nenner des gesuchten Bruchs könnt ihr jetzt N mit Hilfe der 1. Gleichung ausdrücken. Macht das!
Tipp 3: Die Stoffmenge n(N) bzw. n(H) ist aus der Angaben leider nicht ableitbar. Aber man kann n(X) ja mit Hilfe der zweiten Gleichung durch m(X) / M(X) ersetzen. Macht das!
Tipp 4: Die Masse m(X) von Stickstoff und Wasserstoff hat man zwar eigentlich auch nicht genau gegeben, aber das Verhältnis! Das genügt, denn die bisher erarbeitete Gleichung verlangt ja nach einer Masse im Zähler und einer im Nenner, daher darf man das gegebenen Verhältnis verwenden. Macht das und berechnet ein Ergebnis und zwar Zähler und Nenner getrennt!
Tipp 5: Was bedeutet dieses Ergebnis jetzt für die Zusammensetzung eines Ammoniak-Moleküls?
Die Lösung zeigt, dass im Stoff Ammoniak pro einem N-Atom drei H-Atome enthalten sind. Das bedeutet die chemische Formel könnte sein NH3, aber auch N2H6 oder N3H9 usw....
Die Aufgabe war nicht so schön. Die nächste wird besser!
Aufgabe 12: Im Labor soll Ammoniak aus den Elementen hergestellte werden (also aus H2 und N2). Es gibt noch exakt 22,4L Stickstoff. Welche Stoffmenge an Wasserstoff benötigt man, um den gesamten Stickstoff zu Ammoniak umzusetzen.
Tipp 1: Es geht hier um die Stoffmenge. Darüber hinaus ist ein Volumen gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte!
Tipp 2: Direkt lässt sich die Stoffmenge von Wasserstoff mit dieser Gleichung nicht berechnen, es fehlt das Volumen, V(H2). Aber wie immer kann über die chemische Gleichung die Stoffmengen der beteiligten Stoffe in Beziehung zueinander setzen. Stelle die chemische Gleichung auf und drücke dann die Stoffmenge des benötigten Wasserstoffs in der Stoffmenge des Stickstoffs aus!
Tipp 3: Jetzt kann die Stoffmenge des Stickstoffs ausgerechnet werden und daraus die Stoffmenge des benötigten Wasserstoffs!
Arbeitsauftrag 27.04.
Für diesen Arbeitsauftrag solltet ihr ca. 30 Minuten benötigen.
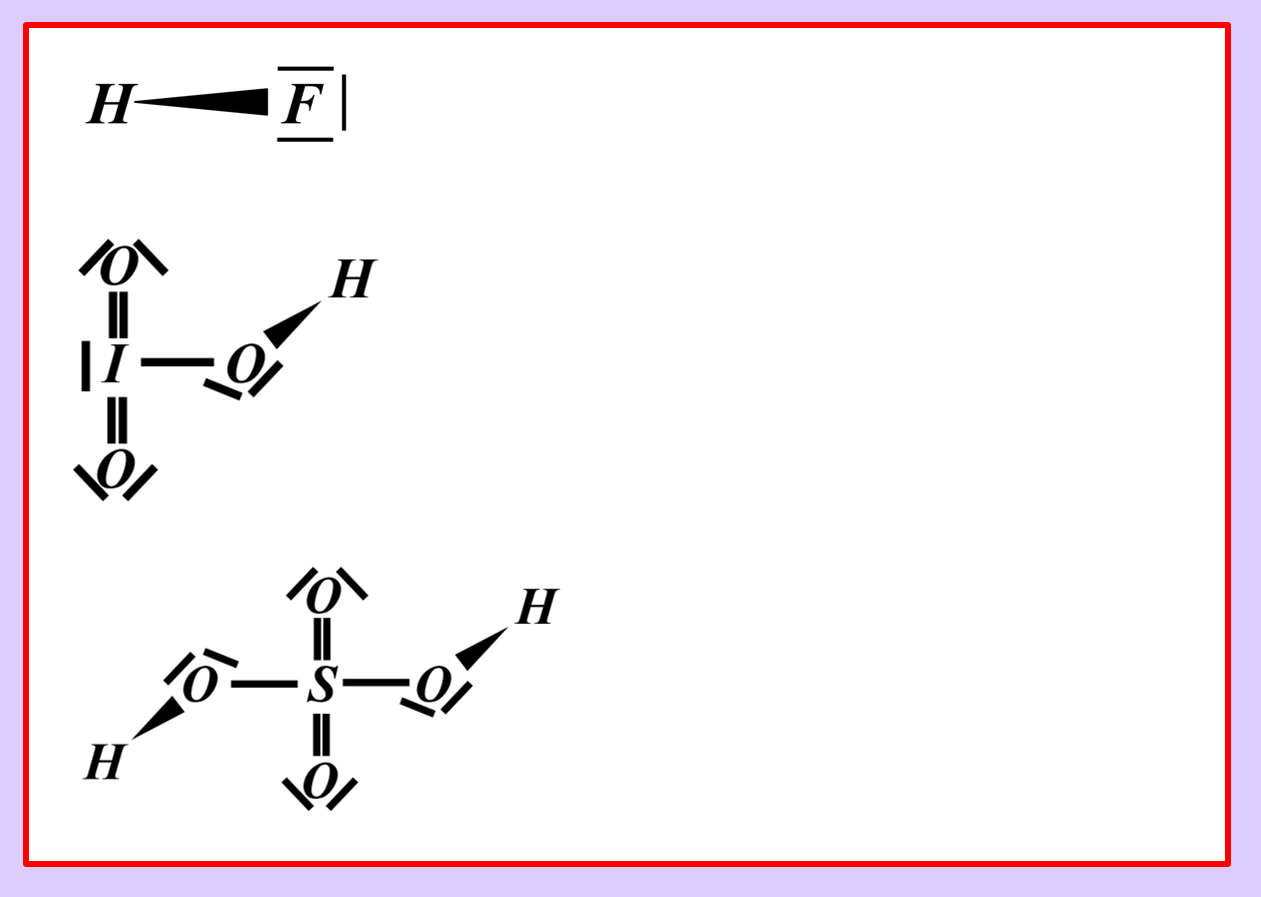
Versucht im folgenden Bild möglichst genau zu beschreiben, was die eingekringelten Symbole bedeuten sollen. (In beiden Fällen wird das gleiche symbolisiert, es sind nur unterschiedliche Varianten.) In eurer Beschreibung sollte der Begriff "Elektronegativität (EN)" vorkommen.
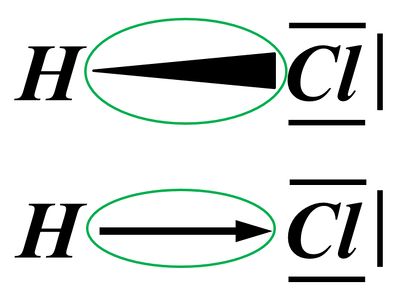
Am besten macht ihr das wirklich schriftlich, damit ihr eure Lösung mit der hier angegebenen nachträglich gut überprüfen könnt!
Die eingekreisten Symbole stehen für eine "polare Atombindung".
Beide Begriffe, polar und Atombindung, sollte man nun erklären.
Eine Atombindung entsteht, wenn zwei Atome jeweils ein Elektron zur Verfügung stellen und dieses Elektronenpaar sich zwischen den beiden Atomkernen aufhalten kann und dadurch zu einer Anziehung der beiden Partner führt.
Polar sind Atombindungen dann, wenn einer der beiden Bindungspartner in der Lage ist, das bindende Elektronenpaar stärker zu sich zu ziehen. Die beiden Elektronen haben dann eine hohe Aufenthaltswahrscheinlichkeit nicht genau in der Mitte zwischen den Atomkernen sondern bei dem Bindungspartner, der die höhere Elektronegativität (EN) hat. Der Keil, bzw. der Pfeil zeigen diese Verschiebung des Elektronenpaars hin zum elektronegativeren Partner an.
Betrachten wir zum Vergleich ein Wasserstoff-Molekül, also zwei Wasserstoffatome, die über ein bindendes Elektronenpaar miteinander verbunden sind. Diese Bindung ist nicht polar, weil beide H-Atome "gleich stark am bindenden Elektronenpaar ziehen". Zwei solche Wasserstoff-Atome würden sich bei Raumtemperatur nicht spontan voneinander trennen. Die Atombindung ist zu stark. Bei polaren Atombindungen gibt es jedoch Situationen, in denen das anders aussieht. Vor allem, wenn der eine Bindungspartner Wasserstoff ist. Bleiben wir bei dem am Anfang dargestellten Molekül "Hydrogenchlorid" (HCl). Hier lassen sich die beiden Partner sehr leicht voneinander trennen. Warum?
Bevor diese Frage beantwortet wird, vorher wieder etwas zum Auffrischen:
- Wie viele Elektronen besitzt ein einzelnes Chlor-Atom insgesamt?
- Wie viele davon sind Valenzelektronen?
- Was muss passieren, damit dieses Chlor-Atom Edelgaskonfiguration erreicht?
- Wie viele Elektronen besitzt ein einzelnes Wasserstoff-Atom insgesamt?
- Wie viele davon sind Valenzelektronen?
- Was muss passieren, damit Wasserstoff-Atom Edelgaskonfiguration erreicht?
- Wirklich? Keine zweite Möglichkeit?
- Ein Chlor-Atom besitzt insgesamt 17 Elektronen
- Sieben davon sitzen auf der äußersten Schale, sind also Valenzelektronen
- Chlor muss ein Elektron aufnehmen
- Ein Wasserstoff-Atom besitzt ein Elektron
- ...sehr witzig...
- Es muss eins aufnehmen, um die Edelgas-Konfiguration von Helium zu erreichen (Zwei Elektronen auf der innersten Schale, die damit voll besetzt ist und einen sehr energiearmen Zustand darstellt)
- Das haben wir noch nicht besprochen: Wasserstoff könnte das eine Elektron auch abgeben. Dann hat es überhaupt keins mehr. Vom Wasserstoffatom bliebe dann nur das eine Proton im Kern übrig. Das ist zwar keine klassische Edelgaskonfiguration, aber dennoch auch ein sehr energiearmer Zustand.
Die folgende Aussage ist "anthropomorph". Das bedeutet, man tut so, als wären die betrachteten Teilchen Lebewesen/Menschen mit Gefühlen und Bedürfnissen. Das ist natürlich nicht so! Solche Aussagen sind aber oft sehr leicht verständlich für Schülerinnen und Schüler. Ich werde die Aussage erst später fachwissenschaftlich umformulieren.
O.k., schauen wir uns die Situation mal an: Wir haben zwei Atome, ein Wasserstoff-Atom und ein Chlor-Atom. Beide teilen sich ein Elektronenpaar und bilden daher ein Molekül. Das Chlor-Atom ist unglaublich scharf auf das Elektronenpaar. Wenn es beide Elektronen komplett haben könnte, hätte es Edelgaskonfiguration. Das Wasserstoff-Atom könnte mit beiden Elektronen zwar auch etwas anfangen, ist aber auch glücklich, wenn es überhaupt kein Elektron mehr hat.
WAS WIRD WOHL PASSIEREN?
Wer keine Ahnung hat, was das soll, vielleicht noch ein anderes Beispiel: Ihr habt ein kleines Geschwister. Das hat zum Geburtstag ein Playmobil-Pferd geschenkt bekommen. Ihr habt den passenden Playmobil-Cowboy dazu, den ihr irgendwie ganz witzig findet, aber mal ehrlich... ihr seid quasi erwachsen, was wollt ihr mit einem Plastik-Cowboy. Euer kleines Geschwister kommt permanent zu euch ins Zimmer, hängt bei euch rum und will mit euch und eurem Playmobil-Cowboy spielen. Eine Zeit lang macht euch das auch Spaß und ihr seid dabei. Aber plötzlich klingelt euer Handy und euer... bester Freund/beste Freundin ist dran. WAS MACHT IHR WOHL? - Vermutlich: Ihr schenkt euren Playmobil-Cowboy eurem Geschwister und schickt ihn aus dem Zimmer. Übertragt das jetzt auf die Atome!
Das bindende Elektronenpaar (Playmobil-Pferd + Playmobil-Cowboy) wird komplett auf das Chlor-Atom (euer Geschwister) übertragen. Es entsteht ein positiv geladenes Wasserstoff-Teilchen (vorher: ein positiv geladenes Proton im Kern, ein negatives Elektron in der Hülle; jetzt; nur noch ein Proton) und ein negativ geladenes Chlor-Teilchen (vorher: 17 Protonen im Kern, 17 Elektronen in der Hülle; jetzt: 17 Protonen im Kern, 18 Elektronen in der Hülle.
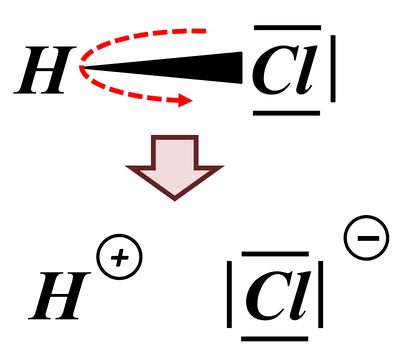
Man spricht in so einem Fall von einer heterolytischen Bindungstrennung. "Bindungstrennung" bedeutet, dass eine Bindung getrennt wird (ziemlich logisch...) und "hetero"(lytisch) bedeutet, dass die Bindung (bzw. besser: das bindende Elektronenpaar) "ungleichmäßig" aufgeteilt wird. Es gibt auch die "homolytische Bindungstrennung", bei der wird die Bindung so aufgeteilt, dass jeder Partner ein Elektron des bindenden Paares bekommt. Das ist hier aber nicht so: Das Wasserstoff-Atom bekommt gar kein, das Chlor-Atom beide. Deswegen: heterolytische Bindungstrennung.
Die Abspaltung eines Wasserstoffteilchens nach diesem Muster ist etwas, was viele Moleküle können (wenn ein passender Reaktionspartner zur Verfügung steht). Man zählt solche Moleküle zur Gruppe der "Säuren". Wenn z.B. etwas "sauer" schmeckt, dann sicher deswegen, weil eine Säure enthalten ist, also ein Molekül, das durch heterolytische Bindungstrennung ein Proton (das was vom Wasserstoffteilchen nach der Abspaltung übrig bleibt) abgespalten hat.
Man kann diese Abspaltung als chemische Gleichung formulieren:
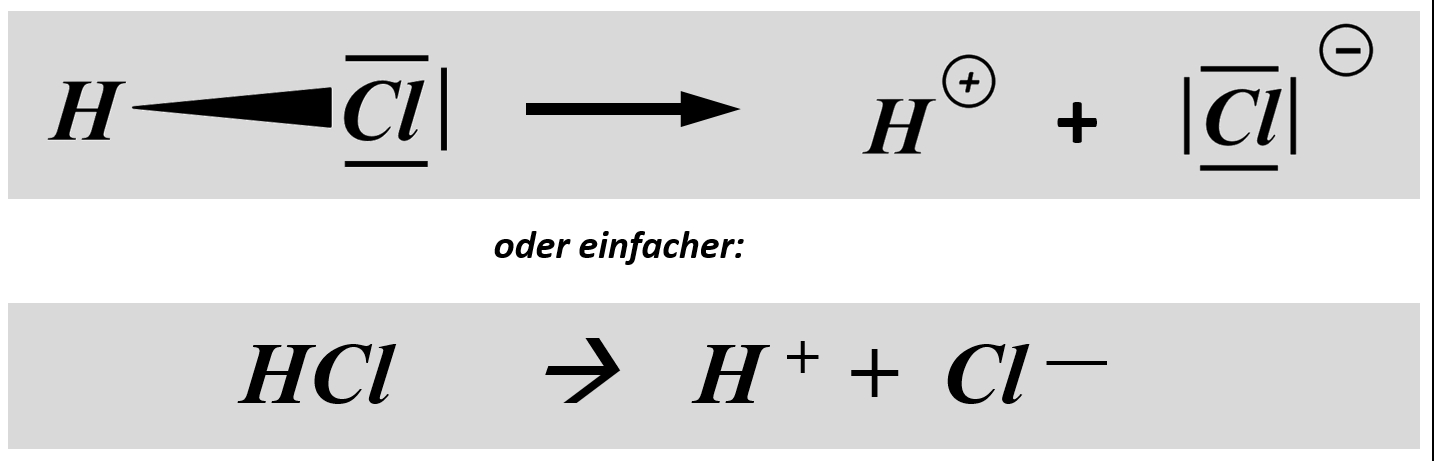
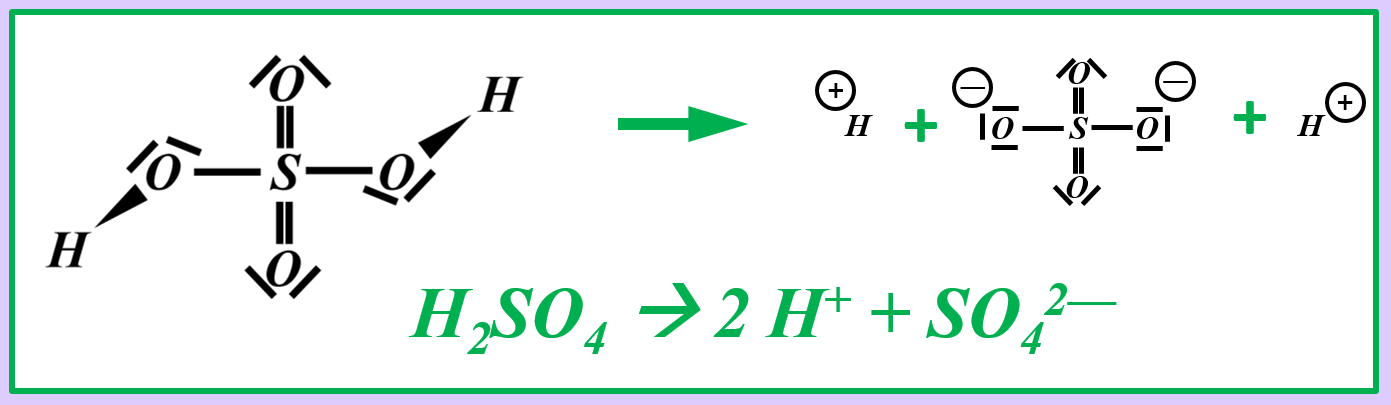
Stellt nach dem gleichen Muster die chemischen Gleichungen (beide Varianten: mit und ohne Valenzstrichformel) für die heterolytische Bindungstrennung für folgende Säure-Moleküle auf:
- Hydrogenfluorid (HF)
- Iodsäure (HIO3)
- Schwefelsäure (H2SO4)
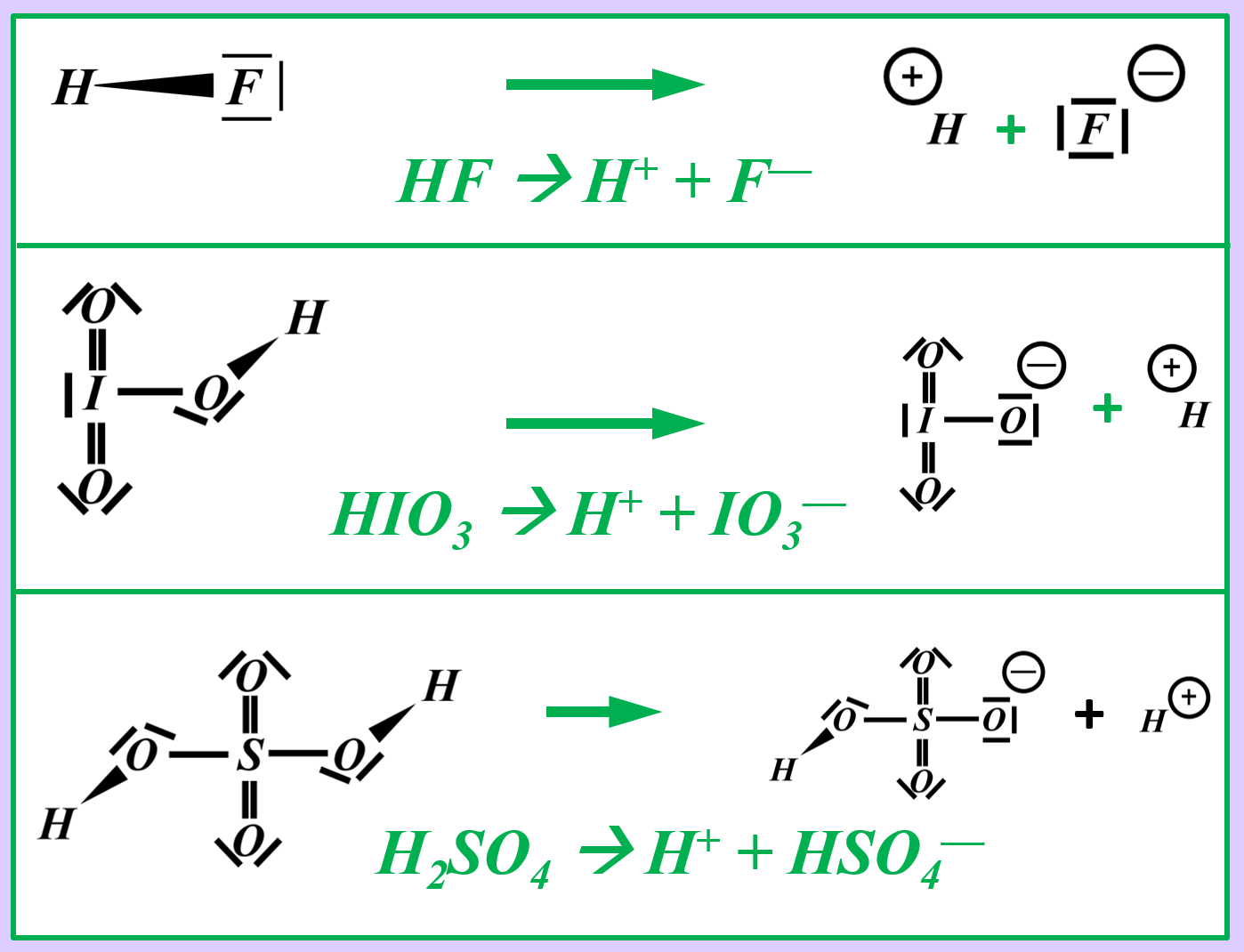
Vielleicht habt ihr bei der Schwefelsäure das andere Proton abgespalten. Das funktioniert. Es können sogar beide Wasserstoff-Teilchen gleichzeitig abgespalten werden. Stellt dafür (sofern ihr es noch nicht getan habt) die Gleichungen (mit und ohne Valenzstrichformeln) auf!
Das Buch geht hier anders vor, deswegen keine Seiten im Buch lesen. Eher etwas praktisches als "Hausaufgabe":
Pflicht: Sucht bei euch zu Hause drei völlig verschiedene Lebensmittel, die sauer sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen").