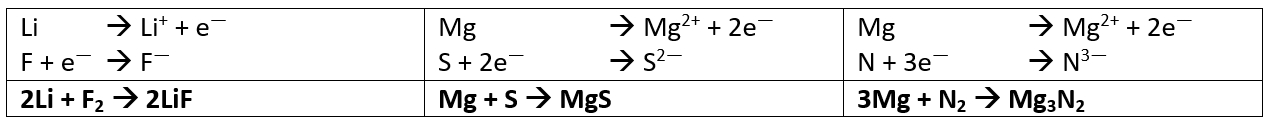9e 2020 21/Chemie
Inhaltsverzeichnis
Distanzunterricht, Distanzlernen
Distanzlernen für Freitag, 18.12.
Je nachdem, wie viel Zeit euch zur Verfügung steht, könnt ihr im folgenden violetten Kasten Aufgaben zum Ausgleichen von chemischen Reaktionen üben (es handelt sich um die Aufgaben von dem Arbeitsblatt, das ihr im Unterricht bekommen habt). Oder ihr führt den Versuch durch, der im blauen Kasten beschrieben ist. Selbstverständlich dürft ihr auch beides machen :)
Auch wenn ihr die Aufgaben auf dem Arbeitsblatt bereits bearbeitet haben solltet: Macht sie einfach hier noch einmal. In der Regel kann man sich an die Lösung nicht automatisch erinnern.
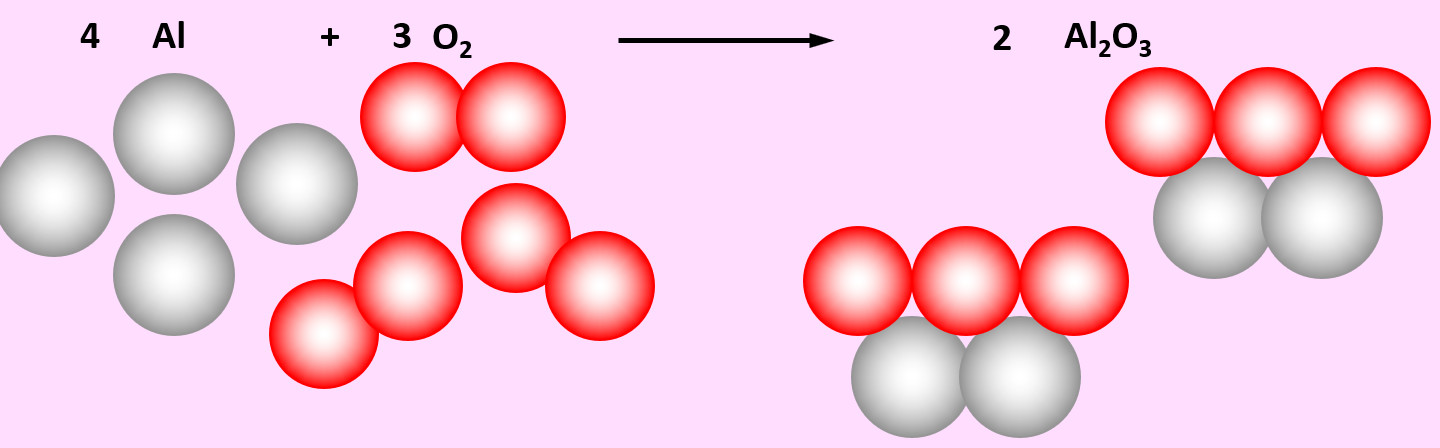
Aufgabe 4 (AB-Vorderseite)
Zu den heftigsten Reaktionen unter den Elementen zählt die Reaktion von Aluminium mit Sauerstoff. Dabei entsteht Aluminiumoxid (Al2O3)
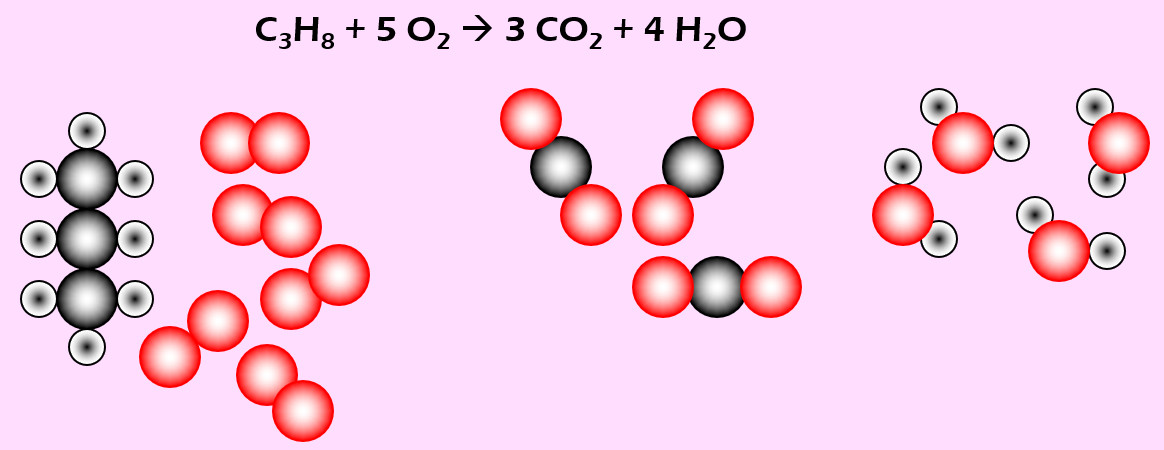
Aufgabe 5 (AB-Vorderseite)
Feuerzeuge enthalten vielfach Propan (C3H8). Bei Gebrauch strömt das Gas aus und wird durch einen Funken entzündet. Dabei reagiert es mit Sauerstoff zu Kohlenstoffdioxid (CO2) und Wasser (H2O)
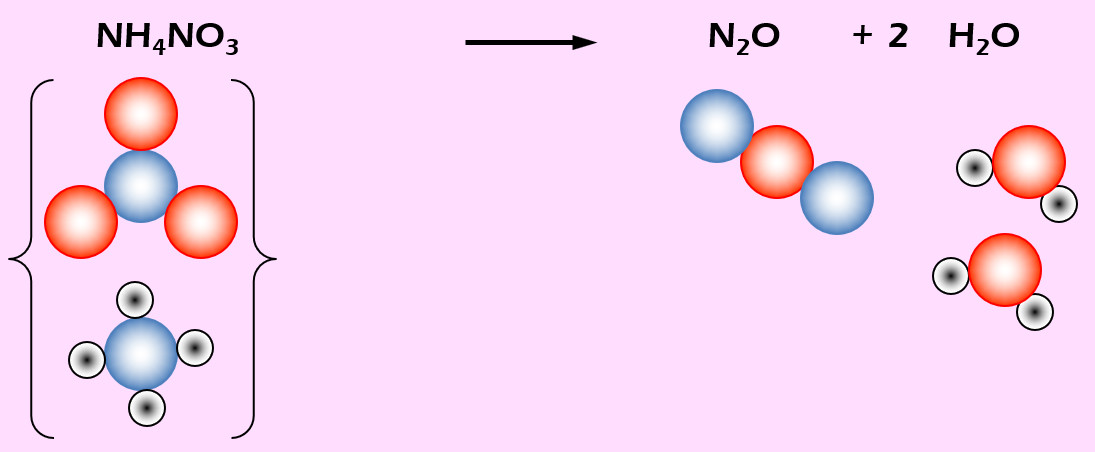
Aufgabe 6 (AB-Vorderseite)
Lachgas (N2O) entsteht beim starken Erhitzen von Ammoniumnitrat (NH4NO3). Daneben entsteht auch noch Wasser (H2O).
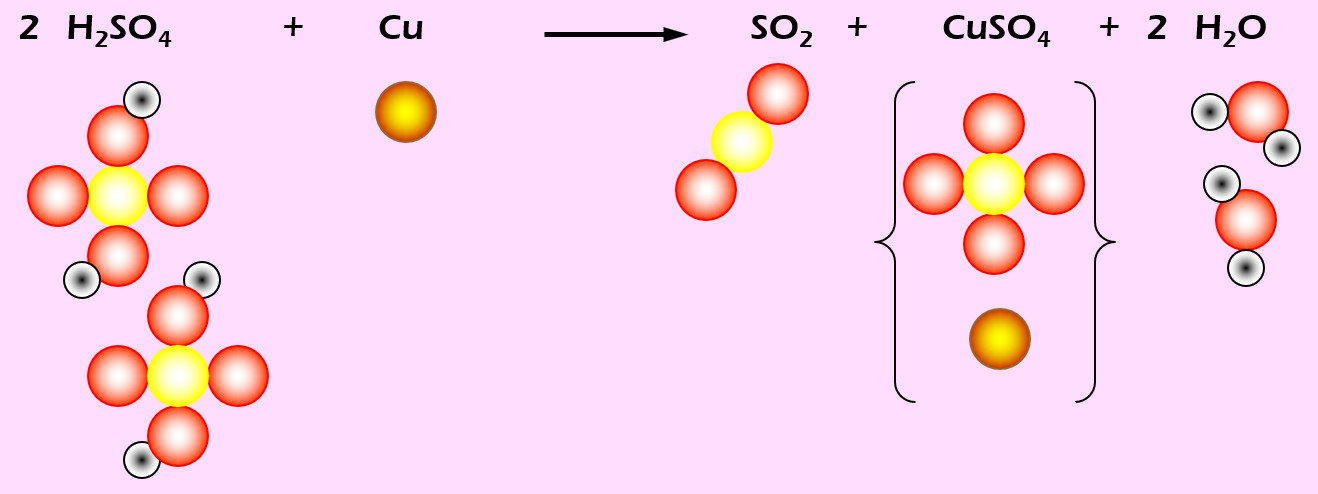
Aufgabe 7 (AB-Vorderseite)
Kupfer löst sich in erhitzter Schwefelsäure (H2SO4). Dabei entsteht Schwefeldioxid (SO2), Kupfersulfat (CuSO4) und Wasser (die chem. Formel f. Wasser müsstet ihr langsam wissen...).
Aufgabe 1 (AB-Rückseite)
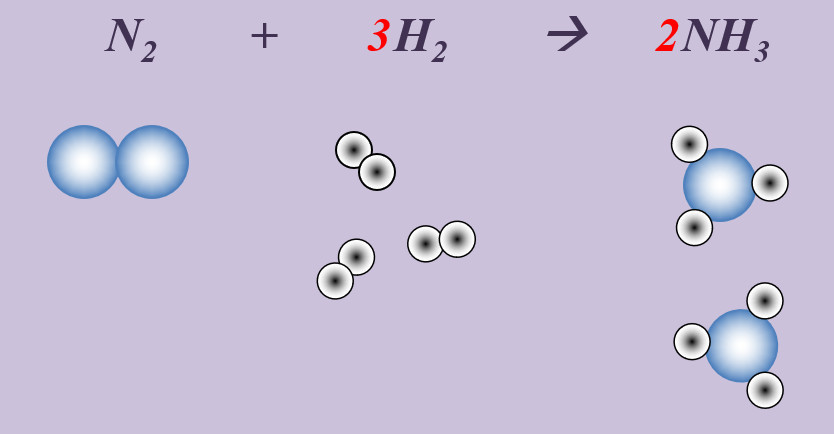
Stickstoff reagiert mit Wasserstoff zu Ammoniak (NH3).
Aufgabe 2 (AB-Rückseite)
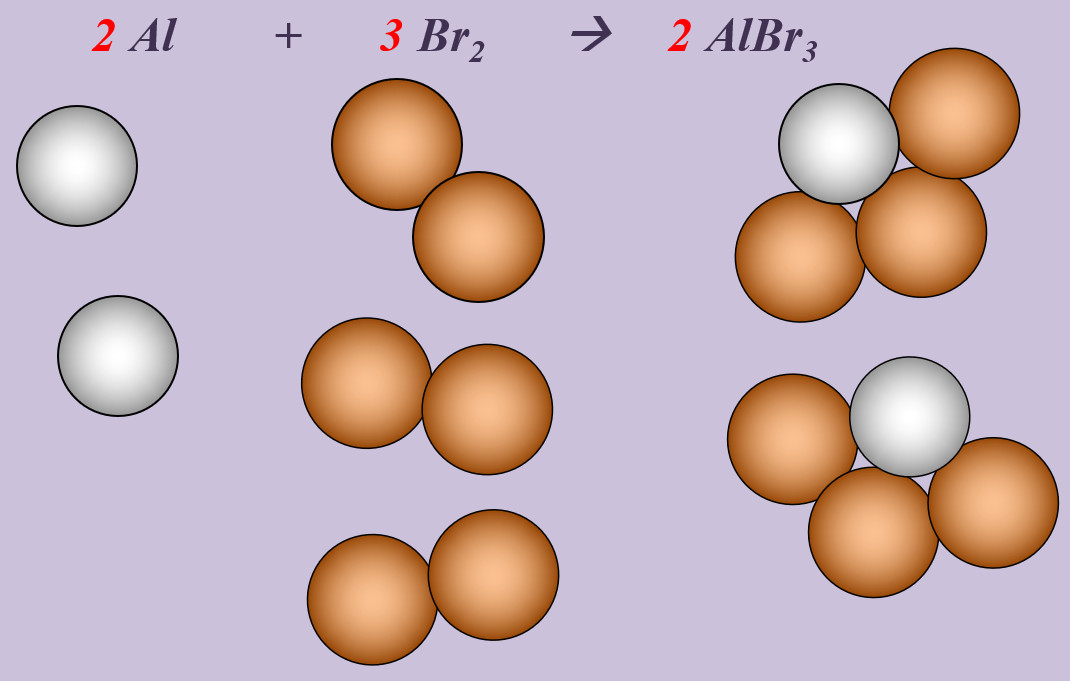
Aluminium reagiert mit Brom zu Aluminiumbromid (AlBr3).
Aufgabe 3 (AB-Rückseite)
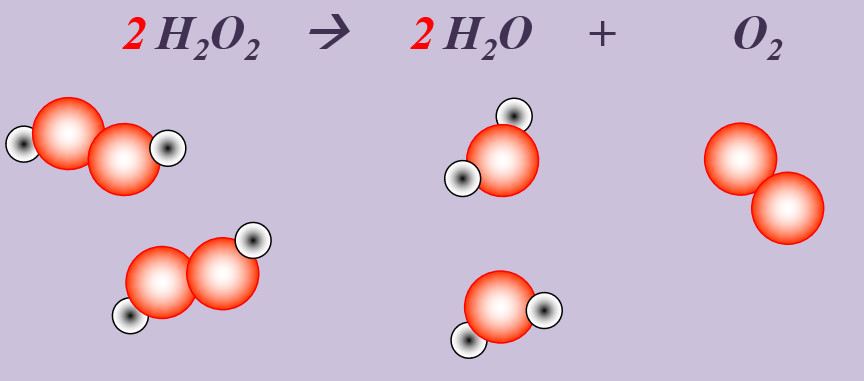
Wasserstoffperoxid (H2O2) zerfällt an der Luft zu Wasser und Sauerstoff.
Aufgabe 4 (AB-Rückseite)
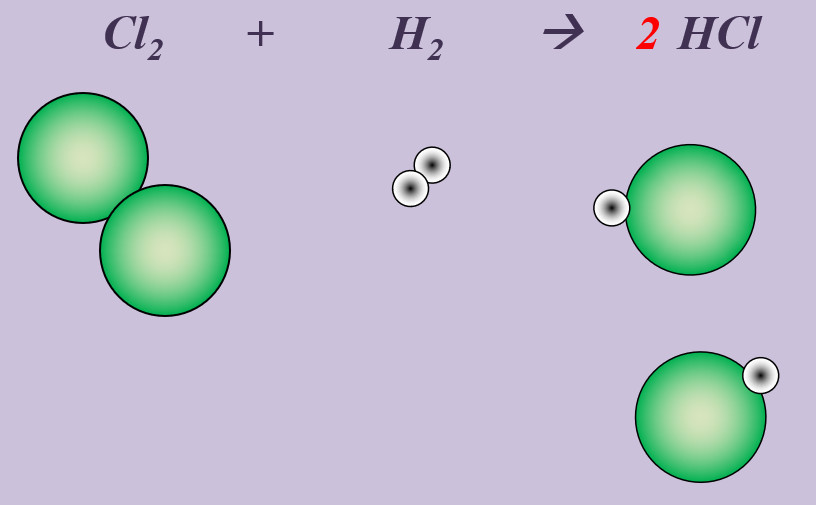
Chlor reagiert in einer heftigen Reaktion mit Wasserstoff zu Hydrogenchlorid (HCl).
Aufgabe 5 (AB-Rückseite)
Kupfer kann beim starken Erhitzen mit Sauerstoff zu Kupfer(I)-oxid (Cu2O) reagieren.
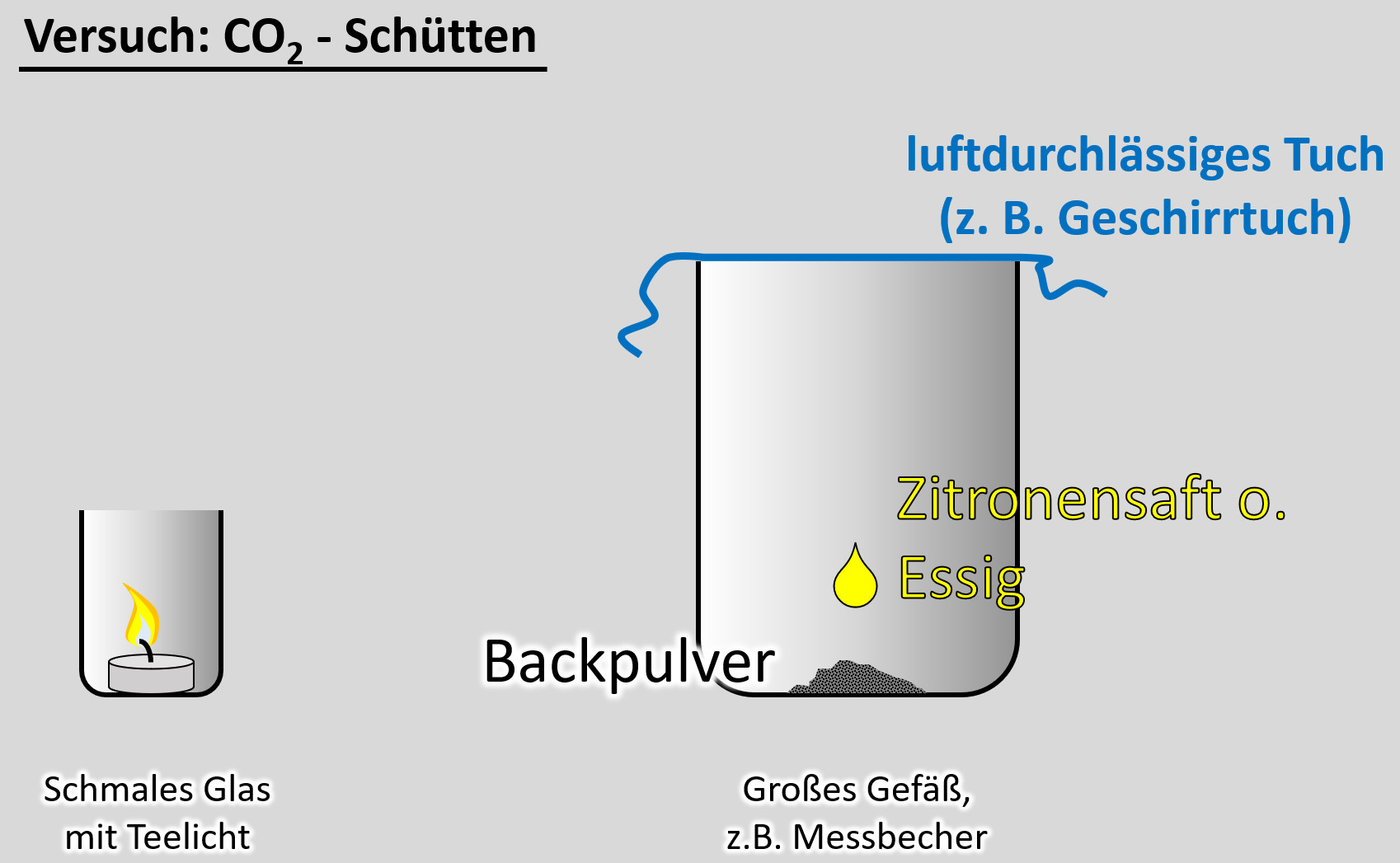
Ein freiwilliger Versuch. Ihr benötigt dazu:
- ein schmale Glas, in das gerade so ein Teelicht passt
- ein Teelicht
- ein größeres Gefäß, z.B. Messbecher
- ein Geschirrtuch (o.ä.)
- ein Päckchen Backpulver
- Essig oder besser: Essigessenz
- Entzündet das Teelicht im schmalen Glas
- Gebt das Backpulver in das große Gefäß und legt das Geschirrtuch bereit
- Schüttet nun etwa 50 - 100mL Essig auf das Backpulver und bedeckt dann sofort das Gefäß mit dem Geschirrtuch. (Hinweis: Bei dem Versuch entsteht das Gas Kohlenstoffdioxid. Das ist schwerer als Luft und soll im Messbecher bleiben. Durch kleinste Luftverwirbelungen wird es aber aus dem Messbecher gespült. Mit dem Geschirrtuch soll das verhindert werden.
- Wartet ab, bis die Gasentwicklung nachlässt. Euer Messbecher ist nun randvoll mit Kohlenstoffdioxid (was man aber nicht sehen kann).
- Zieht nun vorsichtig das Geschirrtuch ab. Und gießt das Kohlenstoffdioxid in das schmale Gefäß mit der Kerze. Achtung: Nicht den Essig in das schmale Gefäß gießen!
Beobachtung/Erklärung:
Da das Gas Kohlenstoffdioxid schwerer als Luft ist, wird es in das schmale Glas "fallen" und dort die Luft verdrängen. Eine Verbrennung ist in reinem Kohlenstoffdioxid nicht möglich. Daher sollte die Kerze erlöschen. Wenn ihr auf "Video" klickt, seht ihr eine Variante, so wie es aussehen sollte.
Arbeitsauftrag für Donnerstag, 17.12.
Mit der einen Gruppe von euch habe ich bereits nach der Schulaufgabe einen kurzen Versuch durchgeführt, der zeigen konnte, dass es Farbstoffe gibt, die ihre Farbe ändern, wenn sie mit Säuren in Berührung kommen. Unser nächstes Thema im Unterricht wird sich genau um diese Säuren und ihre "Gegenspieler" die Basen drehen. Farbstoffe, die auf Säuren oder Basen reagieren, nennt man Säure-Base-Indikatoren. Davon findet man auch viele in der Natur und dazu ein kleiner Versuch.
Ihr benötigt:
- Blaukraut/Rotkohl (frisch oder aus der Konserve)
- Zitronensaft
- Natron oder Kernseife
Zupft ein paar Blätter vom Rotkohl ab, schneidet sie sehr klein und gebt die Schnipsel in ein Glas mit Wasser. Wartet 5 min.
Solltet ihr keinen frischen Rotkohl zu Hause haben, dann könnt ihr auch den Saft aus einem Glas eingemachten Rotkohl nehmen. Bitte sprecht aber mit euren Eltern ab, dass das geöffnete Glas dann auch gegessen wird. Falls ihr weder frischen Rotkohl noch welchen im Glas zu Hause habt, dann verschiebt den Versuch bitte!

Verteilt den so erzeugten violetten "Blaukraut-Saft" auf drei Gläser und verdünnt ihn mit Wasser. Gebt zum einen Glas Zitronensaft, zum anderen Natron oder Kernseife. Vergleicht die drei Gläser! Ihr könnt gerne auch andere Stoffe aus dem Haushalt ausprobieren und checken, welche Farbe der Blaukrautsaft annimmt.
Termine
Schulaufgabe am 07.12.2020 (für Gruppe B)
Schulaufgabe am 08.12.2020 (für Gruppe A)
Prüfungsstoff: Neben Grundwissen, den Hefteinträgen und den Versuchsprotokollen eignen sich folgende Seite im Buch (Galvani Chemie 2) als Vorbereitung für die Schulaufgabe (chronologisch sortiert):
- S. 20 - 21 Unterschied zwischen qualitativen und quantitativen Nachweisen
- S. 22 - 24 Nachweismethoden
- S. 25 - 26 Die Spektralanalyse
- S. 92 - 93 Fällungsreaktionen
- S. 54 - 55 Das Orbitalmodell (Die Inhalte dieser Seite werden nicht direkt in der Schulaufgabe abgefragt, aber zum Verständnis der nächsten Seiten sind sie meiner Meinung schon relevant.
- S. 56 - 57 Der räumliche Bau von Molekülen
- S. 63 - 64 Die polare Atombindung (ohne den letzten Absatz "Polarität und Dissoziationsenergie")
- S. 65 Dipole
- (S. 72 - 73 Zwischenmolekulare Kräfte - Wiederholung)
- S. 76 - 77 Van-der-Waals-Kräfte
- S. 74 - 75 Wasserstoffbrückenbindungen
- S. 78 Einfluss zwischenmolekularer Kräfte auf Stoffeigenschaften
Versuchsprotokolle
Eine Musterlösung für das Versuchsprotokoll zur Übung vom 08.10. "Flammenfärbung von Na- und K-Salzen":
- Zum Herunterladen: Hier klicken
Eine Musterlösung für das Versuchsprotokoll zur Übung vom 22.10. "Nachweis von ausgewählten Halogenid-Ionen":
- Zum Herunterladen: Hier klicken
Grundwissen
Text
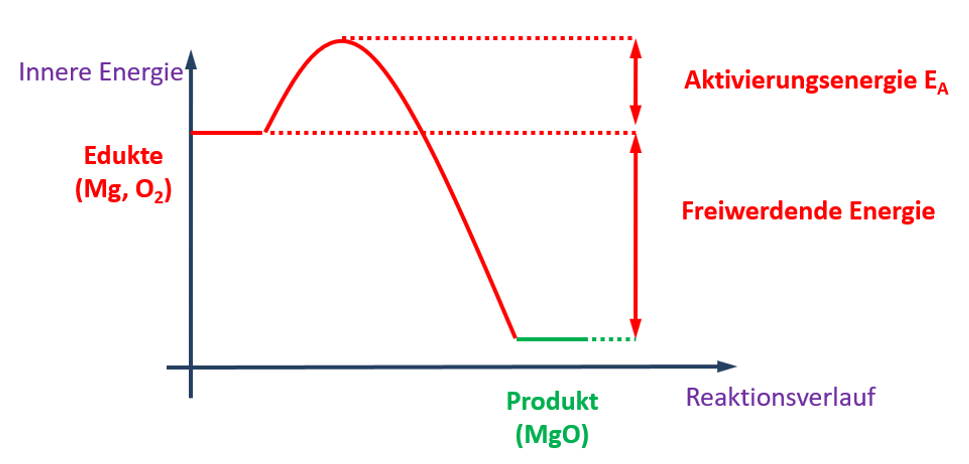
Magnesium ist ein sehr reaktives Metall und wird an Schulen häufig in Form von langen Bändern verwendet. Sobald man ein Ende eines solchen Magnesium-Bandes kurz erhitzt, beginnt es mit dem Sauerstoff aus der Luft zu reagieren. Dabei entsteht sehr viel Hitze und Licht. Früher hat man daher Magnesium als „Blitzlicht-Pulver“ eingesetzt. Einmal gestartet, endet die Reaktion erst, wenn das gesamte Magnesium-Band „verbrannt“ ist. Übrig bleibt ein weißer Feststoff: Magnesiumoxid (MgO).
Aufgaben
- Stelle die chemische Reaktionsgleichung für den beschriebenen Prozess auf!
- Ordne diese chemische Reaktion verschiedenen Gruppen zu: Beachte bei der einen Zuordnung den Energieumsatz und bei der anderen Zuordnung die Anzahl der Pro- und Edukte!
- Zeichne das vollständig beschriftete Energie-Zeit-Diagramm dieser Reaktion!
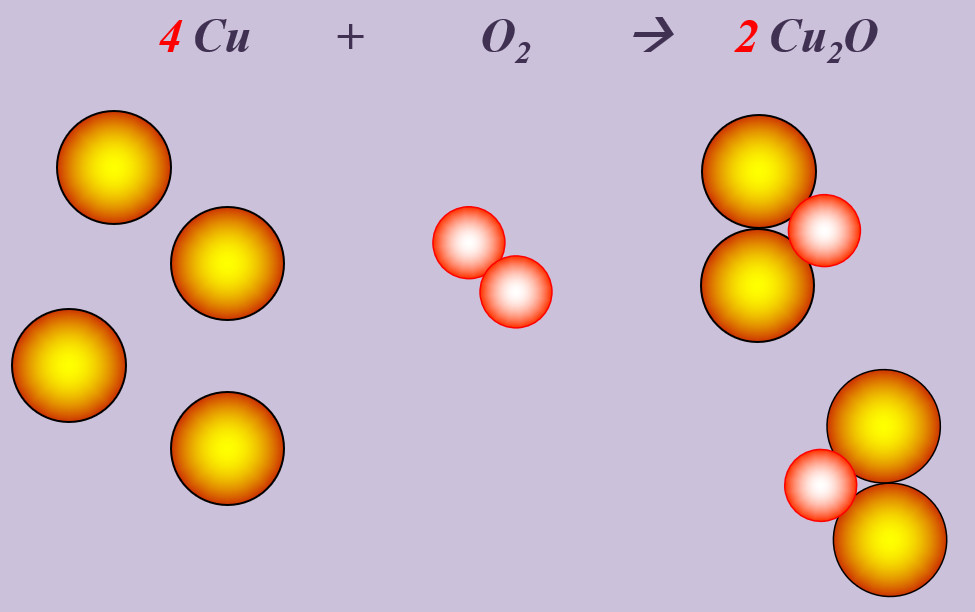
Text + Grafik
Die folgende Grafik enthält viele Informationen. Leite aus dieser Grafik die folgenden Punkte ab:
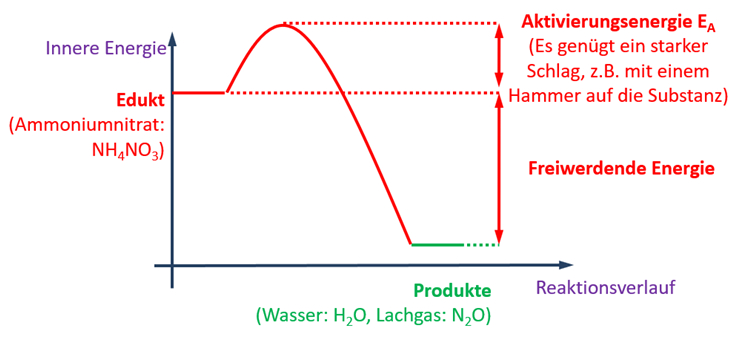
Aufgaben
- Beschreibe mit einem schönen, deutschen Satz die ablaufende Reaktion!
- Stelle die vollständig ausgeglichene Reaktionsgleichung auf!
- Ordne die dargestellte Reaktion zwei Gruppen zu. Betrachte bei der ersten Zuordnung die an der Reaktion beteiligte Energie, bei der der zweiten Zuordnung die Anzahl der vorhandenen Pro- und Edukte!
Atombau
- Bestimme mit Hilfe des PSE die Anzahl an Protonen, Neutronen, Elektronen und Valenzelektronen in einem Atom von Aluminium, Arsen und Antimon!
- Finde in den Hauptgruppen des PSE das Element, bei dem ein Atome zwei Valenzelektronen und 50 Neutronen besitzt!
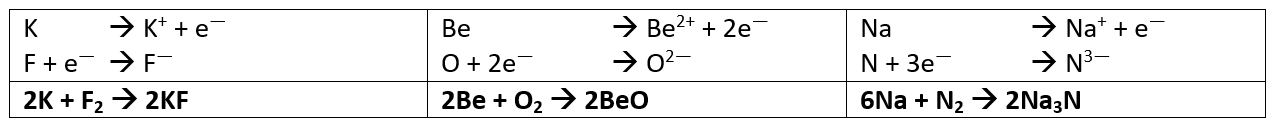
Salzgleichungen
- Stelle die chemischen Gleichungen zur Bildung der folgenden Salze aus den Elementen auf: Kaliumfluorid (aus Kalium und Fluor), Berylliumoxid (aus Beryllium und Sauerstoff) und Natriumnitrid (aus Natrium und Stickstoff)
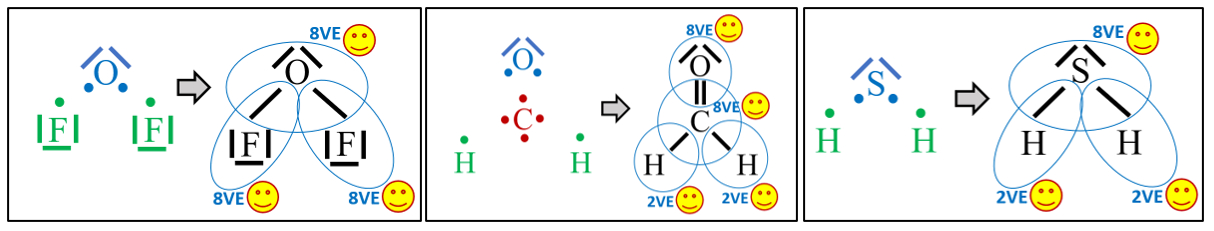
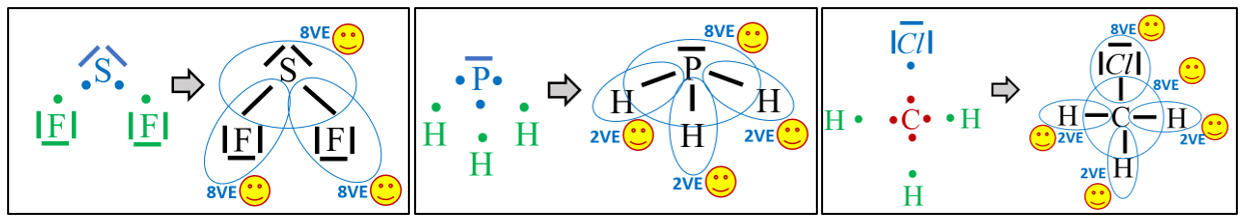
Moleküle
- Zeichne die Valenzstrichformel der folgenden Moleküle: Sauerstoffdifluorid (OF2), Formaldehyd (CH2O) und Schwefelwasserstoff (H2S)
Atombau
- Bestimme mit Hilfe des PSE die Anzahl an Protonen, Neutronen, Elektronen und Valenzelektronen in einem Atom von Bor, Brom und Barium!
- Finde in den Hauptgruppen des PSE das Element, bei dem ein Atome drei Valenzelektronen und 14 Neutronen besitzt!
Salzgleichungen
- Stelle die chemischen Gleichungen zur Bildung der folgenden Salze aus den Elementen auf: Lithiumfluorid (aus Lithium und Fluor), Magnesiumsulfid (aus Magnesium und Schwefel) und Magnesiumnitrid (aus Magnesium und Stickstoff)
Moleküle
- Zeichne die Valenzstrichformel der folgenden Moleküle: Schwefeldifluorid (SF2), Phosphan (PH3) und Chlormethan (CH3Cl)