Benutzer:Thomas Lux/Test Q11-Struktur
Quarantäne-Einheit 2
Für die folgende Einheit benötigt ihr: Das Schulbuch, eine Internetverbindung, Stift + Zettel und Ruhe. Die Arbeitszeit sollte 45 Minuten nicht übersteigen.
Einstieg
Vor ein paar Wochen habt ihr im Unterricht gesehen, dass Alkane brennbar sind. Ihr solltet aus dieser Stunde zwei Erkenntnisse mitgenommen haben:
- Reine Alkane brennen nicht, dazu ist auch noch Sauerstoff nötig.
- Je nach Zerteilungsgrad kann die Reaktion sehr heftig sein (s. Versuch Explosions-Rohr)
Die Verbrennung von Kohlenwasserstoffen wollen wir heute etwas genauer betrachten. Zunächst als Einstieg:
- Stellt die Reaktionsgleichung für die Verbrennung von Propan an der Luft auf! (Erst auf "Lösung" klicken, wenn ihr wirklich eine Gleichung mit dem Stift auf das Papier geschrieben habt!)
Hast Du tatsächlich schon eine komplett ausgeglichene Gleichung? Hilfe: Propan reagiert mit Sauerstoff zu Wasser und Kohlenstoffdioxid
C3H8 + 5 O2 --> 3 CO2 + 4 H2O
- Nachdem das so gut geklappt hat, vielleicht noch eine etwas schwerere Aufgabe: Wie schaut es mit der Verbrennung von Octan, einem Bestandteil von Benzin aus? Formuliere die chemische Gleichung!
2 C8H18 + 25 O2 --> 16 CO2 + 18 H2O
Neu
Die oberen Gleichungen gelten theoretisch. In der Praxis laufen sie (vor allem bei größeren Alkanen) nicht ab. Meist steht nicht genügend Sauerstoff für eine vollständige Verbrennung zur Verfügung. Dann reagieren nur Teile der Alkan-Moleküle und es bleiben Bruchstücke übrig. Die Situation ist in eurem Buch dargestellt. Hier wird die Verbrennung von Propan in einem Bunsenenbrenner betrachtet:
- Schlagt S. 58 auf!
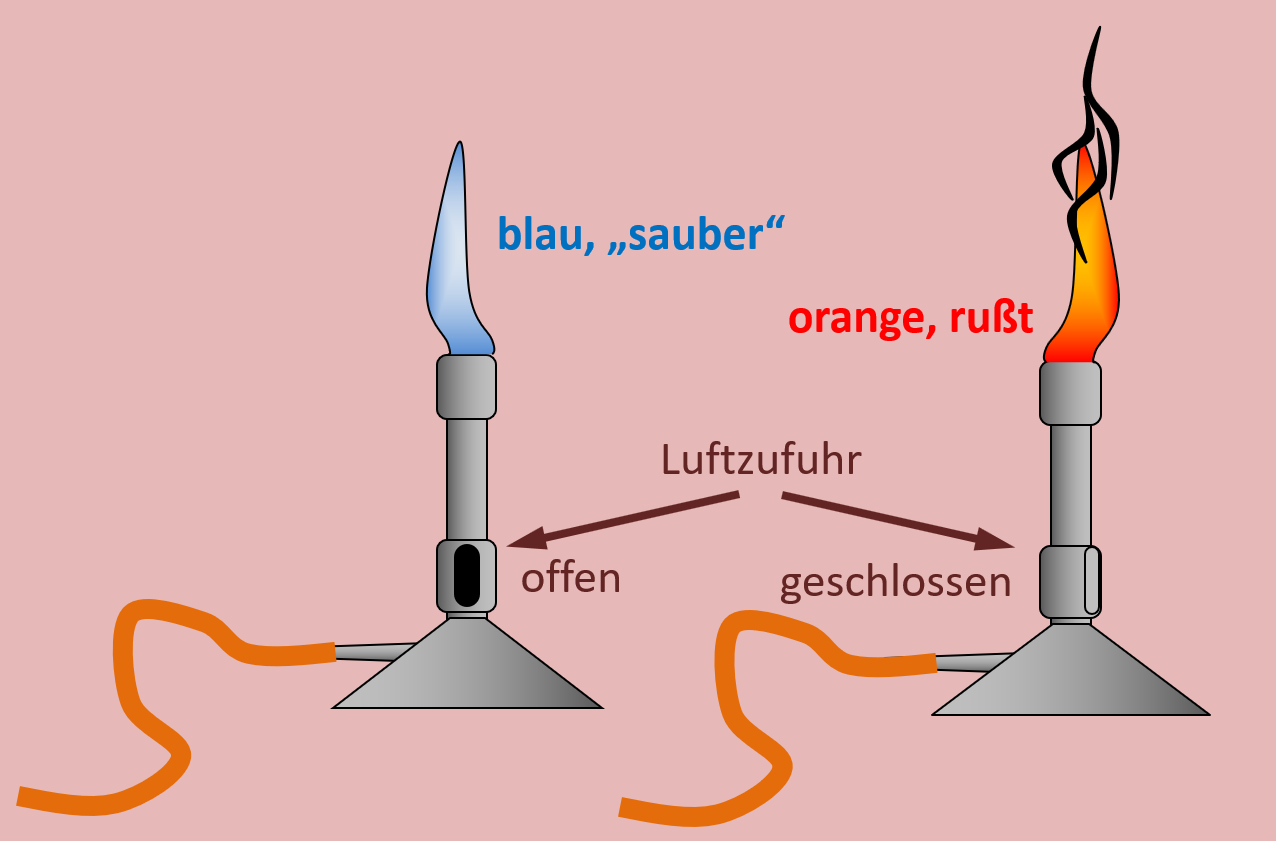
- Vergleicht die Abbildung 2a) und 2b)
- Vergleicht sowohl die äußeren Bilder miteinander und notiert euch Unterschiede und
- vergleicht dann auch die inneren Bilder und notiert Gemeinsamkeiten und Unterscheide!
- Was müsst ihr mit einem Bunsenbrenner tun, damit die links abgebildete Flamme entsteht; was, damit die rechts abgebildete Flamme entsteht?
- äußere Bilder: Bei der vollständigen Verbrennung (links) entsteht eine bläuliche Flamme, auch rauschende Flamme genannt. Bei der unvollständigen Verbrennung (rechts) entsteht eine orange-leuchtende Flamme.
- innere Bilder: Bei der vollständigen Verbrennung (links) sind in der Flamme nur die Produkte der Reaktionsgleichung von oben zu erkennen (CO2 und H2O), bei der unvollständigen Verbrennung (rechts) sind auch noch unverbrannte Propan-Moleküle und Kohlenstoff-Atome zu erkennen.
- Jeder Bunsenbrenner besitzt eine Schraube oder Manschette, mit der die Luftzufuhr reguliert werden kann. Um eine vollständige Verbrennung zu erzeugen, muss diese so gestellt werden, dass möglichst viel Luft in das Brennerrohr gelangen kann.
- Lest nun den Text auf der S. 58 und beantwortet dann die Frage, warum die Flamme bei einer unvollständigen Verbrennung eine orange Farbe annimmt!
Die orange Farbe stammt von unverbrannten Kohlenstoff-Teilchen, die in der Hitze der Flamme orange glühen.
Neben den unterschiedlichen Flammenfarben gibt es noch einen weiteren optischen Unterschied der auf den Bildern in eurem Buch nicht so gut zu erkennen ist: Bei einer unvollständigen Verbrennung rußt die Flamme oft. Das folgende GIF-Bild zeigt die Verbrennung von zwei flüssigen Kohlenwasserstoffen, wobei die rechte Verbrennung unter stark rußender Flamme abläuft:
Datei:C10NTG VerbrAlkanAlken GIF.jpg
- Lies nun die S. 59 und erkläre dann, warum manche Kohlenwasserstoffe eine stärker rußende Flamme erzeugen als andere!
Ein hoher Kohlenstoff-Anteil in den Molekülen eines Kohlenwasserstoffs führt oft dazu, dass für deren Verbrennung nicht genügend Sauerstoff zur Verfügung steht. Viele unverbrannte Kohlenstoff-Atome können sich zu schwarzen Ruß-Teilchen verklumpen und erzeugen den schwarzen Rauch.
Bei den beiden Flüssigkeiten handelt es sich um Hexan und Hex-1-en.
- Zeichne die Valenzstrichformel dieser beiden Moleküle!
- Entscheide, welche Schale welchen Stoff enthalten hat und begründe!
- Stelle die Situation in beiden Schalen zeichnerisch auf Teilchenebene dar. Orientiere Dich dabei an den beiden inneren Abbildung der Abb. 2a und b auf S. 58
Nachdem dies die letzte Stunde vor den Ferien war: Keine Hausaufgabe!
Falls fachliche Fragen auftauchen, meldet euch über den Schulmanager. Schöne Ferien, erholt euch gut und bleibt gesund.