Benutzer:Thomas Lux/Test Q11-Struktur
Inhaltsverzeichnis
Arbeitsauftrag Chemie für den 11.05.
Ihr habt in den letzten beiden Einheiten Säuren und Basen kennengelernt. Hier noch einmal eine Kurz-Zusammenfassung über deren typische Eigenschaften auf molekularer Ebene:
- Säuren können aus einer heterolytischen Bindung zwischen einem Wasserstoff-Atom und einem anderen Atom ein Proton abspalten, z.B. HCl (Hydrogenchlorid):
- Basen können ein Proton über ein freies Elektronenpaar ein Proton binden, also aufnehmen, z.B. NH3 (Ammoniak)
Protonen können aber weder von Säuren einfach so "ins Freie" abgegeben werden, noch fliegen Protonen einfach so in der Gegend herum und können von Basen beliebig aufgenommen werden. Dazu ist immer ein Reaktionspartner nötig, der diese Protonen aufnimmt oder hergibt.
Insofern sind Säuren und Basen hervorragende Reaktionspartner und reagieren in einer typischen "Säure-Base-Reaktion" miteinander:

Wie ihr sehen könnt, entsteht bei dieser Reaktion ein Salz. Also ein Stoff, der aus positiv geladenen Teilchen (hier NH4+) und negativ geladenen Teilchen (hier: Cl-) aufgebaut ist. Salze entstehen auch bei der Reaktion von Metallen mit Nichtmetallen, z.B. von Natrium mit Chlor.
- Vergleicht diese beiden Reaktionstypen miteinander! "Vergleichen" heißt: Gemeinsamkeiten und Unterschiede herausstellen.
- Bei der Salzbildung aus Metall und Nichtmetall gibt das Metall Elektronen ab, das Nichtmetall nimmt Elektronen auf.
- Bei der Salzbildung aus Säure und Base gibt die Säure ein Proton ab, die Base nimmt ein Proton auf.
- Gemeinsamkeit: In beiden Fällen entstehen unterschiedlich geladene Ionen, die das Salz bilden.
Die direkte Reaktion einer Säure mit einer Base betrachtet man an dieser Stelle im Unterricht eher selten. Einfach deswegen, weil viele Säure-Base-Reaktionen im Wasser ablaufen. Und Wasser hat ein besondere Eigenschaft.
Betrachtet zunächst die dargestellte Reaktion, die beim Einleiten von HCl-Gas in Wasser abläuft und beschreibt sie mit Worten:

Ein HCl-Molekül gibt ein Proton an ein Wassermolekül ab. Es entsteht ein Chlorid-Ion und ein Oxonium-Ion (den Namen wusstet ihr wahrscheinlich noch nicht, auch "H3O+-Teilchen" wäre o.k. gewesen.
Betrachtet nun die dargestellte Reaktion, die beim Einleiten von NH3-Gas in Wasser abläuft und beschreibt sie mit Worten:

Ein Ammoniak-Molekül entreißt einem Wasser-Molekül ein Proton. Es entsteht ein Ammonium-Ion (NH4+-Teilchen) und ein Hydroxid-Ion (OH--Teilchen)
Legt nun den Fokus eurer Betrachtung auf das Wassermolekül. Zunächst zur oberen Gleichung: Was hat das Wassermolekül hier "gemacht"?
Es hat ein Proton aufgenommen.
- Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind?
Basen.
Jetzt zur unteren Gleichung: Was hat das Wassermolekül hier "gemacht"?
Es hat ein Proton abgegeben.
- Wie heißen Teilchen, die zu einer solchen Reaktion fähig sind?
Säuren.
Diese Eigenschaft von Wasser führt dazu, dass beim Zugeben von Säuren (egal welcher) zu Wasser saure Lösungen entstehen, die alle eine Gemeinsamkeit haben: Sie enthalten das Oxonium-Ion H3O+:

Ähnliches gilt für Basen. Egal welche Basen man in Wasser gibt, es entstehen immer eine basische Lösungen, die das Hydroxid-Ion enthalten OH-:

Allerdings gibt es noch eine andere Stoffgruppe, die zu basischen Lösungen führt, in denen OH--Ionen enthalten sind: Nämlich Hydroxid-Salze, wie z.B. NaOH oder KOH oder Ca(OH)2. All diese Salze lösen sich in Wasser und setzen dabei Hydroxid-Ionen frei, ohne dass eine chemische Reaktion mit Wasser stattfinden müsste. Das Ergebnis ist aber ein ähnliches wie mit NH3, es entsteht eine basische Lösung, die Hydroxid-Ionen enthält:

Schüttet man nun eine saure Lösung und eine basische Lösung zusammen, so reagieren eigentlich nicht die Säure und die Base direkt miteinander, sondern die bereits vorher durch den Kontakt mit Wasser gebildeten Oxonium-Ionen H3O+ mit den Hydroxid-Ionen OH-:

Diese Reaktion führ zu einer Verringerung der Oxonium- bzw. Hydroxid-Ionen, die für den sauren bzw. basischen Charakter verantwortlich waren. Die entstehende Lösung ist also weder sauer noch basisch sondern neutral. Man kann also sagen, Säuren und Basen neutralisieren sich gegenseitig.
Schüler formulieren folgende Aufgabe oft "stark vereinfacht":
- Formuliere die Neutralisationsgleichung für die Reaktion von Natronlauge mit Salzsäure:
Lösung der Schüler: HCl + NaOH --> H2O + NaCl
Was dabei übersehen wird: Salzsäure ist nicht das selbe wie HCl. HCl ist ein Gas. Wenn dieses in Wasser gelöst wird, entsteht erst die "Salzsäure". Formuliert die Gleichung für diese Reaktion!
HCl + H2O --> H3O+ + Cl-
Auch NaOH ist nicht das gleiche wie Natronlauge. Diese entsteht erst durch Lösen von NaOH in Wasser. Formuliert die Gleichung für diese Reaktion!
NaOH --> Na+ + OH-
Man sollte also besser forulieren:

Formuliert die Reaktion von folgenden Stoffen mit Wasser:
- Schwefelsäure
- Iodsäure (HIO3)
Arbeitsauftrag Bio9
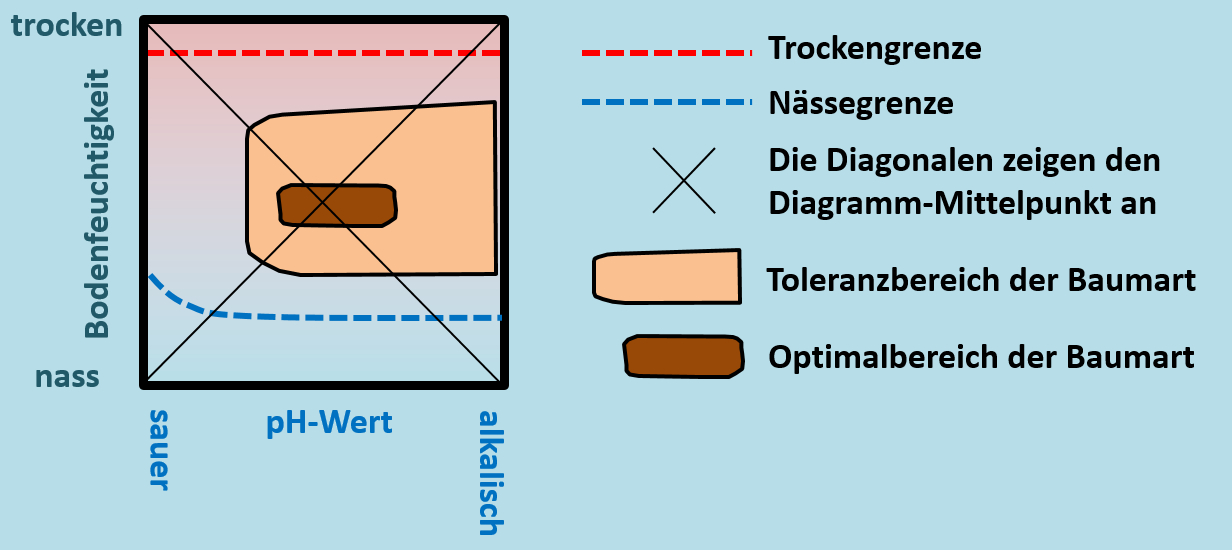
In der letzten kurzen Unterrichtseinheit wurden bereits Baumdiagramme angesprochen, in denen die Wachstums-Stärke (ein Maß für die "Vitalität") verschiedener Baumarten in Abhängigkeit vom pH-Wert und der Bodenfeuchtigkeit darstellt wird. Macht euch zunächst noch einmal mit diesem Diagramm-Typ vertraut:

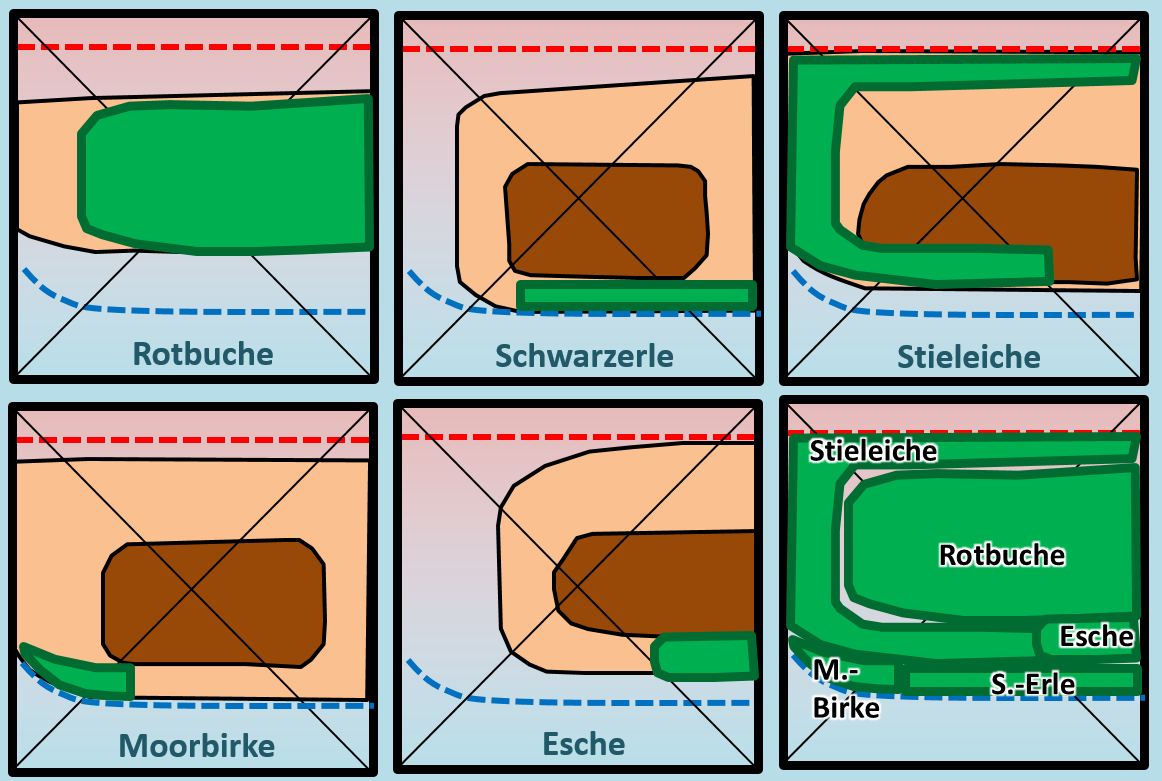
Die Beschreibung eines solchen Diagramm wurde in der letzten Einheit behandelt. Falls ihr euch nicht mehr erinnert, schaut bitte dort nach. Ihr seht in der folgenden Abbildung fünf solche Diagramme für verschiedene Baumarten, die alle in Mitteleuropa vorkommen:
Falls ihr die oben aufgeführten Bäume nicht kennt, klickt auf die folgenden Links! Ihr gelangt dann zur entsprechenden Wikipedia-Seite über diese Bäume. Ihr braucht die Seite nicht lesen. Schaut nur die Abbildungen an. Es geht nur darum, dass ihr einen optischen Eindruck vom Baum gewinnt!
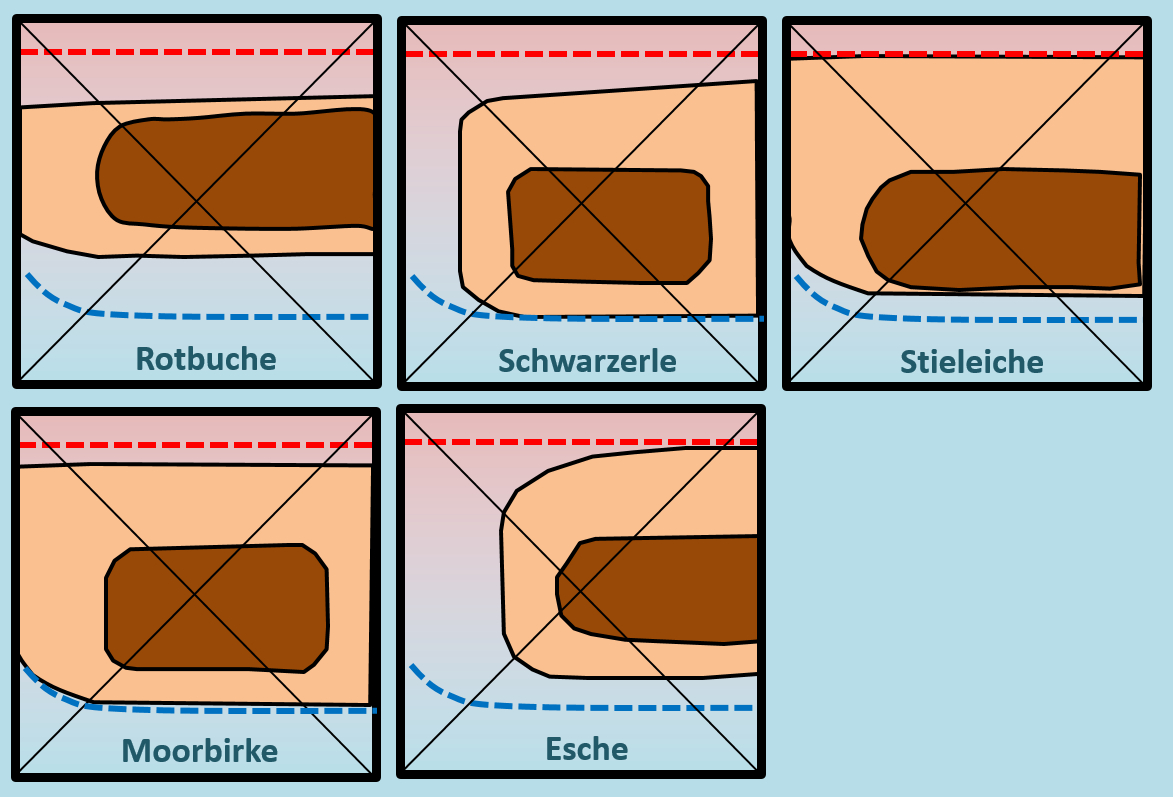
Betrachtet die Optimalbereiche der Bäume in Bezug auf deren Lage zum Diagramm-Mittelpunkt (das ist dort, wo sich die Diagonalen schneiden, der Punkt steht für einen mittleren pH-Wert und eine mittlere Bodenfeuchtigkeit. Formuliert einen einfachen Satz, der eure Erkenntnisse diesbezüglich zusammenfasst!
Die Optimalbereiche aller Baumarten liegt um den Diagramm-Mittelpunkt herum. (Das genügt schon) Nur noch mal etwas deutlicher: Alle Baumarten "bevorzugen" also eine mittlere Bodenfeuchtigkeit und einen mittleren pH-Wert. Oder noch besser: Alle Baumarten wachsen auf Böden mit mittlerer Bodenfeuchtigkeit und einem mittleren pH-Wert optimal.
Die oberen Diagramme wurden teilweise aufgrund von Versuchen erstellt, die nicht den "natürlichen Bedingungen" in einem Ökosystem entsprechen. Zum Beispiel wurden die Bäume auf Feldern angepflanzt, auf denen keinen anderen Bäume wuchsen also keine Konkurrenz durch andere Arten herrschte.
In den folgenden Diagrammen sind zusätzlich die Boden-Bereiche grün gekennzeichnet, auf denen man in der unberührten Natur die entsprechende Baumart tatsächlich auch findet und diese sich gegen andere Baumarten auch durchsetzen kann (man nennt diesen Bereich: Herrschaftsbereich). Betrachtet zunächst die Herrschaftsbereiche von Rotbuche und Schwarzerle in Bezug auf ihren Toleranz- und Präferenzbereich. überlegt euch eine schöne Formulierung, wie man das sprachlich darstellen könnte!
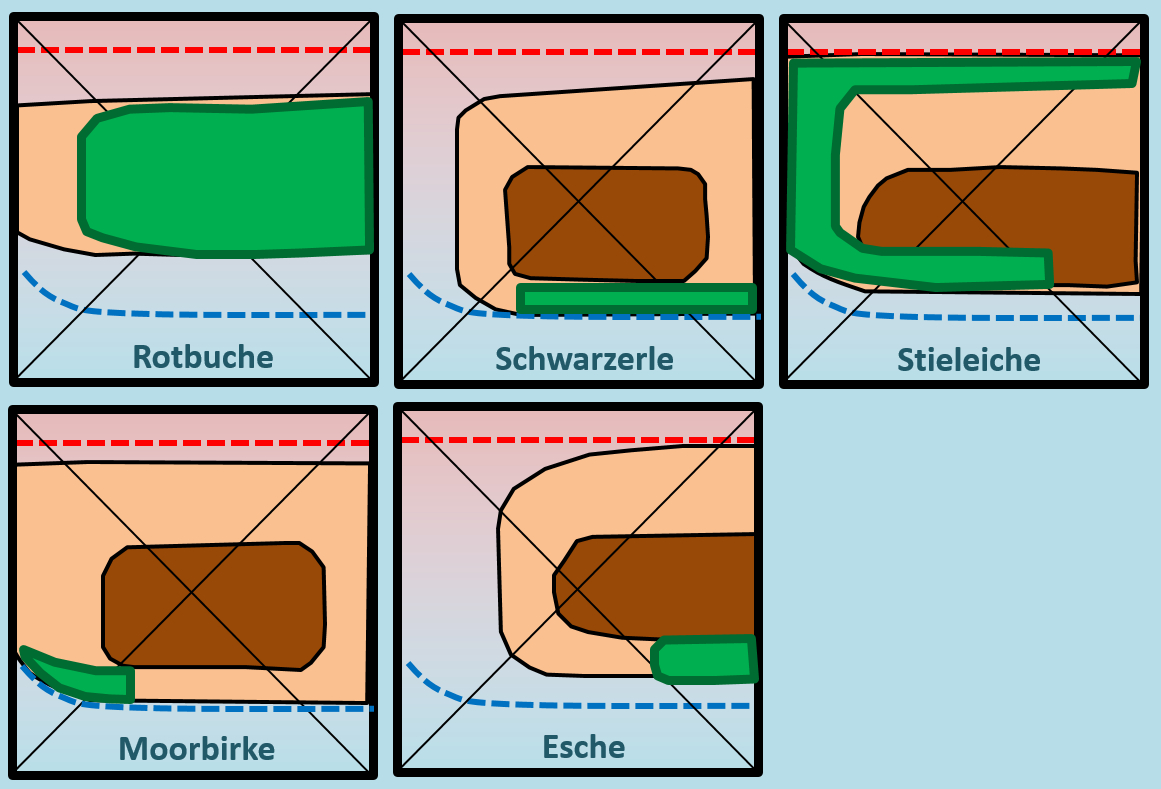
Der Herrschaftsbereich der Rotbuche deckt sich ziemlich genau mit dem experimentell ermittelten Optimalbereich bezüglich der Bodenfaktoren pH-Wert und Feuchtigkeit. Der Herrschaftsbereich der Schwarzerle dagegen liegt am äußersten Ende ihres Toleranzbereichs: Nur auf Böden, auf denen die Schwarzerle gerade noch wachsen kann, schafft sie es sich gegen andere Baumarten durchzusetzen.
- Zeichnet ein leeres Diagramm, so wie es die erste Abbildung dieser Einheit zeigt auf ein leeres Blatt, ca. 10 x 10 cm groß.
- Übertragt alle Herrschaftsbereiche der hier dargestellten Baumarten in dieses eine leere Diagramm.
- Versucht das Ergebnis in Worte zu fassen!
Morgen (Mittwoch) wird es keine neue Einheit geben, aber ihr verbessert bitte morgen diese Hausaufgabe selbständig. Eine Musterlösung lade ich am Mittwoch hoch.
- noch nicht vorhanden. Erst am Mittwoch, 06.05. -
Musterlösung
Arbeitsauftrag Chemie11
Ihr habt im vergangenen Schuljahr drei wichtige Bindungstypen kennengelernt, die dafür verantwortlich sind, dass bestimmte Teilchen zusammenhalten:
- Ionenbindung bei Salzen
- Atombindung bei Molekülen
- Metallbindung bei Metallen
Es gäbe noch einen vierten Bindungstyp, den ich persönlich früher gerne unterrichtet habe: Die Komplexbindung. Sie spielt z.B. beim grünen Blattfarbstoff Chlorophyll oder roten Blutfarbstoff Hämoglobin eine Rolle. Die Komplexbindung ist aber kein Bestandteil des Lehrplans mehr.
Bleiben wir daher bei den bekannten drei Gruppen. Heute nur eine kleine Aufgabe:
Zeichnet stark vergrößerte, schematische Ausschnitte von den folgenden Stoffen, die erkennen lassen, wie die beteiligten Teilchen zusammenhängen. Alle drei Zeichnungen sollten zusammen auf ein DIN-A4-Blatt passen. Jede Zeichnung müsste also ca. 9cm hoch und ca. 20cm breit sein:
- Kaliumbromid (KBr)
- Ammoniak (NH3)
- Magnesium (Mg)
Eine Lösung für diese Aufgabe gibt es nächsten Montag! Hebt eure Zeichnungen auf jeden Fall so lange auf!
- wird am Montag, 11.05. hochgeladen -
Arbeitsauftrag Chemie (EK) für den 04.05.
Pflicht: Sucht bei euch zu Hause drei völlig verschiedene Lebensmittel, die sauer sind (mit "völlig verschieden" meine ich, dass ihr nicht so etwas findet wie "Äpfel" und "Birnen").
Freiwillig: Versucht zu recherchieren, welches Molekül für den sauren Geschmack des Lebensmittels verantwortlich ist!
- z.B.: Essig - Essigsäure (CH3-COOH)
- z.B.: Zitronen (allgemein Früchte) - Zitronensäure (C6H8O7)
- z.B.: Joghurt (allgemein Sauermilchprodukte) - Milchsäure (C3H6O3)
- z.B.: Limo (allgemein sprudelnde Getränke) - Kohlensäure (H2CO3)
In der letzten Einheit habt ihr gesehen, dass es Moleküle mit einer polaren Atombindung zwischen einem elektronegativen Atom und einem Wasserstoff-Atom gibt, die heterolytisch ein Proton abspalten können. Hier noch einmal verschiedene Darstellungsformen am Beispiel von Hydrogenchlorid (HCl).
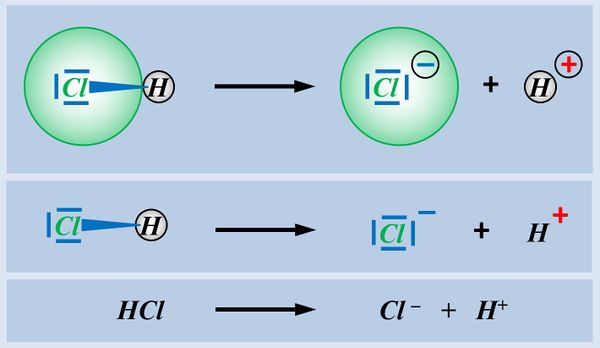
Moleküle, bei denen eine derartige Reaktion möglich ist, nennt man Säuren. Typische Eigenschaften von Säuren sind z.B. der "saure Geschmack" oder "greifen unedle Metalle an". Diese Eigenschaften sind auf das abspaltbare Proton zurückzuführen.
Sicher können sich diejenigen, die Chemie schon länger in der Schule hatten erinnern, dass es zu Säuren einen "Gegenspieler" gibt. Wie heißen diese Gegenspieler?
Basen oder Laugen (als Lauge bezeichnet man in der Regel eine wässrige Lösung einer Base)
Diese Gegenspieler sind in der Lage, die saure Wirkung von Säuren zu neutralisieren, also aufzuheben. Dazu gleich ein Versuch. Vorher noch etwas Theorie: Wenn die saure Wirkung einer Säure darauf beruht, dass die Säure-Teilchen ein Proton abgeben, welche Fähigkeit muss dann ein solches Gegenspieler-Teilchen besitzen, wenn es diese Wirkung aufzuheben vermag?
Es muss in der Lage sein, ein Proton aufzunehmen
Ein einfaches Molekül, dass in der Lage ist, ein Proton aufzunehmen ist NH3 (Ammoniak). Der Vorgang ist hier dargestellt. Beschreibt die Abbildung mit Worten und unter Verwendung von Fachbegriffen:
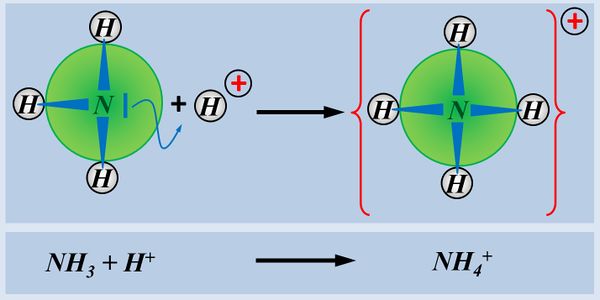
Das Ammoniak-Molekül NH3 stellt sein freies Elektronen-Paar für eine Atombindung mit einem Proton zur Verfügung
Was ist der Unterschied zwischen dieser neu gebildeten Atombindung im Vergleich zu einer "normalen" Atombindung, wie ihr sie früher kennengelernt habt?
Bei der Bildung einer Atombindung sind wir in den vorangegangenen Einheiten davon ausgegangen, dass jeder Partner ein Elektron zur Verfügung stellt. Hier stammen aber beide Elektronen der Atombindung nur vom Stickstoff-Atom. Das Proton hat kein Elektron zur Bindung beigetragen.
Ein freiwilliger Versuch. Ihr benötigt dazu:
- Zitrone(nsaft)
- Bullrichsalz (Tabletten oder Pulver), falls nicht verfügbar ist auch Backpulver möglich.
- 2 kleine Gläschen (z.B. Schnapsgläser)
Durchführung:
- Füllt die zwei Schnapsgläser zur Hälfte mit Leitungswasser. In ein Glas gebt ihr eine Tablette Bullrich-Salz (oder einen halben Teelöffel Pulver oder einen halben Teelöffel Backpulver.
- Anschließend tropft ihr in beide Gläschen die gleiche Menge Zitronensaft (ich habe es mit jeweils 50 Tropfen Z.-Saft ausprobiert) und rührt ca. 1 Minute lang um.
- Probiert von jeder Lösung einen Teelöffel voll (Ihr könnt das noch einmal wiederholen, dann aber bitte keine größeren Mengen mehr von der Backpulver-Lsg. schlucken. Backpulver kann im Magen zur Bildung großer Mengen Gas führen.
Beschreibt das Ergebnis in Form eurer Geschmacks-Empfindung
Die Lösung mit Bullrich-Salz / Backpulver sollte deutlich weniger sauer schmecken. Es kommt aber ein bisschen auf die Zitrone an. Die muss sehr sauer sein, damit der Versuch gut klappt.
Nur kurz zur Erklärung: Bullrichsalz enthält Natriumhydrogencarbonat. In Wasser gelöst entstehen Hydrogencarbonat-Ionen. Diese sind in der Lage Protonen aufzunehmen. Sie fungieren also als Base.
Die sauere Wirkung von Zitronensaft beruht auf der Zitronensäure, die ein (bzw. auch mehrere) Proton(en) abgeben kann. Nachdem diese jedoch von den Hydrogencarbonat-Ionen "abgefangen" werden, entsteht auf der Zunge kein sauerer Eindruck.
Formuliert die Aufnahme eines Protons auf Teilchen-Ebene von folgenden Basen:
- Hydrogencarbonat-Ion
- Sulfid-Ion
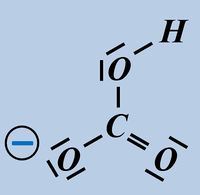
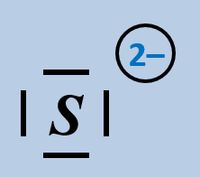
Bitte wirklich erst auf "Lösung" klicken, wenn ihr diesen chemischen Vorgang auf ein Stück Papier gezeichnet habt!
Hast Du wirklich die Lösung schon gezeichnet?
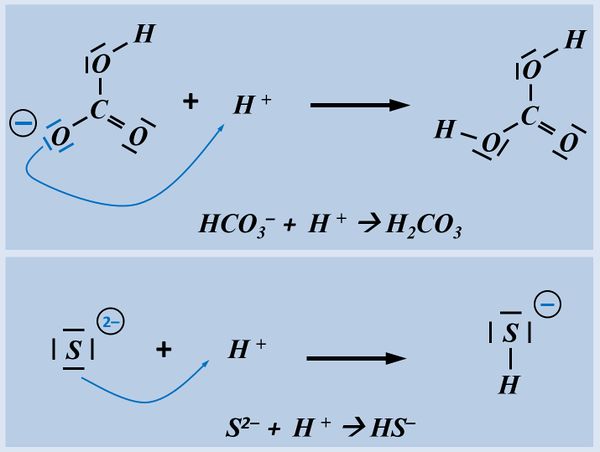
Beim Hydrogencarbonat-Ion könnte es sein, dass ihr ein anderes freies Elektronenpaar für die Bindung zum Proton verwendet habt. Das ist aber falsch! Das Proton wird immer über eines der drei freie Elektronenpaare gebunden, die am Sauerstoff mit der negativen Ladung sitzen (im Bild blau markiert). Schon allein aufgrund der elektrischen Ladung dort, wird das positiv geladene Proton dort hin gezogen.
Beim Sulfid-Ion ist egal, welches Elektronenpaar verwendet wird, das Ergebnis ist faktisch immer das selbe.
Startseiten-Struktur-Test
Hier im Schulwiki findet jede Klasse auf der jeweiligen Klassenseite alle Arbeitsaufträge, die erledigt werden sollten. Die Stunden orientieren sich am Stundenplan der Klasse.
Stöbern in anderen Klassen ist erlaubt!
Um in den Ferien keine Langeweile aufkommen zu lassen gibt es für alle Klassen eine
- Ideenbörse für Kollegen
- Tipps und Tricks zum Arbeiten im Wiki
- Basismodule]
- Digitale Didaktik
- Fortbildungskonzept
- Mitdenken! Mitreden! Mitgestalten!
- Pädagogischer Tag Kollaboration
- Bildung für nachhaltige Entwicklung
Unterstufe
- 5a - 5b - 5c - 5d - 5e - 5f - M5 - E5 - Eth5
- 6a - 6b - 6c - 6d - 6e - E6
- 7a - 7b - 7c - 7d
Mittelstufe
- 8a - 8b - 8c - 8d - 8e - E8
- 9a - 9b - 9c - 9d - WR9
- 10a - 10b - 10c - 10d - 10e - M10 - WR10
Q11-Kurse
- Astronomie (Link Ast): AST1
- Bio: 1b1 - 1b2 - 1b3 - 1b4 - 1b5
- Chemie: 1c1 - 1c2
- Deutsch: 1d1 - 1d2 - 1d3 - 1d4 - 1d5 - 1d6 - 1d7
- Englisch:
- Englisch Konversation:
- Ethik:
- Evangelische Religionslehre:
- Französisch:
- Geschichte:
- Geographie:
- Informatik:
- Katholische Religionslehre:
- Kunst:
- Latein:
- Mathematik:
- Musik:
- Physik:
- Rhetorik:
- Sozialkunde:
- Sport:
- Spanisch (spätbeginnend):
- Sport-Theorie:
- Wirtschaft:
Q12-Kurse
- Bio: 1b1 - 1b2 - 1b3 - 1b4 - 1b5
- Chemie: 1c1 - 1c2
- Deutsch: 1d1 - 1d2 - 1d3 - 1d4 - 1d5 - 1d6 - 1d7
- Englisch:
- Ethik:
- Evangelische Religionslehre:
- Französisch:
- Geschichte:
- Geographie:
- Informatik:
- Katholische Religionslehre:
- Kunst:
- Latein:
- Mathematik:
- Musik:
- Physik:
- Astrophysik:
- Sozialkunde:
- Sport:
- Spanisch (spätbeginnend):
- Sport-Theorie:
- Wirtschaft:
W-Seminare Q11 + Q12
Q11
- 1W01: Klassiker der dt. Literatur (D)
- 1W02: Klassiker der engl. Literatur (E)
- 1W03: Klassiker der franz. Literatur (F)
- 1W04: Klassiker der biologischen Literatur (B)
- 1W05: Klassiker der chemischen Literatur (C)
- 1W06: Klassiker der mathematischen Literatur (M)
- 1W07: Klassiker der geschichtlichen Literatur (G)
- 1W08: Klassiker der sportlichen Literatur (Spo)
- 1W09: Klassiker der musikalischen Literatur (Mu)
- 1W10: Klassiker der künstlerischen Literatur (Ku)
- 1W11: Klassiker aller Klassiker (K)
Q12
- 2W01: Klassiker der dt. Literatur (D)
- 2W02: Klassiker der engl. Literatur (E)
- 2W03: Klassiker der franz. Literatur (F)
- 2W04: Klassiker der biologischen Literatur (B)
- 2W05: Klassiker der chemischen Literatur (C)
- 2W06: Klassiker der mathematischen Literatur (M)
- 2W07: Klassiker der geschichtlichen Literatur (G)
- 2W08: Klassiker der sportlichen Literatur (Spo)
- 2W09: Klassiker der musikalischen Literatur (Mu)
- 2W10: Klassiker der künstlerischen Literatur (Ku)
- 2W11: Klassiker aller Klassiker (K)
P-Seminare Q11 + Q12
Q11
- 1P01: Klassiker der dt. Literatur (D)
- 1P02: Klassiker der engl. Literatur (E)
- 1P03: Klassiker der franz. Literatur (F)
- 1P04: Klassiker der biologischen Literatur (B)
- 1P05: Klassiker der chemischen Literatur (C)
- 1P06: Klassiker der mathematischen Literatur (M)
- 1P07: Klassiker der geschichtlichen Literatur (G)
- 1P08: Klassiker der sportlichen Literatur (Spo)
- 1P09: Klassiker der musikalischen Literatur (Mu)
- 1P10: Klassiker der künstlerischen Literatur (Ku)
- 1P11: Klassiker aller Klassiker (K)
Q12
- 2P01: Klassiker der dt. Literatur (D)
- 2P02: Klassiker der engl. Literatur (E)
- 2P03: Klassiker der franz. Literatur (F)
- 2P04: Klassiker der biologischen Literatur (B)
- 2P05: Klassiker der chemischen Literatur (C)
- 2P06: Klassiker der mathematischen Literatur (M)
- 2P07: Klassiker der geschichtlichen Literatur (G)
- 2P08: Klassiker der sportlichen Literatur (Spo)
- 2P09: Klassiker der musikalischen Literatur (Mu)
- 2P10: Klassiker der künstlerischen Literatur (Ku)
- 2P11: Klassiker aller Klassiker (K)
Verschachtelte Verstecke?
Kann man in einer "Lösung versteckt"-Box eine "Lösung versteckt"-Box integrieren?
Bist Du wirklich fertig mit der Lösung? Hast Du wirklich drei schön gezeichnete Skizzen vor Dir liegen?
Also gut, ich will Dir mal glauben. Dann hier die Lösung: