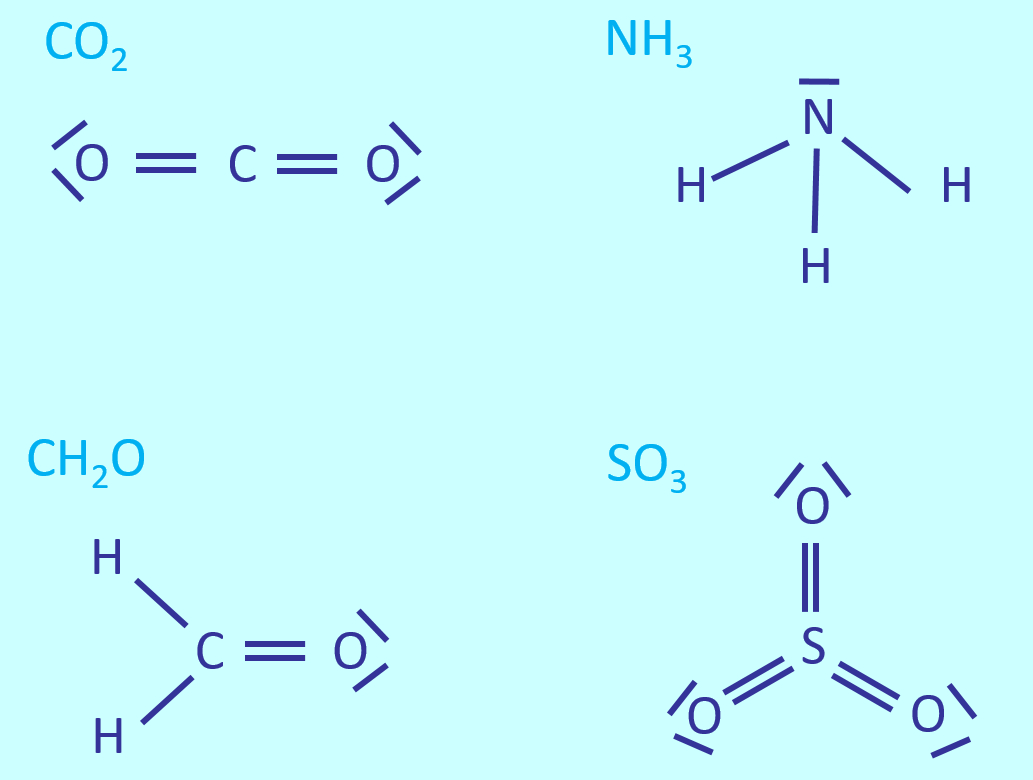
Benutzer:Thomas Lux/Test Q11-Struktur
Arbeitsauftrag 8
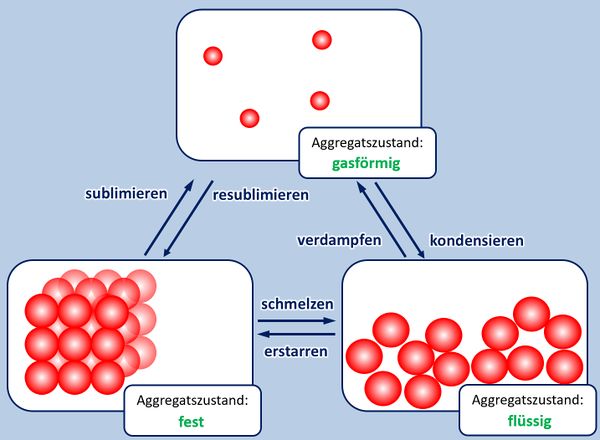
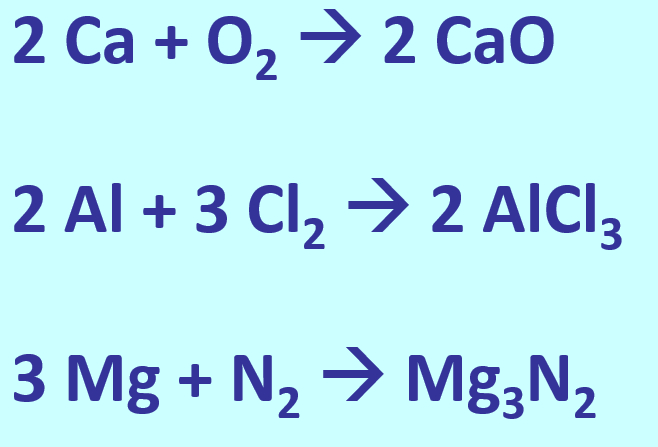 Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
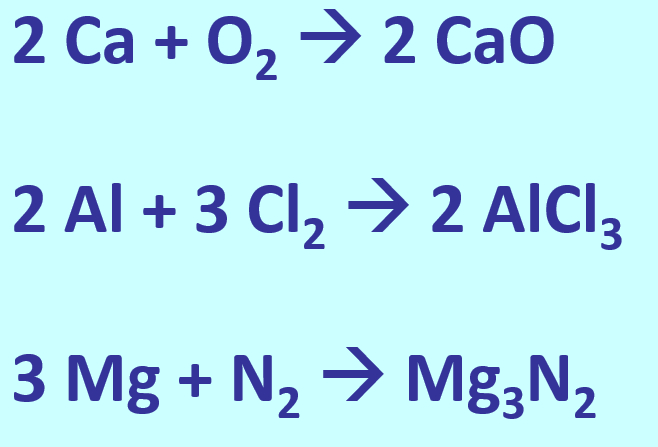 In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden