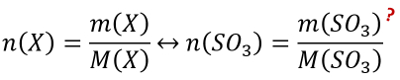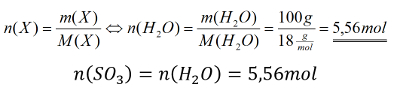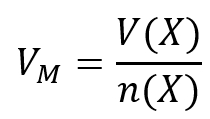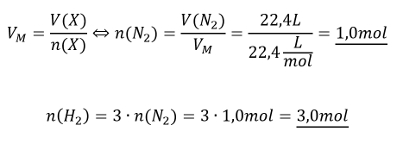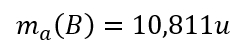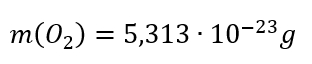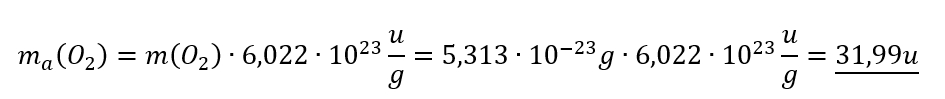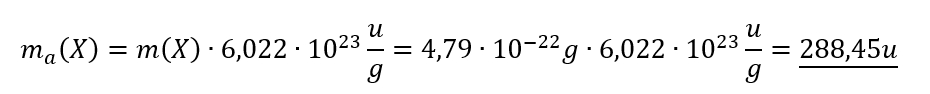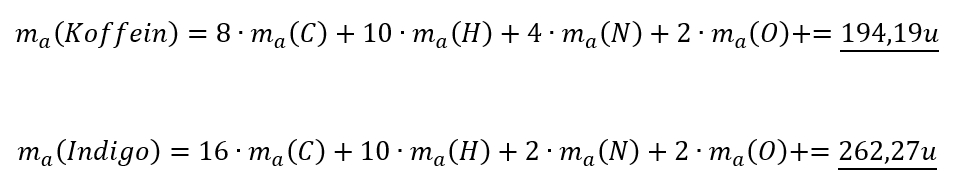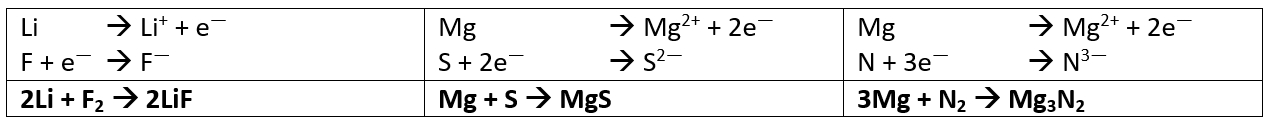9e 2020 21/Chemie
Inhaltsverzeichnis
- 1 Distanzunterricht im Januar
- 1.1 Distanzunterricht Dienstag, 26.01.
- 1.2 Distanzunterricht Montag, 25.01.
- 1.3 Distanzunterricht Donnerstag, 21.01.
- 1.4 Distanzunterricht Dienstag, 19.01.
- 1.5 Distanzunterricht Montag, 18.01.
- 1.6 Distanzunterricht Donnerstag, 14.01.
- 1.7 Distanzunterricht Dienstag, 12.01.
- 1.8 Arbeitsauftrag für Montag, 11.01.
- 2 Distanzlernen vor Weihnachten
- 3 Termine
- 4 Versuchsprotokolle
- 5 Grundwissen
Distanzunterricht im Januar
Distanzunterricht Dienstag, 26.01.
Verbessert gegenseitig eure Hausaufgabe:
- Findet einen Partner, mit dem ihr zusammenarbeiten wollt. Wenn ihr keinen findet, könnt ihr eure Hausaufgabe auch alleine verbessern.
- Besorgt euch einen Rotstift!
- Macht ein Foto von eurer Hausaufgabe (Aufgabe 10 und Aufgabe 12 auf dem AB) und schickt sie an eure Korrekturpartnerin bzw. eurem Korrekturpartner!
- Druckt dann die Lösungen, die ihr jetzt erhalten habt aus (wenn ihr euch selbst korrigiert ist das natürlich nicht nötig)
- Solltet ihr keinen Drucker haben, könnt ihr das Foto auch in z.B. Powerpoint einfügen und dann mit dem Mauszeiger etwas hineinmalen.
- Geht zunächst auf dieser Seite Schritt für Schritt die Musterlösung durch und vergleicht mit der Lösung, die vor euch liegt. Verbessert mit roter Farbe die Fehler!
- Schickt eurem Korrekturpartner die Arbeit zurück (z.B. wieder ein Foto davon)
- Wenn ihr euch nicht selbst korrigiert habt, dürft ihr jetzt in grün die Korrektur korrigieren - sofern die Korrektur falsch ist oder ihr euch ungerecht behandelt fühlt.
- Ihr erhaltet um 13:50 Uhr einen Arbeitsauftrag über den Schulmanager. Als Antwort auf diesen Arbeitsauftrag schickt ihr mir eure (doppelt) korrigierte Lösung zurück!
Aufgabe 10: Berechne die Stoffmenge an Schwefeltrioxid, die man benötigt, um mit 100g Wasser vollständig zur Schwefelsäure zu reagieren.
Tipp 1: Es geht hier um die Stoffmenge und eine Masse ist gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte!
Tipp 2: Direkt lässt sich die Stoffmenge von Schwefeltrioxid mit dieser Gleichung nicht berechnen. Das geht nur, wenn alle anderen Größen der Gleichung bekannt wären, aber die Masse von Schwefeltrioxid ist unbekannt. Über die chemische Gleichung kann man die Stoffmenge von Schwefeltrioxid jedoch mit der Stoffmenge des Wassers in Beziehung setzen: Wie verhält sich die Stoffmenge (also die Anzahl der Teilchen) von Schwefeltrioxid zu der Stoffmenge (also der Anzahl der Teilchen) von Wasser?
Tipp 3: Die Stoffmenge des Schwefeltrioxids lässt sich also durch die Stoffmenge des Wassers ausdrücken. Und die kann berechnet werden! Denn von Wasser hat man die Masse gegeben. Berechne zunächst die Stoffmenge des Wassers und schließe dann die Aufgabe ab!
Aufgabe 12: Im Labor soll Ammoniak aus den Elementen hergestellte werden (also aus H2 und N2). Es gibt noch exakt 22,4L Stickstoff. Welche Stoffmenge an Wasserstoff benötigt man, um den gesamten Stickstoff zu Ammoniak umzusetzen.
Tipp 1: Es geht hier um die Stoffmenge. Darüber hinaus ist ein Volumen gegeben. Finde die Gleichung, in der diese beiden Parameter vorkommen und die nützlich sein könnte!
Tipp 2: Direkt lässt sich die Stoffmenge von Wasserstoff mit dieser Gleichung nicht berechnen, es fehlt das Volumen, V(H2). Aber wie immer kann über die chemische Gleichung die Stoffmengen der beteiligten Stoffe in Beziehung zueinander setzen. Stelle die chemische Gleichung auf und drücke dann die Stoffmenge des benötigten Wasserstoffs in der Stoffmenge des Stickstoffs aus!
Tipp 3: Jetzt kann die Stoffmenge des Stickstoffs ausgerechnet werden und daraus die Stoffmenge des benötigten Wasserstoffs!
Distanzunterricht Montag, 25.01.
Videokonferenz: Rechnen mit molaren Größen
- Bitte Hausaufgabe bereithalten: Ihr solltet die Aufgaben 1 - 4 auf der zweiten Seite dieses Arbeitsblattes bearbeiten: Hier klicken
- Neuer Unterrichtsstoff: Das molare Volumen (Bereits auf verteiltem Hefteintrag enthalten)
Distanzunterricht Donnerstag, 21.01.
Videokonferenz: Rechnen mit molaren Größen
Distanzunterricht Dienstag, 19.01.
Videokonferenz: Rechnen mit molaren Größen
Distanzunterricht Montag, 18.01.
In den vorangegangenen Einheiten habt ihr einen historischen Einblick in die Probleme erhalten, die sich beim Arbeiten mit der Masse von Stoffportionen ergeben. Für die weiteren Einheiten sind diese historischen Aspekte erst einmal weniger interessant. Wir wollen in den nächsten Einheiten eher dahin kommen, dass in der Lage seid, z.B. folgende Aufgaben zu lösen:
"Ein Auto verbraucht pro hundert gefahrene Kilometer im Durchschnitt 5,0L Benzin. Wie viel Gramm Kohlenstoffdioxid wird auf diesem Weg ausgestoßen."
Bis dahin müssen jedoch noch einige Dinge geklärt werden und wir fangen heute erst einmal mit kleinen Schritten an. Ihr benötigt für diese Einheit einen Stift, Zettel und euer Buch!
Ihr solltet in der letzten Einheit bemerkt haben, dass die "frühen Chemiker" sehr daran interessiert waren, die Masse von einzelnen Atomen zu bestimmen. Diese Atommasse spielt eine wichtige Rolle bei der Berechnung von Mengeneinheiten, um chemische Reaktionen vollständig durchführen zu können. Nachdem es keine Waage gab, mit der man so kleine Massen bestimmen konnte, behalf man sich mit einer willkürlichen Größe: Die atomare Masseneinheit u wurde eingeführt. Man wusste zwar nicht, wie viel Gramm ein Teilchen wog, welches 1u schwer war, aber man konnte bestimmen wie viel u z.B. ein Sauerstoffatom und wie viel u ein Wasserstoffatom wog. So konnte man die Atome von unterschiedlichen Elementen vergleichen.
Mit Hilfe von Massenspektrometern gelang es irgendwann, für die atomare Masseneinheit u einen Wert in Gramm zu bestimmen, es gilt:
1u = 1,66 x 10-24g
Damit lassen sich nun schon ein paar einfache Aufgaben rechnen. Um zu unterscheiden, ob man von der Masse eines Teilchens in g oder der atomaren Masseneinheit in u spricht, gibt es die zwei Variablen m(X) für die "normale" Masse und ma(X) für die atomare Masseneinheit. X steht dabei für die Teilchen, das man betrachtet. Die folgenden Ausdrücke bedeuten dann folgendes:
m(O-Atom) = 2,658 x 10-23g.
Die Masse eines Sauerstoffatoms beträgt zwei Komma sechs fünf acht mal zehn hoch minus dreiundzwanzig Gramm.
ma(C-Atom) = 12,0u
Die Masse eines Kohlenstoffatoms beträgt zwölf Komma Null u.
Test:
Schreibe als mathematische Gleichung: Misst man die Masse eines Bor-Atoms in atomaren Masseneinheiten, so erhält man 10,811u.
Schreibe als mathematische Gleichung: Die Masse eines Sauerstoff-Moleküls (!) beträgt 5,313 x 10-23 Gramm
Mit Hilfe des oben beschriebenen Zusammenhangs zwischen der Masse in g und der atomaren Masseneinheit in u lassen sich die beiden Größen auch leicht ineinander umwandeln:
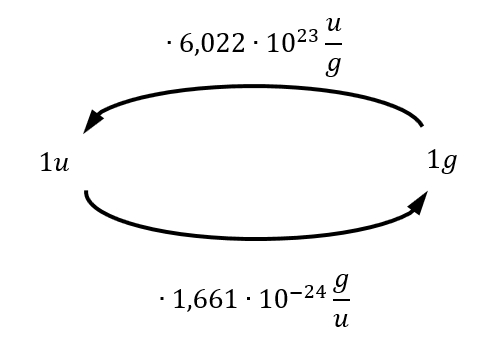
Berechne die Masse eines Sauerstoffmoleküls in u! (Die Masse in Gramm ist oben bereits angegeben)
Nachdem ein unbekannter Stoff X im Massenspektrometer untersucht wurde, konnte die Masse eines Teilchens dieses Stoffes auf 4,79 x 10-22g bestimmt werden. Rechne diesen Wert in atomare Masseneinheiten um!
Man sollte meinen, nachdem man jetzt die atomare Masseneinheit auch in Gramm bestimmen kann, ist die Angabe in u doch nicht mehr nötig. Es war doch nur eine Hilfsgröße, solange man das Gewicht von Atomen noch nicht direkt bestimmen konnte. Die Einheit hat sich aber gehalten, denn sie ist (unter anderem) in folgendem Punkt ganz praktisch: Sie lässt sich einfacher schreiben! Nehmt an, ihr habt ein Molekül "XYZ", für das gilt: ma(XYZ) = 212,3u und m(XYZ) = 3,5 x 10-24g.
Versucht beide Angaben in einem Word-Dokument zu schreiben! Das geht mit der atomaren Masseneinheit sehr leicht, mit der "normalen" Masse tut man sich deutlich schwerer. Dieses "Zehn hoch irgendwas" ist einfach umständlich.
Wenn ihr eure Hausaufgabe gemacht habt und das Buch auf den Seiten 34 - 35 gelesen habt, dann wisst ihr schon, dass man die Masse von Molekülen oder die Formelmasse von Salzen, gemessen in der atomaren Masseneinheit u, ganz einfach bestimmen kann, indem man die Masseneinheiten der einzelnen Atome, die am Aufbau des Moleküls oder der Formelmasse beteiligt sind, zusammenzählt. Bsp.: Möchte man die Masse eines Schwefelsäure-Moleküls (H2SO4) wissen (in u), dann addiert man einfach die Masseneinheiten der am Aufbau beteiligten Atome, also: 2 x ma(H) + ma(S) + 4 x ma(O).
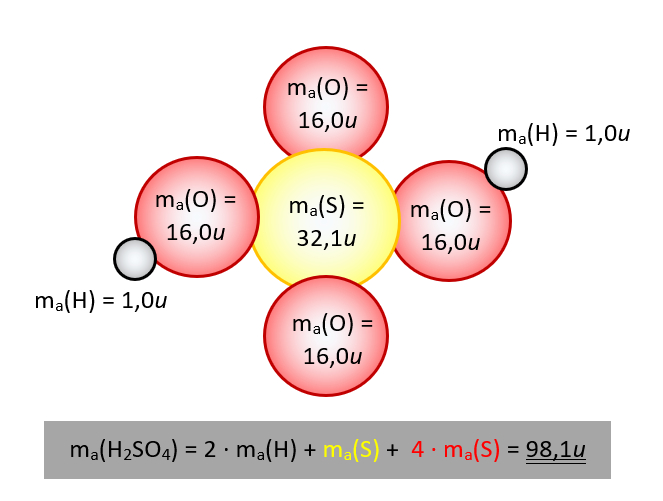
Das leuchtet vermutlich den meisten ein, aber die große Frage ist doch: Woher weiß man die Werte für die einzelnen Atome? - Sie stehen im Periodensystem! Nehmt das Periodensystem im Buch auf der letzten Seite zur Hand. Ihr erkennt im oberen weißen Feld "Erklärungen", dass die Zahl links oberhalb des Elementsymbols die Atommasse in u angibt.
Berechnet nun mit Hilfe des PSEs die Molekülmassen (in u) von:
- Adrenalin (ein Hormon, welches euer Körper in stressigen Situationen ausschüttet), chem. Formel: C9H13NO3
- Koffein (ein Stoff in Kaffee oder Cola, der anregend wirkt), chem. Formel: C8H10N4O2
- Indigo (ein Stoff zum Färben von Jeans), chem. Formel: C16H10N2O2
Adrenalin C9H13NO3:
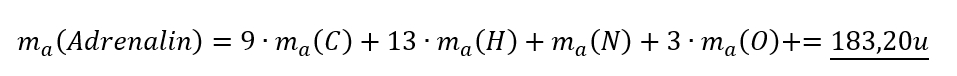
Solltet ihr das nicht richtig haben, dann überprüft genau, wo der Fehler lag und rechnet die anderen beiden Stoffe noch einmal nach!
Mit dem nun verfügbaren Atomgewicht könnte man theoretisch schon arbeiten. Betrachten wir noch einmal das Beispiel aus der letzten Einheit. Es ging um die chemische Reaktion: Eisen reagiert mit Schwefel zu Pyrit:
Fe + 2 S --> FeS2
Diese chemische Gleichung sagt aus, dass man doppelt so viele Schwefel-Atome wie Eisenatome braucht, damit alles miteinander reagiert und nichts übrig bleibt. Angenommen ihr habt einen Teelöffel voll Eisenpulver und wollte exakt die Menge Schwefel dazugeben, die nötig ist, um alles vollständig in Pyrit umzuwandeln. Dann könnte man jetzt die Portion Eisen wiegen, mit Hilfe der Atommasse von Eisen ausrechnen, wie viele Atome das sind. Diese Anzahl verdoppeln und dann ausrechnen, welche Masse diese Anzahl an Schwefelatomen hat. Diese Menge könnte man dann abwiegen. Das folgende Bild veranschaulicht den Rechenweg:
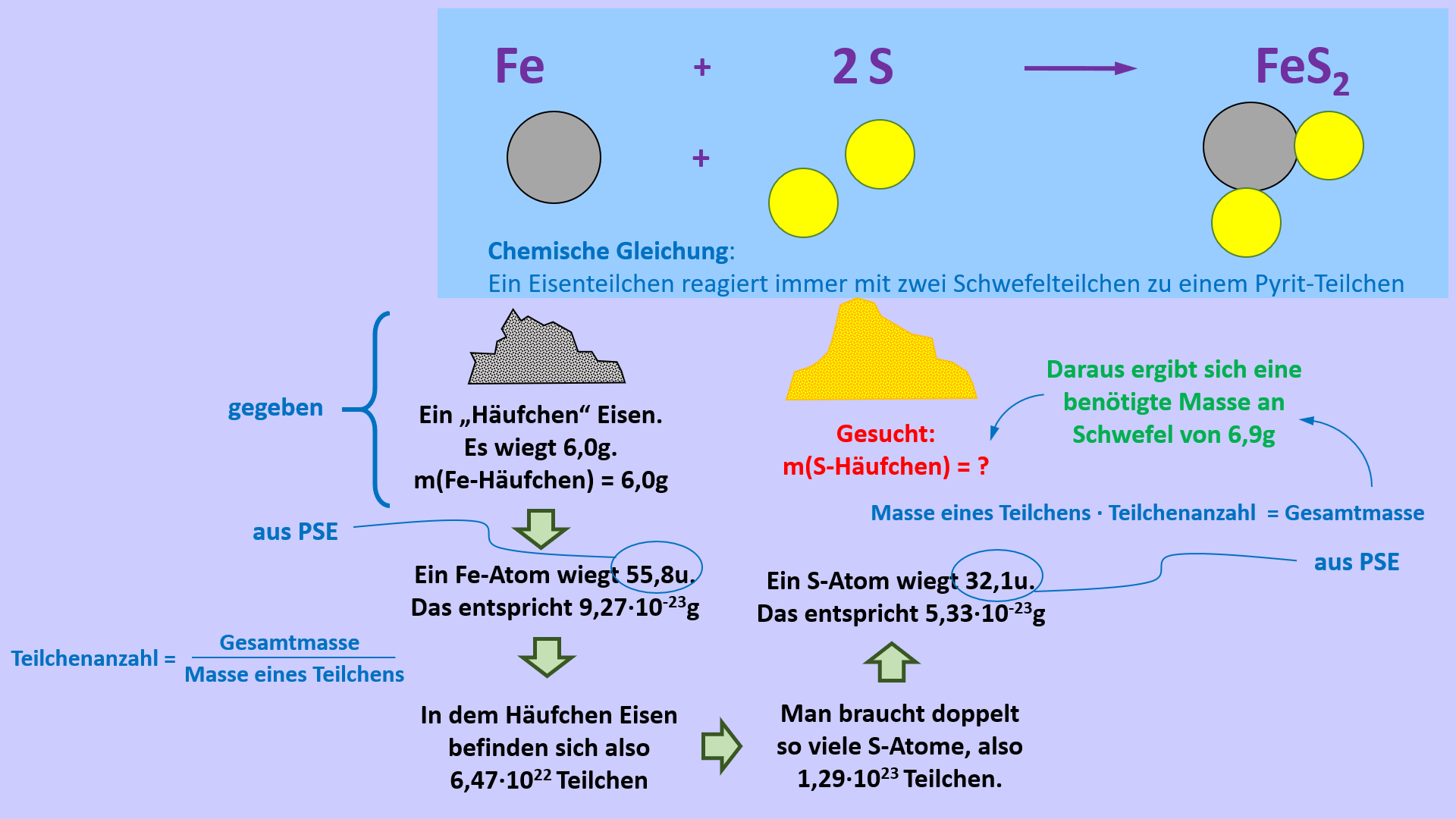
Das wirkt noch etwas umständlich...
Bei dieser Berechnung tauchen nämlich wieder sehr große, unhandliche Zahlen auf: Die Anzahl der Teilchen. Diese wird in der Chemie mit einem N(X) gekennzeichnet. Also z.B. kann man den Satz: "In meinem Zimmer liegen 3208 Legosteine auf dem Boden mathematisch so formulieren:
N(Legosteine) = 3208
Weil Atome so klein sind, befinden sich in den 6,0g Eisen einfach unglaublich viele Atome: Die Anzahl beträgt N(Fe) = 6,47 x 1022. Eine Zahl mit dreiundzwanzig Stellen (!), in Worten also ungefähr 600 Trilliarden Atome...
Daher hat man sich etwas einfacheres ausgedacht: Man betrachtet einfach eine sehr große Menge an Teilchen und gibt dieser Anzahl einen bestimmten Namen. Das ist nicht so ungewöhnlich, wie es vielleicht im ersten Moment klingt. Ihr kennt z.B. sicher den Ausdruck "ein Dutzend" für die Anzahl 12. (Wo jetzt genau der Sinn darin liegt zu sagen, "Ich hole beim Bauern ein Dutzend Eier" anstatt "Ich hole beim Bauern zwölf Eier", kann ich euch auch nicht genau sagen. Aber das Phänomen gibt es eben. Fragt mal eure Oma ob sie den Begriff "Schock" noch kennt, für eine Anzahl an z.B. Eiern).
In der Chemie hat man nun den Begriff "Mol" eingeführt. Das ist die Bezeichnung für eine bestimmte Anzahl an Teilchen, nämlich 6,022 x 1023. Man nennt diesen Wert auch Avogadro-Konstante NA = 6,022 x 1023 1/mol
Freiwilliger Test:
- Besorgt euch eine Stoppuhr oder ruft die Funktion auf eurem Handy auf!
- Stoppt die Zeit, die ihr benötigt, um zehn mal "Sechs Komma null zwei zwei mal zehn hoch dreiundzwanzig" zu sagen!
- Stoppt die Zeit, die ihr benötigt, um zehn mal "Ein Mol" zu sagen!
Ergebnis? - Seht ihr, die Einheit "Mol" ist eben praktisch.
Warum jetzt ausgerechnet 6,022 x 1023? - Das ist genialer Schachzug der Chemiker gewesen. Diese Zahl wurde deshalb gewählt, weil dann die im PSE angegebene atomare Masseneinheit genau übereinstimmt mit der Masse in g, die ein Mol dieser Teilchen wiegt.
Nochmal langsam, zum mitschreiben: Die Zahl, die oben links bei den Elementsymbolen im PSE steht, gibt also nicht nur die Masse eines Atoms dieses Elements in u an, sondern gleichzeitig entspricht dieser Wert der Masse in g von einem Mol dieser Atome. - Wahnsinn! Diese Chemiker..., das sind vielleicht Teufelskerle!
Und jetzt wieder ernst: Diese Größe, also die Masse, die ein Mol eines Stoffes in g wiegt, nennt man Molare Masse M(X). Ein Beispiel: "Die molare Masse von Wasser, also diejenige Masse in Gramm, die ein Mol Wassermoleküle wiegen, beträgt 18g/mol." oder in Form einer mathematischen Gleichung: M(H2O) = 18g/mol.
Die Variable, um eine Anzahl in Mol zu messen, nennt man "Stoffmenge", sie wird mit einem kleinen n(X) gekennzeichnet, die Einheit Mol wird abgekürzt mit mol. Wenn man also sagen möchte: "Ich habe heute 2 Mol Erdbeeren gepflückt, dann kann man das so formulieren:
n(Erdbeeren) = 2mol (Dieser Wert ist völlig unrealistisch. So viele Erdbeeren gibt es auf der ganzen Welt nicht)
Test:
Wie spricht man die folgende Gleichung aus: n(Sterne im Universum) = 0,1mol (Dieser Wert stimmt ungefähr)? Wie viele Sterne sind das?
- Die Anzahl der Sterne im Universum beträgt Null Komma Ein Mol.
- Das sind 6,022 x 1022 oder auch 0,602 x 1023
Schreibe als mathematische Gleichung: In der Sahara gibt es ungefähr Null Komma eins Mol Sandkörner.
Einfache Aufgaben
- Es liegen 14,007g Stickstoffatome vor. Wie viel Mol sind das?
- Wie viel Gramm wiegen 2 Mol Kohlenstoffatome?
- Im Jahr 2018 wurden grob geschätzt 4 x 1011 Äpfel auf der ganzen Welt geerntet. Wie viel Mol sind das?
- Der Wert der angegebenen Masse in g entspricht genau dem Wert, der im PSE links über dem Element steht, also ist das genau die Masse eines Mols Stickstoffatome
- Die Zahl links oberhalb des Kohlenstoffs im PSE lautet 12,000. Das ist die Masse in g, die ein Mol wiegen würde. Zwei Mol müssen dann das doppelte wiegen, also 24,0g.
- Als Hilfe: Das ist eine ähnliche Frage, wie man wissen will: "Wie viele Dutzend sind 7 Eier?". Man muss die tatsächliche Anzahl durch diejenige Anzahl teilen, die in einem Dutzende stecken, also 7 geteilt durch 12. Bei dem Beispiel mit den Äpfeln: 4 x 1011 geteilt durch 6,022 x 1023. Ergibt 6,67 x 10-13mol.
Die einfachen Berechnungen in den oberen Kästen waren mehr so... "freestyle". Viele von euch werden die Aufgaben relativ problemlos lösen können. Manche brauchen aber vielleicht etwas mehr Struktur. Diesen Personen empfehle ich das Buch (S. 35 - 38), die Hefteinträge (s. u.) und ganz knapp zusammengefasst die folgende Übersicht, die die bisher besprochenen Größen und ein paar Gleichungen zum Umrechnen enthält:
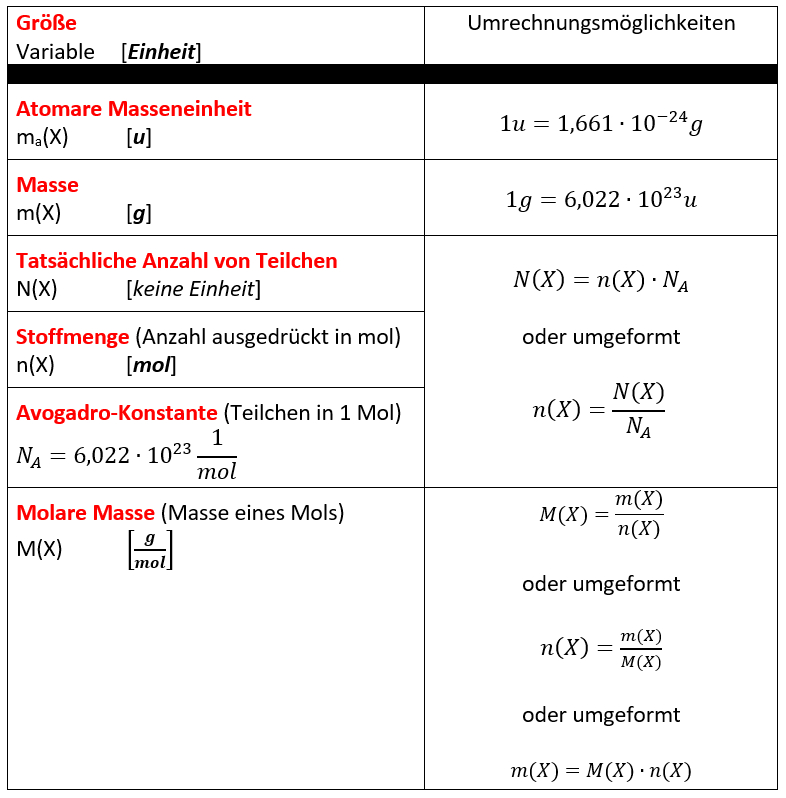
Hausaufgabe:
Auch wenn ihr zu der Gruppe gehört, die glaubt, bereits alles verstanden zu haben, lest ihr bitte als Hausaufgabe im Buch die folgenden Absätze und die Hefteinträge. Die Datei mit den Hefteinträgen haltet ihr bitte morgen Nachmittag bereit (z.B. geöffnet in einem Fenster auf dem PC, an dem ihr arbeitet). Wir machen eine Videokonferenz, besprechen noch einmal alles und lösen dann die in der pdf-Datei enthaltenen Aufgaben!
- Die Teilchenzahl (S. 36)
- Die Stoffmenge (S. 36-37)
- Teilchenzahl und Stoffmenge (S. 37)
- Teilchenzahl und Masse (S. 37)
- Molare Masse und molares Volumen (S. 38)
- Die molare Masse (S. 38)
- Hefteinträge zu dieser und letzter Stunde (Punkt 4 wurde noch nicht besprochen): pdf-Datei
Distanzunterricht Donnerstag, 14.01.
Videokonferenz mit Besprechung der Ergebnisse vom Versuch der letzten Einheit.
Distanzunterricht Dienstag, 12.01.
Bitte bearbeitet diese Einheit am besten von 14:00 Uhr bis 14:45 Uhr. Es handelt sich hier um einen kleinen "Versuch". Das Ergebnis eures Versuchs sollt ihr alle in ein einziges Dokument schreiben, damit man eure Ergebnisse vergleichen kann. Dies funktioniert am besten über ein Padlet: Das ist ein Online-Dokument, in das viele Nutzer auch gleichzeitig Sachen eintragen können. Ihr erhalten über den Schulmanager am Dienstag gegen 13:45 Uhr einen Arbeitsauftrag, in dem der Link zu diesem Padlet enthalten ist.
Sollte der Schulmanager heute nachmittag (Dienstag, 12.01.) immer noch nicht funktionieren, dann erhaltet ihr hier eine .pdf-Datei, in der ein Link zu einer Excel-Tabelle verfügbar ist, in die ihr eure Werte eintragen könnt. Direkt ins Netz möchte ich diesen Link nicht stellen, da hier die Gefahr der unerlaubten Verwendung zu groß ist.
Lasst euch das, was wir gestern (Montag) besprochen haben noch einmal kurz durch den Kopf gehen. Ihr könnt dazu auf dieser Seite etwas nach unten scrollen und die Fragen überfliegen, die im letzten Arbeitsauftrag behandelt wurden.
Wie würdet ihr in höchstens drei Sätzen zusammenfassen, was ihr aus dieser letzten Einheit mitgenommen habt?
Möglich wäre z.B.:
- Ein Schokokuchen ist schon was leckeres...
- Auf "Vogelhäuschen selber bauen" hätte ich ja gar keinen Bock. Da kauf ich lieber eins.
- Eine Tonne Äpfel auf einem Anhänger??? Auf den Anhänger von meinem Onkel passen 16 Tonnen!
O.k., das könnten zwar auch Dinge gewesen sein, die euch durch den Kopf gegangen sind, aber jetzt mal in Bezug auf Chemie!
Möglich wäre z.B.:
- In chemischen Gleichungen spielt die Anzahl von Teilchen (Atomen, Molekülen, Salzeinheiten) eine Rolle
- Leider kann man solche Teilchen aber nicht abzählen
- Man müsste die Masse von diesen Teilchen wissen, damit man etwas damit anfangen kann
Ihr sollt heute einen kleinen Versuch durchführen, mit dem man die Masse von kleinen Teilchen ziemlich genau bestimmen kann, auch wenn man sie nicht direkt wiegt. Mit einzelnen Atomen oder Molekülen könnt ihr natürlich nicht arbeiten, daher nehmen wir andere "kleine Teilchen". Ihr benötigt also:
- Entweder Reiskörner oder trockene Erbsen oder trockene Linsen oder sonst irgendetwas kleines (Reißnägel, Büroklammern etc.)
- Eine Küchenwaage
- Geduld
Die Objekte, die ihr euch aussucht, sollten so klein (und leicht) sein, dass eine Küchenwaage "nichts" anzeigt, wenn man eins dieser Objekte darauf legt. Zählt jetzt so viele Teilchen ab (z.B. 100, evtl. aber auch 1000), dass eure Küchenwaage einen "vernünftigen Wert" anzeigt, ich würde empfehlen so um die 10 Gramm.
Ihr könnt auch umgekehrt vorgehen: Wiegt exakt 10,0g ab und bestimmt dann die in dieser Menge enthaltene Anzahl an Objekten.
Berechnet aus diesen beiden Werten (Anzahl und Gewicht) das Gewicht eines Teilchens. Recherchiert dann im Internet ob ihr einen Wert findet, der euer Ergebnis bestätigt (oder auch widerlegt). Wenn ihr Pflanzenteile genommen habt, dann werdet ihr wahrscheinlich sehr schnell auf Wikipedia fündig. Als Suchtipp kann ich euch auch den Begriff "Tausendkornmasse" empfehlen.
Tragt euer Ergebnis in das Padlet ein. Den Link findet ihr im Arbeitsauftrag des Schulmanagers!
Arbeitsauftrag für Montag, 11.01.
Bitte bearbeitet von 09:45 Uhr bis 10:10 Uhr die folgenden Aufgaben. Ihr benötigt dazu euer Schulbuch! Um 10:15 Uhr starten wir eine Konferenz, um die gestellten Aufgaben zu verbessern! (Den Link für die Konferenz habt ihr per Schulmanager bekommen)
Nehmt an, ihr sei bei Freunden zum Geburtstag eingeladen und es gibt Kuchen (ich gebe zu, in Zeiten von "Corona" kein sehr praxisnahes Beispiel...). Der Kuchen schmeckt sehr lecker und ihr wollt ihn "nachmachen". Dann fragt ihr vermutlich nach dem Rezept (oder ihr recherchiert im Internet).
Anderes Beispiel: Nehmt an, ihr seht beim Spazierengehen in einem Garten ein sehr schönes Vogelhäuschen, in dem viele verschiedene Vogelarten gerade fressen. Ihr wollt dieses Vogelhäuschen nachbauen und recherchiert im Internet nach der Bauanleitung.
Worin unterscheiden sich die Bauanleitung für das Vogelhäuschen von dem Rezept für einen Kuchen?
- Beim Kuchenrezept sind die Angaben für die Zutaten in der Regel in Gramm (also einer Gewichtseinheit) angegeben.
- Bei der Bauanleitung werden eher Stückzahlen genannt.
Wie schaut das bei chemischen Reaktionen aus? Eine chemische Gleichung ist im Prinzip ja auch eine "Anleitung", an die man sich halten kann, wenn man einen bestimmten Stoff herstellen will. Nehmt an, ihr wollt FeS2 (Pyrit) herstellen. Ihr findet im Internet dazu die folgende chemische Gleichung:
Fe + 2 S --> FeS2
Was bedeutet das genau? Sprich diese chemische Gleichung in einem schönen, deutschen Satz aus! Beachte, dass auch der vorkommende Koeffizient (die Zahl 2 vor dem S) in Deinem Satz vorkommt!
Es gibt hier mehrere Möglichkeiten, z.B.: "Ein Eisenatom reagiert mit zwei Schwefelatomen zu einem Pyrit-Teilchen"
Bitte übt dieses "Übersetzen" noch ein paar Mal mit diesen Gleichungen:
- 2 H2 + O2 --> 2 H2O
- 4 Al + 3 O2 --> 2 Al2O3 (Aluminiumoxid)
- 2 H2O2 (Wasserstoffperoxid) --> 2 H2O + O2
- Zwei Wasserstoffmoleküle reagieren mit einem Sauerstoffmolekül zu zwei Wasser-Molekülen.
- Vier Aluminiumatome reagieren mit drei Sauerstoffmolekülen zu zwei Aluminiumoxid-Einheiten. (Aluminiumoxid ist ein Salz, d. h. ganz viele pos. geladene Kationen und ganz viele neg. geladene Anionen finden sich zu einem riesigen Gitter zusammen, ein "einzelnes Al2O3-Teilchen" gibt es nicht.
- Zwei Wasserstoffperoxid-Moleküle zerfallen zu zwei Wassermolekülen und einem Sauerstoffmolekül.
Man sieht, bei chemischen Gleichungen wird eher so vorgegangen, wie bei der Bauanleitung für Vogelhäuschen: Es geht hier um die Anzahl bestimmter Teilchen. Leider nützt einem das im Labor nichts! Nehmen wir wieder die erste Gleichung:
Fe + 2 S --> FeS2
Sie besagt also, dass man pro Eisenatom zwei Schwefelatome verwenden muss, um eine vollständige Reaktion zu Pyrit zu erhalten. Wenn man "mehr" Pyrit haben will, kann man auch 1000 Eisenatome verwenden, dann braucht man eben 2000 Schwefelatome. Reicht das immer noch nicht, kann man auch 80 Quadrillionen Eisenatome nehmen, dann muss man die eben mit 160 Quadrillionen Schwefelatomen reagieren lassen. So weit so gut, aber warum nützen einem diese Überlegungen nichts?
Weil man keine Möglichkeit hat, im Labor Atome (oder Moleküle oder andere Teilchen) abzuzählen!
Nehmt an, ihr habt ein "Häufchen Eisenpulver", welches ihr mit Schwefel komplett zu Pyrit umwandeln wollt. Die Anzahl der Eisenatom in dem Häufchen könnt ihr also nicht abzählen, aber welche Größe lässt sich im Labor oder auch zu Hause sehr leicht bestimmen?
Das Gewicht oder besser: Die Masse!
O.k., man kann das Häufchen Eisenpulver also auf die Waage legen und z.B. feststellen, es wiegt 3,0g. Das ist zwar einfach, nützt einem aber wieder nicht viel! Damit ich mit Hilfe der chemischen Gleichung abschätzen kann, wie viel Schwefel ich für die Reaktion brauche, muss ich wissen, wie viele Eisenatome in diesen 3,0g drin sind! Welche Größe würde dieses Problem lösen?
Habt ihr wirklich schon eine Lösung gefunden? Vielleicht noch ein einfacheres Beispiel: Ein Landwirt lädt im Herbst alle Äpfel seiner Streuobstwiese auf den Anhänger seines Traktors. Alle Äpfel zusammen wiegen genau eine Tonne (1000kg). Er möchte wissen, wie viele Äpfel das ungefähr sind. Welche Größe braucht er für diese Berechnung?
Die Masse eines Apfels! - Oder im ersten Beispiel: Die Masse eines Eisenatoms.
Früher gab es keine Möglichkeit die Masse eines einzelnen Eisenatoms zu bestimmen. Heute geht das. Man verwendet dazu Massenspektrographen. In eurem Buch ist ein solches Gerät schematisch abgebildet. Nehmt euer Buch zur Hand auf S. 34. Betrachtet zunächst die Abbildungen 1 und 2, lest dann den Abschnitt "Wie vergleicht und ermittelt man Atommassen?" ganz unten auf der Seite 34. Lest wirklich nur diesen Absatz, nicht das was vorher steht und auch nicht, was danach kommt!
Beschreibt nun laut mit Worten die Abbildungen!
Wenn ihr das getan habt, solltet ihr euch für die Videokonferenz vorbereiten! Ruft über den Link im Schulmanager den BBB-Raum auf und loggt euch ein. Sollte es noch deutlich vor 10:10 Uhr, dürft ihr euch gerne erst einen Kaffee holen (oder was man als Neuntklässer eben so trinkt zum Frühstück...). Bis gleich!
Distanzlernen vor Weihnachten
Arbeitsauftrag für Donnerstag, 17.12.
Mit der einen Gruppe von euch habe ich bereits nach der Schulaufgabe einen kurzen Versuch durchgeführt, der zeigen konnte, dass es Farbstoffe gibt, die ihre Farbe ändern, wenn sie mit Säuren in Berührung kommen. Unser nächstes Thema im Unterricht wird sich genau um diese Säuren und ihre "Gegenspieler" die Basen drehen. Farbstoffe, die auf Säuren oder Basen reagieren, nennt man Säure-Base-Indikatoren. Davon findet man auch viele in der Natur und dazu ein kleiner Versuch.
Ihr benötigt:
- Blaukraut/Rotkohl (frisch oder aus der Konserve)
- Zitronensaft
- Natron oder Kernseife
Zupft ein paar Blätter vom Rotkohl ab, schneidet sie sehr klein und gebt die Schnipsel in ein Glas mit Wasser. Wartet 5 min.
Solltet ihr keinen frischen Rotkohl zu Hause haben, dann könnt ihr auch den Saft aus einem Glas eingemachten Rotkohl nehmen. Bitte sprecht aber mit euren Eltern ab, dass das geöffnete Glas dann auch gegessen wird. Falls ihr weder frischen Rotkohl noch welchen im Glas zu Hause habt, dann verschiebt den Versuch bitte!

Verteilt den so erzeugten violetten "Blaukraut-Saft" auf drei Gläser und verdünnt ihn mit Wasser. Gebt zum einen Glas Zitronensaft, zum anderen Natron oder Kernseife. Vergleicht die drei Gläser! Ihr könnt gerne auch andere Stoffe aus dem Haushalt ausprobieren und checken, welche Farbe der Blaukrautsaft annimmt.
Termine
Schulaufgabe am 07.12.2020 (für Gruppe B)
Schulaufgabe am 08.12.2020 (für Gruppe A)
Prüfungsstoff: Neben Grundwissen, den Hefteinträgen und den Versuchsprotokollen eignen sich folgende Seite im Buch (Galvani Chemie 2) als Vorbereitung für die Schulaufgabe (chronologisch sortiert):
- S. 20 - 21 Unterschied zwischen qualitativen und quantitativen Nachweisen
- S. 22 - 24 Nachweismethoden
- S. 25 - 26 Die Spektralanalyse
- S. 92 - 93 Fällungsreaktionen
- S. 54 - 55 Das Orbitalmodell (Die Inhalte dieser Seite werden nicht direkt in der Schulaufgabe abgefragt, aber zum Verständnis der nächsten Seiten sind sie meiner Meinung schon relevant.
- S. 56 - 57 Der räumliche Bau von Molekülen
- S. 63 - 64 Die polare Atombindung (ohne den letzten Absatz "Polarität und Dissoziationsenergie")
- S. 65 Dipole
- (S. 72 - 73 Zwischenmolekulare Kräfte - Wiederholung)
- S. 76 - 77 Van-der-Waals-Kräfte
- S. 74 - 75 Wasserstoffbrückenbindungen
- S. 78 Einfluss zwischenmolekularer Kräfte auf Stoffeigenschaften
Versuchsprotokolle
Eine Musterlösung für das Versuchsprotokoll zur Übung vom 08.10. "Flammenfärbung von Na- und K-Salzen":
- Zum Herunterladen: Hier klicken
Eine Musterlösung für das Versuchsprotokoll zur Übung vom 22.10. "Nachweis von ausgewählten Halogenid-Ionen":
- Zum Herunterladen: Hier klicken
Grundwissen
Text
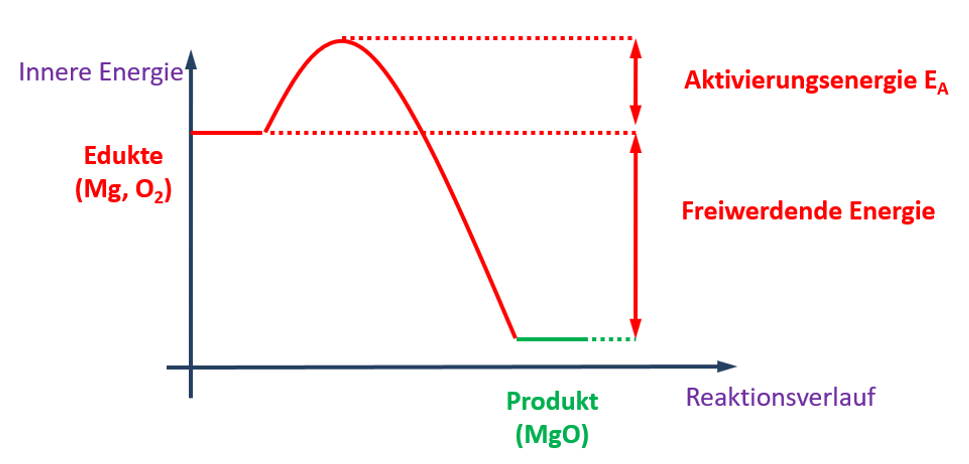
Magnesium ist ein sehr reaktives Metall und wird an Schulen häufig in Form von langen Bändern verwendet. Sobald man ein Ende eines solchen Magnesium-Bandes kurz erhitzt, beginnt es mit dem Sauerstoff aus der Luft zu reagieren. Dabei entsteht sehr viel Hitze und Licht. Früher hat man daher Magnesium als „Blitzlicht-Pulver“ eingesetzt. Einmal gestartet, endet die Reaktion erst, wenn das gesamte Magnesium-Band „verbrannt“ ist. Übrig bleibt ein weißer Feststoff: Magnesiumoxid (MgO).
Aufgaben
- Stelle die chemische Reaktionsgleichung für den beschriebenen Prozess auf!
- Ordne diese chemische Reaktion verschiedenen Gruppen zu: Beachte bei der einen Zuordnung den Energieumsatz und bei der anderen Zuordnung die Anzahl der Pro- und Edukte!
- Zeichne das vollständig beschriftete Energie-Zeit-Diagramm dieser Reaktion!
Text + Grafik
Die folgende Grafik enthält viele Informationen. Leite aus dieser Grafik die folgenden Punkte ab:
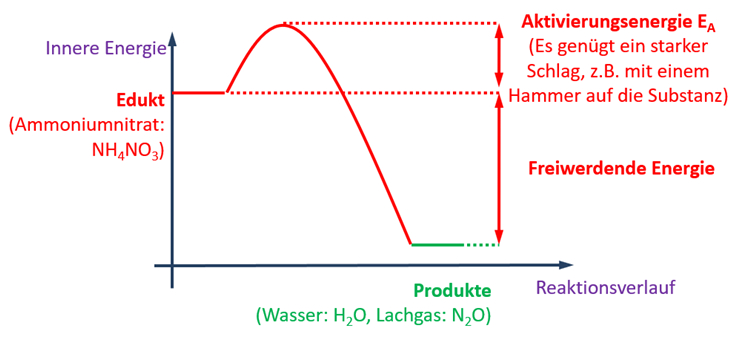
Aufgaben
- Beschreibe mit einem schönen, deutschen Satz die ablaufende Reaktion!
- Stelle die vollständig ausgeglichene Reaktionsgleichung auf!
- Ordne die dargestellte Reaktion zwei Gruppen zu. Betrachte bei der ersten Zuordnung die an der Reaktion beteiligte Energie, bei der der zweiten Zuordnung die Anzahl der vorhandenen Pro- und Edukte!
Atombau
- Bestimme mit Hilfe des PSE die Anzahl an Protonen, Neutronen, Elektronen und Valenzelektronen in einem Atom von Aluminium, Arsen und Antimon!
- Finde in den Hauptgruppen des PSE das Element, bei dem ein Atome zwei Valenzelektronen und 50 Neutronen besitzt!
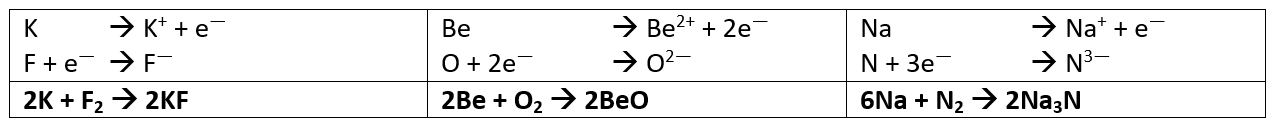
Salzgleichungen
- Stelle die chemischen Gleichungen zur Bildung der folgenden Salze aus den Elementen auf: Kaliumfluorid (aus Kalium und Fluor), Berylliumoxid (aus Beryllium und Sauerstoff) und Natriumnitrid (aus Natrium und Stickstoff)
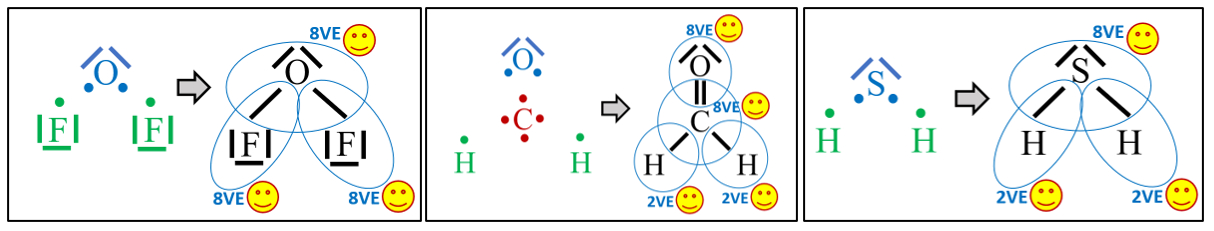
Moleküle
- Zeichne die Valenzstrichformel der folgenden Moleküle: Sauerstoffdifluorid (OF2), Formaldehyd (CH2O) und Schwefelwasserstoff (H2S)
Atombau
- Bestimme mit Hilfe des PSE die Anzahl an Protonen, Neutronen, Elektronen und Valenzelektronen in einem Atom von Bor, Brom und Barium!
- Finde in den Hauptgruppen des PSE das Element, bei dem ein Atome drei Valenzelektronen und 14 Neutronen besitzt!
Salzgleichungen
- Stelle die chemischen Gleichungen zur Bildung der folgenden Salze aus den Elementen auf: Lithiumfluorid (aus Lithium und Fluor), Magnesiumsulfid (aus Magnesium und Schwefel) und Magnesiumnitrid (aus Magnesium und Stickstoff)
Moleküle
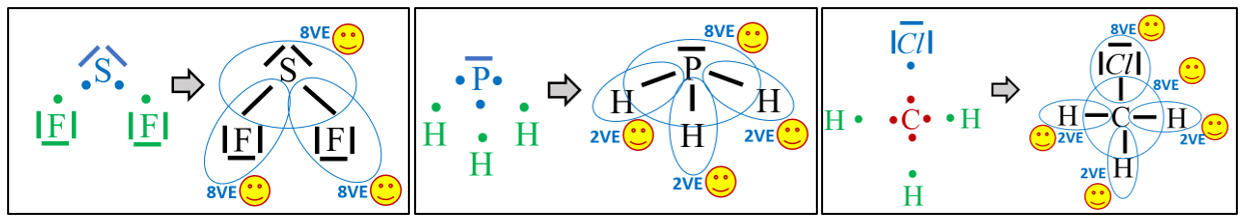
- Zeichne die Valenzstrichformel der folgenden Moleküle: Schwefeldifluorid (SF2), Phosphan (PH3) und Chlormethan (CH3Cl)