Arbeitsauftrag 8
Ergebnisse der Hausaufgabe
 Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner.
Vielen Dank an diejenigen, die mitgemacht haben! Ich hoffe, ich habe kein Bild übersehen. Momentan bekomme ich sehr viele E-Mails, etliche (auch wichtige) landen aber im Spam-Ordner.
Ihr solltet euch zusätzlich zu den Bildern auch Gedanken dazu machen, warum manche Gegenstände aus Metall sind und kein anderes Material zur Herstellung verwendet wurde. Eine Eigenschaft wurde sehr häufig hervorgehoben, auch wenn ihr es teilweise unterschiedlich ausgedrückt habt: Die "Stabilität" von Metallen. In dieser und der nächsten Einheit, möchte ich mit euch versuchen zu klären, woher diese "Stabilität" kommt.
Achtung: "Stabilität" steht im Moment noch in Anführungszeichen, weil dieser Begriff eigentlich ziemlich ungenau ist: Wenn ihr einen Eisennagel und ein Stück Plastik im Garten vergrabt, werdet ihr nach einem Jahr den Nagel ziemlich verrostet wiederfinden, während das Stück Plastik sich kaum verändert hat. Chemisch betrachtet sind viele Metalle nämlich überhaupt nicht "stabil".
Wiederholung
Das, was wir gerade besprechen, ist übrigens ein Haupt-Anliegen der Wissenschaft "Chemie": Sie versucht Zusammenhänge herzustellen zwischen dem Aufbau von Stoffen und den Eigenschaften, die diese Stoffe haben.
Einen solchen wichtigen Zusammenhang habt ihr nun schon oft gehört und in der letzten Einheit vor den Osterferien noch einmal intensiv besprochen: Es gibt einen Zusammenhang zwischen dem Aggregatszustand eines Stoffes (bei Raumtemperatur) und den Anziehungskräften der im Stoff enthaltenen Teilchen. Die Anziehungskräfte wiederum hängen eng mit dem Aufbau der Teilchen zusammen.
Ihr könnt inzwischen erklären, warum Salze bei Raumtemperatur in der Regel fest sind, Moleküle dagegen (zumindest die kleinen, wie z.B. O2, gasförmig)
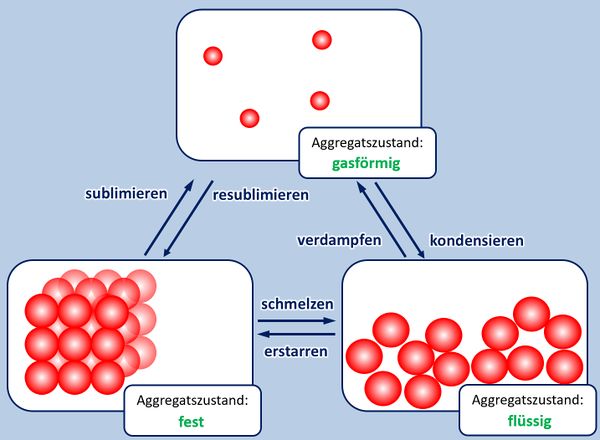
- Zur Wiederholung: Nenne zunächst die Aggregatszustände und die Möglichkeiten sie ineinander umzuwandeln!
- Erkläre, warum Salze so hohe Schmelz- und Siedetemperaturen besitzen! Gehe bei Deiner Erklärung auch darauf ein, wie sich Salze aus den Elementen bilden.
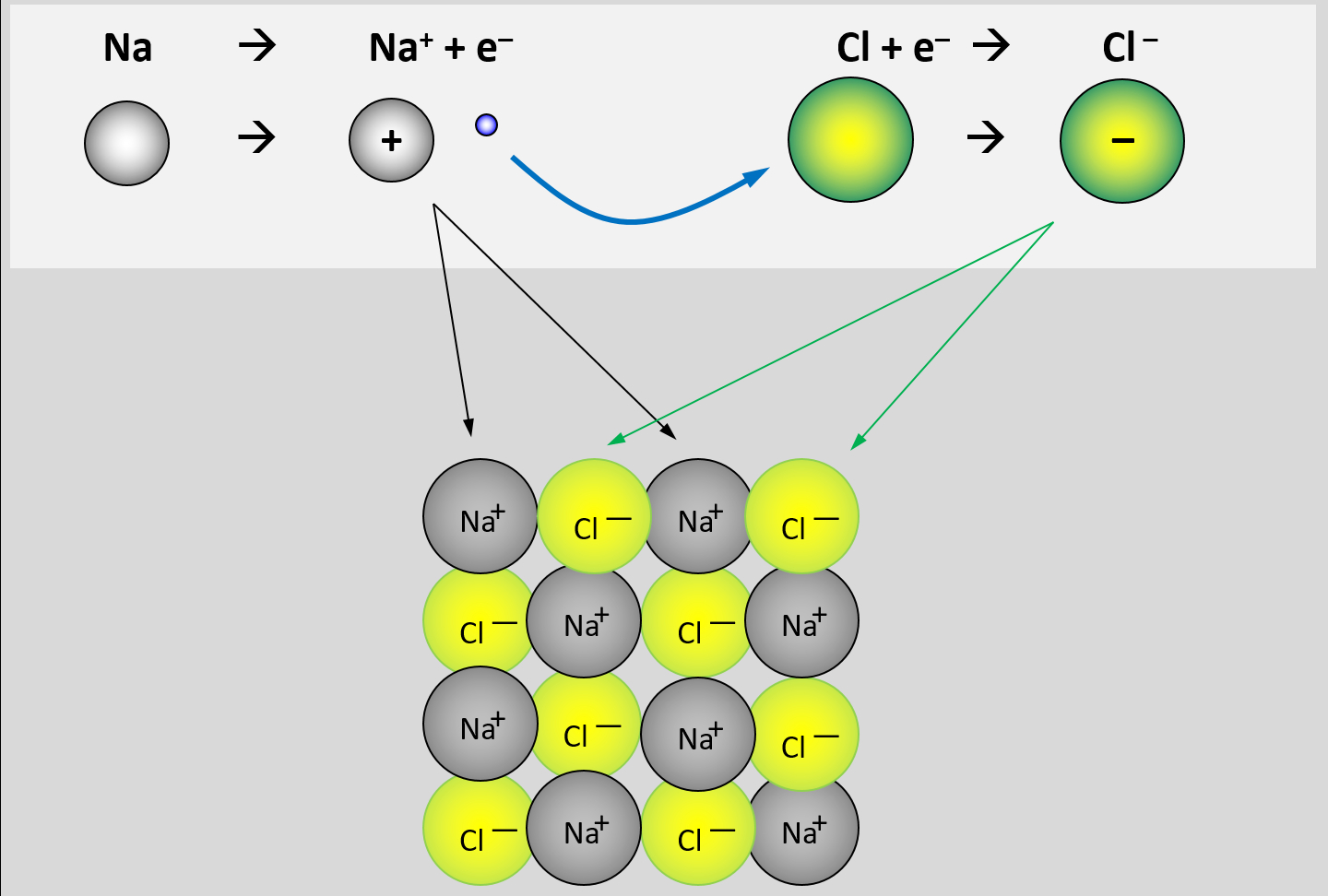 Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Nachdem die meisten Metalle bei Raumtemperatur ebenfalls fest sind, könnte man zunächst ja vermuten, dass ein ähnlicher Grund wie bei den Salzen zur starken Anziehung der Metallteilchen untereinander führt.
Man stößt allerdings sehr schnell auf Probleme, wenn man versucht das Bindungs-Prinzip von Salzen auf ein Stück Metall zu übertragen. Versucht zu begründen, warum in einem Stück Magnesium-Metall die Bindung der Mg-Atome aneinander keinesfalls auf den gleichen Gründen beruhen kann, wie bei einem Salzkristall.
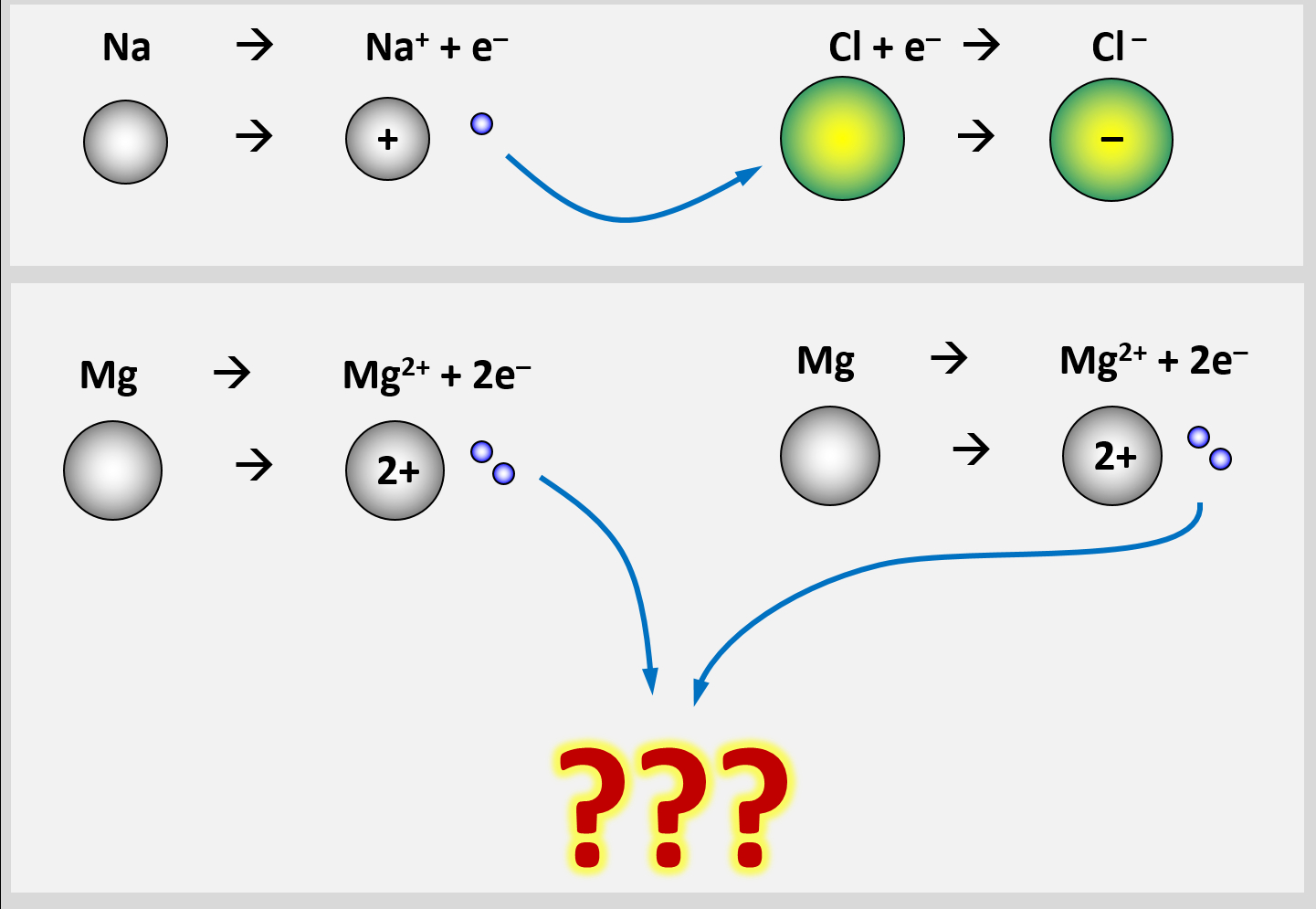 In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
Im Magnesium-Stück gibt es aber keine aufnehmenden Partner. Es sind nur Mg-Atome vorhanden, die alle ihre Valenzelektronen abgeben wollen. Eine Bindung kann in Metall-Stücken also nicht dadurch zustande kommen, dass sich unterschiedlich geladene Ionen bilden
Gut. Beziehungsweise: schlecht. Schauen wir noch einmal kurz auf die andere Art der Bindung, die wir bereits kennengelernt haben: Die Atombindung. Auch die funktioniert hier nicht.
- Versuche aus zwei Mg-Atomen ein Molekül zu bilden und beschreibe genau, die Probleme, die dabei auftauchen!
- Vergleicht die Situation mit einem Sauerstoff-Molekül
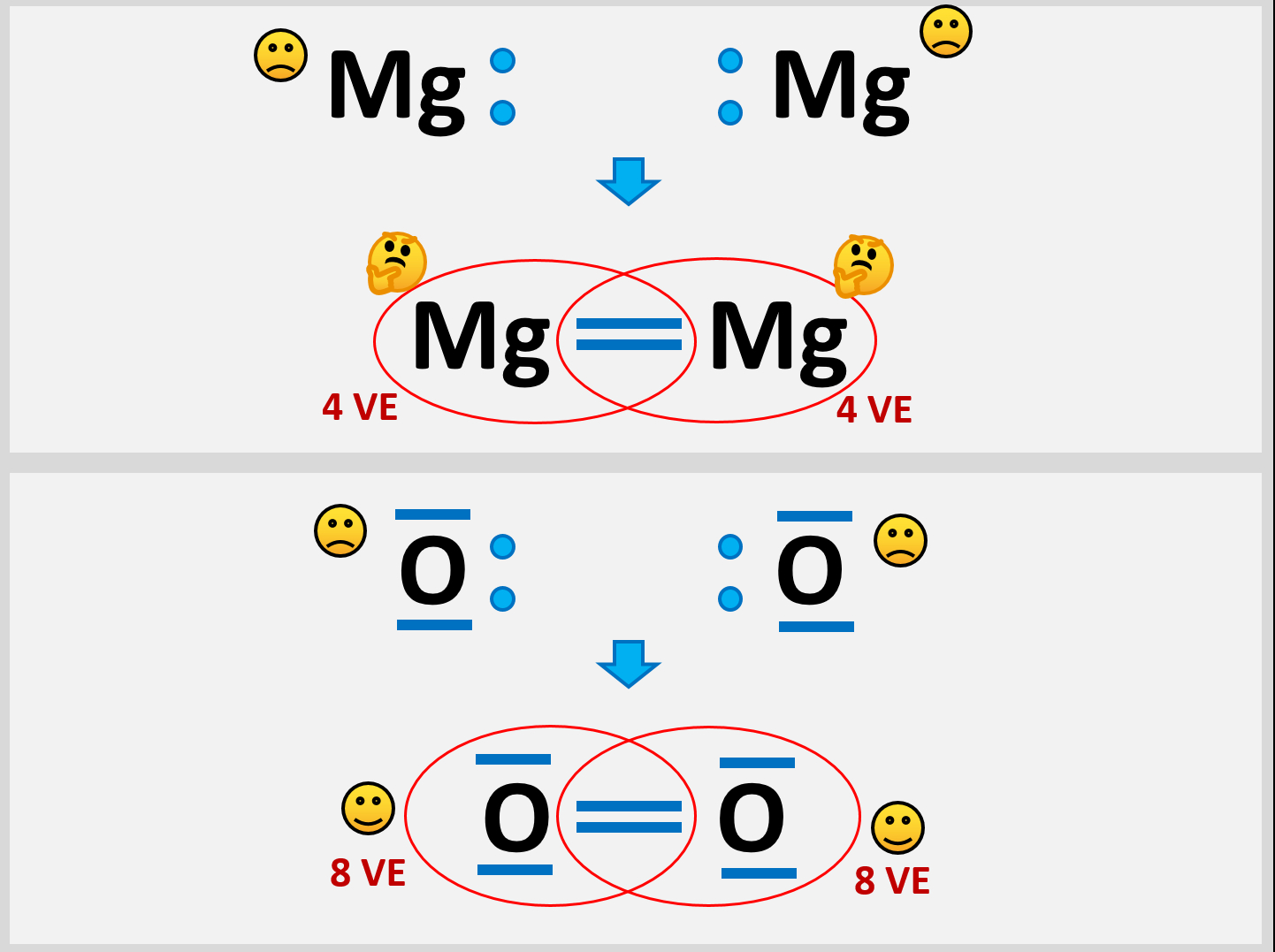 Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.
Außerdem wären damit erst zwei Mg-Atome aneinander gebunden. Damit könnte man immer noch nicht erklären, warum es große Magnesium-Klumpen gibt, in denen nahezu unzählig viele Mg-Atome aneinander hängen.
Die Lösung ist eigentlich simpel. Wenn man sie kennt. Von alleine darauf zu kommen ist schwierig (glaube ich). Trotzdem zeige ich euch mal ein Szenario aus der "Lebenswelt" auf und ihr versucht das auf Metall-Atome zu übertragen: Stellt euch vor, ihr wollt alle mit einem Ball spielen. Aber nicht jeder von euch hat einen. Sagen wir mal, nur jeder zweite. Was kann man tun, damit alle "zufrieden" sind?
Jeder sucht sich einen Partner, es bilden sich also Pärchen. Alle können so mit den zur Verfügung stehenden Bällen spielen.
Die oben genannte Situation könnte man mit der Situation bei Molekülen vergleichen, die ja aus Nichtmetallen aufgebaut sind: Bei Nichtmetall-Atomen sind viele Elektronen verfügbar (jedes Atom hat 6 VE). Die Elektronen entsprechen den Bällen. Wenn sich jedes Atom ein Elektron (auch zwei oder drei) Elektronen mit einem anderen Partner teilt, sind alle "zufrieden" (fachwissenschaftlich: Es entsteht ein energetisch günstiger Zustand).
Bei Metallen funktioniert das nicht. Es sind einfach zu wenig Elektronen verfügbar. Wieder zurück zum Beispiel mit den Bällen: Alle (sagen wir z.B. mal 22 Schülerinnen und Schüler) wollen Ball spielen, aber es ist nur ein Ball da. Was kann man tun?
Man spielt Fußball! - Was hat das jetzt mit der Metall-Bindung zu tun? Ich gebe zu, das Beispiel ist jetzt nicht der Wahnsinn, aber soooo schlecht ist es auch nicht: Beim Fußball-Spielen teilen sich viele Menschen einen Ball. Weil alle spielen wollen, sorgt der Ball dafür, dass alle auf dem Spielfeld bleiben.
So ähnlich ist es auch bei Metallen: Alle Metall-Atome stellen ihre wenigen Valenzelektronen allen zur Verfügung. Es ist aber kein Partner da, der sie tatsächlich aufnimmt. Die Elektronen schwirren daher einfach zwischen den nun positiv geladenen Atomrümpfen herum und gehören irgendwie allen. Bildlich kann man sich das ungefähr so vorstellen:
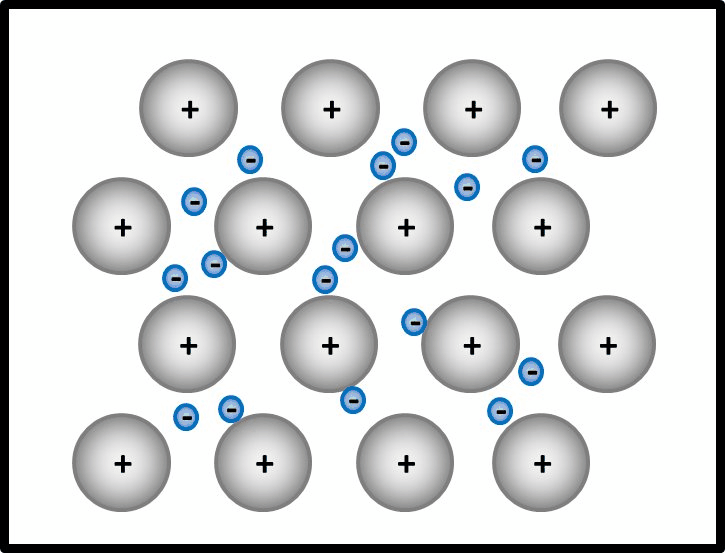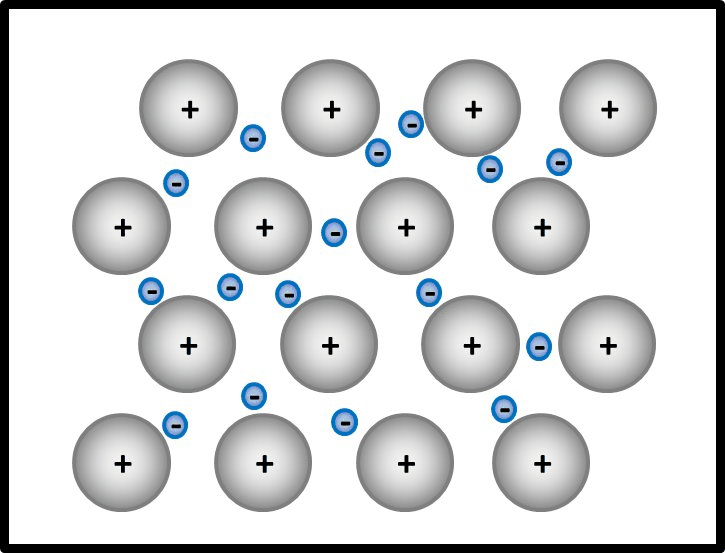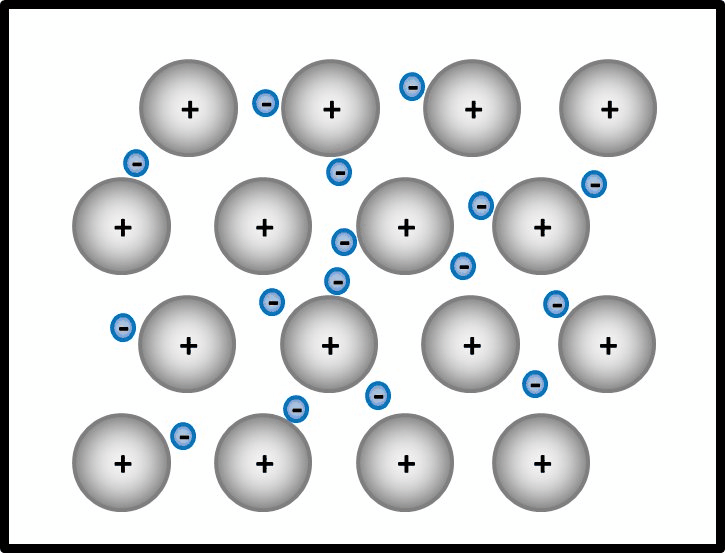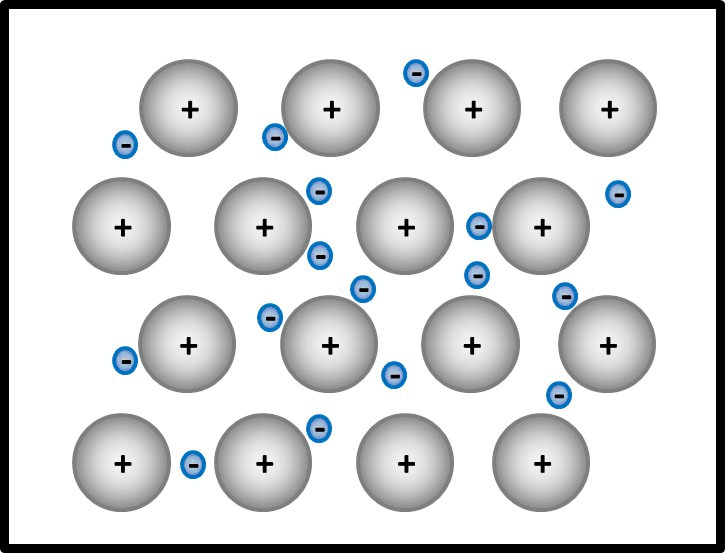
Erklärt diese Vorstellung jetzt das Phänomen, warum Metalle in der Regel Feststoffe sind?
Ja! Metalle bestehen nach dieser Vorstellung aus positiv geladenen Teilchen: Den Atomrümpfen, die durch die Abgabe von Valenzelektronen entstanden sind. Und aus negativ geladenen Teilchen: Den frei beweglichen Elektronen, auch Elektronengas genannt. Es sind hier also viele Ladungen im Spiel, die zu sehr hohen Anziehungskräften führen, ganz ähnlich wie bei den Salzen
Noch ein Wort zu den positiv geladenen Atomrümpfen. In der animierten Abbildung seht, ihr dass eine Reihe von Atomrümpfen immer versetzt zur vorangegangen ist und das schön regelmäßig. In Wirklichkeit ist das ganze natürlich dreidimensional. Wenn man nur die Atomrümpfe betrachtet ohne das Elektronengas, sähe das dann so aus aus (man spricht von einer dichtesten Kugelpackung):

Ähnlich wie bei Salzen, die ja auch einen regelmäßigen Aufbau besitzen, sollten also Metalle ebenfalls Kristalle bilden können. Tatsächlich tun sie das auch, aber oft nur unter bestimmten Umständen. Das folgende Bild zeigt eine Metallplatte, die in flüssiges Zink getaucht wurde. Die unterschiedlich grauen Flächen, die scharf voneinander abgegrenzt sind, stellen solche Metall-Kristalle dar:

Hausaufgabe
Lest im Buch die S. 126 und von der S. 127 den 2. Absatz
- Recherchiert (das geht auch ohne PC) das einzige Metall, das bei Raumtemperatur flüssig ist!
- Recherchiert (auch das geht ohne PC) ein Metall, das in der Hand schmilzt!
- Formuliert in einem Satz eine Antwort auf die Frage: Was ist eine Legierung?
Lernen zuhause
Hier im Schulwiki findet jede Klasse auf der jeweiligen Klassenseite alle Arbeitsaufträge, die erledigt werden sollten. Die Stunden orientieren sich am Stundenplan der Klasse.
Stöbern in anderen Klassen ist erlaubt!
Um in den Ferien keine Langeweile aufkommen zu lassen gibt es für alle Klassen eine
Ferienbox
Weitere Seiten für Lehrer
- Ideenbörse für Kollegen
- Tipps und Tricks zum Arbeiten im Wiki
- Basismodule]
- Digitale Didaktik
Themen
- Fortbildungskonzept
- Mitdenken! Mitreden! Mitgestalten!
- Pädagogischer Tag Kollaboration
- Bildung für nachhaltige Entwicklung
Klassen
Unterstufe
- 5a - 5b - 5c - 5d - 5e - 5f - M5 - E5 - Eth5
- 6a - 6b - 6c - 6d - 6e - E6
- 7a - 7b - 7c - 7d
Mittelstufe
- 8a - 8b - 8c - 8d - 8e - E8
- 9a - 9b - 9c - 9d - WR9
- 10a - 10b - 10c - 10d - 10e - M10 - WR10
Oberstufen-Kurse und -Seminare
Q11-Kurse
- Astronomie (Link Ast): AST1
- Bio: 1b1 - 1b2 - 1b3 - 1b4 - 1b5
- Chemie: 1c1 - 1c2
- Deutsch: 1d1 - 1d2 - 1d3 - 1d4 - 1d5 - 1d6 - 1d7
- Englisch:
- Englisch Konversation:
- Ethik:
- Evangelische Religionslehre:
- Französisch:
- Geschichte:
- Geographie:
- Informatik:
- Katholische Religionslehre:
- Kunst:
- Latein:
- Mathematik:
- Musik:
- Physik:
- Rhetorik:
- Sozialkunde:
- Sport:
- Spanisch (spätbeginnend):
- Sport-Theorie:
- Wirtschaft:
Q12-Kurse
- Bio: 1b1 - 1b2 - 1b3 - 1b4 - 1b5
- Chemie: 1c1 - 1c2
- Deutsch: 1d1 - 1d2 - 1d3 - 1d4 - 1d5 - 1d6 - 1d7
- Englisch:
- Ethik:
- Evangelische Religionslehre:
- Französisch:
- Geschichte:
- Geographie:
- Informatik:
- Katholische Religionslehre:
- Kunst:
- Latein:
- Mathematik:
- Musik:
- Physik:
- Astrophysik:
- Sozialkunde:
- Sport:
- Spanisch (spätbeginnend):
- Sport-Theorie:
- Wirtschaft:
W-Seminare Q11 + Q12
Q11
- 1W01: Klassiker der dt. Literatur (D)
- 1W02: Klassiker der engl. Literatur (E)
- 1W03: Klassiker der franz. Literatur (F)
- 1W04: Klassiker der biologischen Literatur (B)
- 1W05: Klassiker der chemischen Literatur (C)
- 1W06: Klassiker der mathematischen Literatur (M)
- 1W07: Klassiker der geschichtlichen Literatur (G)
- 1W08: Klassiker der sportlichen Literatur (Spo)
- 1W09: Klassiker der musikalischen Literatur (Mu)
- 1W10: Klassiker der künstlerischen Literatur (Ku)
- 1W11: Klassiker aller Klassiker (K)
Q12
- 2W01: Klassiker der dt. Literatur (D)
- 2W02: Klassiker der engl. Literatur (E)
- 2W03: Klassiker der franz. Literatur (F)
- 2W04: Klassiker der biologischen Literatur (B)
- 2W05: Klassiker der chemischen Literatur (C)
- 2W06: Klassiker der mathematischen Literatur (M)
- 2W07: Klassiker der geschichtlichen Literatur (G)
- 2W08: Klassiker der sportlichen Literatur (Spo)
- 2W09: Klassiker der musikalischen Literatur (Mu)
- 2W10: Klassiker der künstlerischen Literatur (Ku)
- 2W11: Klassiker aller Klassiker (K)
P-Seminare Q11 + Q12
Q11
- 1P01: Klassiker der dt. Literatur (D)
- 1P02: Klassiker der engl. Literatur (E)
- 1P03: Klassiker der franz. Literatur (F)
- 1P04: Klassiker der biologischen Literatur (B)
- 1P05: Klassiker der chemischen Literatur (C)
- 1P06: Klassiker der mathematischen Literatur (M)
- 1P07: Klassiker der geschichtlichen Literatur (G)
- 1P08: Klassiker der sportlichen Literatur (Spo)
- 1P09: Klassiker der musikalischen Literatur (Mu)
- 1P10: Klassiker der künstlerischen Literatur (Ku)
- 1P11: Klassiker aller Klassiker (K)
Q12
- 2P01: Klassiker der dt. Literatur (D)
- 2P02: Klassiker der engl. Literatur (E)
- 2P03: Klassiker der franz. Literatur (F)
- 2P04: Klassiker der biologischen Literatur (B)
- 2P05: Klassiker der chemischen Literatur (C)
- 2P06: Klassiker der mathematischen Literatur (M)
- 2P07: Klassiker der geschichtlichen Literatur (G)
- 2P08: Klassiker der sportlichen Literatur (Spo)
- 2P09: Klassiker der musikalischen Literatur (Mu)
- 2P10: Klassiker der künstlerischen Literatur (Ku)
- 2P11: Klassiker aller Klassiker (K)
 Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
Bei der Bildung von Salzen reagiert ein Metall mit einem Nichtmetall. Das Metall gibt Elektronen ab und es entstehen positiv geladene Metall-Kationen. Das Nichtmetall nimmt Elektronen auf und es entstehen negativ geladene Anionen. Aufgrund der unterschiedlichen Ladungen ziehen sich diese Ionen stark an und bilden ein festes, regelmäßiges Gitter. Nur durch starke Energiezufuhr (z.B. hohe Temperaturen) lassen sich diese Anziehungskräfte überwinden und Salze verflüssigen oder verdampfen.
 In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome.
In einem Stück Metall gibt es nur Metall-Atome. Diese zeigen das Bestreben, Elektronen abzugeben, um Edelgaskonfiguration zu erreichen. Bei der Bildung eines Salzes sind Reaktionspartner vorhanden, die diese Elektronen aufnehmen können und damit ebenfalls Edelgaskonfiguration erreichen: Die Nichtmetall-Atome. Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.
Selbst wenn ein Mg-Atom mit all seinen VE (sind ja nur zwei) Bindungen zu einem weitern Mg-Atom eingehen würde, entstünde ein Gebilde, bei dem jedem Mg-Atom nur 4 VE zugerechnet werden. Das ist weit entfernt von einer Edelgaskonfiguration.







