Corona-Arbeitsaufträge (Chemie) LUX
Arbeitsaufträge für die Woche vom 23.03. - 27.03.
Sofern ihr Arbeitsauftrag Chemie1 durchgeführt habt, könnt ihr nun folgende Überlegungen anstellen:
- Gibt es in eurem Haushalt noch andere "reine Salze" mit denen ihr diesen Versuch durchführen könnte. Wenn ja: Probiert es aus!
- Wenn man das Wasser vollständig verdunsten lässt, entstehen ganz zum Schluss viele kleine Kristalle, die wie ein Schleier alles überziehen.
- Wenn man das nicht möchte, kann man vorher (z.B. nach 12 Stunden) einen kleinen, sauberen Kristall aus der Lösung holen und in ein neues Gefäß mit gesättigter Salzlösung überführen. Man kann ihn auch an einem Faden in ein Glas mit der Salzlösung hängen. Im Internet gibt es dazu reichlich Anleitungen. Wenn man Glück hat, wächst nur der kleine Kristall zu einem großen heran. Versucht das!
- Man kann aus Draht z.B. einen Stern formen und diesen in ein Glas mit der Salzlösung hängen. Oder auch wieder in eine Untertasse mit der Salzlösung legen. Lässt man das Wasser komplett verdunsten, ist der Draht dann überall mit kleinen Kristallen überzogen. Manche finden das schön.
- Führt den Versuch erneut durch. Stellt das Gefäß, in dem die Kristalle wachsen sollen, an einen ungestörten Ort. Baut eine Halterung, in der ihr euer Handy / euren Fotoapparat zum Anfertigen des Fotos kurz einspannen könnt, so dass jedes Foto vom Versuch aus exakt der selben Perspektive gemacht wird. Macht alle 8 Stunden (besser alle 4 oder 2 - was nachts aber schwierig ist...) ein Foto. Aus diesen Fotos kann man später eine Zeitrafferaufnahme machen.
Die folgende verpflichtende Unterrichtseinheit hat eine Bearbeitungszeit von ca. 45 Minuten. Ihr benötigt für die Bearbeitung: Das Schulbuch, das PSE, einen Zettel, Stift, Internetzugriff um ein yt-Video zu schauen. Und Ruhe. Bitte bearbeitet die gestellten Aufgaben tatsächlich erst selbst, bevor ihr auf die Lösung klickt!
Die Atombindung (auch: kovalente Bindung)
Das folgende yt-Video bietet einen sehr guten Einstieg in die Thematik. Tatsächlich würde ich im Unterricht nahezu genau das gleiche sagen. Zu Beginn des Videos wird auf andere Videos verwiesen, die vorausgesetzt werden. Diese Videos braucht ihr nicht zu schauen. Wir haben das bereits im Unterricht besprochen.
Zum Einstieg vielleicht eine kleine Wiederholung (ca. 5 Min.):
- Notiere, was "Valenzelektronen" sind!
Das sind die Elektronen, die sich bei Atomen eines bestimmten Elements auf der äußersten Schale befinden.
- Bestimme die Anzahl der Valenzelektronen (VE) der Atome folgender Elemente mit Hilfe des PSE: Calcium, Lithium, Iod!
Ca: 2 VE, Li: 1 VE, I: 7 VE
- Erkläre, wie Du diese Anzahl bestimmt hast!
Die Anzahl der VE entspricht der Hauptgruppen-Nr. im PSE.
- Bestimme die chemische Formel des Salzes Berylliumbromid!
Beryllium besitzt 2 VE. Um Edelgaskonfiguration zu erreichen, muss es diese beiden abgeben. Es entstehen Be2+-Ionen. Brom besitzt 7 VE. Um Edelgaskonfiguration zu erreichen muss es ein Elektron aufnehmen. Es entstehen Br--Ionen. Damit ein neutrales (nicht geladenes) Salz entsteht und keine Elektronen verloren gehen oder übrig bleiben, müssen immer zwei Bromid-Atome mit einem Beryllium-Atom reagieren. Die Formel des entstehenden Salzes lautet dann BeBr2
Das genügt als Wiederholung. Jetzt zum yt-Video (10:06 min.): Hier klicken
Testet, ob ihr die Inhalte des Videos wiedergeben könnt.
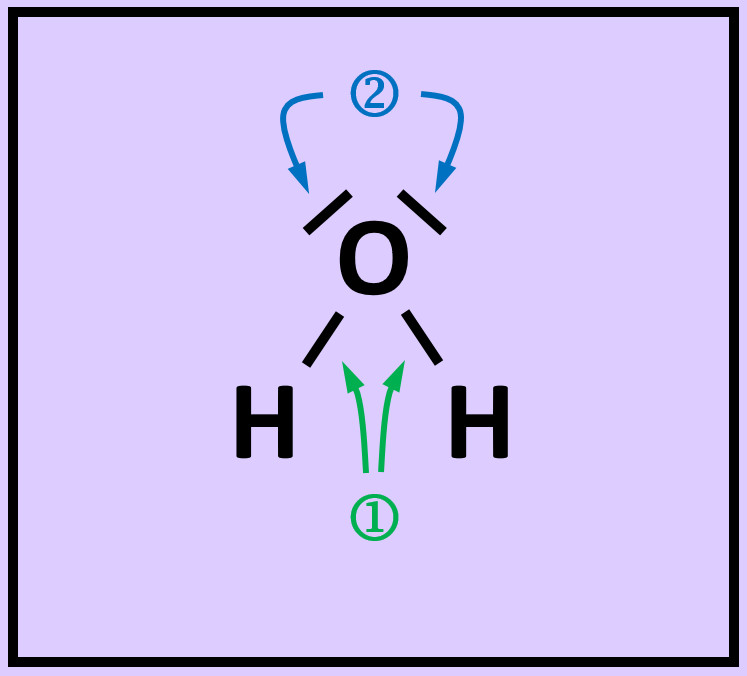
- Das folgende Bild zeigt die Valenzstrichformel des Wassermoleküls. Was bedeuten die mit unterschiedlichen Ziffern markierten Striche?
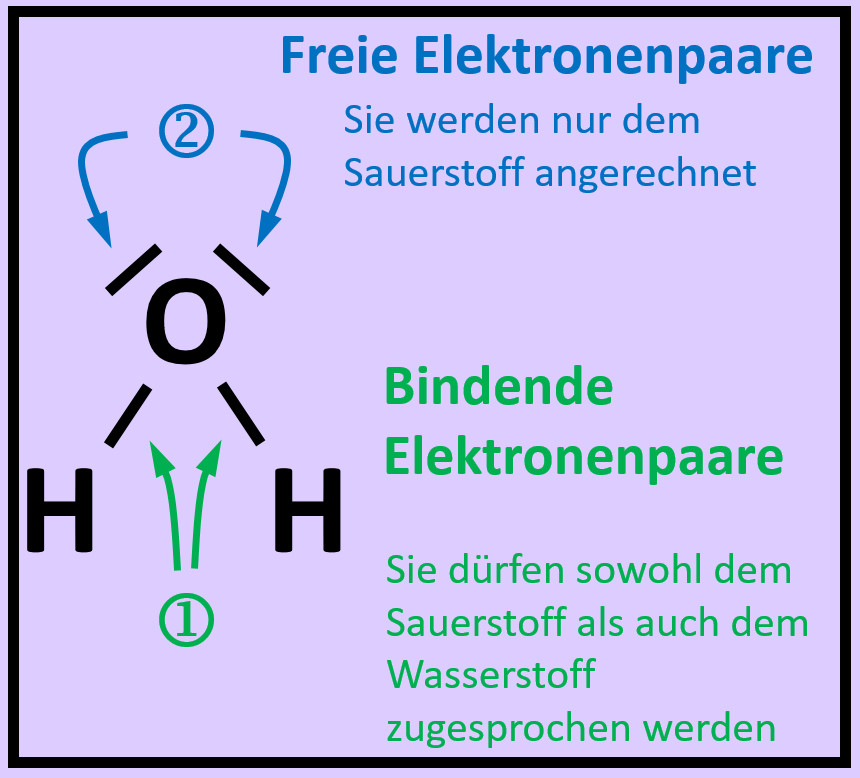
Freie Elektronenpaare stammen nur von dem Atom, das sie umgeben. Bei den bindenden Elektronenpaaren stammt ein Elektron vom einen Partner (hier: Sauerstoff) und das andere Elektron vom anderen Partner (hier: Wasserstoff)
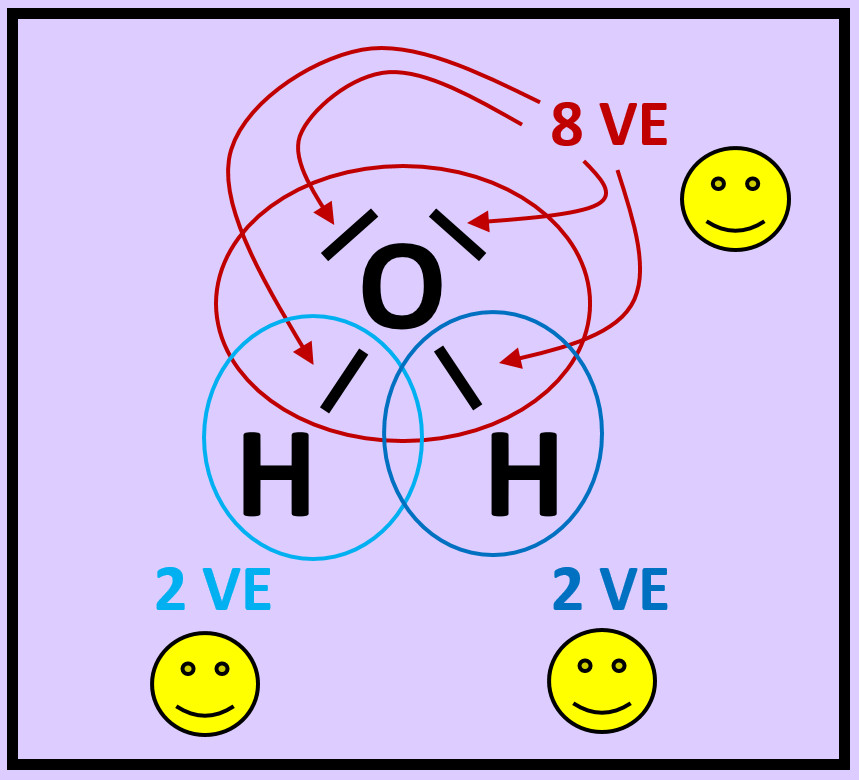
- Zeichnet das Wassermolekül ab. Kreist nun jedes Atom ein. Achtet dabei darauf, dass im Kreis alle Elektronen (freie Elektronenpaare und bindende Elektronenpaare) enthalten sind, die dem Atom zugerechnet werden können!
- Zählt nun die Elektronen, die ihr jedem Atom zugeordnet habt!
- Entscheidet, ob durch diese Anordnung Edelgaskonfiguration erreicht wurde!
- Warum kann man beim Wasserstoff von Edelgaskonfiguration sprechen, obwohl ihm nur zwei Elektronen zugesprochen werden?
Die beiden Elektronen sitzen auf der innersten Schale, der K-Schale. Damit ist diese voll besetzt. Dies entspricht der Konfiguration von Helium und damit einem Edelgas.
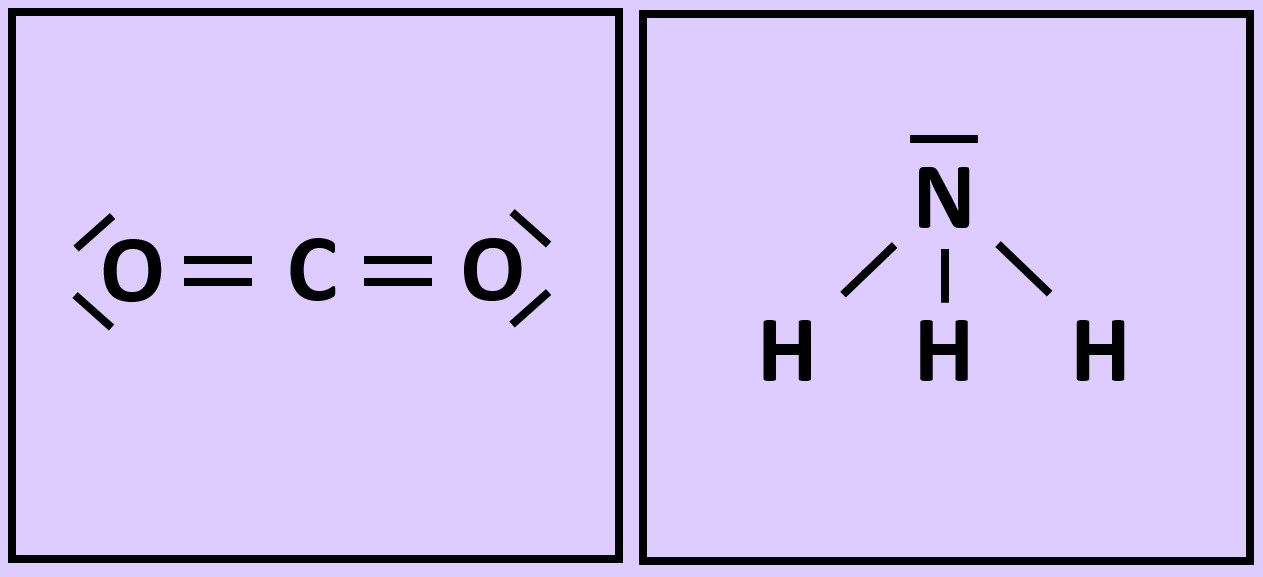
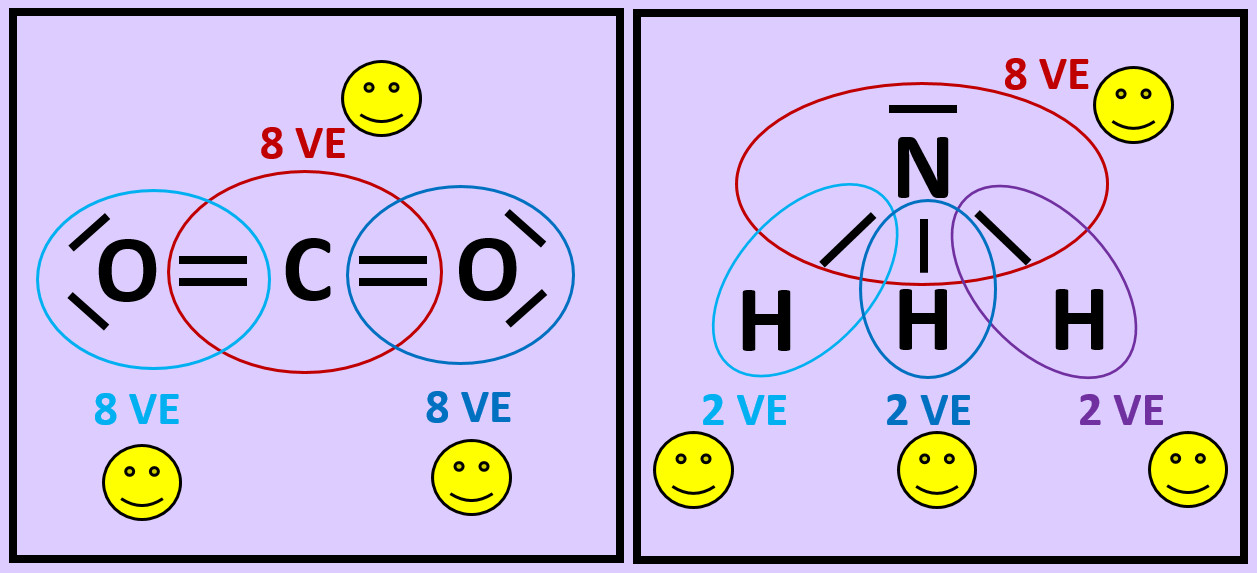
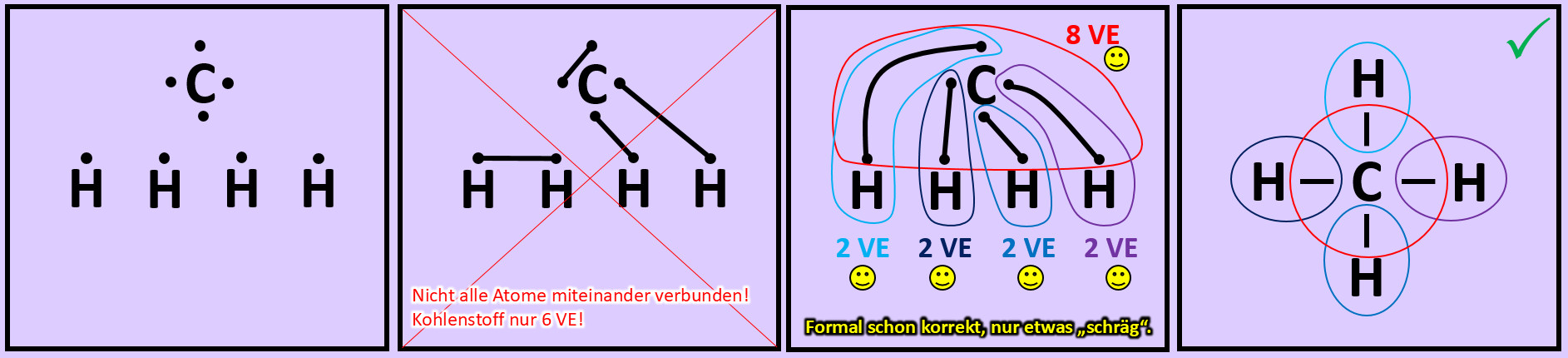
- Wiederholt die vorangegangenen Schritte (Einkreisen der Atome; Zählen der Elektronen; Entscheiden, ob Edelgaskonfiguration vorliegt) für die Moleküle "Kohlenstoffdioxid" (CO2) und "Ammoniak" (NH3)
Versucht nun mit Hilfe der Valenzstrichformel selbst ein Molekül zu zeichnen, das ihr noch nicht im Video gesehen habt: "Methan" (CH4). Geht wie folgt vor:
- Zeichnet die Elementsymbole aller fünf Atome auf das Papier. Tipp: Wählt eine möglichst symmetrische Anordnung.
- Zeichnet nun um jeden Atom die richtige Anzahl an Valenzelektronen.
- Versucht nun die Punkte so zu verbinden, dass alle Atome miteinander zusammenhängen und gleichzeitig Edelgaskonfiguration erreicht wird.
- Hinweis: Wenn man die zwei Valenzelektronen von zwei Wasserstoffen miteinander verbindet, dann besitzen zwar diese beiden Edelgaskonfiguration können aber keine weitere Bindung mehr eingehen. Sie können dann mit den restlichen Atomen nicht mehr verknüpft werden. Man muss also nach einer anderen Lösung suchen...
In eurem Buch ist auf der Seite 113 ist ein Verfahren beschrieben, mit dem man die Valenzstrichformeln "berechnen" kann. Ihr dürft das in Zukunft gerne so durchführen. Wenn man etwas übt, dann klappt es aber nach einiger Zeit auch ohne dieses Verfahren. Lest dieses Verfahren jetzt noch nicht, sondern erst als Hausaufgabe.
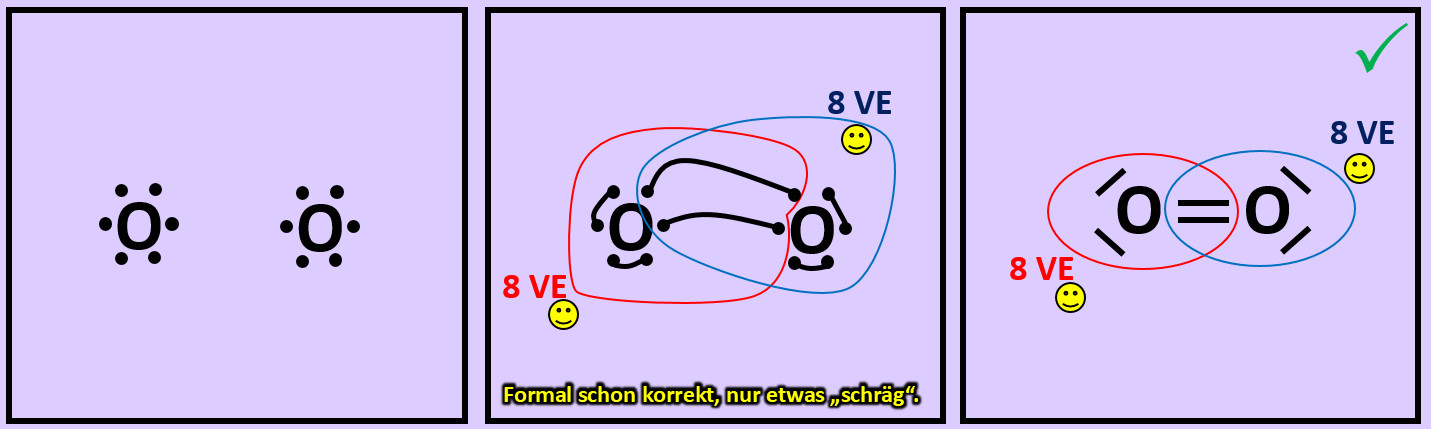
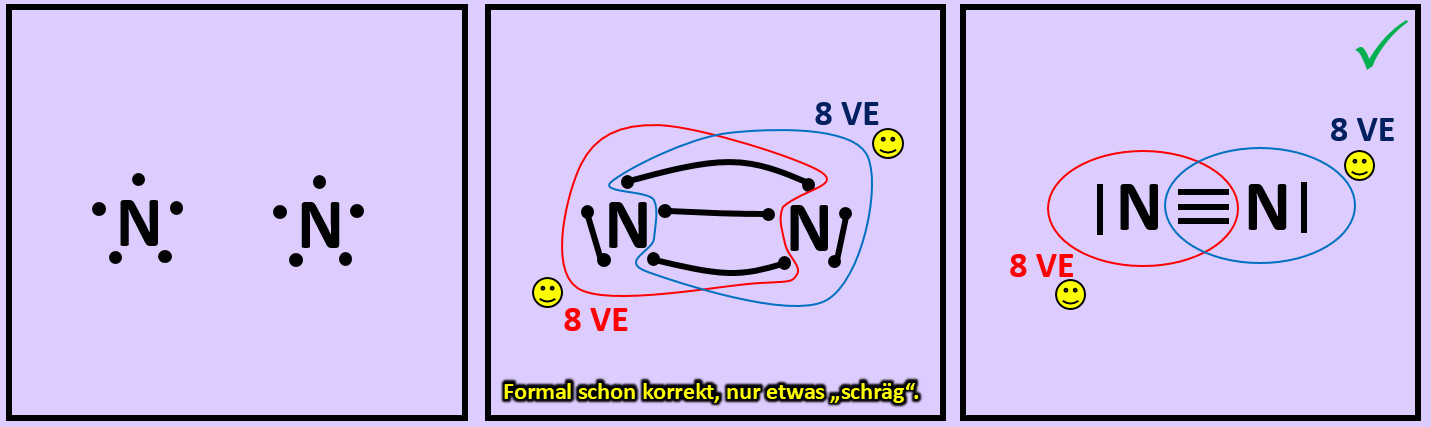
- Versucht erst noch zwei weitere Moleküle mit Hilfe der Valenzstrichformeln darzustellen: "Sauerstoff" (O2) und "Stickstoff" (N2)
- Beim Sauerstoffmolekül sind an der Bindung zwischen den beiden Atomen zwei Elektronenpaare, beim Stickstoffmolekül drei beteiligt. Diese Formen von Bindungen haben eigene Namen. Wie nennt man diese Bindungen?
Beim Sauerstoffmolekül: Doppelbindung, beim Stickstoffmolekül: Dreifachbindung.
Hausaufgabe: Lest im Buch folgende Abschnitte: S. 107 "Das Konzept der Elektronenpaarbindung", S. 108 komplett, S. 109 "Die Molekülformel". (Hinweis: Der Begriff "stöchiometrische Wertigkeit" spielt im meinen Unterricht keine große Rolle.) Bearbeitet die Aufgaben 1 + 3 auf S. 107 und stellt die Valenzstrichformel für Wasserstoffperoxid (H2O2) auf (schwierig).
Arbeitsaufträge für die Woche vom 16.03. - 20.03.
Züchtet einen Salzkristall:
- Dokumentiert jeden der folgenden Schritte mit einem Foto, damit ihr daraus später eine schöne Anleitung am PC erstellen könnt!
- Füllt ein Glas mit heißem Wasser. Ihr braucht es nicht extra erhitzen, nehmt einfach das heißeste Wasser, was ihr aus eurer Leitung bekommen könnt.
- Gebt löffelweise Spülmaschinen-Salz dazu und rührt um. Minutenlang! (Wenn ihr kein Spülmaschinen-Salz habt, geht auch normales Speisesalz)
- Irgendwann wird sich das Salz im Glas nicht mehr auflösen. Lasst den Ansatz dann noch 5 Minuten stehen.
- Filtriert das Salzwasser durch einen Kaffee-Filter und fangt das Wasser in einem zweiten Glas auf
- Schüttet etwas von dem Filtrat in eine Untertasse (am besten eine, die nicht weiß ist) und stellt es an einen sonnigen Platz auf das Fensterbrett, wo der Ansatz bis Montag stehen bleiben kann ohne dass er stört. Er sollte nicht bewegt werden.
- Macht alle 24 Stunden ein Foto.
- Am Montag, 23.03. geht es weiter